Семян и зародышей редких видов растений
| Вид материала | Автореферат диссертации |
- Красная книга, 61.32kb.
- Молекулярно-генетический анализ генофондов редких и исчезающих видов растений пермского, 701.05kb.
- Венции должны содействовать восстановлению исчезающих видов, в частности, путем разработки, 98.37kb.
- «Красной книге», 31.74kb.
- Школьные экскурсии, 230.88kb.
- Программа для поступающих в нввкус по специальности «Психология», 284.28kb.
- Международного Союза Охраны Природы Питеру Скотту. По его инициативе в мсоп в 1949, 1423.12kb.
- «Путешествие по регионам Большого Алтая, 177.44kb.
- Перечень видов продукции, на которые оформляются сертификаты качества муки, хлебобулочных, 13.78kb.
- Лекция Многообразие растение. Водоросли Систематика растений, 162.25kb.
1.2.Влияние стратификации на преодоление покоя семян и развитие зародышей в культуре in vitro.
Универсальным фактором, устраняющим физиологический покой семян, является холодная стратификации (Поздова, Разумова 1997; Baskin & Baskin, 2004).
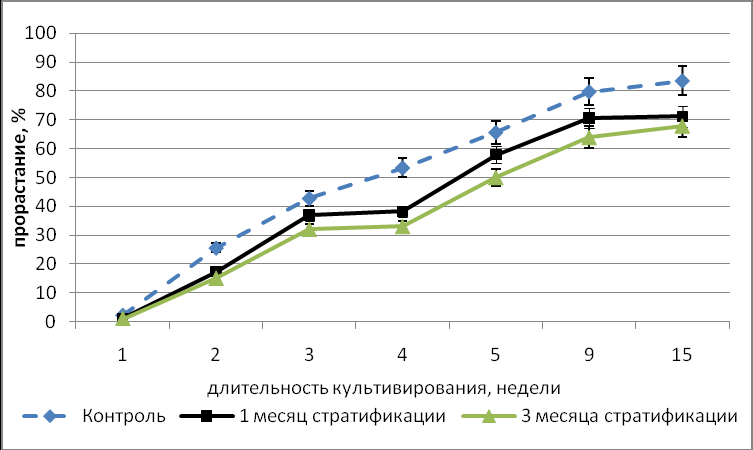
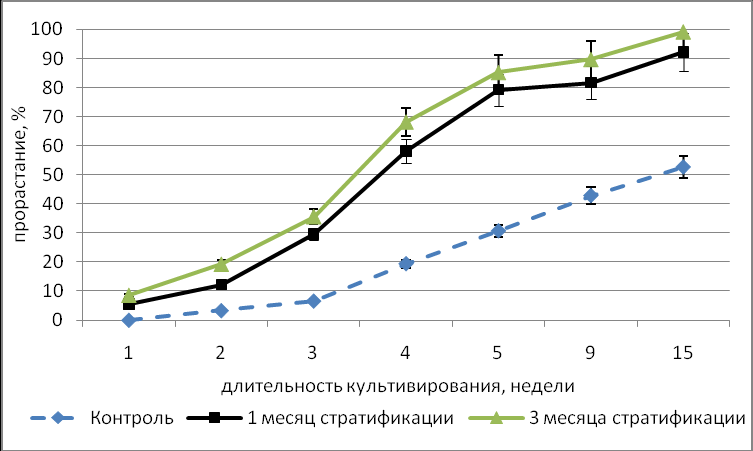
На динамику прорастания значительное влияние оказали тип покоя, длительность стратификации и периода хранения исходных семян. Показано, что в контрольном варианте эксперимента процент прорастания культивируемых in vitro семян всех видов, прошедших 2-х летний период хранения был значительно ниже по сравнению с процентом прорастания семян, хранившихся 1 год. Для видов с неглубоким типом покоя (I.pumila, I.scariosa) показано, что стратификация ингибирует прорастание семян, хранившихся 1 год, и значительно стимулирует прорастание семян, хранившихся два года. (Рис.3).
А В
Рис.3. Влияние стратификации на динамику прорастания in vitro семян с неглубоким типом физиологического покоя (I. pumila). А – 1 год хранения семян, В – 2 года хранения семян.
Во всех остальных вариантах эксперимента, не зависимо от срока хранения, было показано стимулирующее влияние стратификации на прорастание семян, находящихся в глубоком и промежуточном физиологическом покое.
Установлено, что развитие зародышей, выделенных из семян, прошедших стратификацию, зависело от длительности периода хранения, типа покоя исходных семян и длительности стратификации.
Максимальные показатели развития проростков, полученных из зародышей, изолированных из семян с неглубоким типом физиологического покоя и хранившихся 1 год отмечены в контрольном варианте (без стратификации) (Рис.4).
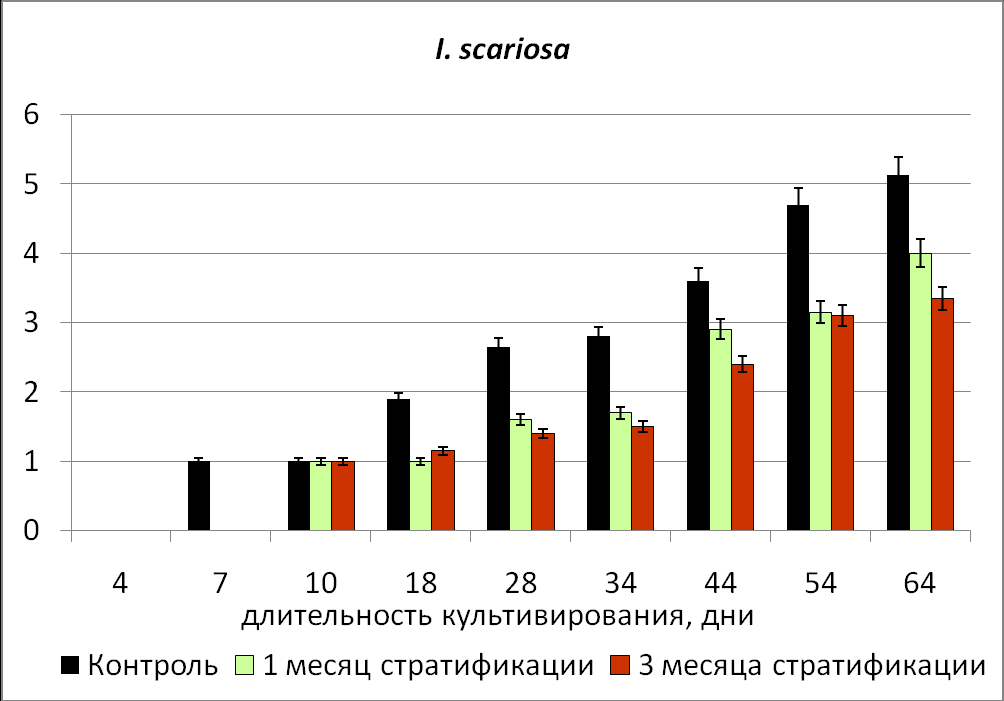
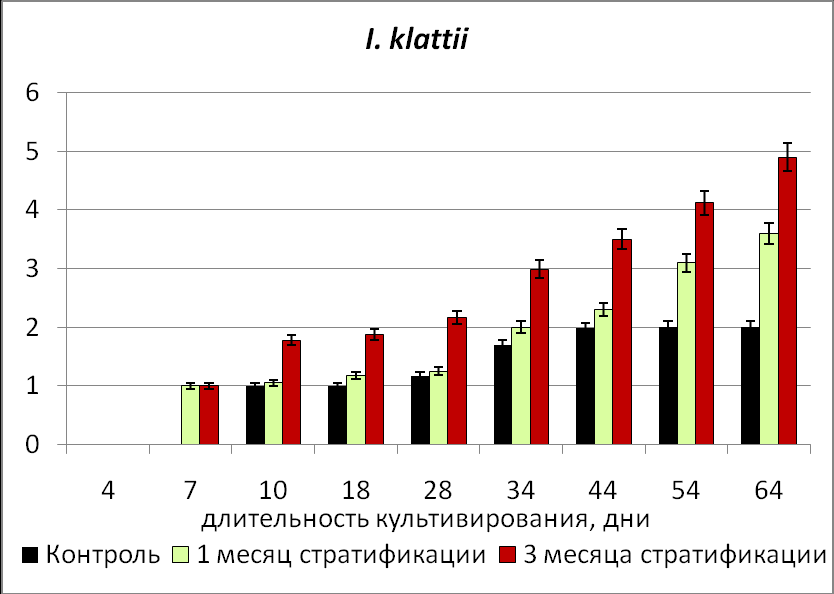
Рис.4. Динамика изменения числа листьев у проростков, полученных из зародышей, изолированных из стратифицированных семян с неглубоким (I. scariosa) и глубоким (I. klattii) типом физиологического покоя.
Для развития проростков, полученных из зародышей, изолированных из семян с промежуточным и глубоким типом физиологического покоя, показано стимулирующее влияние стратификации исходных семян на развитие проростков, не зависимо от периода хранения (Рис.4).
1.3.Эмбриокультура незрелых зародышей представителей Iris и Belamcanda.
Использование культуры незрелых зародышей позволяет значительно сократить период покоя семян. Благодаря свойству относительной «автономности» зародыша (способности развиваться в нормальное растение вне материнского организма), прорастание в условиях культуры in vitro становиться возможным уже на ранних стадиях эмбриогенеза (Батыгина, Васильева, 1987; 2002).
Показано, что критерием выбора сроков изоляции зародышей для введения в культуру in vitro всех 14 модельных видов, является достижение ими стадии относительной автономности, которая, как было установлено экспериментальным путем, наступает на 35-45 ДПО – в период дифференциации осевых органов.
Общей закономерностью для всех изученных видов является снижение жизнеспособности и процента прорастания зародышей, изолированных в более поздние фазы развития (65-75ДПО) по сравнению с прорастанием зародышей первого возрастного периода (35-45ДПО) (Табл.2, Рис.5). В наибольшей степени такая динамика выражена у видов Subgenus Xyridion, семена которых характеризуются комбинированным – физическим с глубоким физиологическим – типом покоя (Аф-В3), в наименьшей у видов Subgenus Iris, семена которых имеют неглубокий физиологический тип покоя (В1-2). Подобная закономерность, очевидно, является следствием блокировки прорастания зародыша в связи со вступлением семени в фазу индукции процессов детерминации покоя (Морозова, 1997; Finkelstein et al., 2008).
Таблица 2
Влияние стадии развития и состава питательной среды на жизнеспособность культивируемых in vitro зародышей.
| Вид | Систематическое положение | Стадия развития зародышей / вариант питательной среды / процент жизнеспособных зародышей | ||||||||
| 35-45 ДПО | 50-60 ДПО | 65-75 ДПО | ||||||||
| МS+0,1мг/л BAP | MS0 | 2 x MS | МS+0,1мг/л BAP | MS0 | 2 x MS | МS+0,1мг/л BAP | MS0 | 2 x MS | ||
| Belamcanda chinensis | Genus Belamcanda | 98,62±4,3 | 73,45±1,1 | -- | 64,72±0,9 | 45,11±1,6 | 47,53±0,9 | 68,92±1,9 | 78,19±2,0 | 65,71±1,4 |
| I. pumila | Subgenus Iris | 88,67±1,1 | 91,64±0,8 | 96,72±1,0 | 62,75±3,8 | 70,68±2,1 | 75,11±1,8 | 83,11±3,1 | 87,15±0,6 | 79,69±4,2 |
| I. aphylla | Subgenus Iris | 95,15±1,3 | 80,23±3,1 | 87,61±2,4 | 78,13±1,1 | 87,88±2,4 | 93,33±2,2 | 87,25±3,1 | 97,0±3,5 | 82,13±1,2 |
| I. ensata | Subgenus Limniris | 97,17±4,4 | 75,50±3,3 | 62,73±3,5 | 59,54±2,7 | 73,62±3,8 | 42,48±2,6 | 73,42±4,3 | 80,19±0,8 | 56,76±2,4 |
| I. pseudacorus | Subgenus Limniris | 91,67±2,7 | 78,22±3,2 | 67,58±2,1 | 72,76±3,8 | 64,88±2,1 | 54,61±0,8 | 60,64±3,4 | 72,73±3,6 | 58,25±0,9 |
| I. klattii | Subgenus Xyridion | 97,39±2,2 | 84,53±3,7 | 89,92±1,8 | 88,89±2,5 | 80,86±5,2 | 72,57±2,7 | 52,47±0,3 | 46,71±2,8 | 31,53±2,5 |
| I. carthaliniae | Subgenus Xyridion | 95,85±4,7 | 83,81±2,1 | 86,97±1,3 | 83,34±2,5 | 77,78±3,5 | 58,27±1,3 | 46,94±2,3 | 49,82±2,1 | 21,63±0,8 |

Рис.5. Динамика прорастания культивируемых in vitro зародышей видов рода Iris. I – 35-45 ДПО; II – 50-60 ДПО; III – 65-75ДПО.
Выявленные общие закономерности развития исходных эксплантов и их видоспецифичная отзывчивость на условия культивирования, а также связь этих процессов с типом покоя семян исследуемых видов и стадией развития изолированных из них зародышей, являлись определяющими не только на ранних этапах культивирования, но и в течении ювенильного и имматурного периода развития растений in vitro
Для видов рода Iris и Belamcanda chinensis, семена которых находятся в промежуточном или глубоком покое ( I. pseudacorus, I. klattii,) максимальные значения основных показателей развития (число листьев, длина листа, длина корня) в фазе проростка были отмечены для растений, полученных из зародышей 35-45 ДПО, минимальные – для проростков, полученных из зародышей 50-60 ДПО (Рис.6).
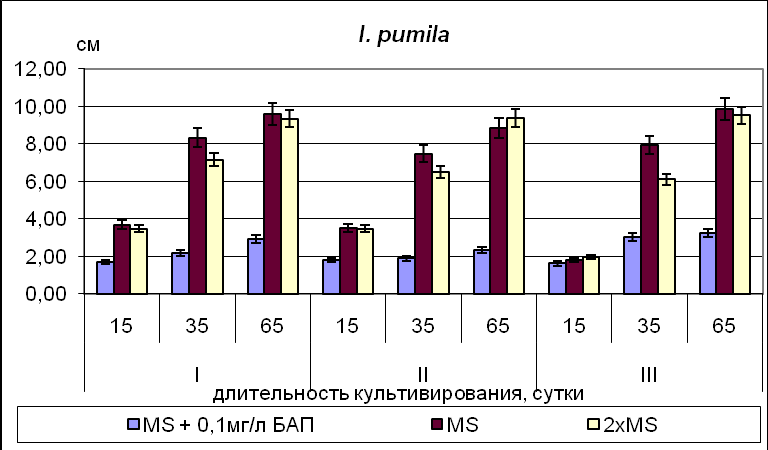
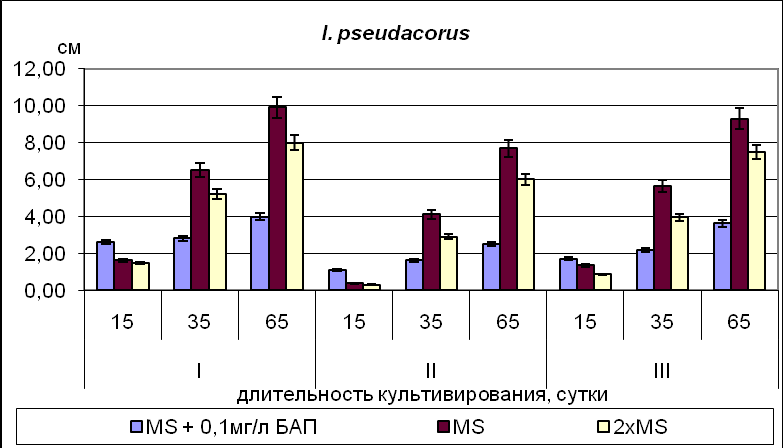
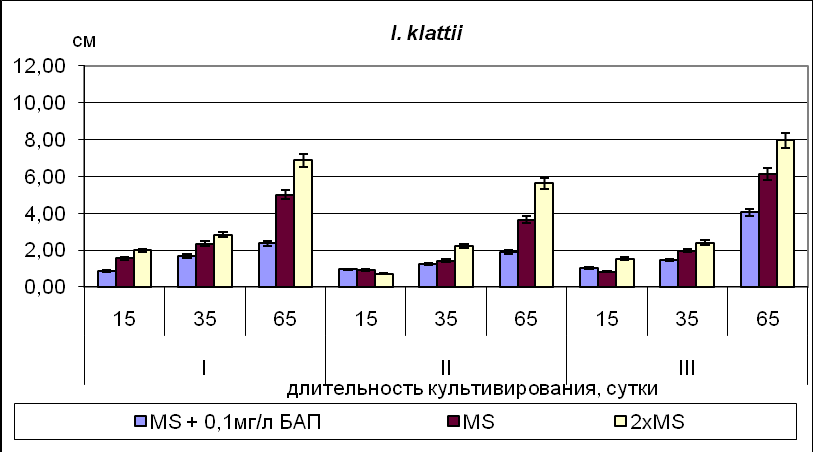
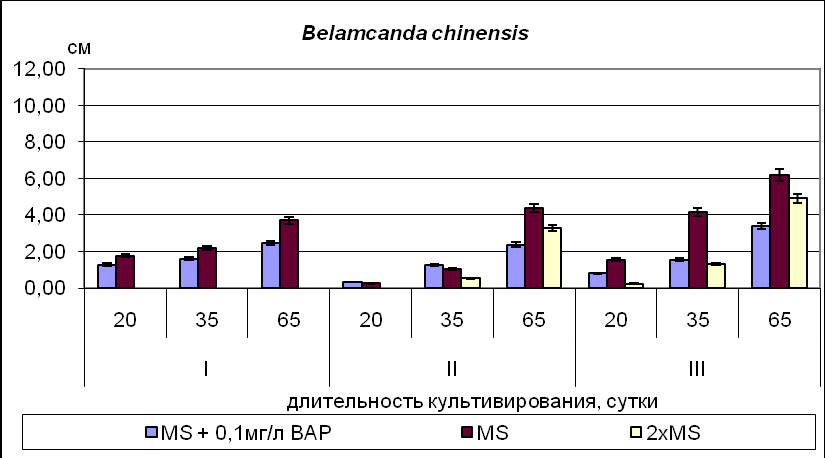
Рис.6. Длина наиболее развитого листа у культивируемых in vitro растений на 15 день (стадия проростка), 35 день (ювенильный период) и 65 день культивирования (имматурный период). Условные обозначения: I – 35-45 ДПО; II – 50-60 ДПО; III – 65-75ДПО.
Присутствие 0,1 мг/л БАП в среде оказывает стимулирующий эффект на рост зародышей и проростков всех исследуемых видов только на первых этапах культивирования (до 10-15 дня), что может свидетельствовать о достижении растениями, вступившими в ювенильную стадию развития абсолютной автономности.
Для видов, семена которых имеют неглубокий покой (I.pumila) основные показатели роста растений, культивируемых на средах без добавления БАП, к 65 дню культивирования значимо не отличаются. Для I. pseudacorus и большинства остальных видов рода Iris, а также Belamcanda chinensis, предпочтительнее было культивирование на безгормональной питательной среде, а для I. klattii и видов Subgenus Xyridion – на среде с высоким содержанием основных питательных веществ.
В результате проведенных нами исследований для всех 14 модельных видов рода Iris и Belamcanda chinensis показана возможность использования эмбриокультуры, как метода преодоления покоя семян. Зародыши всех видов, извлеченные из незрелых семян способны прорастать в условиях in vitro с 35-45ДПО и в дальнейшем формировать нормальные растения. Установлено, что реализация программы относительной автономности развития эксплантов in vitro детерминируется типом покоя семян, сроком изоляции зародышей и условиями культивирования.
2.Культура in vitro семян и зародышей представителей Paeonia
Семена видов рода Paeonia имеют простой глубокий морфофизиологический покой и для его нарушения необходима двухэтапная стратификации – теплая (для доразвития зародыша) и холодная (для снятия физиологического механизма торможения прорастания – ФМТ) (Николаева, 1985; 1999).
В ходе проведенного эксперимента было показано, что для преодоления покоя и получения нормальных проростков in vitro, использование культуры семян неэффективно. При длительном культивировании семян происходит поликонденсация в питательную среду веществ фенольной природы, которая приводит к ингибированию клеточных делений, снижению жизнеспособности и дальнейшей гибели зародыша в семени.
На первом этапе культивирования изолированных зародышей данного таксона (теплая стратификация), оптимальной является безгормональная питательная среда. Установлено, что жизнеспособность изолированных зародышей зависит от продолжительности хранения исходных семян (Табл.3).
Таблица 3
Влияние состава питательной среды на жизнеспособность P.tenuifolia на этапе теплой стратификации.
| Вариант питательной среды | Продолжительность культивирования / процент жизнеспособных эксплантов | |||||
| 1 неделя | 3 недели | 5 недель | ||||
| 1 год* | 2 года | 1 год | 2 год | 1 год | 2 года | |
| MS0 | 13,71 ± 0,9 | 3,45 ± 0,2 | 56,71 ± 1,2 | 15,34 ± 0,5 | 87,20 ± 2,1 | 31,54 ± 0,9 |
| 2 x MS | 10,23 ± 0,6 | 1,11 ± 0,0 | 15,46 ± 0,9 | 7,28 ± 0,2 | 49,12 ± 1,7 | 10,37 ± 0,9 |
| МS + 0,1БАП | 19,76 ± 0,7 | 2,53 ± 0,1 | 23,93 ± 1,2 | 4,95 ± 0,4 | 28,56 ± 0,8 | 9,89 ± 0,3 |
| МS + 0,3БАП | 15,54 ± 1,0 | 0,98 ± 0,0 | 20,48 ± 0,8 | 2,29 ± 0,2 | 25,29 ± 1,1 | 11,17 ± 0,2 |
* - длительность хранения исходных семян.
Питательные среды, содержащие различные концентрации БАП, в первые недели развития зародышей стимулировали активацию их роста, однако даленейшее культивирование растений на этих средах приводило к появлению большого количества различных аномалий развития и, как следствие, остановке роста растений. В некоторых случаях отмечено появление морфогенного (P.peregrina) и неморфогенного (P. mascula, P. amomala) каллуса на семядолях и гипокотиле, образование которого ингибировало нормальное развитие растений, что согласуется с данными других исследователей (Брюхин, 1993; Зарипова, 2007; Stanys et al, 2007).
Для некоторых видов ( P. delavayi, P. peregrina и P. lutea) было предпочтительно культивирование зародышей на питательной среде с повышенным содержанием питательных веществ.
Добавление в питательную среду ГК3 в концентрации 0,1 – 1 мг/л позволяет сократить период эпикотильного покоя, однако не заменяет полностью необходимость холодной стратификации (развития апикальной меристемы побега без выдерживания проростков при низких положительных температурах ни в одном из вариантов опыта получено не было) (Табл.4).
Таблица 4
Влияние состава питательной среды на прорастание P. аnomala на этапе холодной стратификации.
| Вариант питательной среды | Продолжительность холодной стратификации / прорастание, % | ||
| 3 недели | 5 недель | 7 недель | |
| Контроль (MS0) | 0 | 43,18 ± 1,0 | 83,32 ± 1,5 |
| 0,1 ГК3 | 0 | 45,52 ± 0,8 | 82,23 ± 2,1 |
| 0,1 ГК3 +0,1 БАП | 0 | 42,76 ± 0,9 | 80,32 ± 1,3 |
| 0,1 ГК3 + 0,5 БАП | 0 | 40,23 ± 1,0 | 79,51 ± 1,2 |
| 0,1 ГК3 + 1 БАП | 0 | 34,12 ± 0,9 | 73,11 ± 0,9 |
| 1 ГК3 | 2,10 ± 0,1 | 52,87 ± 1,0 | 91,33 ± 1,6 |
| 1 ГК3 + 0,1 БАП | 1,15± 0,1 | 46,12 ± 0,9 | 83,39 ± 1,1 |
| 1 ГК3 + 0,5 БАП | 0 | 42,42 ± 0,9 | 80,05 ± 1,2 |
| 1 ГК3 +1 БАП | 0 | 36,38 ± 1,1 | 75,33 ± 1,3 |
Установлено, что длительность этапа холодной стратификации зависит от видовой принадлежности объекта и продолжается от 4-5 ( P. mascula) до 7-8 недель (P. suffruticosa) (Рис.7).
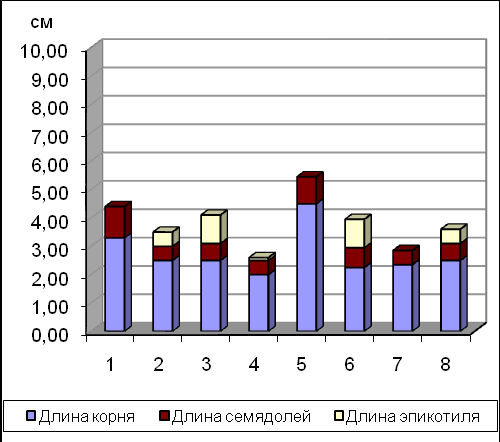
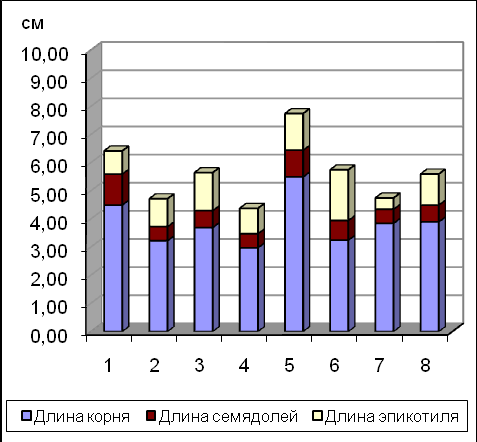
А В
Рис.7. Развитие проростков видов Paeonia на 5(А) и 8(В) неделе холодной стратификации. Условные обозначения: 1 – P. delavayi, 2 – P. anomala, 3 – P. mascula, 4 – P. wittmanniana, 5 – P.lutea, 6 – P. tenuifolia, 7 – P. suffruticosa, 8 – P. lactiflora.
Недостаточный период холодной стратификации у всех модельных видов Paeonia приводил к проявлению физиологической карликовости проростков.
В ходе эксперимента с эмбриокультурой незрелых зародышей было установлено, что получение проростков возможно только при использовании в качестве исходного материала эксплантов, изолированных из семян на 40-50 ДПО. На этом этапе формирования семени зародыш Paeonia находится в стадии торпеды и достигает относительной автономности (Батыгина, Васильева, 2002). Оптимальной для культивирования незрелых зародышей была безгормональная среда, в остальных вариантах эксперимента был получен высокий процент аномалий роста и развития.
В результате проведенных нами исследований для всех видов рода Paeonia показана возможность использования культуры зрелых и незрелых зародышей in vitro, как метода преодоления покоя семян. Показано, преимущество эмбриокультуры, по сравнению с культурой семян и установлена видоспецифичность в поведении эксплантов на разных этапах культивирования.
3.Культура in vitro семян и зародышей представителей Fritillaria.
Семена видов рода Fritillaria., находятся в сложном глубоком морфофизиологическом покое и для доразвития зародыша и снятия ФМТ нуждаются в многоэтапной стратификации, включающей чередование теплого и холодного периода (Николаева, 1985; Разумова, Поздова, 1999).
В ходе исследования было установлено, что для снятия покоя и получения нормальных проростков, на первом этапе культивирования обязательна теплая стратификация на протяжении 4-5 недель. Без предварительного культивирования семян при 20-220С процессов доразвития зародыша в семени не происходит (Табл.5).
Таблица 5
Влияние температурного режима на процесс доразвития зародыша видов рода Fritillaria в течение первого этапа стратификации
| Вид | Продолжительность культивирования / семена с развитым зародышем, % | |||
| 3 недели 20-220C | 3 недели 3-50C | |||
| 1 год | 2 года | 1 год | 2 года | |
| F. grandiflora | 46,25 ± 1,2 | 0 | 0 | 0 |
| F. imperialis | 64,32 ± 0,2 | 0,99 ± 0,02 | 1,23 ± 0,2 | 0 |
| F. lutea | 70,91 ± 1,9 | 0 | 3,11 ± 0,7 | 0 |
| F. meleagris | 77,35 ± 1,7 | 0 | 2,63 ± 0,2 | 0 |
| F. michailovskyi | 5,22 ± 0,1 | 0 | 2,49 ± 0,4 | 0 |
| F. montana | 80,11 ± 0,3 | 3,45 ± 0,2 | 2,27 ± 0,3 | 0 |
| F. pallidiflora | 34,16 ± 1,2 | 0 | 1,78 ± 0,02 | 0 |
| F. ruthenica | 78,23 ± 2,3 | 3,53 ± 0,2 | 1,37 ± 0,1 | 0 |
| F. sewerzovii | 84,58 ± 3,0 | 5,86 ± 0,3 | 5,76 ± 0,05 | 0 |
Показано, что на доразвитие зародыша оказывает влияние длительность периода теплой и холодной стратификации. Активный линейный рост зародыша наблюдается до 5-7 недели теплой стратификации. Дальнейшее развитее зародышей в семенах возобновлялось только в условиях низких положительных температур. Длительность холодной стратификации, в течение которой происходило окончательное формирование зародыша и нарушение действия ФМТ, существенно влияла на прорастание культивируемых семян всех видов. Максимальный процент прорастания для семян всех видов был получен только после трех месяцев холодной стратификации (Рис.8).
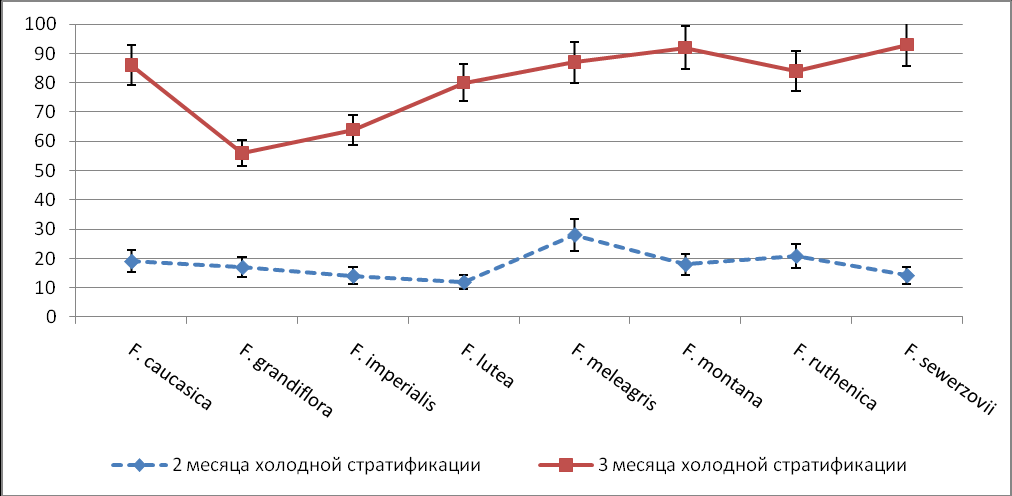
Рис.8. Влияние продолжительности периода холодной стратификации
на прорастание in vitro семян видов рода Fritillaria.
Добавление в питательную среду регуляторов роста (1 мг/л ГК3 и 1 мг/л BAP) значимого влияния на доразвитие зародыша в период теплой и холодной стратификации не оказывает.
В результате проведенного эксперимента было установлено, что дальнейшего роста и развития зародышей Fritillaria извлеченных из семени на разных этапах стратификации и высаженных на различные варианты питательных сред получено не было. Нормальные проростки развивались из семян, полностью прошедших все необходимые этапы стратификации, что свидетельствует о сложности биохимических и метаболических процессов, связанных с выходом семени из состояния покоя данного типа (Разумова, 1997; Кравкина, Котеева, 2005, 2007).
В ходе проведенных исследований на всех представителей Iris, Belamcanda, Paeonia и Fritillaria показано преимущество эмбриокультуры, как метода преодоления покоя семян. В зависимости от типа покоя и его сложности, использование культуры изолированных зародышей позволяет частично или полностью снять необходимость холодной стратификации и соответственно сократить период прорастания.
Показано, что критерием выбора сроков для культивирования изолированных зародышей является достижение ими стадии относительной автономности. По полученным экспериментальным данным и анализу литературных источников Родионенко, 1956; Lakshmanan, Philip, 1970; Алимова и др., 1985; Guignard, 1962; Соколовская, Яковлев, 1978; 1980; Smith, Grierson, 1985; Батыгина, Васильева, 1987, 2002; Сравнительная эмбриология…, 1987, 1990; Эмбриология цветковых…, 1997 и др.) предложены следующие схемы становления стадии относительной автономности зародыша, связи этого процесса с покоем семян и использованием в работе с эмбриокультурой модельных объектов (Рис.9).
Из представленных схем видно, что у всех изучаемых объектов относительная автономность зародыша достигается в период дифференциации основных органов, а в зависимости от типа покоя наступление этой стадии может происходить как в середине или конце эмбрионального, так и в латентный период онтогенеза, на основании чего, были установлены оптимальные сроки изоляции зародышей модельных объектов и условия их культивирования in vitro.
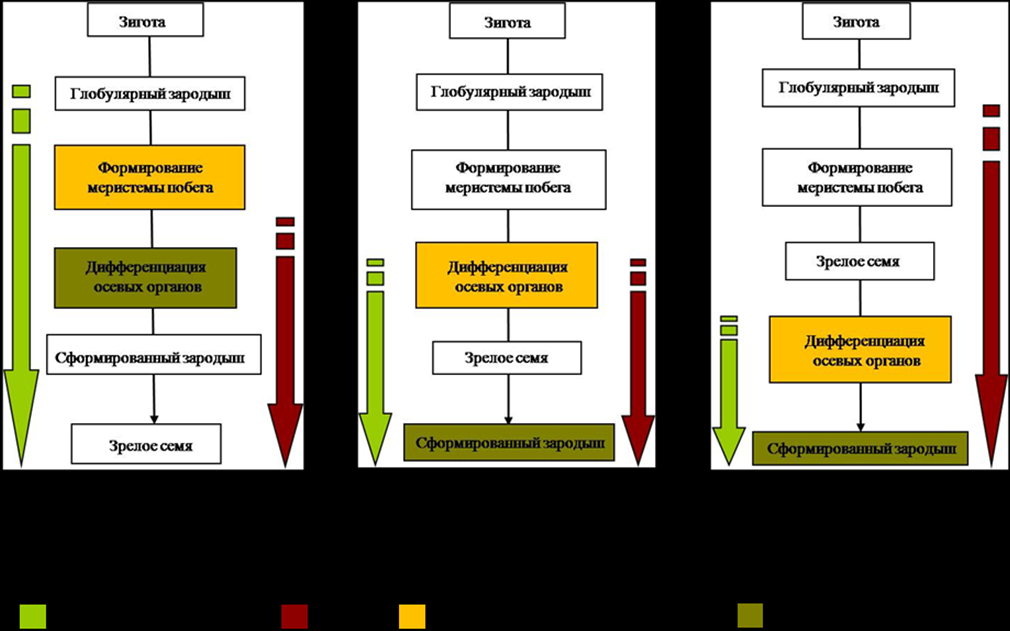
Рис.9. Схемы становления относительной автономности зародыша у представителей родов
Iris, Belamcanda, Paeonia и Fritillaria.
