Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
4.1.4 Использование роторного испарителя для получения липосом

Рисунок 10 - Роторный испаритель IKA®RV 10 basic.
Основное назначение роторного испарителя - дистилляция (процесс термического разделения жидких соединений на основе разности их температур кипения с последующей конденсацией отогнанного растворителя). Однако он с успехом может использоваться и для других целей, например – для последующего создания липосом.
Получение, свойства и возможности применения липосом описаны в ряде монографий и обзоров, поэтому здесь эти вопросы будут рассмотрены кратко с использованием конкретных примеров.
В самом общем случае, к липосомам можно отнести любые типы липидных дисперсий, состоящих из «сферически замкнутых» липидных частиц с внутренним водным содержимым. В зависимости от числа сферических липидных оболочек (каждая оболочка представляет собой один бислой) в такой частице выделяют 1) моноламеллярные липидные дисперсии или липосомы, содержащие один липидный бислой (иногда их называют везикулы или моноламеллярные везикулы) и 2) мультиламеллярные липидные дисперсии или мультиламеллярные везикулы, содержащие набор липосом с различным числом липидных бислоев в оболочках (но более одного). Последний тип липосом получается самопроизвольно при «механическом диспергировании» (встряхивании рукой или на механическом «шейкере») фосфолипидов в воде и собственно был впервые предложен в качестве модели биомембран в 1965 году английским биохимиком и биофизиком Бэнгхемом. В настоящее время с этой целью мультиламеллярные везикулы используется редко (из-за сложности их внутренней организации, что затрудняет анализ результатов) и по этим же причинам, широко используются моноламеллярные везикулы.
В последнее время различают малые моноламеллярные везикулы (ММВ) с диаметром от 20 до 50 нм и большие моноламеллярные везикулы (БМВ) с диаметром от 50 до 500 нм.
Малые моноламеллярные везикулы
Для получения малых моноламеллярных везикул (ММВ) чаще всего используют ультразвуковую обработку водных дисперсий фосфолипидов при постоянной температуре в течение определенного времени (чем дольше проводится так называемое «озвучивание», тем меньше средние размеры ММВ и разброс по диаметру частиц). После этого ММВ фракционируют по размерам методом гельпроникающей хроматографии или центрифугированием в градиенте глицерола с получением практически монодисперсных частиц. Например, из фосфатидилхолина куриного яйца можно получить таким образом ММВ с гидродинамической молекулярной массой 1,88106, диаметр наружного монослоя 19,8 нм, диаметр внутреннего монослоя 12,2 нм, толщина наружного монослоя 2,1 нм, толщина внутреннего монослоя 1,6 нм, площадь поверхности на «полярную голову» в наружном монослое 0,74 нм2 (во внутреннем монослое 0,61 нм2): поперечное сечение ацильных цепей в центре бислоя в наружном монослое 0,46 нм2 (во внутреннем монослое 0,97 нм2), толщина гидрофобной области бислоя 3,7 нм, число липидных молекул в наружном монослое 1658 (во внутреннем монослое 790).
Большие моноламеллярные везикулы
Для получения больших моноламеллярных везикул (БМВ) чаще всего используются следующие методы.
Диализ от детергента или разбавление растворов липида и детергента. Вначале избытком детергента диспергируют липиды (или липид-белковую смесь), а затем концентрацию детергента уменьшают (диализом, удалением или просто разбавлением) до уровня, при котором липиды начинают самопроизвольно формировать везикулы с достаточно большим внутренним водным объемом (от 5 до 20 л/моль). Причем средние размеры БМВ зависят как от типа детергента, так и от скорости его удаления. Например, с помощью октилглюкозида получают БМВ достаточно крупного размера (диаметром от 100 до 200 нм), тогда как при использовании холатов получают БМВ относительно небольшого размера (диаметром от 50 до 80 нм).
Методы слияния объединяют несколько подходов, основанных на слиянии ММВ до образования БМВ. Например, повторные операции замораживания-оттаивания, особенно удобные для реконструкции ряда мембранных белков, а также использование ионов кальция для слияния ММВ, содержащих фосфатидилсерин.
Обращенно-фазовое упаривание и инфузия, т.е. методы, связанные с использованием неполярных растворителей. Например, введение эфирного раствора липида в теплую воду вызывает мгновенное испарение органического растворителя и образование БМВ. Однако эти методы непригодны для получения смешанных липид-белковых липосом из-за возможной денатурации белков в неполярных растворителях и при повышенной температуре.
Добавление фосфатидилхолинов с короткими цепями в количестве до 20% от общего содержания липидов приводит к переходу мультиламеллярных липидных дисперсий в стабильные БМВ.
Добавление жирных кислот или детергентов при определенных условиях вызывает слияние ММВ с образованием БМВ.
Быстрая экструзия мультиламеллярных липидных дисперсий через поликарбонатные фильтры приводит к образованию БМВ с диаметром 60-100 нм в зависимости от условий процесса.
Для отдельных классов липидов можно использовать свои методы, например, кратковременное повышение рН мультиламеллярных липидных дисперсий фосфатидной кислоты может приводить к образованию как ММВ, так и БМВ.
4.2 Анализ результатов по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов.
4.2.1 Влияние полиэлектролитного окружения на активность липаз из поджелудочной железы свиньи и гриба Mucor javanicus
Для изучения влияния полимеров на активность липаз были взяты разнозаряженные полиэлектролиты. Na-полистиролсульфонат (ПСС) – как полианион, полидиаллилдиметиламмоний хлорид (ПАМА) – как поликатион. Полиэлектролиты таких типов находят широкое применение в химических технологиях (как флокулянты для очистки воды), в медицине и бионанотехнологиях (формирование полиэлектролитных оболочек на коллоидных частицах различной природы для получения микрокапсул, получение нанотрубок, лечение гиперкалиемии и т.д.). Белковые молекулы ферментов являются полиамфолитами, так как входящие в их состав аминокислоты могут быть заряжены как положительно (лизин, аргинин, гистидин), так и отрицательно (аспарагиновая и глутаминовая кислоты). Поэтому на поверхности белков в нейтральных средах присутствуют как положительные, так и отрицательные заряды. В связи с такой особенностью строения белковых молекул, с их полипептидной цепью могут взаимодействовать соединения, содержащие ионогенные группы, в том числе и полиэлектролиты. Результатом такого взаимодействия является образование нековалентных белок-полиэлектролитных комплексов.
Активность липазы из поджелудочной железы свиньи и липазы из гриба Mucor javanicus была измерена в присутствии ПАМА и ПСС в соотношениях липаза : полимер 1:1, 1:10, 1:100 при рН 7,0 и t 25 ºС. Активность липаз без полиэлектролитов была принята за 100 %.
Было установлено, что такие комплексы образуются спонтанно при смешении компонентов и существуют, главным образом, за счет электростатических взаимодействий между противоположно заряженными группами белка и полииона. Главными условиями проявления активационного и стабилизационного эффектов являются наличие электростатических контактов между компонентами комплекса и растворимость фермент-полиэлектролитных комплексов в воде (при их приготовлении). Такой растворимостью обладают комплексы нестехиометрического состава, в которых большая часть заряженных групп полиэлектролита не вовлечена во взаимодействие с противоположно заряженными группами белка. Увеличение числа контактов при образовании фермент-полиэлектролитного комплекса приводит к его упрочнению, и тем самым, обеспечивает повышение устойчивости фермента к инактивации различными факторами. Стабильность белок-полиэлектролитных комплексов может быть обусловлена гидрофобными взаимодействиями или водородными связями, возникающими вследствие неионных взаимодействий между молекулами белка и неполярными участками полиэлектролита. Благодаря этим взаимодействиям образование белок-полиэлектролитных комплексов может происходить даже при таких значениях pH, при которых знаки заряда белковых глобул и цепей полиэлектролитов совпадают.
Активность липазы из поджелудочной железы свиньи в присутствии ПСС при соотношениях 1:10 и 1:100 различалась незначительно (117 и 115 %, соответственно) и была максимальной, что может быть связано с увеличением микрогетерогенности системы в результате взаимодействия липазы с полиэлектролитом. В то же время использование эквимолярной смеси липаза:ПСС (1:1) приводит к значительному уменьшению активности липазы (до 23%), поскольку недостаточно ПСС для образования микрогетерогенной границы раздела фаз.
В присутствии ПАМА наивысшая активность панкреатической липазы наблюдалась при соотношении липаза : полимер равное 1:10 (94%). Присутствие ПАМА в соотношении 1:10 незначительно уменьшает активность липазы по сравнению с контролем (на 6%). Это может быть связано с тем, что отрицательно заряженная при нейтральных значениях рН липаза в процессе комплексообразования оказывается расположенной внутри глобулы положительно заряженного полимера и становится менее доступной для субстрата.
Это подтверждается тем, что при увеличении концентрации ПАМА в смеси с липазой до 1:100 происходит значительное уменьшение активности до 44% по сравнению с эквимолярной системой (при 1:1 активность составила 73%). Это свидетельствует о значительном экранировании активных центров липазы при связывании с избытком положительно заряженного ПАМА.
Максимальная активность липазы из гриба Mucor javanicus наблюдалась в присутствии ПАМА при соотношении 1:100 (116%), а в присутствии ПСС при соотношении 1:1 (152%). Увеличение активности липазы из Mucor javanicus с увеличением концентрации положительно заряженного ПАМА относительно фермента (от 96 % при соотношении 1:1 до 116 % при соотношении 1:100) связано прежде всего с удалением отрицательно заряженных жирных кислот из реакционной смеси путем электростатического взаимодействия с полиэлектролитом и сдвигом равновесия в сторону образования продуктов реакции. Увеличение активности липазы на 52 % в случае эквимолярного соотношения фермента с ПСС можно объяснить закреплением каталитически выгодной конформации фермента в комплексе с ПСС.
Таким образом, активность липазы существенно зависит от заряда полиэлектролита и от концентрации его относительно фермента. Наилучшими для липазы из поджелудочной железы свиньи являются системы с ПСС 1:10 и 1:100, для липазы из Mucor javanicus – системы с ПАМА 1:100 или ПСС 1:1.
4.2.2 Изучение динамического поверхностного натяжения систем липазы из поджелудочной железы свиньи с природными и синтетическими полиэлектролитами
Для оценки взаимодействия липазы с полиэлектролитами в растворе и на границе раздела фаз вода/воздух было исследовано динамическое поверхностное натяжение (ДПН) подобных комплексов при различных соотношениях липаза : полиэлектролит. Изучение динамического поверхностного натяжения может дать ценную информацию для понимания механизмов адсорбции молекул на границе раздела фаз, что особенно важно для данных исследований, поскольку известно свойство липаз активироваться на границе раздела фаз масло/вода и гидрофобных поверхностях. Известно, что слишком низкое поверхностное давление, то есть, слишком высокое поверхностное натяжение, может привести к необратимой денатурации липазы, а очень высокое поверхностное давление (низкое поверхностное натяжение) уменьшает активность липазы в результате недоступности субстрата к активному центру липазы.
Впервые исследовано динамическое поверхностное натяжение раствора липазы в присутствии природного полимера – бычьего сывороточного альбумина, а также в присутствии синтетических полиэлектролитов – положительно заряженных полилизина и полидиаллилдиметиламмоний хлорида, и отрицательно заряженных – полиглутаминовой кислоты и полистиролсульфоната натрия.
4.2.3 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в смеси с полистиролсульфонатом натрия
Поверхностное натяжение раствора липазы из поджелудочной железы свиньи было измерено в присутствии отрицательно заряженного синтетического полимера полистиролсульфоната натрия (ПСС) при молярных соотношениях липаза : ПСС 1:100, 1:10, 1:1, 10:1, 100:1 (рис. 11-16).
 |
| Рисунок 11 - Зависимость поверхностного натяжения раствора ПСС от времени существования поверхности. |
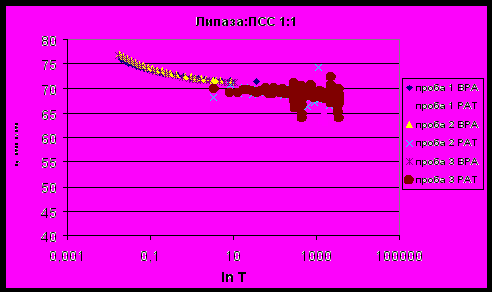 |
| Рисунок 12 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:1 от времени существования поверхности. |
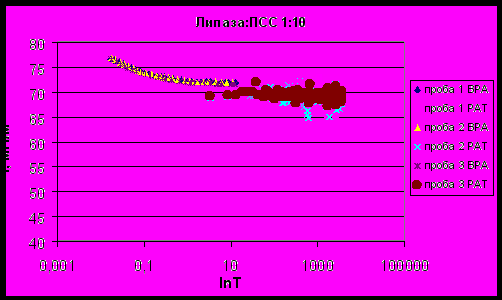 |
| Рисунок 13 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:10 от времени существования поверхности. |
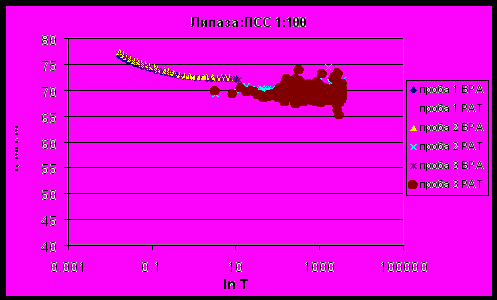 |
| Рисунок 14 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:100 от времени существования поверхности. |
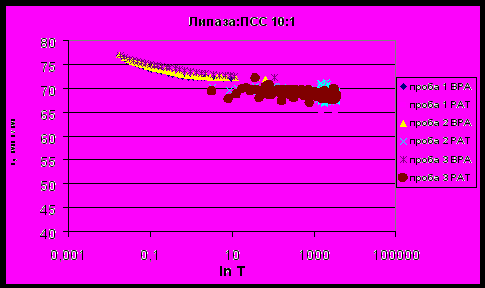 |
| Рисунок 15 - Зависимость поверхностного натяжения смеси липаза : ПСС 10:1 от времени существования поверхности. |
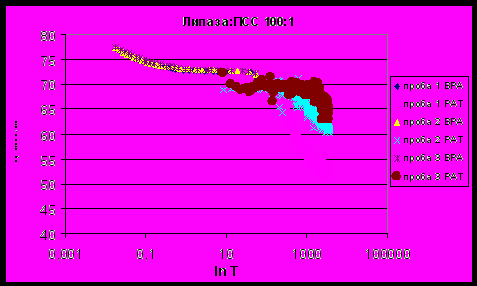 |
| Рисунок 16 - Зависимость поверхностного натяжения смеси липаза : ПСС 100:1 от времени существования поверхности. |
Из полученных тензиограмм были рассчитаны показатели поверхностного натяжения в динамике (табл. 2). При коротких временах существования поверхности 0,01 и 0,1 с ПН растворов ПСС и смесей липаза : ПСС в различных соотношениях близко к ПН воды и незначительно изменяется от 75,73±0,11 до 78,21±0,15 мН/м (эти значения соответствуют ПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм увеличивается на 3-5 мН∙м-1с1/2 при добавлении ПСС к раствору липазы.
Полистиролсульфонат натрия является поверхностно неактивным соединением, как и все остальные полиэлектролиты. Его ПН соответствует динамическому поверхностному натяжению воды, и лишь незначительно ниже при длинных временах существования поверхности. При длинных временах существования поверхности σ4 раствора липазы меньше, чем ПН раствора ПСС на 26 мН/м.
При временах жизни 1 и 100 с различия в σ2 и σ3 смесей липаза : ПСС еще не видны. ПН изменяется от 70,61±0,33 до 73,00±0,17 мН/м.
Таблица 2 - Показатели поверхностного натяжения смеси липаза:ПСС при различных временах существования поверхности 0,01 с (σ0), 0,1 с (σ1), 1 с (σ2), 100с (σ3) и 3500 c (σ4), а также углы наклона тензиограмм (λ0, λ1).
| Соотношение липаза:ПСС | σ0 | σ1 | σ2 | σ3 | σ4 | λ0 | λ1 |
| 0:1 | 77,71 ±0,17 | 77,95 ±0,21 | 72,30 ±0,04 | 71,68 ±0,08 | 69,18 ±0,11 | 10,27 ±0,27 | 0,95 ±0,14 |
| 1:100 | 77,53 ±0,50 | 77,59 ±0,47 | 72,34 ±0,14 | 71,84 ±0,23 | 68,76 ±0,66 | 10,38 ±0,46 | 0,68 ±0,11 |
| 1:10 | 77,32 ±0,07 | 77,46 ±0,11 | 71,95 ±0,16 | 71,52 ±0,15 | 68,71 ±0,06 | 10,24 ±0,39 | 0,39 ±0,07 |
| 1:1 | 77,10 ±0,57 | 77,30 ±0,63 | 72,01 ±0,17 | 71,18 ±0,10 | 66,61 ±0,74 | 9,27 ±1,01 | 0,63 ±0,13 |
| 10:1 | 77,42 ±0,19 | 77,55 ±0,06 | 72,81 ±0,63 | 71,92 ±0,31 | 67,28 ±0,58 | 8,62 ±0,17 | 0,89 ±0,08 |
| 100:1 | 77,97 ±0,14 | 78,21 ±0,15 | 73,00 ±0,17 | 72,03 ±0,27 | 54,98 ±3,16 | 9,67 ±0,32 | 1,72 ±0,21 |
| 1:0 | 75,73 ±0,11 | 76,73 ±0,16 | 71,68 ±0,06 | 70,61 ±0,33 | 42,86 ±1,18 | 5,32 ±0,46 | 1,19 ±0,60 |
В случае смесей липаза : ПСС показательным также является лишь значение поверхностного натяжения при длинных временах существования поверхности - σ4 (рис.17). В отличие от смесей липазы с полилизином и полиглутаминовой кислотой поверхностное натяжение смесей липаза : ПСС практически при всех соотношениях (1:100, 1:10, 1:1, 10:1) близко к ПН поверхностно неактивного ПСС. Лишь при самой маленькой относительной концентрации ПСС (100:1) σ4 снижается на 13,8 мН/м до 54,98±3,16 мН/м, но это значение тем не менее на 12 мН/м больше ПН индивидуального раствора липазы. Это, как и в случае с отрицательно заряженной полиглутаминовой кислотой, может объяснятся образованием комплекса между ПСС и липазой за счет гидрофобных взаимодействий.
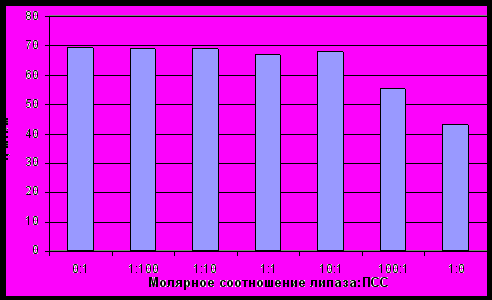 |
| Рисунок 17 - Поверхностное натяжение (σ4) комплексов липаза : ПСС при различных молярных соотношениях. |
4.2.4 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в смеси с полидиаллилдиметиламмоний хлоридом
Поверхностное натяжение раствора липазы из поджелудочной железы свиньи было измерено в присутствии положительно заряженного полимера полидиаллилдиметиламмоний хлорида (ПАМА) при молярных соотношениях липаза : ПАМА 1:100, 1:10, 1:1, 10:1, 100:1 (рис.18-23).
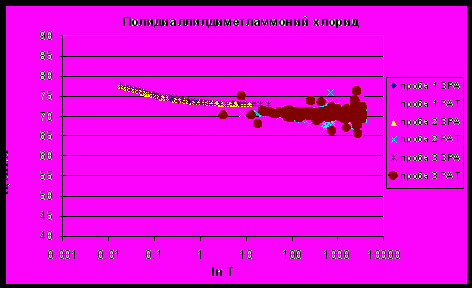 |
| Рисунок 18 - Зависимость поверхностного натяжения раствора полидиаллилдиметиламмоний хлорида от времени существования поверхности. |
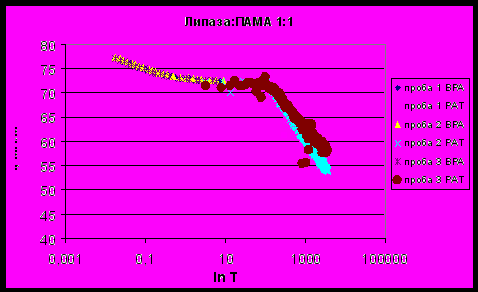 |
| Рисунок 19 - Зависимость поверхностного натяжения смеси липаза : ПАМА 1:1 от времени существования поверхности. |
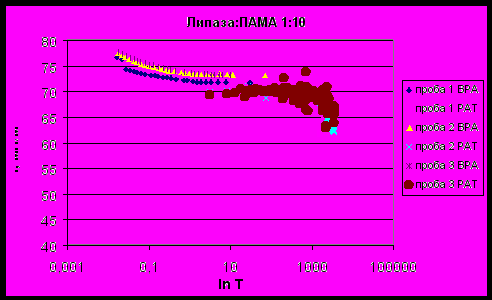 |
| Рисунок 20 - Зависимость поверхностного натяжения смеси липаза : ПАМА 1:10 от времени существования поверхности. |
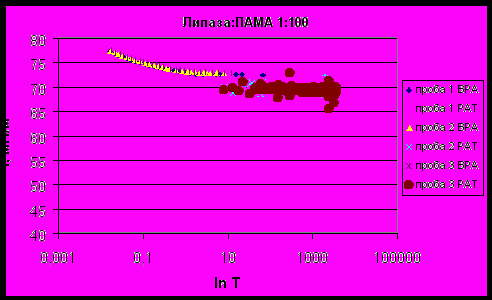 |
| Рисунок 21 - Зависимость поверхностного натяжения смеси липаза : ПАМА 1:100 от времени существования поверхности. |
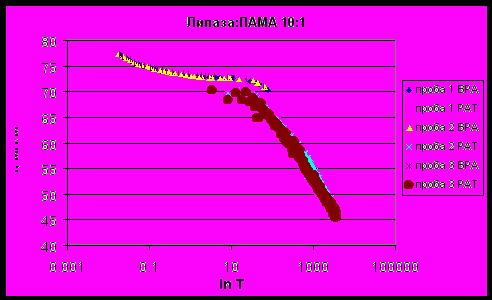 |
| Рисунок 22 - Зависимость поверхностного натяжения смеси липаза : ПАМА 10:1 от времени существования поверхности. |
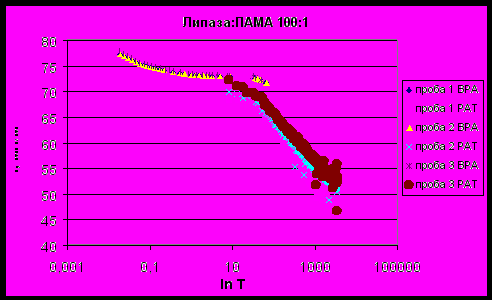 |
| Рисунок 23 - Зависимость поверхностного натяжения смеси липаза : ПАМА 100:1 от времени существования поверхности. |
Из полученных тензиограмм были рассчитаны показатели поверхностного натяжения в динамике. При коротких временах существования поверхности 0,01 и 0,1 с ПН растворов ПАМА и смесей липаза : ПАМА в различных соотношениях близко к ПН воды и незначительно изменяется от 75,73±0,11 до 78,33±0,20 мН/м (эти значения соответствуют ПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм увеличивается на 3-4 мН∙м-1с1/2 при добавлении ПАМА к раствору липазы.
Полидиаллилдиметиламмоний хлорид является поверхностно неактивным соединением, как и все остальные полиэлектролиты, его ПН соответствует динамическому поверхностному натяжению воды, и лишь незначительно ниже при длинных временах существования поверхности. При длинных временах существования поверхности σ4 раствора липазы меньше, чем ПН раствора ПАМА на 27 мН/м.
При временах жизни 1 и 100 с различия в σ2 и σ3 смесей липаза : ПАМА еще не видны. ПН изменяется от 70,51±0,35 до 73,45±0,08 мН/м.
Самым информативным показателем, также как для смесей липазы с другими полиэлектролитами, оказался параметр динамического поверхностного натяжения - σ4 (рис.24).
Поверхностное натяжение снижается на 5 мН/м уже при соотношении 1:10 и еще на 14 мН/м при уменьшении относительной концентрации ПАМА в 10 раз (соотношение 1:1), что может быть объяснено электростатическим взаимодействием между отрицательно заряженной липазой и положительно заряженным полидиаллилдиметиламмоний хлоридом и образованием гидрофобного комплекса, стремящегося на поверхность раздела фаз. При избытке липазы (соотношения липаза : ПАМА 10:1 и 100:1) σ4 близко к ПН чистой липазы. Таким образом, общее снижение σ4 при увеличении содержания фермента от 1:100 до 100:1 для системы липазы с ПАМА составило 22,5 мН/м.
 |
| Рисунок 24 - Поверхностное натяжение (σ4) комплексов липаза : ПАМА при различных молярных соотношениях. |
