Протокол № от Юсупова Л. Я. Председатель ЦК горина И. А
| Вид материала | Документы |
СодержаниеНомер варианта |
- Юсупова Алсу Харисовна (Ф. И. О. учителя) Расмотрено на заседании педагогического совета, 516.06kb.
- Протокол, 387.64kb.
- Протокол рабочего совещания мкс в Великом Новгороде, 96.26kb.
- Председатель Совета Школы №11 Утвержден приказом № от 28. 08. 2011 Директор моу сош, 1244.91kb.
- Т. Е. Протокол № от 2010г. Публичный доклад, 222.23kb.
- Председатель Совета Протокол №30 от 12 мая 2011г. Председатель Общего Собрания акционеров, 226.69kb.
- Оргкомитет конференции: Председатель, 64.43kb.
- Программа обсуждена на заседании кафедры Протокол №3 от " 29 " сентября 2007 г. Зав, 663.47kb.
- Председатель Управляющего Совета Тебякина Е. Ф. Колесов А. А. г г. Протокол № программа, 429.37kb.
- Протокол о допуске к участию в конкурсе по государственному закупу работ, 231.77kb.
Федеральное агентство по образованию
ФГОУ СПО «Уфимский механико-технологический колледж»
Организация самостоятельной работы
по дисциплине
«Физическая и коллоидная химия»
| | Разработал преподаватель |
| | Горина И.А. |
| | |
| Согласовано______________ | |
| | Рассмотрено на заседании ЦК ЕНД |
| Методист УМТК_______________ | Протокол № ___от «_____________ |
| Юсупова Л.Я. | Председатель ЦК _______________ |
| | Горина И.А. |
2008
Вопросы для самостоятельного изучения
Модуль I «Агрегатные состояния вещества»
1. Охарактеризуйте газообразное, жидкое и твердое состояние вещества.
2. Что такое идеальное и реальные газы?
3. Напишите уравнение газового состояния Менделеева-Клайперона.
4. Какова размерность универсальной газовой постоянной и ее величина.
5. Напишите уравнение Ван-дер-Ваальса. Объясните физический смысл
поправок в этом уравнении.
6. Какая температура является критической для газов?
7. Что такое вязкость? В каких единицах она измеряется?
8. Как отличить кристаллическое вещество от аморфного?
Модуль II «Основы химической термодинамики»
1. Что изучает термодинамика? Что называется термодинамической системой? Какие виды систем Вы знаете?
2. Как формулируется первое начало термодинамики?
3. Что такое энтальпия?
4. Каково содержание второго закона термодинамики?
5. Что изучает термохимия?
6. Как читается закон Гесса?
7. Какие уравнения называются термохимическими?
8. Дайте определение теплоте образования.
9. Что называется теплотой сгорания?
Модуль III «Фазовые равновесия и растворы»
1. Дайте определение понятиям фаза, компонент, степень свободы.
2. Что называется фазовым переходом и фазовым равновесием?
3. Как считается правило фаз?
4. Что такое раствор?
5. Что называется диффузией?
6. Что такое осмос? От чего зависит осмотическое давление раствора?
7. По какой формуле рассчитывается осмотическое давление?
8. Сформулируете закон Рауля.
9. Напишите формулы, выражающие зависимость повышения температуры кипения и понижения температуры замерзания от изменения концентрации раствора.
10. Дайте определение криоскопической и эбулиоскопической постоянной растворителя.
Модуль IV «Химическая кинетика»
1. Что называется скорость химической реакции?
2. Что изучает химическая кинетика?
3. Какие задачи ставит перед собой химическая кинетика?
4. Как количественно выражается скорость химической реакции?
5. Факторы, влияющие на скорость химической реакции
6. Влияние на скорость химической реакции изменение концентрации. Закон действующих масс.
7. Правило Вант-Гоффа. Влияние на скорость реакции температуры
8. Влияние на скорость химической реакции катализатора
9. Что такое катализ?
10. Виды катализа:
а) гомогенный катализ;
б) гетерогенный катализ
11. Ферментативный катализ. Ферментативный катализ в пищевой промышленности.
12. Цепные реакции
13. Фотохимические реакции
14. Фотосинтез
15. Значение фотосинтеза в круговороте веществ?
16. Kaкие реакции называются обратимыми?
17. Что такое химическое равновесие?
18. Константа равновесия
19. Принцип Ле-Шателье
20. Смещение состояния химического равновесия по принципу Ле-Шателье.
21. Правило фаз.
22. Тройная точка воды.
Модуль V «Поверхностные явления. Сорбция. Адсорбция»
1. Что называется сорбцией? Какие виды сорбции Вы знаете?
2. От каких факторов зависит адсорбция?
3. Какие вещества называются поверхностно-активными? Какое строение
имеют дифильные молекулы?
4. Как изменяется поверхностная активность от длины углеводородной цепи молекулы ПАВ?
5. Основные положения теории молекулярной адсорбции?
6. Как влияет на молекулярную адсорбцию из растворов природа растворителя, адсорбента, растворенного вещества?
7. Укажите области применения ПАВ в пищевой промышленности.
8. В чем состоит гидрофобилизация и и гидрофилизация поверхности?
9. В чем состоит сущность хромотографического метода? Применение хроматографии в пищевой промышленности.
10. Применение адсорбции в пищевой промышленности.
Модуль VI «Дисперсные системы. Свойства дисперсных систем»
1. Что называется дисперсной системой, дисперсной фазой, дисперсионной
средой?
2. Приведите схему классификацию дисперсных систем.
3. Какие основные признаки коллоидных систем?
4. Назовите методы получения коллоидных систем. Укажите их сущность. 5. Какие методы очистки золей Вы знаете?
6. Какими оптическими свойствами обладают коллоидные системы?
7. В чем сущность брауновского движения?
8. Что понимают под кинетической устойчивостью коллоидных систем?
9. Сущность электролитических явлений. Применение электрофореза и
электроосмоса.
10. Какие ионы называются потенциал определяющими и противоионами? Какой слой ионов называется адсорбционным и какой диффузным?
11. Что такое коагуляция и какие причины ее вызывают?
12. Дайте определение термодинамического и электрокинетического потенциала.
13. Какое состояние золя называется изоэлектрическим?
14. Изложите сущность пептизации.
Модуль VII «Микрогетерогенные грубодисперсные»
1. Что называется прямыми и обратными эмульсиями?
2. Какие вещества применяются в качестве эмульгаторов и каков принцип их
действия?
3. Какие вещества относятся к пищевым пенообразователям? Приведите примеры пищевых продуктов, имеющих структуру пены?
4. Что представляют собой суспензии?
5. Какие дисперсные системы называются аэрозолями? Дайте их классификацию.
6. Какие методы разрушения аэрозолей Вы знаете?
7. В чем промышленное значение микрогетерогенных систем?
Модуль VIII «Коллоидные ПАВ»
1. Какие вещества относятся к коллоидным поверхностно-активным?
2. Объясните строение мицеллы мыла в водной среде.
3. Каковы факторы устойчивости коллоидных ПАВ?
4. Что такое критическая концентрация мицеллообразования К'КМ?
5. Чем объясняется моющее действие мыла?
6. Что называется сольюбилизацией?
Модуль XI «Высокомолекулярные соединения и их растворы»
1. Приведите примеры природных и синтетических высокомолекулярных соединений.
2. Что такое набухание? Каково его значение?
3. Укажите стадии набухания.
4. Что называется студнями?
5. В чем проявляется сходство растворов ВМС с коллоидными растворами? В чем различие?
6. По каким признакам растворы ВМС можно отнести к истинным растворам?
7. Что такое изоэлектрическая точка?
8. В чем защитное действие ВМС?
Вопросы для самостоятельного изучения
1. Твердое состояние. Типы кристаллических решеток.
2. Общая характеристика растворов.
3. Растворимость; газов в жидкостях.
4. Мембранная технология.
5. Методы хроматографии. Ионно-обменная адсорбция; применения ее в
пищевой промышленности.
6. Строение мицеллы. Электрокинетический и термодинамический потенциалы.
7. Подготовка рефератов, докладов, творческих работ.
Примерные темы рефератов, докладов, творческих работ
1. Зависимость вязкости кисломолочных продуктов от содержания жира.
2. Дисперсные системы в пищевой промышленности: эмульсии, суспензии, аэрозоли.
3. Проблема эмульсий и пен в пищевой промышленности.
4. Поверхностноактивные вещества и применение их в пищевой промышленности.
5. Студни и студнеобразование в пищевой промышленности.
6. Растворимость газов в жидкостях. Получение газированных напитков.
7. Применение процесса экстракции в пищевой промышленности.
8. Особенности взаимной растворимости жидкостей. Явление концентрации.
9. Диффузия и осмос в живой природе. Применение диффузии и осмоса в пищевой промышленности.
10. Законы Рауля. Криоскопия и эбуллиоскопия в ТХК пищевых производств.
11. Законы Коновалова, перегонка. Ректификация.
12. Сорбция. Адсорбция в пищевой промышленности.
13. Хроматография в пищевой промышленности и ТХК пищевых производств.
14. Мицеллообразование в пищевых системах.
15. Процессы коагуляции в пищевых системах.
16. Применение электрофореза и электроосмоса в пищевых производствах.
17. Тиксотропия и синерезис в пищевых системах.
Задачи по теме: «Агрегатные состояние вещества»
1. В баллоне емкостью 12 л при температуре 00 С находится 100 г кислорода. Определить давление в баллоне.
2. Привести к н.у. условиям газ, который при давлении 93280 Па и температуре 250C занимает объем 1,5 м.
3. Определить массу водорода, занимающего объем 6 литров при температуре 20°С и давление 103990 Па.
4. Определить молярную массу газа, если при температуре 20°С и давлении 104000 Па масса 600 см3 газа составляет 1,56 г.
5. Газ при вдавление 202650 Па и температуре 170 С занимает 1,5 м. Привести газ к нормальным условиям.
6. Определить давление, под которым будут находится 20 г оксида углерода (II) в сосуде емкостью 10 л при температуре 1200С.
7. Объем 0,96 г паров ацетона при температуре 870С и давлении 98659 Па равен 500 см3. Вычислить молярную массу ацетона.
8. Определить массу азота, занимающего объем 20 л при температуре 230С и давлении 506620 Па
9. Какой объем занимают 450 г HCI при н.у.?
10. Какой объем занимает 200 г воздуха при температуре 170С и давлении 152000 Па? Молярная масса воздуха Мвозд. = 29 кг/кмоль.
11. При 170С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 1000С, если давление остается неизменным?
12. Давление газа, занимающего объем 2,5 л, равно 121,6 кПа (912 мм.рт.ст). Чему будет равно давления, если не изменяя температуры, сжать газ до объема в 1 л?
13. При 270С и давление 720 мм.рт.ст объем газа равнее 5 л. Какой объем займет это же количество газов при 390С и давлении 104 кПа?
14. При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до -330С?
15. При нормальных условиях 1 г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 00С и давлении, равном 93,3 кПа (700 мм.рт.ст).
16. Давление газа 100 кпа (750 мм.рт.ст). Каким станет давление газа, если нагреть сосуд до 300С?
17. В стальном баллоне объемом 12 л находится при 00С кислород под давлением 15,2 мПа. Какой объем кислорода, находящегося при нормальных условиях, можно получить из такого баллона?
18. Температура азота, находящегося в стальном баллоне под давлением 12,5 мПа, равна 170С. Предельное давление для баллона 20,3 мПа. При какой температуре давление азота достигнет предельного значения?
19. При давлении 98,7 кПа и температуре 910С некоторое количество газа занимает объем 680 мл. Найти объем газа при н.у.
20. Какой объем при нормальном давлении займут дымовые газы, если объем той же самой массы газов при давлении 840 мм.рт.ст и неизменной температуре равны 10 м3? (Давление выразить в Па).
21. Баллон объемом 30 л содержит 1 кг СО2. вычислите давление в баллоне при 300С.
22. В закрытом баллоне объемом 40 л находится 70 г СО2. Манометр, присоединенный к баллону, показывает давление 800 мм.рт.ст. Вычислите температуру газа. Давление переведите в Па.
23. При 390С и 741 мм.рт.ст (переведите в Па) масса 640 мл газа равна 1,73 г. Вычислите молярную массу газа.
24. При 00С и 896 мм.рт.ст 1 моль N2 занимает объем 19 л. Какой объем он займет при нормальных условиях?
25. Некоторое количество газа при давлении 1 атм. занимает объем 32 л. Какому давлению необходимо подвергнуть газ при постоянной температуре, чтобы его объем стал равным 25 л?
26. Через нижнее сеяние дымовой трубы при 5000С в 1 с проходит 5 м дымовых газов. Определить их объем в верхней части дымовой трубы при температуре 500С.
27. При 600С газ занимает объем 35,5 м3. До какой температуры нужно охладить газ при неизменном давлении, чтобы его объем стал равным 30 м3?
28. Стальной баллон заполнен азотом при 150 атм (переведите в Па) и 180С. Предельное давление для баллона 200 атм. При какой температуре давление азота достигнет этой величины?
29. Пары 0,0240 кг вещества при 270С и 912 мм.рт.ст занимают объем 0,0250 м . Какова молярная масса этого вещества?
30. В емкости объемом 1500 м при -250С и 4,00 атм содержится этилен. Определите его массу. Каким станет давление газа в емкости, если температура повысится до 250С?
Задачи по теме: «Термохимии. Закон Гесса»
1. Вычислите, сколько тепла выделится при сгорании 100 литров (н.у.) углеводородов. Реакция горения протекает по уравнению:
для I подгруппы:
1. С2Н6 (г) + 3,5 О2 (г) → 2СО2 (г) + 2Н2О (ж) + 1559,9 кДж
2. С2Н2 (г) + 2,5 О2 (г) → 2СО2 (г) + Н2О (ж) + 1299,63 кДж
3. С2Н4 (г) + 3 О2 (г) → 2СО2 (г) + 2Н2О (ж) + 1410,97 кДж
4. С3Н8 (г) + 5 02 (г) → 3СО2 (г) + 4Н2О (ж) + 2219,99 кДж
5. С3Н6 (г) + 4,5 02 (г) → 3СО2 (г) + ЗН2О (ж) + 2017,64 кДж
6. С4Н10 (г) + 6,5 02 (г) → 4СО2 (г) + 5Н2О (ж) + 3127,94 кДж
7. С4Н8 (г) + 6 О2 (г) → 4СО2 (г) + 4Н2О (ж) + 2718,51 кДж
8. С4Н6 (г) + 5,5 О2 (г) → 4СО2 (г) + ЗН2О (ж) + 2543,46 кДж
9. С5Н,2 (г) + 8 О2 (г) → 5СО2 (г) + 6Н2О (ж) + 3536,19 кДж
10. С5Н10 (г) + 7,5 О2 (г) → 5СО2 (г) + 5Н2О (ж) + 3319,51 кДж
11. С3Н4 (г) + 4 О2 (г) → 3СО2 (г) + 2Н2О (ж) + 1944,31 кДж
12. С6Н6 (г) + 7,5 О2 (г) → 6СО2 (г) + ЗН2О (ж) + 2190,98 кДж
13. С6Н12 (г) + 9 О2 (г) → 6СО2 (г) + 6Н2О (ж) + 2772,47 кДж
14. С6Н14 (г) + 9,5 О2 (г) → 6СО2 (г) + 7Н2О (ж) + 3414,22 кДж
15. С6Н8 (г) + 8 О2 (г) → 6СО2 (г) + 4Н2О (ж) + 2331,97 кДж
для II подгруппы:
1. С2Н5ОН (г) + 3 О2 (г) → 2СО2 (г) + 3Н2О (ж) + 1359 кДж
2. СН3ОН (г) + 1,5 О2 (г) → СО2 (г) + 2Н2О (ж) + 726,5 кДж
3. С6Н12О6 (кр) → 2С2Н5ОН (ж) + 2СО2 (г) + 675,6 кДж
4. С6Н12О6 (кр) + 6 О2 (г) → 6СО2 (г) + 6Н2О (ж) + 1250 кДж
5. С7Н16 (г) + 11 О2 (г) → 7СО2 (г) + 8Н2О (ж) + 4010 кДж
6. С7Н!4 (г) + 10,5 О2 (г) → 7СО2 (г) + 7Н2О (ж) + 4810 кДж
7. С7Н12 (г) + 10 О2 (г) → 7СО2 (г) + 6Н2О (ж) + 5100 кДж
8. С8Н18 (г) + 12,5 О2 (г) → 8СО2 (г) + 9Н2О (ж) + 5500 кДж
9. С8Н16 (г) + 12 О2 (г) → 8СО2 (г) + 8Н2О (ж) + 6500 кДж
10. С8Н14 (г) + О2 (г) → 8СО2 (г) + 5Н2О (ж) + 6750 кДж
11. С3Н6 (циклопропан) + 4,5 О2 (г) → 3СО2 (г) + 3Н2О (ж) + 2092,8 кДж
12. C6H5NH2 (ж) + 7,75 О2 (г) → 6СО2 (г) + 3,5Н2О (ж) + 0,5N2 (г) + 3396 кДж
13. СН3С1 (ж) + 3 О2 (г) → 2СО2 (г) + 2Н2О (ж) + 2HCI (г) + 1374 кДж
14. Н2 (г) +
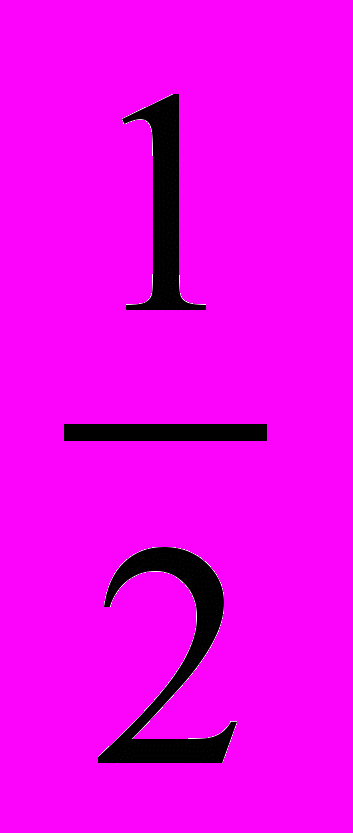 О2 (г) → Н2О (ж) + 571,7 кДж
О2 (г) → Н2О (ж) + 571,7 кДж15. 2SО2 (г) + О2 (г) → 2SО3 (г) + 196,6 кДж
2. Вычислите стандартный тепловой эффект реакции:
для I подгруппы:
1. 2СО (г) + 2Н2 (г) → СН4 (г) + СО2 (г)
2. СО (г) + 3Fe2О3 (кр) → 2Fe3О4 (кр) + СО2 (г)
3. СО (г) + Fe2О4 (кр) -> 3 FeO (кр) + СО2 (г)
4. 2СО (г) + 4Н2 (г) → 2С2Н5ОН (г) + Н2О (г)
5. 2NH3 (г) + 2О2 (г) → N2О (г) + 3Н2О (г)
6. 4NH3 (г) + 3О2 (г) → 2N2 (г) + 6Н2О (г)
7. 4NH3 (г) + 5О2 (г) → 4NO (г) + 6Н2О (г)
8. Са3(РО4)2 (кр) + 5С (графит) → 2Р (г) + 5CO (г) + 3СаО (кр)
9. CS2 (г) + 4Н2 (г) → 2H2S (г) + СН4 (г)
10. СН4 (г) + 4S4 (г) → CS2 (г) + 2H2S (г)
11. С2Н4(г) + Н2(г) → С2Н6(г)
12. СаСО3 (кр) → СаО (кр) + СО2 (г)
13. Са(ОН)2 (кр) + СО (г) → СаСО3 (кр) + Н2О (г)
14. 2СО (г) + SО2 (г) → S (т) + 2СО2 (г)
15. Са3(РО4)2 (кр)+ 3SiО2(кр)+5С(графит)→ 3CaSiО3 (кр)+2Р (белый)+5СО (г) для II подгруппы:
1. 2NО2 (г) + О3 → О3 (г) + N2О5 (г)
2. СН4 (г) + 2О2 → СО2 (г) + 2Н2О (г)
3. РС15 (т) + Н2О (г) → POCI (ж) + 2HCI (г)
4. С2Н5ОН (ж) → С2Н4 (г) + Н2О (ж)
5. 2H2S (г) + О2 → 2S (ТВ) + 2Н2О (г)
6. 4H2S (г) + 2SО2 (г) → 3S2 (г) + 4Н2О (г)
7. СН4 (г) + 2H2S (г) → CS2 (г) + 4Н2 (г)
8. FeO (кр) + СО (г) → Fe (кр) + СО2 (г)
9. 2NaNО3 (кр) → 2NaNО2 (кр) + О2 (г)
10. С6Н6 (ж) ЗН2 (г) → С6Н12(ж)
11. 2AgN03 (кр) → 2Ag (кр) + 2 NО2 (г) + О2 (г)
12. Н2 (г) + СО2 (г) → Н2О (г) + СО (г)
13. Fe3О4 (кр) + Н2(г) → 3FeO (кр) + Н2О (г)
14. 2NaHCО3 (кр) → Na2CО3 (г) + Н2О (г) + СО2 (г)
15. CS2 (ж) + 3О2 (г) → СО2 (г) + 2SО2 (г)
Растворы. Коллигативные свойства растворов
1. При 25°С давления насыщенного пара воды составляет 3,166 кПа (23,75 мм.рт.ст). Найти при той же температуре давление насыщенного пара над 5% водным раствором карбамида (мочевины) CO(NH2)2.
2. Рассчитать, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы С6Н12О6.
3. Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,860С, тогда как чистый эфир кипит при 35,60°С. Определить молекулярную массу вещества.
4. Чему равно осмотическое давление 0,5М раствора глюкозы C6H12О6 при 25°С?
5. вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 гр Н2О при 293K. Плотность раствора считать равной единице.
6. Определить молярную массу растворенного вещества. Если раствор, содержащий 12,2 г вещества в 1 л, при 17°С обладает осмотическим давлением 489 кПа.
7. Вычислить давление пара раствора 6,0 г нафталина С10Н8 в 90 г бензола С6Н6 при температуре 20°С. Давление паров бензола при данной температуре 9960 Па.
8. Сколько граммов фруктозы С6Н12О6 надо приготовить к 500 см3 воды, чтобы понизить температуру замерзания до -1°С кр = 1,86.
9. При какой температуре будет кипеть 10%-ый раствор мальтозы С12Н22О11, Кэб = 0,52.
10. Сколько граммов глюкозы С6Н12О6 должно находится в 0,5 л растворы, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина С3Н5(ОН)3?
11. Сколько граммов этанола С2Н5ОН нужно растворить в 300 см3 воды, чтобы осмотическое давление этого раствора при температуре 200С было равно 212780 Па?
12. Вычислить давление пара 12%-ного раствора глюкозы С6Н12О6 при температуре 25°С. Давление паров воды при этой же температуре 3168Па.
13. При какой, приблизительно, температуре будет замерзать водный 15%-ый раствор метанола СН3ОН? Ккр = 1,86.
14. На сколько градусов повысится температура кипения, если в 100 г воды растворить 11 г мочевины CO(NH2)2? Кэб = 0,52.
15. Рассчитать осмотическое давление раствора, содержащего 1,30 г анилина C6H5NH2 в 500 см воды при температуре 23 °С.
16. Давление пара воды при температуре 180С равно 2064 Па. Вычислить давление пара 20%-ного водного раствора ацетальдегида СН3СНО при этой температуре.
17. Сколько граммов глюкозы C6H12О6 содержится в 100 г воды, если раствор кипит при температуре 101°С? Кэб = 0,52.
18. При какой температуре будет замерзать раствор, содержащий 3 г нафталина С10Н8 в 40 г бензола. Температура замерзания бензола 5,3°С. Ккр = 5,1.
19.1 Чему равно осмотическое давление раствора сахарозы С12Н22О11, содержащего 125 г вещества в 2 л воды при температуре 150С?
20. Зная, что давление пара воды при температуре 17°С равно 1937 Па, определить давление 8%-ного водного раствора глюкозы С6Н12О6.
21. Найти температуру замерзания 7%-ного водного раствора глицерина
С3Н8О3,Ккр = 1,86;
22. На сколько градусов повысится температура кипения, если в 400 г воды
растворить 35 г мочевины CO(NH2)2. Кэб = 0,52.
23. Вычислить осмотическое давление раствора мочевины CO(NH2)2,
содержащего 0,55 г мочевины в 200 см воды при температуре 250С.
24. Зная, что давление пара воды при температуре 25°С равно 3168 Па,
определить давление 8%-ного водного раствора глюкозы С6Н12О6.
25. Сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы С6Н12О6.
26. При какой, приблизительно, температуре будет кристаллизоваться 40%-ый по массе) раствор этанола С2Н5ОН?
27. Рассчитать величину осмотического давления раствора, содержащего в одном литре 2,1 г формальдегида НСНО при температуре 120С.
28. При растворении 13 г вещества в 400 г воды температура кипения повысилась на 0,57°С. Определить молярную массу вещества.
29.При температуре 18°С давление водяного пара равно 2060 Па. Сколько растворить в 150 т Н2О, чтобы понизить давление пара на 130 Па?
30. Раствор, содержащий 9 г вещества в 100, 26°С. Определить молярную массу растворенного вещества, Кэб = 0,52.
Задачи по теме: «Строение мицеллы золей. Коагуляция золей»
I подгруппа
1. Даны растворы NaJ и AgNО3 (изб) Коагулятор: NaF, Ca(NО3)2; K2SО4
2. MgCI2 (изб) + NaOH; ядро Mg(OH)2
коагулятор: KCI, Zn(CH3COO)2; AICI3
3. Даны растворы: NH4CNS, AgNО3 (изб), ядро AgCNS
Коагулятор: KNО3; NaCH3COO, Na2SО4
4. Растворы: CaCI + Na2SО4 (изб) ядро: CaSО4
Коагулятор: ZnCI2; AICI3; NaCH3COOH
5. Даны растворы: BrCI2 + NH4OH (изб) ядро: Вг(ОН)2
Коагулятор: Na2SО4; ZnCI2; Fe(NО3)3
6. Растворы: (NH4)2S (изб) + AgNО3 ядро: Ag2S
Коагулятор: NaCI; Mg(NО3)2; AI(NО3)3
7. Растворы: AICI3 (изб) + NaOH ядро: AI(OH)3
Коагулятор: KCI; K2SО4; K3PО4
8. Растворы: NaJ; CaCI2; AICI3
9. Растворы: ZnCI2 (изб) + NaOH ядро: Zn(OH)2
Коагулятор: NaBr; Na2SО4; Na3PО4
10. Растворы: К2СrО4 (изб) + AgNО3 ядро: Ag2CrО4
Коагулятор: NaCI; FeCI2; AICI3
11. Даны ZnCI2 (изб) + (NH4)2S ядро: ZnS
Коагулятор: NaCI; NaBr; NaJ
12. Даны FeCI3 + KOH (изб) ядро: Fe(OH)3
Коагулятор: NaCI; KCI; CaCI2
13. Даны растворы: Ba(NО3)2 (изб) + K2SО4 ядро : BaSО4
Коагулятор: NaCI; Na2CО3; Na3PО4
14. Даны растворы: СоС12 (изб) + (NH4)2S ядро: CoS
Коагулятор: NaCI; K2SО4; CaCI
15. Даны растворы: Ni(NО3)2 (изб) + (NH4)2S ядро: NiS
Коагулятор: NH4CI; Na2SО4; SnCI2
16. Даны растворы: Pb(NО3)2 + HCI (изб) ядро: PbCI2
Коагулятор: KJ; Ca(NО3)2; A1CI3
17. Даны растворы: SnCI2 + (NH4)2S (изб) ядро: SnS
Коагулятор: Na2SО4; Ca(CH3COO)2; KCI
18. Даны растворы: CaCI2 +K2S (изб) ядро: CaS
Коагулятор: (NH4)2SО4; CaBr2; NaCI
19. Даны растворы: Pb(NО3)2 + KJ (изб) ядро: PbJ2
Коагулятор: KNО3; Fe(NО3)2; Fe(NО3)3
20. Растворы: Na2SiО3 (изб) + HCI ядро: H2SiО3
Коагулятор: Na2SО4; Al(NО3)3; NH4CI
21. Даны растворы: Pb(NО3)2 + H2SО4 (изб) ядро: PbSО4
Коагулятор: Zn(NО3)2; CH3COONa; Na2SО4
22. Даны растворы: CuCI2 (изб) + КОН ядро: Cu(OH)2
Коагулятор: NaNО3; Na2SО4; Na3PО4
23. Даны растворы: Cu(NО3)2 + Na2S (изб) ядро: CuS
Коагулятор: SiNQ3; NaN03; NaN03; KN03
II подгруппа
1. Даны растворы: Na2SiО3 (изб) + AgNО3 ядро: Ag2SiО3
Коагулятор: NaJ; MgJ2; A1J3
2. Даны растворы: Na2S + NiSО4 (изб) ядро: NiS
Коагулятор: NH4СI; Na2SО4; SrCI2
3. Даны растворы: Вi(NO3)2 (изб) + K2S ядро: Bi2S3
Коагулятор: NH4CH3COO; NaNО3; HCI
4. Даны растворы: AICI3 (изб) + КОН ядро: А1(ОН)3
Коагулятор: NaBr; NaJ; NaCI
5. Даны растворы: Na2CО3 (изб) + CaCI2 ядро: СаСО3
Коагулятор: KNО3; Ca(NО3)2; AI(NО3)3
6. Даны растворы: FeCI3 (изб) + КОН ядро: Fe(OH)3
Коагулятор: NaCI; Na2CО3; Na3PО4
7. Даны растворы: Na3PО4 (изб) + AgNО3 ядро: Ag2PО4
Коагулятор: NaCI; CaCI2; A1CI3
8. Даны растворы: Na2SО3 (изб) + Hg(NО3)2 ядро: HgSО3
Коагулятор: NaCI; KCI; RbCI
9. Даны растворы: Мn(NOз)2 (изб) + Na2SiО3 ядро: MnSiО3
Коагулятор: NaCJ; Na2SО4; Na3PО4
10. Даны растворы: Sn(NО3)2 + К(ОН) (изб) ядро: Sn(OH)2
Коагулятор: NaCl; Na2SО4; Na3PО4
11. Даны растворы: Mg(NО3)2 + K2SiО3 (изб) ядро: MgSiО3
Коагулятор: NaCI; CaCI2; FeCI3
12. Даны растворы: СоС12 (изб) + Na3PО4 ядро: Со3(РО4)2
Коагулятор: NaCI; NaBr; NaJ
13. Даны растворы: K2SiО3 + H2SО4 (изб) ядро: H2SiО3
Коагулятор: NaCJ; Na2CО3; Na3PО4
14. Даны растворы: Zn(NО3)2 (изб) + Na2CО3 ядро: ZnCО3
Коагулятор: NaCI; NaJ; NaBr
15. Даны растворы: MnCI2 (изб) + NaOH ядро: Мn(ОН)2
Коагулятор: NaCI; NaJ; CH3COONa
16. Даны растворы: Pb(NО3)2 + K2SО3 (изб) ядро: PbSО3
Коагулятор: NaCI; Mg(NО3)2; AICI3
17. Даны растворы: Co(NО3)2 + K3PО4 (изб) ядро: Со3(РО4)2
Коагулятор: NaCI; AICI3; FeCI2
18. Даны растворы: K2S + Hg(NО3)2 (изб) ядро: HgS
Коагулятор: NaCH3COO; NaCI; NaBr
19. Даны растворы: AICI3 (изб) + КОН ядро: А1(ОН)3
Коагулятор: NH4CI; (NH4)2SО4; (NH4)3PО4
20. Даны растворы: ZnCI2 + Na2S (изб) ядро: ZnS
Коагулятор: NaNО3; Ca(NО3)2; AI(NО3)3
21. Даны растворы: CoCI2 + Na3PО4 (изб) ядро: Со3(РО4)2
Коагулятор: KCI; CaCI2; AICI3
22. Даны растворы: Sr(NО3)2 + KF (изб) ядро: SrF2
Коагулятор: FeCI2; ZnCI2; NaCI
23. Даны растворы: ZnCI2 (изб) + К2СО3 ядро: ZnCО3
Коагулятор: NaCI; CH3COONa; NaJ
| I п/гр | II п/гр | ||
| Номер варианта | Задачи | Номер варианта | Задачи |
| 1 | 1,15,30 | 1' | 2,16,29 |
| 2 | 2,14,28 | 2' | 1,17,27 |
| 3 | 3,13,23 | У | 4,14,24 |
| 4 | 4,15,25 | 4' | 5,15,26 |
| 5 | 5,16,26 | 5' | 3,13,24 |
| 6 | 6,16,27 | 6' | 16,26,30 |
| 7 | 7,17,28 | 7' | 21,17,9 |
| 8 | 8,18,29 | 8' | 10,12,22 |
| 9 | 9,19,23 | 9' | 11,14,27 |
| 10 | 10,13,21 | 10' | 26,6,16 |
| 11 | 11,15,25 | 11' | 8,12,24 |
| 12 | 12,22,29 | 12' | 13,18,25 |
| 13 | 13,23,24 | 13' | 6,7,17 |
| 14 | 14,24,1 | 14' | 8,9,19 |
| 15 | 15,25,3 | 15' | 10,14,18 |
Модуль IV Химическая кинетика
1. Чему равен температурный коэффициент реакции, если при увеличении температуры на 600С скорость реакции возросла в 10 раз?
2. Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 700С, если температурный коэффициент реакции равен трем?
3. Как изменится скорость реакции 2NO (г) + О2 (г) → 2NO2 (г), если концентрация исходных веществ увеличить в 4 раза?
4. Реакция между веществами А и В протекает по уравнению А + 2 · В = С. Начальная концентрация вещества А равна 0,5 моль/л, а вещества В – 0,5 моль/л. Константа скорости данной реакции равна 0,4. Вычислить начальную скорость.
5. Взаимодействие между оксидом углерода и хлором идет по уравнению СО + СI2 → СОСI2. Концентрация оксида углерода 0,3 моль/л, а хлора 0,2 моль/л. Как изменится скорость реакции, если увеличить концентрацию хлора до 0,6 моль/л, а концентрацию оксида углерода до 1,2 моль/л?
6. В каком направлении сместится равновесие системы Н2S
 Н2S, если:
Н2S, если:а) увеличить концентрацию водорода;
б) понизить концентрацию Н2S?
7. В каком направлении сместится равновесие системы
3Fe (тв) + 4Н2О (г)
 Fe3O4 (тв) + 4Н2 (г), если:
Fe3O4 (тв) + 4Н2 (г), если:а) увеличить концентрацию водорода;
б) уменьшить концентрацию паров воды?
8. В каком направлении сместиться равновесие при повышении температуры в системах:
а) N2 (г) + О2
 2NО (г); ∆Н = 180 кДж;
2NО (г); ∆Н = 180 кДж;б) N2 (г) + 3Н2 (г)
 2NH3 (г); ∆Н = -88 кДж.
2NH3 (г); ∆Н = -88 кДж.9. В каком направлении сместиться равновесие при повышении давления в системах:
а) 2 NО (г) + О2 (г)
 2 NО2 (г);
2 NО2 (г);б) 4НСI (г) + О2
 2Н2О (ж) + 2СI2 (г);
2Н2О (ж) + 2СI2 (г);в) 2SО3 (г)
 2SО2 (г) + О2 (г)
2SО2 (г) + О2 (г)10. Две реакции протекали с такой скоростью, что за единицу времени в первой образовался сероводород массой 3 г, во второй – иодоводород массой 10 г. Какая из реакций протекала с большей скоростью?
11. Реакция при температуре 200С протекает за 3 мин 20 сек. За сколько времени закончится эта реакция при температуре 600С, если температурный коэффициент реакции равен 2?
12. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 64 раза? Температурный коэффициент скорости реакции равен 2?
13. При 200С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция: а) при 00С; б) при 500С? Температурный коэффициент скорости реакции равен 2.
14. При температуре 300С реакция протекает за 25 мин, при 500С – за 4 мин. Рассчитайте температурный коэффициент скорости реакции.
15. Скорость реакции при 00С равна 1 моль/л·с. Вычислите скорость этой реакции при 300С, если температурный коэффициент скорости реакции при 300С, если температурный коэффициент скорости реакции равен 3.
16. Реакция протекает по уравнению:
2SО2 (г) + О2 (г)
 2SО3 (ж), ∆Н0 = -284,2 кДж
2SО3 (ж), ∆Н0 = -284,2 кДжИзменение каких параметров можно добиться смещения равновесия в сторону образования оксида серы (VI)?
17. Как повлияет увеличение давления на равновесие в системах:
а) SО2 (г) + СI2 (г)
 SО2СI2 (г);
SО2СI2 (г);б) Н2 (г) + Br2 (г)
 2НBr (г)
2НBr (г)18. Как повлияет уменьшение температуры на равновесие в следующих системах:
а) А + В → 2 С, ∆Н0 = 50 кДж;
б) 2Д + Е → 2F, ∆Н0 = - 80 кДж
19. Как повлияет уменьшение давления на равновесия в реакциях:
а) N2О4
 2NО2;
2NО2; б) 2NО (г) + О2
 2NО2 (г);
2NО2 (г);в) 3Fe2O3 (к) + CO (г)
 2 Fe3O4 (к) + СО2 (г)
2 Fe3O4 (к) + СО2 (г)20. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 250С?
21. Как повлияет на равновесие следующих реакций:
а) 2Н2 (г) + О2 (г)
 2Н2О (г), ∆Н0 = -483,6 кДж;
2Н2О (г), ∆Н0 = -483,6 кДж;б) СаСО3 (кр)
 СаО (кр) + СО2 (г), ∆Н0 = 179 кДж;
СаО (кр) + СО2 (г), ∆Н0 = 179 кДж;а) повышение давления;
б) повышение температуры?
22. Указать, какими изменениями концентрацией реагирующих веществ можно сместить равновесие вправо реакции: СО2 (г) + С (графит)
 2СО (г)
2СО (г)23. В каком направлении сместится равновесие реакции
А2 (г) + В2 (г)
 2АВ (г), если давление увеличится в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.
2АВ (г), если давление увеличится в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скорости прямой и обратной реакции равны соответственно 2 и 3.24. Написать выражения для констант равновесия следующих реакций:
а) Н2О (г) + СО (г)
 СО2 (г) + Н2 (г);
СО2 (г) + Н2 (г);б) СО2 (г) + С (графит)
 2 СО (г);
2 СО (г);в) N2 (г) + 3Н2 (г)
 2NH3 (г)
2NH3 (г)25. Во сколько раз изменится скорость прямой реакции
2SО2 (г) + О2 (г)
 2SО3 (г), если:
2SО3 (г), если:а) увеличить давление в системе в 3 раза;
б) уменьшить объем в системе в 2 раза;
в) увеличить концентрацию О2 в 4 раза?
26. При 200С константа скорости некоторой реакции равна 10-4 мин-1, а при 500С – 8 · 10-4 мин-1. Чему равен температурный коэффициент скорости реакции?
27. Дана равновесная система: N2 (г) + 3 Н2 (г)
 2NН3 (г), ∆Н0 = -92,4 кДж
2NН3 (г), ∆Н0 = -92,4 кДжКакие факторы вызовут смещение равновесия в системе в сторону образования аммиака?
28. Равновесие в системе Н2 (г) + J2 (г)
 2 HJ (г) установилось при следующих концентрациях: [Н2] = 0,025 моль/л; [J2] = 0,005 моль/л; [НJ]=0,09 моль/л. Найти константу равновесия реакции.
2 HJ (г) установилось при следующих концентрациях: [Н2] = 0,025 моль/л; [J2] = 0,005 моль/л; [НJ]=0,09 моль/л. Найти константу равновесия реакции.29. При некоторой температуре равновесия в системе
2NО2 (г)
 2NО (г) + О2 (г) установилось при следующих концентрациях: [NО2] = 0,006 моль/л; [NО] =0,024 моль/л; [О2]= 0,012 моль/л. Найти константу равновесия реакции.
2NО (г) + О2 (г) установилось при следующих концентрациях: [NО2] = 0,006 моль/л; [NО] =0,024 моль/л; [О2]= 0,012 моль/л. Найти константу равновесия реакции.30. При 1500С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости равным 2,5; рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 2000С; б) при 800С.
