Предисловие
| Вид материала | Методическое пособие |
- Содержание предисловие 3 Введение, 2760.07kb.
- Томас Гэд предисловие Ричарда Брэнсона 4d брэндинг, 3576.37kb.
- Электронная библиотека студента Православного Гуманитарного Университета, 3857.93kb.
- Е. А. Стребелева предисловие,, 1788.12kb.
- Breach Science Publishers». Предисловие. [3] Мне доставляет удовольствие написать предисловие, 3612.65kb.
- Том Хорнер. Все о бультерьерах Предисловие, 3218.12kb.
- Предисловие предисловие petro-canada. Beyond today’s standards, 9127.08kb.
- Библейское понимание лидерства Предисловие, 2249.81kb.
- Перевод с английского А. Н. Нестеренко Предисловие и научное редактирование, 2459.72kb.
- Тесты, 4412.42kb.
Занятие № 7
Тема: Санитарно-бактериологическое изучение природных биоценозов.
Цель занятия: Обучить санитарно-бактериологическим методам исследования природных биоценозов.
Материалы и оборудование: Колба Бунсена, фильтр Зейтца, расплавленный МПА, чашки Петри со средой Эндо, стерильные чашки Петри, стерильные градуированные пипетки, чашки Петри с МПА, чашки Петри с кровяным агаром, почвенная болтушка в разведении 1: 10.
Демонстрация:
1. Аппарат Кротова для определения наличия гемолитического стафилококка в воздухе
Вопросы для обсуждения:
1. Свойства микроорганизмов, определяющие их повсеместное распространение в природе.
2. Сапробность и микробное число воды.
3. Оценка степени загрязнения воды бактериями группы кишечной палочки (БГКП). Понятия Coli-титра и Coli-индекса.
4. Микрофлора воздуха. Общая бактериальная обсемененность воздуха.
5. Методы определения санитарно-бактериологического состояния воздуха: аспирационный, седиментационный.
6. Микрофлора почвы: методы определения санитарно-бактериологического состояния почвы. Классификация почв по степени загрязнения.
I. Микрофлора воды
Микрофлора воды делится по составу микробиоценозов на микрофлору подземных вод (артезианской, ключевой), микрофлору поверхностных вод (рек, озер, водохранилищ) и микрофлору питьевой воды. Степень загрязнения водоемов органическими веществами и наличие в них микроорганизмов соответствует определенным зонам сапробности:
1. Олигосапробная зона содержит мало органических веществ и мало бактерий от 10 до 1000 в 1 мл воды;
- Мезосапробная зона – зона более загрязненной воды, где происходит минерализация органических веществ с интенсивным окислением и
выраженной нитрификацией. Количество бактериальных клеток меньше 100 000 в 1 мл;
- Полисапробная зона – зона сильного загрязнения: бедна кислородом, богата органическимим соединениями. Число бактерий в ней доходит до 1000000 и более в 1 мл. Преобладают E.coli и анаэробы, вызывающие процессы гниения и брожения.
Наличие E.coli в воде является признаком свежего фикального загрязнения и наличия в воде патогенных микроорганизмов. При санитарно-бактериологическом исследовании воды выделяют бактерии группы кишечной палочки (БГКП), определяют Coli-T, Coli-Ind, общее микробное число воды (ОМЧ воды) и другие показатели (табл. 1).
К БГКП относят Гр (-) микроорганизмы, не образующие спор, сбраживающие лактозу с образованием кислоты и газа и не обладающие оксидазной активностью. Coli-Т это наименьшее количество жидкости в миллилитрах, в котором содержится 1 E.coli. Coli-Ind это количество особей E.coli, которое находится в 1 литре.
Т а б л и ц а 1
Оценка эпидемиологической опасности воды
по индикаторным микроорганизмам
| № | Показатели оценки | Ед. измерения | Норматив |
| 1 | Термотолерантные колиформные бактерии (до 37 o С) | Число бактерий в 100 мл (ранее было 333) | отсутствие |
| 2 | Общие колиформные бактерии | Число бактерий в 100 мл (ранее было 333) | отсутствие |
| 3 | ОМЧ | Число образовавшихся колоний в 1 мл | 50 |
| 4 | Колифаги (индикатор загрязнения воды вирусами) | Число бляшкообр.ед. в 100 мл | Должны отсутствовать в 100 мл |
| 5 | Споры | Число спор в 20 мл | отсутствие |
| 6 | Цисты лямблий | Число цист в 50 мл | отсутствие |
Методы санитарно-бактериологического исследования воды:
1. Метод двухфазной бродильной пробы. Сущность метода заключается в посеве заданного объема воды в среду Эйкмана (глюкозо-пептонную среду). Общий объем воды открытых водоемов 111.1 мл ( 100, 10, 1, 0.1), а для водопроводной воды 333 мл ( 3 объема по 100 мл, 3 объема по 10 мл, и 3 объема по 1 мл). Посевы выдерживают в течение 24 часов в термостате
при 43оС, при этой температуре развивается только кишечная палочка теплокровных животных и человека, а другие микроорганизмы угнетены. На вторые сутки все объемы воды проверяются, отмечаются подозрительные на наличие E. coli (где обнаружены муть и газ в поплавках). Затем производят отсев бактериологической петлей на среду Эндо (или розоловый дифференциальный агар – РДА) и инкубируют при 37оС 18 часов. Затем из ярко-красных колоний с бронзовым отсветом делают мазки, окрашивают по Граму и осуществляют дифференциацию кишечной палочки.
2. Метод глубинного посева. Этим методом определяют общее микробное число микроорганизмов воды. В стерильной чашке Петри исследуемую воду в объеме 1 мл заливают расплавленным и остуженным до 45оС МПА (15 мл). Инкубируют посев в термостате при 37оС в течение 48 часов и подсчитывают число колоний.
- Метод мембранных фильтров. Данным методом определяют Coli-T и Coli-Ind с помощью аппарата для фильтрования воды (колбы Зейтца и фильтра Бунсена). Фильтры после фильтрации переносят в чашку Петри со средой Эндо и помещают в термостат при 37оС на 24 часа. Наличие ярко-красных колоний с бронзовым отсветом будет свидетельствовать о подозрении наличия в данном объеме воды E.coli.
II. Микрофлора воздуха
В воздух микроорганизмы попадают с поверхности земли вместе с частицами пыли, из выделений живых организмов. Качественный и количественный состав микроорганизмов атмосферы зависит от: климатических условий, времени года, степени урбанизации территории и других причин. В воздухе находятся наиболее устойчивые против высыхания и действия УФО микроорганизмы (пигментообразующие формы, микрококки, сарцины, споры бактерий и грибов, дрожжи). Могут встречаться и болезнетворные микроорганизмы, устойчивые к высушиванию (туберкулезные палочки, патогенные стрептококки и стафилококки, вирусы).
При санитарно-бактериологическом исследовании воздуха определяют ОМЧ воздуха и наличие санитарно-показательных микроорганизмов, по содержанию которых в воздухе можно судить о степени его чистоты. Такими организмами являются гемолититческие (растворяющие эритроциты
крови) стрептококки, которые постоянно обитают в верхних дыхательных путях, слизистой носа и ротовой полости человека, а также золотистый стафилококк и Гр(-) синегнойные бактерии (табл. 2).
Для очистки воздуха от микроорганизмов используют:
- дезинфекцию использование веществ, которые вызывают быструю гибель микробов;
- применение антисептиков, например триэтиленгликоля;
- использование УФО.
Т а б л и ц а 2
Оценка воздуха по эпидемиологическому надзору в лечебно-профилактических учреждениях и жилых помещениях
| Место забора | Условия | ОМЧ, м3 | St.aureus | Гр(-)синегнойные бактерии | |
| Операционная | До работы | Не > 100 в м3 | Не должно быть в 1 м3 | ||
| Реанимационное отделение | Всегда в работе | Не > 1000 в м3 | Не > 4 клеток | Не должно быть | |
| Боксы (ожоговые) | Перед посещением больного | Не > 50 в м 3 | Не должно быть | ||
| Во время пребывания больного | Не > 250 в м3 | Не > 12 клеток | |||
| Жилые помещения | Летом | До 1500 | Не > 4 клеток | - | |
| Зимой | До 4500 | Не > 9 клеток | - | ||
Методы санитарно-бактериологического исследования воздуха:
1. Аспирационный метод с помощью аппарата Кротова. Предназначен для исследования воздуха на присутствие гемолитического стафилококка. Для этого метода чашку Кротова с 5%-ным кровяным агаром помещают в аппарат Кротова и пропускают 250 литров воздуха. Посев инкубируют в термостате при температуре 37оС в течение 48 часов. При наличии в воздухе a- или b-гемолитического стафилококка на среде вырастают колонии, окруженные зоной гемолиза.
- Седиментационный метод по Коху. С помощью данного метода определяют общее микробное число воздуха. Общее микробное число воздуха рассчитывают по формуле Омелянского, который опытным путем
доказал, что за 5 минут на площадь в 100 см 2 оседают микробы, содержащиеся в 10 литрах воздуха:
Х = 5 · А · 100 · 1000
С · 10 · S , где
Х – количество микробов в 1 м3 воздуха – микробное число; А – количество колоний в чашке Петри; S – площадь чашки Петри (если d = 8, то S = 50; d = 9, S = 63; d = 10, S = 78, 5 см 2); С – экспозиция посева.
III. Микрофлора почвы
Качественный и количественный состав микроорганизмов почвы зависит от: химического состава почвы, физических свойств, рН, влагоемкости, степени аэрации, климатических условий, времени года, способов сельскохозяйственной обработки, характера растительного покрова. Неодинаково распространение микроорганизмов по горизонтам почвы. Меньше всего их содержится в поверхностном толщиной несколько миллиметров слое, где микроорганизмы подвергаются неблагоприятному воздействию солнечного света и высушивания. Особенно обильно населен слой до 5 сантиметров, а по мере углубления число микроорганизмов уменьшается.
С глубиной меняется и качественный состав микроорганизмов. В верхних слоях почвы, содержащих много остатков животных и растений, а также подвергающихся хорошей аэрации, преобладают аэробные сапрофитные микроорганизмы, способные расщеплять сложные органические соединения. В почве могут обитать микроорганизмы, разлагающие клетчатку, нитрифицирующие, денитрифицирующие и азотфиксирующие формы. Среди болезнетворных бактерий в почве преобладают спорообразующие бактерии (возбудители столбняка, газовой гангрены, ботулизма), патогеные бесспоровые бактерии (брюшнотифозные, дизентерийные).
При санитарной оценке почвы критерием служит титр кишечной палочки и количество сапрофитных бактерий (табл. 3).
Т а б л и ц а 3
Оценка санитарного состояния почвы
по микробиологическим показателям
| Категория почв | E.coli | Нитрифицирующие | Cl.perfingens | Термофилы |
| Чистая | 1 и > | 0.1 и > | 0.1 и > | 1001000 |
| Загрязненная | 0.01 | До 0.1 | До 0.1 | 100110.000 |
| Сильно загрязненная | < 0.01 | < 0.01 | < 0.01 | > 10.000 |
Методы санитарно-бактериологического исследования почвы:
1. Бактериологический метод. Данный метод позволяет определить микробное число почвы с помощью посева почвенной суспензии на МПА. При определении ОМЧ почвы подсчитывают число выросших колоний и делают перерасчет на 1 г почвы (число колоний умножают на коэффициент разведения).
2. Определение Coli-титра и перфингенс-титра почвы.
Ход работы:
I. Отобрать пробы воды для изучения микрофлоры. В чистые стерильные склянки (объем 400500 мл) взять с соблюдением стерильности пробы воды из водопровода (предварительно водопроводный кран простерилизовать в пламени спиртовки и пропустить воду в течение 1015 минут).
II. Для определения микробного числа воды произвести посев воды в стерильные чашки Петри и залить расплавленным и остуженным до 4050оС МПА. Вылитый агар слабым покачиванием равномерно смешать с исследуемой водой. Посевы подписать и поместить в термостат при 37оС на 2448 часов.
III. Поставить опыты для определения Coli-T и Coli-Ind.
- Бродильным методом (разбор).
- Методом мембранных бумажных фильтров: мембранные фильтры № 3 дважды покипятить в дистиллированной воде. Стерильные фильтры стерильным пинцетом вложить в стерильный фильтр Зейтца, установленный на колбе Бунзена, соединенной с вакуумным насосом, и произвести фильтрование воды в общем объеме жидкости 333 мл. Стерильным пинцетом перенести прокипяченные мембран
ные фильтры на чашку Петри со средой Эндо лицевой стороной вверх. Посевы подписать и поставить в термостат при 37оС на 24 часа.
IV. Поставить опыты для определения ОМЧ почвы:
- Почвенную болтушку в разведении 1:10 взболтать и дать отстояться в течение 510 минут. Из почвенной суспензии приготовить ряд последовательных разведений (1:100, 1:1000 и т.д.);
- Из двух последних разведений по 1 мл почвенной взвеси внести в чашку Петри и залить расплавленным и остуженным до 4550оС МПА. Вылитый агар равномерно смешать с исследуемой суспензией. Посевы подписать и поставить в термостат при 37оС на 2448 часов.
- Определение Coli-титра и перфингенс-титра (разбор).
V. Поставить опыты для определения ОМЧ воздуха методом Коха:
- Чашки Петри с МПА открыть и выдержать открытыми в течение 510 минут. Чашки закрыть, подписать и поставить в термостат при 37оС на 2448 часов;
- Для определения санитарно-показательных микроорганизмов этим методом чашки с КА открыть и выдержать открытыми 40 минут.
VI. Рассчитать микробное число воды, воздуха, почвы. Определить Coli-титр и Coli -индекс воды; полученные данные сравнить с допустимыми санитарными нормами и сделать выводы. Результаты исследований занести в протокол.
Тесты для проверки знаний:
- Микробное число воздуха определяют: а) по методу Коха, б) на среде Эндо, в) посевом на чашку с МПА в аппарате Кротова, г) с помощью формулы Омелянского.
Ответ: а, в, г
- Санитарно-бактериологическую оценку воды выводят исходя из: а) цветности, б) микробного числа, в) Coli-титра, г) запаха, д) Coli-индекса.
Ответ: б, в, д
Ключевые слова: индикаторные микроорганизмы, микробное число,
Coli-титр, Coli-индекс, перфингенс-титр, сапробность
РАЗДЕЛ IV. ИНФЕКЦИЯ И ИММУНИТЕТ
Занятие № 8
Тема: Реакции иммунитета.
Цель занятия: Обучить постановке и учету реакций агглютинации и преципитации
Материалы и оборудование: Предметные стекла, исследуемая чистая культура E.coli на скошенном МПА, агглютинирующая сыворотка E.coli, испытуемый экстракт для реакции кольцепреципитации, преципитирущая туляримийная сыворотка, преципитирующая сибироязвенная сыворотка, нормальная сыворотка, люминесцирующие сыворотки, пипетки мерные и пастеровские.
Демонстрация:
1. Ряд с развернутой реакцией агглютинации для учета.
2. Планшет с РНГА для учета.
3. Планшет с ИФА для учета.
4. Реакция по Манчини для учета.
5. Реакция по Оухтерлони для учета.
Вопросы для обсуждения:
1. Антигены, химическая природа.
2. Антитела, структура иммуноглобулинов.
3. Принцип использования серологических реакций.
4. Реакции агглютинации, ингредиенты, способы постановки.
5. Нагрузочные реакции агглютинации.
6. Реакции преципитации, ингредиенты, способы постановки.
7. Реакции с метками. Варианты. Учет реакций.
I. Введение
В основе всех реакций иммунитета лежит специфическое взаимодействие антитела (Ат) с антигеном (Аг). Эти реакции называют серологическими, так как для их постановки используют сыворотки (serum), содержащие Ат. В серологических реакциях один компонент (ингредиент) должен быть всегда известен.
Серологические реакции применяются в следующих случаях:
а) для определения неизвестного Аг (бактерия, вирус, токсин и др.) с помощью известного Ат (иммунная сыворотка);
б) для определения Ат в сыворотке с помощью известного Аг.
В зависимости от состояния Аг и особенностей среды, в которой взаимодействуют Аг и Ат, различают реакции агглютинации, преципитации, лизиса, связывания комплемента, иммунофлюоресценции, иммуноферментного анализа, радиоиммунного анализа и другие.
II. Реакции агглютинации
Феномен агглютинации заключается в способности антитела связываться с микробными клетками и другими корпускулярными антигенами в присутствии электролита. Образующийся агрегат выпадает в осадок. Различают реакции прямой и непрямой агглютинации.
В
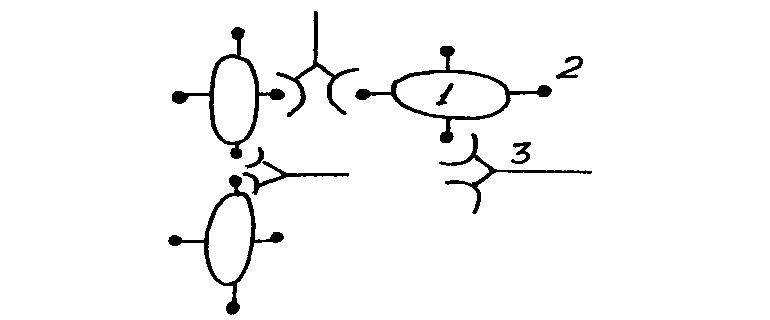
реакциях прямой агглютинации Ат агглютинируют непосредственно корпускулы, связываясь с входящими в их состав антигенными детерминантамии.
Рис. 2. Реакция прямой агглютинации: 1– клетка; 2 Аг; 3 – Ат
Существует два основных метода постановки реакции агглютинации: реакция на стекле и развернутая реакция (пробирочный вариант).
1 . Пластинчатая реакция агглютинации на стекле (ориентировочная).
На обезжиренное предметное стекло наносят каплю иммунной сыворотки и каплю изотоничного раствора. В обе капли бактериологической петлей вносят культуру микроорганизмов и тщательно перемешивают. Если через 35 минут в капле физиологического раствора наблюдается равномерное помутнение, а в капле сыворотки хлопья или зерна агглютината, то результат реакции считается положительным.
2 . Развернутая реакция агглютинации.
Готовят в пробирках последовательные разведения сыворотки (чаще двукратные: 1:50 ® 1:100 ® 1:200 и т.д.). Во все пробирки (кроме одной контроль сыворотки) вносят по две капли корпускулярного Аг (диагностикума). Диагностикум вносят и в пробирку с физиологическим раствором,
которая служит контролем Аг. В результате реакции в пробирках должно появиться помутнение. Пробирки встряхнуть и поставить в термостат при 37 градусах. Учитывать через 1820 часов, начиная с контролей.
Контроль Аг должен быть равномерно мутным; контроль Ат совершенно прозрачным. При положительном результате реакции в пробирках появляется осадок, жидкость над осадком при этом просветляется. Титром сыворотки считается ее наибольшее разведение, в котором наблюдается четкая агглютинация.
3 . Реакцию непрямой (пассивной)агглютинации ставят с растворимыми антигенами белковой или полисахаридной природы. Аг предварительно адсорбируют на корпускулярном носителе, которым служат инертные вещества (латекс, бентонит) или клетки, например эритроциты (препарат эритроцитарный диагностикум). Чаще адсорбентом являются эритроциты, реакция при этом носит название пассивной (непрямой) гемагглютинации (РПГА). При постановке реакции к исследуемой сыворотке (Ат?) с разными разведениями добавляют эритроцитарный диагностикум. В положительном случае происходит гемагглютинация.
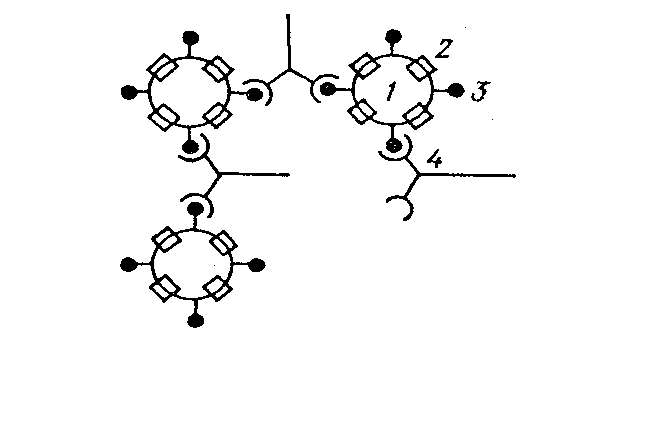
Рис. 3. Реакция пассивной гемагглютинации:1 эритроциты, 2 Аг эритроцита, 3 – конъюгированный Аг, 4 Ат
4. Реакцию преципитации ставят в тех случаях, когда в качестве антигена пользуются веществами: лизатами, экстрактами, гаптенами и т.п. При взаимодействии такого антигена с антителом в присутствии электролита образуется преципитат в виде мутного кольца или осадка.
Реакцию преципитации обычно применяют для определения Аг при диагностике ряда инфекционных болезней (сибирской язвы, туляремии, пастереллеза и др.); в судебной медицине – для определения видовой принадлежности крови; в санитарно-гигиенических исследованиях при установлении фальсификации продуктов; для количественного определения белков, участвующих в защите животных: иммуноглобулинов, комплемента, лизоцима и других. С помощью реакции преципитации также определяют филогенетическое родство животных, растений и микроорганизмов. Основными методами проведения реакции преципитации являются реакция кольцепреципитации и реакция преципитации в геле.
5. Реакция кольцепреципитации. Реакцию проводят в специальных пробирках диаметром 0.40.5 см и высотой 78 см. В пробирку вносят 0.2 мл иммунной сыворотки; на сыворотку осторожно наслаивают такой же объем Аг , чтобы не произошло смешивание ингредиентов. При положительном результате на границе Аг и Ат образуется белое кольцо – преципитат.
6. Реакция преципитации в геле. Особенность этой реакции в том, что взаимодействие Аг с Ат происходит в полутвердой среде – геле, чаще агаровом. Так как молекулы Ат и Аг диффундируют в геле, то этот метод часто называют иммунодиффузией. При встрече в геле комплементарных друг другу Ат и образуется белая линия, полукольцо или кольцо.
В основном используется 2 варианта иммунодиффузии в геле:
а) по Манчини (простая, радиальная диффузия) (рис. 4);
б) по Оухтерлони (двойная иммунодиффузия) (рис. 5).
По методу Манчини Ат к искомому Аг (любому белку) вносятся в теплый (50 оС) жидкий гель. Гель с антителами выливается на стеклянную поверхность, и когда он застывает, в нем делают лунки, куда и вносят искомый Аг. Аг диффундирует в гель и, соединившись со специфическими Ат, формирует кольца преципитации, диаметры которых зависят от концентрации Аг в лунках.
Реакция Манчини используется для количественного определения любого молекулярного Аг, так как с помощью колибровочных кривых измерив диаметр кольца, можно выявить количество Аг.
Р
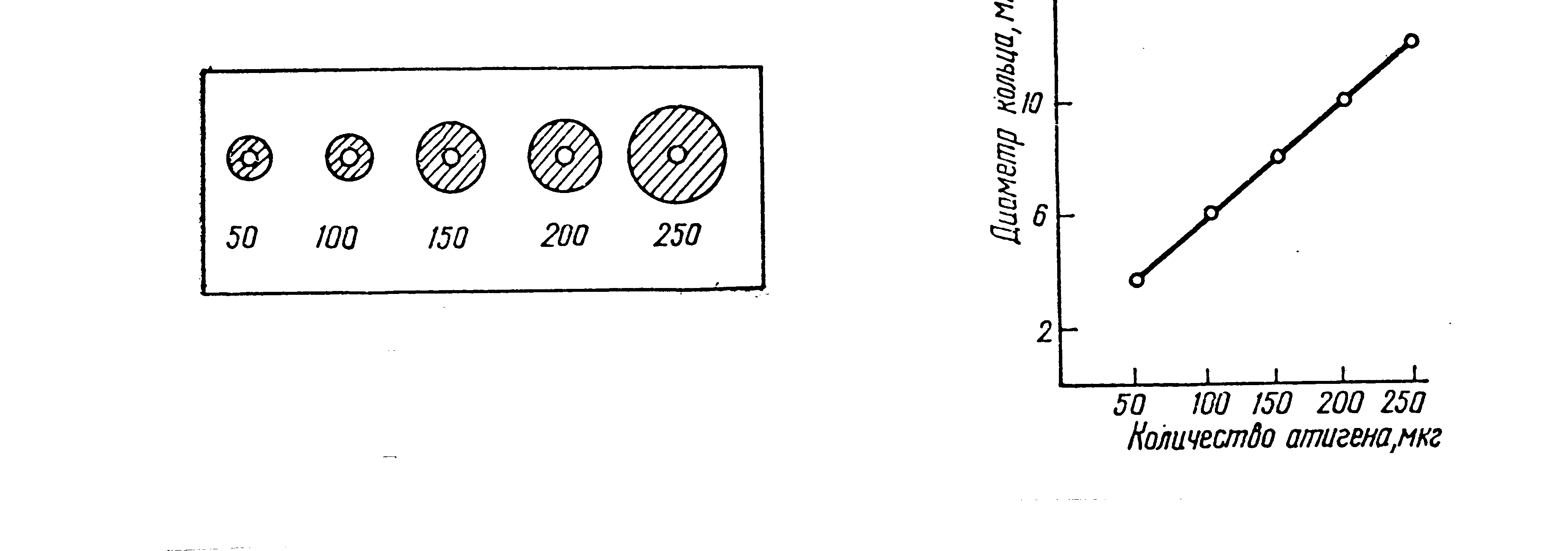
ис. 4. Простая радиальная иммунодиффузия: кольца преципитации, калибровочная кривая.
П
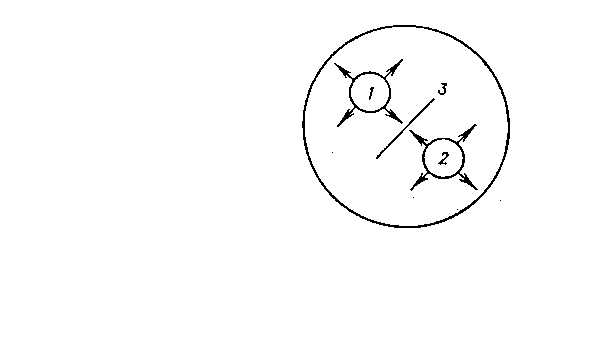
о методу Оухтерлони Аг и Ат (одно известное, другое нет) помещают в лунки геля, вырезанные на некотором расстоянии друг от друга. Оба ингредиента диффундируют в гель, и если они друг другу комплементарны, на месте их встречи образуется белая линия. Этот метод используется для качественного анализа.
Рис. 5. Двойная радиальная иммунодиффузия: 1 – Аг, 2 – Ат, 3 – линия преципитации
В последние годы широко применяются серологические реакции, в которых используются меченые тем или иным способом антитела (иногда антигены). Меченые Ат не изменяют своей специфичности. Основные требования к метке: она должна легко выявляться, сохраняя специфичность иммунологических реакций. Серологические реакции с использованием метки позволяют быстро получать результат, отличаются высокой
чувствительностью, находят широкое применение в экспресс-диагностике бактерий, грибов, вирусных инфекций.
7. Реакции иммунофлюоресценции (РИФ) основаны на использовании флюорохромов, коньюгированных с Ат (рис. 6). При этом Ат сохранили способность взаимодействовать со строго определенными Аг. Комплексы Аг (в виде клетки) с меченым Ат можно легко определить по интенсивному желто-зеленому свечению в УФ лучах люминесцентного микроскопа. РИФ могут быть поставлены в несколько вариантах:
1. Прямая РИФ - предполагает применение люминесцирующей сыворотки против каждого изучаемого Аг (сибироязвенная люминесцирующая сыворотка, бруцилезная люминесцирующая сыворотка, и т.д.).
2. Непрямая РИФ - основана на использовании двух различных антисывороток. Вначале к фиксированному на стекле Аг прибавляют немеченые Ат против изучаемого Аг, препарат промывают и на II этапе реакции образовавшийся комплекс АгАт обрабатывают люминесцирующей сывороткой, содержащей меченые флюорохромом Ат к Jg того животного, чья сыворотка была использована на первом этапе. Непрямой РИФ можно выявить как Ат, так и Аг в исследуемой сыворотке больного животного.
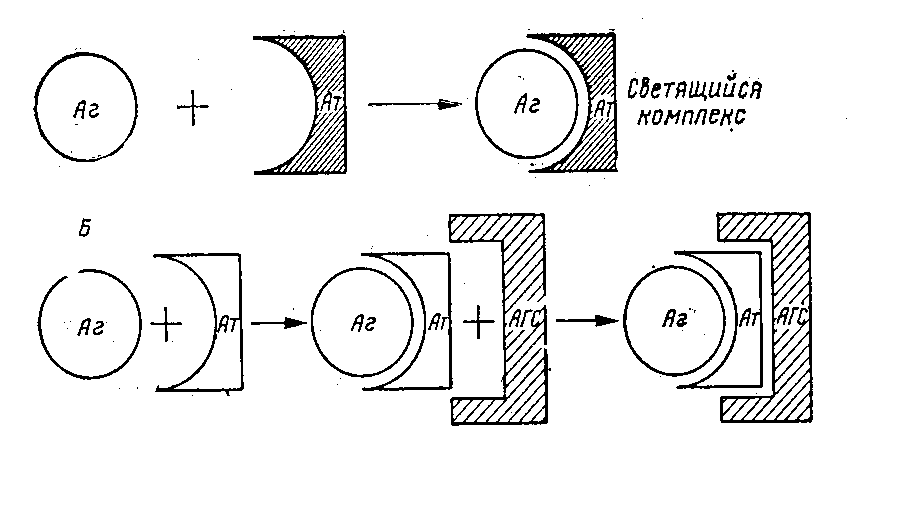
Рис. 6. Схема иммунофлюоресценции (метод Кунса): А прямой вариант; Б непрямой вариант; Аг – антиген, Ат – антитело, АГС – антиглобулиновая сыворотка.
8. Реакция энзиммеченых антител (РЭМА), или иммуноферментный анализ (ИФА) основана на использовании в качестве метки Ат ферментов, способных разлагать субстрат с образованием окрашенных продуктов. В качестве фермента часто используется пероксидаза хрена, а в качестве субстрата для нее ортофенилендиамин, 5аминосалициловая кислота и другие вещества. Существует много методических вариантов ИФА: прямой, непрямой, двойной, конкурентный. По ферменту судят об образовании иммунного комплекса АгАт, одно из которых было неизвестно.
Ход работы:
I. Поставить пластинчатую агглютинацию.
II.Учесть по готовому ряду развернутую реакцию агглютинации. Определить титр антител в сыворотке.
III. Учесть РНГА. Сделать выводы. Зарисовать.
IV. Поставить реакцию кольцепреципитации:
- В 3 пробирки налить по 1 мл сыворотки: в 1-ю - сибироязвенную преципитирующую сыворотку, во 2-ю - туляримийную преципитирующую сыворотку, в 3-ю - нормальную сыворотку (АТ нет);
- Во все пробирки наслоить постепенно на сыворотку 1 мл испытуемого экстракта;
- Учесть реакцию, сделать выводы, зарисовать;
V. Учесть реакцию преципитации по Манчини и Оухтерлони. Сделать выводы. Зарисовать.
VI. Учесть реакцию ИФА. Сделать выводы.
VII. Результаты работы занести в протокол.
Тесты для проверки знаний:
1. Для реакции агглютинации берут: а) живые клетки бактерий, б) убитые клетки бактерий, в)лизат из клеток, г) токсины бактерий, д) ферменты бактерий. Ответ: а, б
2. Для реакции преципитации в качестве Аг используют: а) убитые клетки бактерий, б) лизаты бактерий, в) экзотоксины бактерий, г) молекулярные вещества. Ответ: б, в, г
Ключевые слова: антиген, антитело, серологические реакции, диагностикум, сыворотка, флюорохром
Занятие № 9
Тема: Методы лабораторной диагностики инфекционных болезней сельскохозяйственных животных, вызываемых бактериями.
Цель занятия: Познакомить с методами лабораторной диагностики инфекционных заболеваний.
Материалы и оборудование: Фиксированные мазки возбудителя туберкулеза, бруцелеза, сибирской язвы; набор красок. Чашки Петри с ростом на МПА, вакцинированные штаммом сибирской язвы СТИ и чумы. Среды Гисса с ростом; чистые культуры E.coli; агглютинирующие сыворотки (коли и сальмонеллезная); испытуемый экстракт на сибиреязвенный Аг; преципитирующая сибиреязвенная сыворотка, нормальная сыворотка, кровь цыпленка с подозрением на пуллороз, пуллорозный антиген для РА.
Демонстрация:
1. Планшет с ИФА на пастереллез (экспресс-диагностика).
2. Развернутая РА (серодиагностика бруцеллеза).
Вопросы для обсуждения:
1. Факторы вирулентности у бактерий.
2. Клеточные структуры бактерий, играющие роль в возникновении инфекционного процесса. Методы их выявления.
3. Антигенная структура бактерий.
4. Бактериоскопический метод диагностики инфекционных болезней.
5. Бактериологический метод диагностики инфекционных болезней.
6. Биологический метод диагностики инфекционных болезней.
7. Серологический метод диагностики инфекционных болезней.
8. Аллергический метод диагностики инфекционных болезней.
9. Экспресс-диагностика инфекционных заболеваний.
-
Методы изучения инфекционных болезней
сельскохозяйственных животных
В микробиологической диагностике инфекционных болезней сельскохозяйственных животных применяют следующие основные методы исследования:
1. Бактериоскопический (микроскопический) метод.
Из исследуемого материала больного животного (гной, раневое отделяемое, мокрота и т.д.) делают мазок, красят по Граму или другим методом и под микроскопом выявляют возбудителя. Так можно диагностировать туберкулез, сибирскую язву, чуму и другие инфекции.
2. Бактериологический метод.
Из материала больного животного выделяют чистую культуру на питательных средах и изучают ее свойства: морфологические, культуральные, биохимические, антигенные и другие.
3. Биологический метод.
С помощью этого метода выделяют чистую культуру возбудителя через лабораторных животных (кролика, морскую свинку и т.д.).
4. Серологический метод.
Обнаружение с помощью серологических реакций (РА, РП, РИФ, ИФА и др.) специфических Ат в сыворотке крови больных животных. Особое значение метод приобретает для диагностики тех заболеваний, возбудителей которых выделить трудно, или при хронических инфекциях.
- Метод кожных аллергических проб.
Метод основан на выявлении гиперчувствительности замедленного типа с помощью аллергенов микробного происхождения. Гиперчувствительность замедленного типа развивается у животных при многих инфекциях: туберкулез, бруцеллез. У больного животного появляются в организме клоны Т-лимфоцитов, сенсибилизированных к определенному аллергену. При введении внутрикожно этому животному соответствующего аллергена сенсибилизированные Т-лимфоциты начинают мигрировать в это место, взаимодействовать с антигеном-аллергеном. При этом Т-лимфоциты выделяют медиаторы воспаления. На месте введения в положительном случае будет реакция воспаления.
6. Экспресс-диагностика.
Данный метод применяется при многих инфекционных заболеваниях. Современными серологическими реакциями (ИФА, РИФ, РИА) можно определить антигенную структуру возбудителя болезни прямо в исследуемом материале, не выделяя чистую культуру возбудителя.
Ход работы:
I.Провести бактериоскопическое исследование на туберкулез, сибирскую язву, бруцеллез.
1.Фиксированный мазок с подозрением на наличие туберкулезной палочки окрасить по ЦильНильсену:
- положить на мазок фильтровальную бумажку,
- на бумажку налить карболовый фуксин Циля,
- мазок подогреть на пламени спиртовки до появления паров,
- добавить краситель и опять нагреть (нагревают около 5 минут),
- бумажку снять,
- мазок промыть водой,
- обесцветить мазок, опуская его на 30 минут в стаканчик с 5%-ным раствором серной кислоты,
- промыть водой,
- окрасить раствором метиленовой синьки в течение 5 минут,
- промыть водой,
- высушить,
- микроскопировать.
Устойчивость некоторых бактерий (туберкулезной палочки) к кислотам связана с наличием в их клеточной стенке липидов и восков. Поэтому кислотоустойчивые туберкулезные палочки окрашиваются по методу ЦильНильсена в красный цвет и не обесцвечиваются кислотой. Все другие бактерии обесцвечиваются кислотой и окрашиваются метиленовым синим в голубой цвет.
2. Зарисовать.
3. Окрасить по Граму фиксированный препарат Bacillus anthracis (сибирская язва). Промикроскопировать. Зарисовать.
4. Окрасить по Граму фиксированный препарат Brucella suis (возбудитель бруцеллеза). Промикроскопировать. Зарисовать.
II. Бактериологический метод лабораторной диагностики.
1. Изучить культуральные свойства (колоний) СТИ-вакцинального штамма сибирской язвы и EV-вакцинального штамма чумы. С объективом ´ 8 изучить края колоний. Зарисовать.
2. Сравнить биохимические свойства E.coli и Salmonella по таблице:
-
Возбудитель
E.coli
Salmonella
Лактоза
КГ
(-)
Глюкоза
КГ
КГ
Индол
(+)
(-)
Сероводород
(-)
(+)
3. Изучить антигенный состав выделенной чистой культуры бактерий в реакции агглютинации на стекле с коли- и сальмонеллезными сыворотками.
4. Поставить реакцию кольцепреципетации по Асколи для выявления в испытуемом экстракте из шкурки зайца сибиреязвенного антигена. Сделать выводы.
III. Серологический метод исследования
1. Поставить РА методом кровяно-капельной реакции для диагностики пуллороза цыплят. На часовое стекло внести каплю исследованной гемолизированной крови (Ат?) цыпленка и в нее внести каплю пуллорозного диагностикума (Аг+). При положительном результате через 45 минут появятся агглютинированные хлопья.
2. Учесть пробирочную РА для серодиагностики бруцеллеза, установить наличие Ат. Сделать выводы.
IV. Экспресс-диагностика
1.Учесть реакцию ИФА для выявления в околоплодной жидкости коровы бруцеллезного антигена. Для этого в лунки планшеты внести разные разведения материала (околоплодные воды): 1/2, 1/4, 1/8 и т.д. Планшеты выдержать в термостате при температуре 37 оС 1820 часов для адсорбции Аг. Во все лунки с Аг? добавить бруцеллезные Ат, конъюгированные с ферментом пероксидаза хрена, и выдержать 1 час при температуре 37 оС. Затем тщательно промыть буферным раствором для того, чтобы вымыть не связавшиеся с Аг антитела.
Теперь нужно определить наличие в лунке фермента (если Ат связались с Аг) или отсутствие фермента (если Ат не связались с Аг, т.е. Аг бруцеллезного в лунке не было). Для этого в лунки вносят субстрат для фермента пероксидазы ортофенилендиамин. Реакцию выдерживают в темноте 30 минут и учитывают по изменению цвета субстрата (из бесцветного субстрата он стал желтым при расщеплении ферментом). Сделать выводы.
2. Учесть ИФА при диагностике ящура (выявление серовара А, О или С ?) при помощи Ат, конъюгированного с ферментом.
3. Изучить действие фага методом стекающей капли.
V. Результаты исследований занести в протокол.
Задача № 1.
В лабораторию поступили мазки-отпечатки из мозга овцы, погибшей, как полагают, от бешенства. Как подтвердить диагноз, если в лаборатории есть люминесцирующая сыворотка к вирусу бешенства?
Ответ: на мазке-отпечатке можно провести прямой вариант реакции иммунофлюоресценции.
Задача № 2.
В лабораторию поступила суспензия ткани легкого свиньи с подозрением на классическую чуму. Как подтвердить диагноз, если в лаборатории имеется: 1) чувствительная культура клеток, 2) среда Игла для клеток, 3) люминесцирующая сыворотка к вирусу классической чумы свиней ?
Ответ: надо вырастить клетки в питательной среде с добавлением антибиотика, внести туда исследуемый материал (суспензию из легкого). Если там есть вирус, он инфицирует клетки. Пораженные вирусом клетки выявить реакцией иммунофлюоресценции (прямой вариант).
Задача № 3.
В лабораторию поступила сыворотка больного животного с подозрением на сальмонеллез. Какими реакциями можно найти титр антител и что нужно иметь для этого в лаборатории ?
Ответ: 1) реакцией агглютинации (Аг сальмонеллезный в виде клеток),
2) реакцией преципитации (лизированные клетки сальмонелл, т.е. молекулярный Аг),
3) реакциями с метками (антииммуноглобулиновые Ат, меченые ферментами, флюорохромом, сальмонеллезными Аг).
Вопрос: Что значит идентифицировать чистую культуру?
Ответ: надо изучить свойства выделенной чистой культуры: 1) морфологические (кокки, палочки и т.д., есть ли капсулы); 2) тинкториальные (как красятся по Граму); 3) культуральные (как растут на питательных средах); 4) биохимические; 5) набор ферментов; 6) антигенные (антигенный состав клетки). По этим свойствам можно определить вид выделенной чистой культуры.
Занятие № 10
Тема: Лабораторная диагностика вирусных инфекций.
Цель занятия: Ознакомить с методами лабораторной диагностики вирусных инфекций.
Материалы и оборудование: Смыв для РГА, 2%-ная взвесь эритроцитов для РГА, часовые стекла, пробирки с МПБ по 4,5 мл, культура E.coli в МПБ, фильтры Зейтца, смесь фага и E.coli в МПБ, стерильные пробирки.
Демонстрация:
1. Мазки по Муромцеву с тельцами БабешаНегри.
2. Препараты с ЦПД вирусов.
3. ИФА для диагностики ящура.
Вопросы для обсуждения:
1. Структура вирусов.
2. Культивирование вирусов.
3. Примеры вирусных инфекций животных.
4. Особенности вирусных инфекций.
5. Бактериофаги.
6. Титрование бактериофагов.
I. Лабораторная диагностика вирусных инфекций
Диагностика вирусных инфекций складывается из трех методологических направлений:
- Экспресс-диагностика - обнаружение возбудителя или его компонентов непосредственно в клиническом материале, взятом от больного животного.
Методы экспресс-диагностики могут быть основаны:
1) На прямом микроскопировании мазков-отпечатков пораженной ткани с целью выявления внутриклеточных включений, например при бешенстве;
2) Аг возбудителя может быть выявлен в пораженной ткани с помощью: а) флюоресцентных Ат, т.е. реакцией иммунофлюоресценции РИФ (бешенство), б) иммуноферментным анализом (ящур, бешенство, грипп птиц), в) иммуноэлектронной микроскопией выявляют образование иммунных комплексов в исследуемом материале при добавлении иммунной сыворотки под электронным микроскопом.
3) Можно изучить структуру ДНК- или РНК-вируса методами молекулярной гибридизации или цепной полимеразной реакцией.
II. Вирусологический метод включает в себя выделение вируса из клинического материала и его идентификацию. Вирус выделяют на чувствительных клетках и организмах. Затем выявляют присутствие вируса по поражению клеток (цитопатическое действие ЦПД), на пораженной клетке адсорбируются добавленные эритроциты (гемадсорбция), в пораженной вирусом клетке появляются вирусные включения и т.д.
Многие вирусы, находящиеся в жидкости, можно выявить реакцией гемагглютинации. У некоторых вирусов есть на поверхности образования гемагглютинина, которыми склеиваются эритроциты.
Для того чтобы определить вид вируса, надо изучить Аг выделенного вируса с помощью РИФ, ИФА и других методов диагностики.
III. Серодиагностика представляет собой выявление прироста титра антител в сыворотке больного животного. Наиболее употребляемыми методами серодиагностики являются РНГА, ИФА, РИА, РП.
Ход работы:
I. Изучить препараты зараженных вирусами фибробластов. Учесть цитопатическое действие (ЦПД) вируса.
II. Промикроскопировать и зарисовать тельца БабешаНегри (по Муромцеву) в препарате из мозга собаки, погибшей от бешенства. В окрашенном препарате фон и цитоплазма клеток бледно-голубые, ядра клеток синие, а тельца БабешаНегри резко очерченные, фиолетовые с розовым оттенком.
III. Поставить реакцию гемагглютинации для обнаружения вируса гриппа птиц:
- Взять каплю отфильтрованного (без бактерий) смыва с глотки курицы и нанести на часовое стекло;
- Добавить каплю 2%-ной взвеси эритроцитов, смешать;
- Отметить результаты реакции. При положительной реакции образуется хлопьевидный осадок из склеившихся вирусами эритроцитов.
IV. Выделить и протитровать коли-фаг:
- В колбу с МПБ произвести посев культуры E.coli. Посев поставить в термостат при 37оС на 34 часа;
- В колбу с ростом 34 часовой культуры E.coli посеять коли-бактериофаг и выдержать в термостате при 37оС 1820 часов;
- Содержимое колбы отфильтровать через бактериальный фильтр Зейтца. Коли-бактериофаг, находящийся в колбе Бунзена, набрать
стерильной пипеткой в стерильную пробирку и использовать его для титрования (1020 мл).
Титрование по Аппельману
| Ингредиенты | Номера пробирок | Контроли | |||||||
| | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1.МПБ, мл | 4.5 | 4.5 | 4.5 | 4.5 | 4.5 | 4.5 | 4.5 | 4.5 | 4.5 |
| 2.Культура фага (фильтрат), мл | 0.5 | | | | | | | | 0.5 |
| Произвести разведение: из 1-й пробирки 0.5 мл перенести во 2-ю, из 2-й в 3-ю и т.д. до 6-й, из нее 0.5 мл в банку с дез.раствором. | |||||||||
| 3.Бульонная суточная культура E.coli в каплях | 2 | 2 | 2 | 2 | 2 | 2 | 2 | - | - |
| Контроли: | 7-я пробирка контроль культуры E.coli 8-я пробирка – контроль стерильности МПБ 9-я пробирка – контроль фага | ||||||||
V. По готовому ряду Аппельмана учесть опыт и определить титр коли-фага, в котором нет роста E.coli.
VI. Результаты опытов занести в протокол.
Тесты для проверки знаний:
1. Структура вирусов:
а) клеточная стенка, б) нуклеоид, в) капсид, г) ДНК или РНК.
Ответ: в, г
2. Методы индикации вирусов:
а) окраска препарата по Граму, б) ЦПД, в) РГА, г) окраска препарата по Пешкову, д) выявление внутриклеточных включений.
Ответ: б, в, д
Ключевые слова: вирус, бактериофаг, серодиагностика, цитопатическое действие, гемагглютинация
РАЗДЕЛ V. МИКРОФЛОРА КОРМОВ, МОЛОКА И МОЛОЧНО-КИСЛЫХ ПРОДУКТОВ
Занятие № 11
Тема: Микробиологическое исследование кормов.
Цель занятия: Обучить методам исследования грубых и сочных кормов.
Материалы и оборудование: предметные стекла, покровные стекла, препаровальные иглы, посев силоса (10-6, 10-7 разведения) в МПБ, суспензия силоса, индикаторные бумажки для определения рН, посев силоса (10-6 разведение) на МПА, увлажненные солома и зерно, посев зерна и соломы методом аппликации на МПА.
Демонстрация:
1. Рост Cl.perfingens на среде ВильсонБлера;
2. Рост грибков на плотных средах;
3. Рост гнилостных бактерий в МПБ;
4. ИФА для выявления токсина ботулизма.
Вопросы для обсуждения:
1. Что такое эпифитная микрофлора и какое ее значение?
2. Почему высушенное сено можно долго хранить?
3. Механизм губительного действия высушивания на микробы.
4. Что лежит в основе силосования корма? Методы силосования сочных кормов.
5. Микроорганизмы, способствующие хорошему качеству силосования.
6. Фазы созревания силосной массы.
7. Методы определения качества силоса.
I. Введение
Грубые корма разнообразны в ботаническом отношении и неоднородны в физическом состоянии. Каждый из них имеет свою технологию и способ хранения, при нарушении которых нередко происходит их порча. Так, например, при увлажнении корма создаются благоприятные условия для размножения гнилостной микрофлоры, плесневых грибов, актиномицетов, которые, развиваясь на растении, используют углеводы, белки, витамины и т.д. и тем самым снижают питательную ценность корма. Кроме того, ряд микроорганизмов могут в процессе своей жизнедеятельности выделять целый ряд токсических продуктов, вызывающих отравление животных. Всесторонний качественный и количественный анализ кормов
довольно затруднен, так как не существует универсальной среды, на которой можно вырастить все встречающиеся виды микроорганизмов.
Чаще всего при анализе грубых кормов определяют:
1) санитарную пригодность корма и его общую обсемененность;
2) наличие споровой микрофлоры, способной вызвать заболевания животных (сибирской язвой, эмфизематозным карбункулом, ботулизмом и др.);
3) микрофлору, вызывающую порчу кормов в процессе их хранения;
4) эпифитную микрофлору, играющую большую роль в процессе силосования (гнилостную, молочнокислую, маслянокислую и др.).
II. Микологическое исследование грубых кормов
Среди микрофлоры, вызывающей порчу грубых кормов, видное место занимают грибы. Известно, что корма, пораженные грибками, могут вызывать микозы и микотоксикозы. Первые возникают при попадании в организм и развитии самого грибка, вторые на почве отравления токсинами (ядовитыми продуктами) грибков, развивающихся на кормах. Поэтому исследование пораженных грибами кормов ведут в двух направлениях:
1) обнаружение и выделение грибковвозбудителей болезней;
2) определение их токсичности.
Наиболее токсичные свойства обнаружены у многих видов Aspergillus и Fusarium, встречающихся на соломе и мякине злаков, в почве и различных продуктах.
При микологическом исследовании грубых кормов используют препарат “раздавленная капля” или выделяют чистую культуру грибков. Для этого в чашки Петри помещают два кружка фильтровальной бумаги (между которыми кладут тонкий слой ваты), завертывают их и стерилизуют в сушильном шкафу. Перед посевом кружки фильтровальной бумаги увлажняют питательной средой (Чапека или ВанИнтерсена) и раскладывают на них исследуемый корм. Ровные отрезки соломки (1.52 см) располагают по радиусу на расстоянии 12 см друг от друга. Культивирование производят в термостате при температуре 2426 оС в течение 1012 дней. При появлении вокруг соломинок черных, сажистых колоний производят микроскопирование и отсев на косой агар (суслоагар, плотную среду Чапека) для получения чистой культуры. При определении видового состава обращают внимание на строение органов спороношения.
III. Определение токсичности грибков
Для испытания токсичности выделенных культур грибков их размножают на доброкачественной соломе, увлажненной жидкой средой (Чапека или ВанИнтерсена) и простерилизованной в автоклаве при 120оС в течение 3040 минут. Культивирование грибка производят при 2025оС в течение 23 недель. Затем культуру убивают текучим паром (в течение часа), соломинки высушивают при 4045оС и извлекают токсин. Экстрагирование токсина производят этиловым эфиром (в течение 6 часов). Вытяжку сгущают и наносят на свежевыбритый участок кожи кролику (ставят дермонекротическую пробу). В качестве контроля на другой участок выбритой кожи наносят вытяжку, полученную из доброкачественной саломы.
Если выделенный гриб образует токсин, то вытяжка из него на 34-е сутки вызовет воспалительную реакцию: отечность, покраснение и омертвление ткани. На месте нанесения контрольной вытяжки изменений на коже не произойдет. Токсин (Аг?) можно определить реакцией преципитации с сыворотками.
Элементарным условием сохранения кормов от заплеснения является обеспечение их сухого состояния. Эта задача решается своевременной уборкой кормов, правильным скирдованием и повседневной борьбой с повышением влажности во время хранения.
IV. Исследование кормов на ботулизм
У лошадей и других животных иногда возникают массовые заболевания, связанные с отравлением их токсином ботулизма. Материалом для исследования в этих случаях могут быть остатки несъеденного корма или содержимое желудка падших животных. Внешне этот корм ничем не отличается от доброкачественного, и выделить культуру возбудителя из него не всегда удается. Поэтому прибегают к постановке биологической пробы на морских свинках или выявляют токсин серологическими реакциями.
1. Присланные пробы корма растирают в ступке с постепенным добавлением физраствора (1:2) и оставляют при комнатной температуре на 12 часа.
2. Полученную взвесь фильтруют через бумажный фильтр и центрифугируют.
3. 12 мл полученной жидкости с помощью шприца спаивают двум морским свинкам. При наличии токсина ботулинуса морские свинки погибают в течение 35 суток при явлениях параличей мышц брюшной стенки и задних конечностей.
4. С фильтратом ставят реакции преципитации и ИФА.
5. Из осадка делают посев в две колбы с бульоном КиттТароцци под маслом (предварительно прокипяченным) и быстро охлаждают.
- После посева одну из колб прогревают при 80оС в течение 20 минут (для уничтожения неспоровых бактерий) и культивируют в термостате при 37оС в течение 47 дней. При появлении в колбе роста из содержимого делают мазки, окрашивают их по Граму и просматривают с иммерсией. Палочка ботулинуса плектридиальной формы, грамположительная, чистую культуру ее получают в анаэробных условиях на кровяном агаре. Токсичность культуры проверяют на белых мышах, морских свинках или реакциями преципитации и ИФА.
V. Микробиологическое исследование силоса
Силос является одной из главных составных частей кормового рациона сельскохозяйственных животных, поэтому его качественному приготовлению уделяется большое внимание. В основе созревания силоса лежат микробиологические процессы. Одни из этих процессов (как, например, молочнокислое брожение) являются причиной созревания и консервирования силоса, тогда как другие (маслянокислое брожение, гниение) вызывают порчу корма. Оценка качества силоса производится по органолептическим, химическим и микробиологическим показателям. Для контроля за ходом силосования пробы рекомендуется брать в три срока:
- в момент закладки силосуемой массы (на количественный и качественный состав эпифитной микрофлоры);
- после созревания силоса (на 1030-й день после закладки);
3) в момент вскрытия силосного сооружения.
В связи с тем, что в разных слоях силосной массы создаются неодинаковые условия для развития микрофлоры, из крупных силосных сооружений (башни, ямы или траншеи) берут не менее трех проб по вертикали: из верхней, центральной и нижней частей.
Из подозрительных участков стога или из кормушек забирают остатки корма (100200 г), упаковывают их в два-три слоя чистой бумаги, этикетируют и направляют в лабораторию. Исследование грубых кормов начинают с определения его ботанического состава, затем описывают органолептические свойства (цвет корма, наличие налетов, расположение налетов и их окраску и т.д.) и только потом проводят полный бактериологический анализ.
Растительные корма богаты разнообразной бактериальной и грибковой микрофлорой (количество бактерий в 1 г различных растений доходит до 100000 клеток). Однако высокая обсемененность корма сама по себе без учета качественного состава микрофлоры не решает вопроса о его непригодности для вскармливания. Так, например, большая обсемененность травы и свежего сена псевдомонадами или молочнокислыми кокками и палочками является хорошим показателем, Тогда как высокая обсемененность корма бактериями группы E.coli или анаэробными бациллами Cl.perfingens ввиду их потенциальной патогенности является неблагоприятным санитарным показателем.
