Провоспалительные цитокины, фенотип лимфоцитов и показатели фагоцитоза у больных ревматоидным артритом 14. 01. 22 ревматология
| Вид материала | Диссертация |
- Анемии различного генеза у больных ревматоидным артритом 14. 01. 22 ревматология, 316.2kb.
- Антицитокиновой терапии моноклональными, 360.2kb.
- Отчет по нир, 154.01kb.
- Психотерапия утрат на примере больных ревматоидным артритом, 81.43kb.
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 308.09kb.
- Функциональное состояние кардиореспираторной системы у больных ревматоидным артритом, 323.57kb.
- Состояние некоторых показателей системы свертывания крови и липидного обмена у больных, 752.77kb.
- Т. Д. Тябут > Л. Н. Маслинская Белорусская медицинская академия последиплом, 187.9kb.
- Стандарт специализированной медицинской помощи больным ревматоидным артритом (при оказании, 403.98kb.
- Цитокины и старение, 135.73kb.
На правах рукописи
ПАЧКУНОВА Марина Валерьевна
ПРОВОСПАЛИТЕЛЬНЫЕ ЦИТОКИНЫ, ФЕНОТИП ЛИМФОЦИТОВ И ПОКАЗАТЕЛИ ФАГОЦИТОЗА У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
14.01.22 - ревматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Ярославль – 2011
Д
 иссертация выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
иссертация выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации| Научный руководитель доктор медицинских наук, профессор | Данилова Татьяна Георгиевна |
| Официальные оппоненты: | |
| доктор медицинских наук, профессор | Носков Сергей Михайлович |
| доктор медицинских наук, профессор | Балабанова Римма Михайловна |
Ведущая организация
Государственное бюджетное образовательное учреждение высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Защита диссертации состоится «____» ___________ 2011 г. в ______ на заседании диссертационного совета Д 208.119.01 при ГБОУ ВПО «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации по адресу: 150000, г. Ярославль, ул. Революционная, д. 5.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Автореферат разослан «____» ___________2011 г.
Ученый секретарь
диссертационного совета Чижов П.А.
Введение
Актуальность проблемы
Ревматоидный артрит занимает одно из ведущих мест среди ревматических болезней, а по тяжести клинической картины и последствиям превосходит другие виды артрита (Е.Л. Насонов, 2007). Основу патогенеза ревматоидного артрита составляют выраженные аутоиммунные нарушения, при этом, важная роль в развитии и прогрессировании данного заболевания отводится цитокиновому каскаду и лимфоцитарному звену иммунной системы (Е.Н. Александрова, Е.Л. Насонов, 2010; А.А. Новиков и соавт., 2010; I. McInnes., G. Schett, 2007; S. Shiozawa et al., 2011).
Неконтролируемая гиперпродукция ключевого провоспалительного цитокина – фактора некроза опухоли альфа (TNF-) лежит в основе прогрессирования воспаления при ревматоидном артрите (В.И. Мазуров и соавт., 2008; Е.И. Алексеева и соавт., 2010; A. Alonso-Ruiz, 2008; A. Inoue et al., 2009). Уровень TNF- при ревматоидном артрите выше, чем у здоровых людей (Е.Л. Лучихина, Д.Е. Каратеев, 2008; А.М. Лила и соавт., 2010; M. Feldmann , S.R. Maini, 2008). Интерферон гамма (IFN) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа (Г.Ф. Железникова, 2008; F.M. Brennan, I.B. McInnes, 2008; O. Meyer, 2009). Полученые исследователями данные об уровне IFN крови у больных ревматоидным артритом неоднозначны (Р.М. Балабанова и соавт., 2003; Г.В. Лукина, Я.А. Сигидин, 2005; В.А. Насонова и соавт., 2008).
При ревматоидном артрите имеет место Th 1- иммунный ответ с нарушением баланса синтеза провоспалительных и противовоспалительных цитокинов (Г.Б. Колотова и соавт., 2008; H. Yamanaca, 2010). Цитотоксические CD8+ Т-лимфоциты непосредственно участвуют в деструкции клеток-мишеней (У.В. Хасанов, Л.П. Сизякина, 2010). CD16+ лимфоциты - натуральные киллеры, осуществляют элиминацию генетически дефектных клеток и клеток, пораженных патогенами (Е.В. Супоницкая, 2008; D.H. Raulet, R.E. Vance, 2006; L. Wu, L. Van Kaer, 2009). Экспрессия молекулярных рецепторов CD19+, CD21+, CD23+, CD25+ на В-лимфоцитах необходима для организации ответа на антигены антителопродукцией (P. Youinou, С. Jamin, 2007; S.B. Cohen, 2010).
Представленные в литературе данные о содержании субпопуляций лимфоцитов периферической крови при ревматоидном артрите немногочисленны и противоречивы (Н.А. Шостак и соавт, 2004; В.В. Соколова, 2007; P.A Klimiuk et al., 2005; Cope A.P, 2008).
Фагоцитарная реакция нейтрофилов тесно связана с иммунными реакциями (Б.В.Пинегин, А.Н. Маянский, 2007). У больных ревматоидным артритом наблюдается резко выраженное нарушение фагоцитарной активности нейтрофилов (Е.А. Венглинская, А.П. Парахонский, 2007; Ю.Г.Лагерева и соавт., 2007).
За последние годы достигнут значительный прогресс в изучении патогенеза ревматоидного артрита, а также разработке современных средств его диагностики и лечения (Д.Е. Каратеев, 2008; Е.Л. Насонов, 2008; Г.В. Лукина, Я.А. Сигидин, 2009). Однако, данные о содержании цитокинов, субпопуляций лимфоцитов, их взаимосвязях и динамике под влиянием терапии у больных ревматоидным артритом малочисленны и противоречивы. В настоящее время в связи с использованием биологической терапии при данном заболевании оценка профиля ключевых цитокинов, а также определение фенотипа лимфоцитов до начала проведения терапии и на фоне лечения, приобретает большое практическое значение (Л.П. Сизякина и соавт., 2010).
Таким образом, изучение состояния провоспалительных цитокинов и взаимосязи их с субпопуляциями лимфоцитов, фагоцитарной активностью нейтрофилов при ревматоидном артрите остается актуальной проблемой.
Цель исследования
Исследовать состояние провоспалительных цитокинов, фенотипа лимфоцитов и показателей фагоцитоза с последующей характеристикой клинико-иммунологических субтипов заболевания и оценкой эффективности фармакотерапии у больных ревматоидным артритом.
Задачи исследования
1. Изучить состояние провоспалительных цитокинов (TNF-, IFNγ), фенотипа лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD25+ клетки) и показателей фагоцитоза (фагоцитарный индекс и фагоцитарное число), иммуноглобулинов A, G и M, циркулирующих иммунных комплексов у больных ревматоидным артритом в зависимости от активности воспалительного процесса, клинической формы, рентгенологической стадии, серопозитивности по РФ, длительности заболевания.
2. Оценить иммунологические особенности при различных вариантах клинического течения ревматоидного артрита.
3. Исследовать взаимосвязи между провоспалительными цитокинами, субпопуляциями лимфоцитов и показателями фагоцитоза при ревматоидном артрите.
4. Изучить воздействие терапии нестероидными противовоспалительными препаратами и глюкокортикостероидами на уровень провоспалительных цитокинов, содержание субпопуляций лимфоцитов и показатели фагоцитоза у больных ревматоидным артритом.
5. Определить состояние субпопуляций лимфоцитов и показателей фагоцитоза (фагоцитарный индекс и фагоцитарное число) у больных остеоартрозом.
Научная новизна
Впервые дана комплексная оценка состояния цитокинов (TNF- , IFNγ), субпопуляций лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD25+), показателей фагоцитоза (фагоцитарный индекс (ФИ) и фагоцитарное число (ФЧ)) при ревматоидном артрите (РА) в зависимости от активности воспалительного процесса, клинической формы, рентгенологической стадии, серопозитивности по РФ, длительности заболевания.
У больных РА по мере роста активности заболевания увеличивается содержание IFNγ, лейкоцитов, нейтрофилов (НФ), иммуноглобулина А (IgA) крови, снижается относительное содержание лимфоцитов без изменения фагоцитарной активности нейтрофилов (ФАН) и содержания субпопуляций лимфоцитов. Выявлена прямая умеренная взаимосвязь уровня TNFα с активностью РА и выраженностью суставного синдрома (F=3,45, p<0,05, r= 0,39, p<0,01).
При РА с системными проявлениями болезни достоверно увеличены уровень TNFα, абсолютное содержание CD3+ , CD4+ , CD8+, CD16+, CD19+ лимфоцитов, содержание лейкоцитов, НФ крови, IgМ и достоверно снижено ФЧ (p<0,05).
При серопозитивных формах РА, по сравнению с серонегативными, выявлено увеличение содержания TNF-α, циркулирующих иммунных комплексов (ЦИК) и IgA крови (p<0,05).
При III-IV рентгенологических стадиях РА, по сравнению с I-II, определено достоверное снижение относительного содержания CD3+ Т-лимфоцитов и CD19+ В – лимфоцитов (p<0,05).
На ранней стадии РА отмечено увеличение относительного содержания CD25+лимфоцитов, ФАН с незначительным ростом IFNγ (p<0,05). При длительности заболевания от 1 года до 10 лет выражено увеличение IFNγ, содержание лимфоцитов, натуральных киллерных клеток (NK) клеток, НФ без изменения ФАН, снижено относительное содержание CD25+ лимфоцитов. У пациентов с поздней стадией РА длительностью более 10 лет снижено содержание лейкоцитов, лимфоцитов и изучаемых субпопуляций лимфоцитов (p<0,05) при сохранении высоких уровней провоспалительных цитокинов, Ig и ЦИК крови.
Терапия больных РА низкими дозами глюкокортикостероидами (ГКС) в сочетании с нестероидными противовоспалительными препаратами (НПВП) приводит к снижению TNFα, IgA, ЦИК и увеличению относительного содержания CD19+–лимфоцитов (p<0,05). Под влиянием комбинированной терапии преднизолоном и диклофенаком на фоне метотрексата снижается уровень TNF-α, относительное содержание CD4+, иммунорегуляторный индекс (ИРИ) (p<0,05).
Впервые исследован фенотип лимфоцитов у больных остеоартрозом (ОА), при этом определено достоверное увеличение относительного и абсолютного содержания CD16+, без изменения содержания CD3+, CD4+, CD8+, CD19+, CD25+ лимфоцитов, Ig, ЦИК,ФИ и ФЧ.
Практическая значимость
Определение содержания цитокинов (TNF-, IFNγ), фенотипа лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD25+), ФАН (ФИ и ФЧ), IgA, IgG, IgM, ЦИК может быть использовано как дополнительный информативный метод для оценки активности воспалительного процесса и эффективности терапии.
Установлено преимущество применения при РА преднизолона в сочетании с диклофенаком, по сравнению с монотерапией диклофенаком, что приводит к снижению уровня TNFα, IgA, ЦИК и увеличению относительного содержания CD19+ лимфоцитов на фоне выраженного клинико-лабораторного улучшения.
Определено, что целебрекс при РА достоверно не отличается по клинической эффективности от диклофенака, однако имеет лучшую субъективную переносимость.
Полученные данные в виде увеличения уровня IFNγ, дисфункции НФ являются основанием для рекомендаций по разработке и внедрению биологической терапии РА на базе антител к IFNγ, а также применению иммуномодулирующих препаратов, направленных на повышение ФАН.
Основные положения, выносимые на защиту
- При РА увеличены уровни TNF-α и IFNγ, относительное и абсолютное содержание NK-клеток, снижено относительное содержание лимфоцитов крови и В-лимфоцитов, увеличено содержание лейкоцитов, НФ крови без роста ФИ и ФЧ. Определены взаимосвязи между Т-, В-лимфоцитами, NK-клетками, цитокинами, Ig, ЦИК и ФАН у больных РА. У больных ОА выявлено увеличение относительного и абсолютного содержания CD16+ клеток, без изменения CD3+, CD4+, CD8+, CD19+, CD25+лимфоцитов и ФАН.
- Показана возможность использования TNF-α, IFNγ, IgA крови, в качестве дополнительных лабораторных тестов, для оценки активности воспалительного процесса при РА.
- На ранней стадии РА отмечено увеличение относительного содержания CD25+лимфоцитов, ФАН и незначительное увеличение IFNγ крови (p<0,05). При длительности заболевания от 1 года до 10 лет увеличено содержание IFNγ, лимфоцитов, NK–клеток, НФ без изменения ФАН, снижено относительное содержание CD25+ лимфоцитов. У пациентов с поздней стадией РА длительностью более 10 лет снижено содержание лейкоцитов, лимфоцитов и CD3+, CD4+, CD8+, CD16+, CD19+ лимфоцитов (p<0,05) при сохранении высоких уровней провоспалительных цитокинов, Ig и ЦИК крови.
- Терапия больных РА низкими дозами ГКС в сочетании с НПВП приводит к снижению TNFα, IgA, ЦИК и увеличению относительного содержания CD19+В–лимфоцитов. Под влиянием терапии преднизолоном, диклофенаком на фоне метотрексата определено снижение TNF-α , относительного содержания CD4+Т-хелперов, ИРИ.
Апробация материалов исследования
Основные положения диссертации доложены на научно-практических конференциях Ярославской областной клинической больницы (2004,2005); V научной конференции « Успехи современного естествознания» (Сочи, 2004); Ежегодной конференции интернов и ординаторов (2005,2009,2010, 20011); VIII и IX Всероссийских научных форумах «Дни иммунологии в Санкт-Петербурге» с международным участием имени академика В.И.Иоффе (2004, 2005); IV съезде ревматологов России (Казань, 2005); III Международном конкурсе молодых ученых на лучшую научную работу в журнале «Лечащий Врач» (2005); II Всероссийской конференции «Социальные аспекты ревматических заболеваний» (Воронеж, 2006); XI и XV Российской конференции “Гепатология сегодня» (Москва, 2006; 2010); Съезде терапевтов Юга России (Ростов-на-Дону, 2009); IV и V Национальном конгрессе терапевтов (Москва, 2009, 2010); VII Научной сессии Института гастроэнтерологии и клинической фармакологии СПбГМА им. И.А. Мечникова (Санкт-Петербург, 2010).
Вклад автора в проведенное исследование
Автором непосредственно проведены отбор, обследование и ведение пациентов, анализ и обобщение полученных результатов. В работах, выполненных в соавторстве, вклад автора является определяющим и заключается в непосредственном участии во всех этапах исследования: постановке задач, клинико-иммунологическом исследовании, обсуждении результатов научных публикациях и докладах, внедрение их в практику.
Реализация результатов работы
Основные положения диссертации внедрены в практику работы ревматологического отделения, ревматологического центра и иммунологической лаборатории ГБУЗ ЯО ОКБ. Результаты исследования используются при обучении врачей-интернов, ординаторов, слушателей института последипломного образования Ярославской государственной медицинской академии. По материалам диссертации опубликовано 25 научных работ, из них 4 статьи опубликовано в рецензируемых научных журналах, определенных ВАК Минобрнауки России.
Объем и структура диссертации
Диссертация изложена на 186 страницах и состоит из следующих разделов: введение, обзор литературы, методы исследования, клиническая характеристика пациентов, 3 главы с результатами собственных исследований, обсуждение полученных результатов, выводы, практические рекомендации, указатель литературы. Указатель литературы включает 221 источник: 100 отечественных и 121 иностранный. Работа иллюстрирована 62 таблицами, 19 рисунками и имеет 2 клинических примера.
Основное содержание работы
Материалы и методы исследования
Клиническая часть работы выполнена на базе ревматологического отделения Государственного учреждения здравоохранения Ярославской области областной клинической больницы ГБУЗ ЯО ОКБ (главный врач – заслуженный врач РФ, кандидат медицинских наук О.П. Белокопытов). Иммунологическое обследование проведено в лаборатории клинической иммунологии ГБУЗ ЯО ОКБ (заведующая лабораторией – Л.А. Цыганова).
Обследовано 104 пациентки, среди них 80 женщин, больных РА и 24 – ОА. Контрольная группа состояла из 25 условно здоровых лиц, репрезентативных по полу и возрасту, не имеющих хронических заболеваний или с хроническими заболеваниями в стадии ремиссии.
При постановке диагноза РА руководствовались диагностическими критериями ACR, 1987 года (F.C. Arnrett et al., 1988). Для верификации диагноза ОА использованы диагностические критерии ОА (R. Altman et al., 1995)
Объем обследования больных: анамнез, объективное исследование: оценка тяжести заболевания врачом и пациентом и субъективная оценка болевого синдрома по 100 мм ВАШ (мм); продолжительность утренней скованности (минуты); суставной индекс Ричи (СИР) (оценка 53 суставов); суставной счет (СС) и число припухших суставов (ЧПС) (исходя из 68 и из 44 суставов соответственно); динамометрия кистей (кгс); время, в течение которого больной проходит 30 м (секунды), поднимается и спускается на 1 пролет лестницы (секунды); опросник состояния здоровья для оценки качества жизни (HAQ), индекс Lequesnе.
Для оценки активности РА использовался индекс DAS-4. Значение DAS-4 > 3,7 соответствовало высокой активности болезни; 2,4 > DAS-4 <3,7 – умеренной; DAS-4 <2,4 - низкой; значение DAS-4 <1,6 - ремиссии.
Наряду с общепринятыми клинико - лабораторными методами исследования, рентгенологическим исследованием суставов, определением С-реактивного протеина (СРП) полуколичественным латекс-тестом, титра РФ твердофазным иммуноферментным анализом, применяли специальные методы исследования: определение сывороточных цитокинов TNF-a и IFN-γ методом твердофазного иммуноферментного анализа с использованием коммерческих наборов реактивов «ИФА-TNF-alfa» и «ИФА-IFN-gamma» Санкт-Петербургского НИИЭМ им. Пастера (А.В. Демьянов, 2003), иммуноцитохимический субпопуляционный анализ лимфоцитов крови (А.А. Тотолян и соавт., 1999) с использованием реактивов фирмы DAKO (Дания). Определение ФИ и ФЧ нейтрофилов крови при помощи микробной тест – культуры стафилококка штамма 209 (В.В. Меньшиков, 1987). Определение ЦИК методом преципитации с 3,5% раствором полиэтиленгликоля ПЭГ- тест ОП 280, используя реактивы фирмы HUMAN (Германия) (В.В. Меньшиков, 1987). Определение Ig методом одномерной радиальной иммунодиффузии в агаровом геле, используя реактивы ФГУП «НПО «Микроген», Нижний Новгород (В.В. Меньшиков, 1987).
Эффективность терапии больных РА оценивали в динамике через 4 недели с учетом индекса DAS-4 (J.S. Smolen et al., 2003) и итоговой оценки по критериям улучшения ACR (D.T. Felson D.T. et al., 1993).
Статистическую обработку материала производили на персональном компьютере с помощью программы «Statistica Stat Soft», версия 6,0. Данные представлены в виде средней арифметической величины и стандартной ошибки среднего (М±m). Для определения достоверности различий использовали методы параметрической и непараметрической статистики: t-критерий Стъюдента, F- критерий, критерии Манна-Уитни, Вилкоксона, критерий χ². Взаимосвязи между вычисляемыми переменными рассчитывали при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
Среди 104 пациентов было 80 больных РА. Возраст больных - от 21 до 70 лет, средний возраст - 51,961,36 года, длительность заболевания – в среднем 7,240,7лет, при этом - длительность РА до 1 года у 20 человек (25%), в том числе, до 6 месяцев - у 9 человек (11,25%), от 1 года– до 10 лет - у 39 (48,75%), более 11 лет–у 21 (26,25%) пациента. I степень активности выявлена у 5 человек (6,25%), II - у 36 (45%) человек, III – у 39 (48,75%) пациентов. Системные проявления имели место у 39 больных (48,75%), серопозитивными по РФ были 80% пациентов (64 человека). I-II рентгенологическая стадия определена у 42 больных (52,2%), Ш-IV – у 38 пациентов (47,5%). Преобладали больные со II и III функциональными классами (соответственно 40% и 55%).
Группу сравнения составили 24 пациента с ОА, средний возраст больных - 51,28±1,5года, средняя длительность заболевания - 9,54±1,34 года. У 21 человека (87,5%) выявлен генерализованный ОА, преобладала II рентгенологическая стадия заболевания – 66,7% (16 человек), III – выявлена в 25% случаев (6 человек), IV – в 8,3% (2 человека). Реактивный синовит имел место у 50% пациентов (12 человек).
Критерии включения в исследование: информированное согласие пациента; установленный диагноз РА в соответствии с критериями АCR 1987 г., установленный диагноз ОА (критерии R. Altman et al., 1995); возраст больных - от 21 до 70 лет.
Критерии исключения: клинически значимые сопутствующие заболевания: инфекционные, аутоиммунные, инфаркт миокарда, недостаточность кровообращения II Б-Ш стадии, декомпенсированный сахарный диабет, другие эндокринные заболевания, новообразования, болезни крови.
При РА по сравнению с нормой определено достоверное увеличение в 3 раза уровней TNF-α и IFNγ (р<0,05, рис. 1), что соответствует данным литературы (В.А. Насонова и соавт., 2008; А.А. Новиков и соавт., 2009; J.M. Dayer, 2002).
У больных РА выявлено увеличение IgА, IgG, IgМ и уровня ЦИК (p<0,05, рис.1).
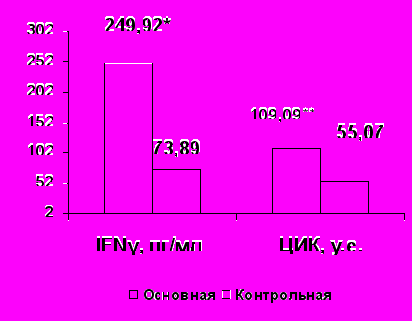 | 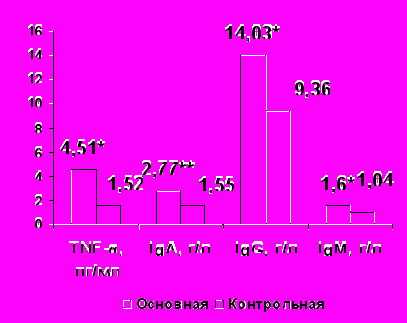 |
Рисунок 1. Содержание цитокинов, иммуноглобулинов и ЦИК крови у больных РА и здоровых лиц
Примечание *- р<0,05, **- р<0,01
У больных РА по сравнению со здоровыми выявлено достоверное снижение относительного содержания лимфоцитов крови, а также рост относительного и абсолютного содержания CD16+лимфоцитов (р<0,05, таблица 1), что свидетельствует о значении NK- клеток в поддержании хронического воспаления при РА (В.В.Соколова и соавт., 2007; I. González-Alvaro et al., 2006). При РА по сравнению с нормой определено достоверное снижение относительного содержания CD19+клеток что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления и усиленной дифференцировкой В-лимфоцитов в иммуноглобулинпродуцирующие плазматические клетки, которые утрачивают способность экспрессировать CD19+рецептор (р<0,05, таблица 1). При РА отмечена тенденция к увеличению процентного содержания CD8+ лимфоцитов (р>0,05, таблица 1) и росту абсолютного числа CD3+, CD4+, CD8+, CD25+ рецепторов, а также тенденция к снижению ИРИ (р>0,05), что можно объяснить активацией лимфоцитарной системы при РА.
При РА по сравнению с нормой определено увеличение лейкоцитов крови, относительного и абсолютного содержания НФ (р<0,01, таблица 1) без изменения ФИ и ФЧ крови (р>0,05), что, может быть обусловлено функциональной неполноценностью НФ.
Таблица 1
Содержание лейкоцитов, нейтрофилов и субпопуляций лимфоцитов крови у больных ревматоидным артритом (М ±m)
| Показатель | Здоровые n =25 | Больные РА n =80 | p |
| Лейкоциты, 109/л | 5,96±0,45 | 7,83±0,32 | p <0,05 |
| Лимфоциты,% | 32,95±1,56 | 27,48±1,17 | p < 0,05 |
CD8 +,% | 23,3±0,95 | 24,82±0,42 | p >0,05 |
CD16 +,% | 22,95±1,4 | 26,49±0,46 | p <0,01 |
CD19 +,% | 24,63±1,0 | 22,51±0,53 | p <0,05 |
CD16 +, 109/л | 0,43±0,04 | 0,56±0,03 | р <0,01 |
| Нейтрофилы ,% | 55,57±1,89 | 61,51±1,58 | p <0,01 |
| Нейтрофилы , 109/л | 3,14±0,2 | 4,75±0,26 | p <0,05 |
Примечание: р – уровень значимости различия групп,
n – количество обследованных
У больных ОА по сравнению со здоровыми определен достоверный рост процентного содержания и экспрессии CD16+ лимфоцитов (р<0,05), что, вероятно, связано с активацией NK. Этот факт свидетельствует о роли клеточных доиммунных механизмов в развитии и прогрессировании ОА. У пациентов с РА по сравнению с больными ОА выявлено снижение относительного содержания лимфоцитов крови (27,48±1,17% и 32,92±1,18%, соответственно, t=- 2,37, р<0,05), тенденция к увеличению CD8+%, CD25+% клеток, лейкоцитов, НФ и снижению CD19+% (р>0,05).
Определена прямая умеренная взаимосвязь уровня TNF-α с активностью РА и выраженностью суставного синдрома (F=3,45, p<0,05, r= 0,39, p<0,01, рис.2).
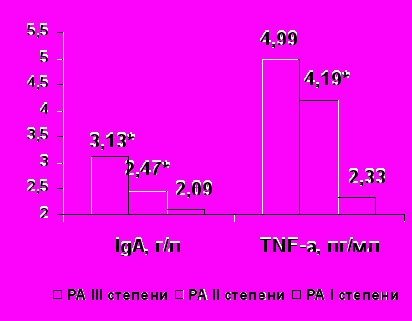 | 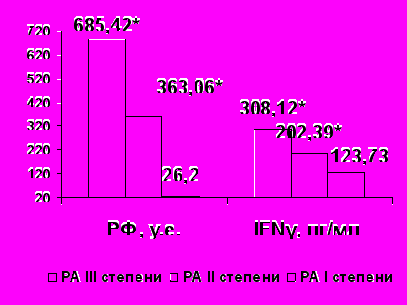 |
Рисунок 2. Содержание TNF-α , IFNγ, IgA и РФ крови в зависимости от активности РА.
Примечание * - р<0,05
Определено увеличение содержания IFNγ (F=2,89, p<0,05, рис. 2), IgА (F=0,46, p<0,05, рис.2) и титра РФ (F=0,41, p <0,05, рис.2), а также усиление дисфункции НФ в виде увеличения лейкоцитов, НФ без изменения ФИ и ФЧ (p <0,05) по мере повышения степени активности РА, что связано, по-видимому, с нарастанием процессов иммунного воспаления. При различных степенях активности РА достоверно не изменялись относительное и абсолютное содержание CD3+, CD4+, CD8+, CD16+, CD19+, CD25+ лимфоцитов (р>0,05), вероятно, динамика субпопуляций лимфоцитов не отражает непосредственно активность воспалительного процесса.
Уровни TNF-α и IgM были статистически значимо выше в группе больных РА с наличием внесуставных проявлений (t = 2,8, t=2,0, соответственно, р<0,05).
У больных с системными проявлениями заболевания по сравнению с группой пациентов без внесуставных изменений выявлено достоверное увеличение абсолютного числа лимфоцитов крови (t= 2,9, р<0,005, рис.3) и CD3+, CD4+, CD8+ CD16+, CD19+лимфоцитов (р<0,05, рис.3). У пациентов с внесуставными проявлениями РА по сравнению с больными без системных проявлений определено увеличение лейкоцитов (t=3,14, р<0,001), абсолютного содержания НФ крови (t=2,6, р<0,05), сопровождающееся достоверным снижением ФЧ (t= - 2,1, р<0,05), что свидетельствует о выраженном дефекте фагоцитоза НФ.
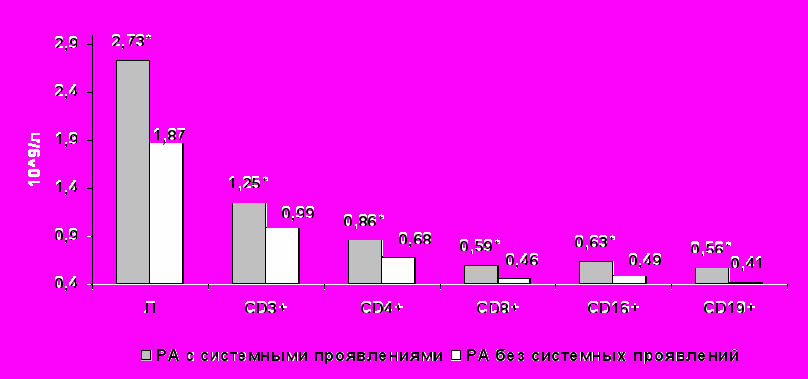
Рисунок 3. Содержание субпопуляций лимфоцитов крови в зависимости от наличия или отсутствия системных проявлений РА.
Примечание *- р<0,05
В обеих группах достоверно не отличались относительное содержание лимфоцитов, CD3+ ,CD4+, CD8+, CD19+, CD25+, абсолютное число CD25+, уровни IFNγ, IgA, IgG и ЦИК (р>0,05).
В группе пациентов с III-IV рентгенологическими стадиями, по сравнению с пациентами с I-II, достоверно снижено содержание CD3+% (t=2,1, р<0,05), CD19+% (t=2,0, р<0,05), а также определена тенденция к снижению ФАН (р>0,05). Уровни TNF-α, IFNγ, относительное и абсолютное содержание CD4+, CD8+, CD16+, CD25 рецепторов, ИРИ, Ig и ЦИК между группами не имели достоверного различия (р>0,05).
При серопозитивной форме РА по сравнению с серонегативной ыявлено достоверное увеличение TNF-α, ЦИК и IgA (t= 2,3, t=2,1, t=2,9, соответственно, p<0,05). Не выявлено достоверного изменения между группами относительного и абсолютного содержания IFNγ, исследуемых лимфоцитов, ИРИ, ФАН, IgG и IgM (p>0,05).
У больных РА с длительностью заболевания до 1 года уровень IFNγ был достоверно ниже, по сравнению с пациентами с большей продолжительностью заболевания (124,56±15,24 пг/мл, 304,25±53,36 пг/мл, 285,66±75,1 пг/мл, длительность РА до 1 года, от 1 до 10 лет, более 10 лет соответственно, p<0,05). При длительности РА до 1 года по сравнению с нормой зафиксировано достоверное увеличение относительного содержания НФ и ФИ (p<0,05), а по сравнению с длительностью заболевания от 1 года до 10 лет, определено достоверное увеличение относительного содержания CD25+ лимфоцитов (p<0,05).
У пациентов с длительностью РА более 10 лет по сравнению с длительностью болезни от 1 до 10 лет определено достоверное снижение абсолютного содержания CD3+, CD4+, CD8+ CD16+, CD19+ лимфоцитов (p<0,05) и лейкоцитов (p<0,05), при этом сохраняются высокие уровни РФ, ЦИК, Ig крови, что свидетельствует о состоянии Т - иммунодефицита, сопровождающегося повышенным образованием антител и ЦИК. Отсутствовало достоверное различие между группами ИРИ, TNF-α, IgA, ЦИК и РФ (p>0,05).
Были исследованы взаимосвязи между клинико-лабораторными и иммунологическими показателями РА, представленные на рисунке 4. Выявлены умеренные прямые корреляционные связи между относительным содержанием CD25+ лимфоцитов, экспрессирующих ранний активационный маркер с одной стороны и относительным содержанием CD8+ клетками (r=0,31, p<0,001), относительным содержанием CD19+ В-лимфоцитами (r=0,41, p<0,004), ФИ (r= 0,39, p<0,007) и ФЧ (r= 0,47, p<0,001) с другой стороны. Зафиксированы умеренные обратные корреляционные связи между относительным содержанием CD25+ лимфоцитов с одной стороны и относительным содержанием Т-хелперов (r= - 0,43, p<0,03), ИРИ (r= - 0,49, p<0,001) и IFNγ крови (r= - 0,37, p<0,01) с другой стороны. Зафиксирована умеренная обратная взаимосвязь между СРП и СОЭ с одной стороны и относительным содержанием CD25+ клеток (r= - 0,36, p<0,01, r= - 0,38, p<0,02, соответственно) с другой. Можно заключить, что увеличение содержания лимфоцитов несущих ранний активационный маркер сопровождается нарастанием в крови относительного содержания цитотоксических клеток, В-лимфоцитов, увеличением ФАН и уменьшением выраженности воспалительной реакции.
Увеличение относительного содержания Т-хелперов и IFNγ крови приводит к уменьшению относительного содержания CD25+ лимфоцитов, что, возможно, препятствует завершению воспалительного процесса.
Обнаружена обратная корреляционная связь между относительным содержанием CD4+ клеток и IFNγ с одной стороны и ФАН с другой стороны (r= - 0,24, p<0,05; r= - 0,4, p<0,01, соответственно) и умеренная прямая корреляционная связь между относительным содержанием CD19+ В-лимфоцитов с одной стороны и ФЧ с другой стороны (r= 0,41, p<0,007). Определены умеренные прямые взаимосвязи между СРП, СОЭ, а также показателями, отражающими функциональное состояние суставов, качество жизни, с одной стороны и содержанием IFNγ крови, IgА, титром РФ крови с другой (p<0,05). Определены умеренные обратные корреляционные связи между СС, ЧВС с одной стороны и относительным содержанием CD3+ лимфоцитов с другой (p<0,05) и прямые умеренные корреляционные связи между СС, ЧВС одной стороны и TNFα с другой (p<0,05). Полученные данные приведены на рисунке 4.
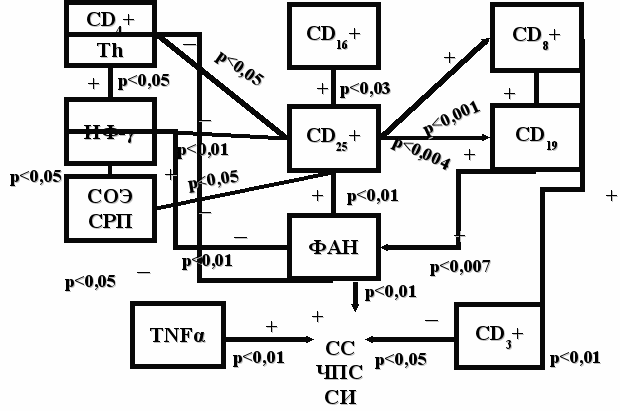
Рисунок 4. Взаимосвязи между клинико-лабораторными и иммунологическими показателями РА.
В соответствии с задачами исследования осуществлялся подбор пациентов, которым при поступлении в отделение были назначены ГКС и НПВП. Больные были разделены на две группы: пациентам первой группы (23 человека) был назначен диклофенак в дозе 150 мг в сутки; второй группы (30 человек) – преднизолон 10 мг в сутки в сочетании с диклофенаком 150 мг в сутки. Группы были репрезентативны по возрасту, длительности заболевания. Клинико-лабораторное исследование производилось в динамике: при поступлении и через четыре недели лечения НПВП и ГКС.
У больных первой группы имело место достоверное клиническое улучшение (p<0,05) без статистически значимой динамики цитокинов, субпопуляций лимфоцитов, ФАН, Ig, ЦИК, острофазовых белков (p>0,05). У больных второй группы статистически значимое клиническое улучшение сопровождалось достоверным снижением TNF-α, IgA, ЦИК, СОЭ, СРП, увеличением гемоглобина и процентного содержания CD19+ (p<0,05, таблица 2).
Таблица 2
Динамика относительного содержания CD4+, CD19+ лимфоцитов, TNF-α, IgА и ЦИК крови под влиянием фармакотерапии (М ±m)
| \ | Показатель | ||||
| CD4+% | CD19+% | TNF-α, пг/мл | IgА, г/л | ЦИК, у.е. | |
| 1.Здоровые (n=25) | 35,89±1,23 | 24,63±1,0 | 1,52±0,08 | 1,55±0,08 | 55,07±0,56 |
| Д. (n=23) 2.До лечения 3.После лечения p (3,2) p (3,1) | 35,89±1,23 36,4±1,07 >0,05 >0,05 | 23,5±0,93 23,87±1,72 >0,05 >0,05 | 4,71 ±0,47 4,11±0,49 >0,05 <0,05 | 2,67±0,17 2,6±0,23 >0,05 <0,05 | 104,42±12,5 83,95±11,49 >0,05 <0,05 |
| Д.+П. (n=30) 4.До лечения 5.После лечения p (5,4) p (5,1) | 36,26±0,78 35,0±1,1 >0,05 >0,05 | 21,48±0,92 3,29±0,89 <0,05 >0,05 | 4,82 ±0,46 3,31±0,42 <0,001 <0,05 | 3,01±0,22 2,51±0,16 < 0,05 < 0,05 | 109,32±10,03 76,78±9,85 <0,05 > 0,05 |
| Д.+П.+МТ. (n=15) 6.До лечения 7.После лечения p (7,6) p (7,1) | 35,86±1,25 31,9±1,3 <0,05 <0,02 | 23,07±1,08 21,3±1,44 >0,05 >0,05 | 3,97 ±0,23 3,01±0,35 <0,05 <0,01 | 2,55±0,32 2,16±0,23 >0,05 > 0,05 | 126,47±13,46 121,71±7,49 >0,05 >0,05 |
Примечания: р – уровень значимости различия групп с соответствующими номерами,
n – количество обследованных
Д. – Диклофенак, П. – Преднизолон, МТ. - Метотрексат
Не выявлено достоверного влияния терапии преднизолоном и диклофенаком на содержание IFNγ, относительный и абсолютный уровни CD3+, CD4+, CD8+, CD16+, CD25+ лимфоцитов (p>0,05). Связь между комбинированной терапией и клиническим эффектом в целом в соответствии с критерием х2 является достоверной (х2=6,31; р=0,01).
В соответствии с задачами краткосрочного исследования оценивалось воздействие сочетания ГКС и НПВП на фоне терапии метотрексатом на клинико-лабораторные и иммунологические показатели. 15 больных РА (первая группа) получали метотрексат в дозе 10 мг в неделю в течение не менее 2 месяцев до поступления в отделение, а также преднизолон – 10 мг в сутки и диклофенак в дозе 150 мг в сутки. Доза метотрексата не менялась на протяжении стационарного лечения. Пациенты второй группы (30 человек) получали преднизолон 10 мг в сутки в сочетании с диклофенаком 150 мг в сутки. Группы были репрезентативны по возрасту, длительности заболевания. Клинико-лабораторное исследование производилось в динамике: при поступлении и через четыре недели лечения, показатели приведены в таблице 2.
У пациентов первой группы после лечения достоверное клиническое улучшение сопровождалось снижением TNF-α (p< 0,05, таблица 2), СОЭ, СРП, увеличением гемоглобина (p<0,05). В этой группе пациентов до лечения по сравнению с нормой не определено достоверного различия в относительном содержании лимфоцитов, CD16+% и CD19+% лимфоцитов (p>0,05), в отличие от пациентов второй группы, у которых до лечения по сравнению со здоровыми, имело место достоверное снижение относительного содержания лимфоцитов, CD19+% клеток и увеличение CD16+% лимфоцитов (p<0,05), связанное с приемом метотрексата. После лечения в первой группе определено достоверное снижение относительного содержания Т-хелперов (p<0,05, таблица 2) и ИРИ (p<0,05). Не выявлено достоверного влияния терапии метотрексатом, преднизолоном и диклофенаком на уровень IFNγ, относительное и абсолютное содержание CD3+, CD8+, CD16+, CD19+, CD25+ лимфоцитов. Не определено достоверной взаимосвязи между терапией в первой и второй группах и клиническим эффектом в соответствии с критерием х2, х2=0,11; р=0,74, что может быть связано с краткосрочностью проводимого исследования на фоне интенсивной противовоспалительной терапии.
Была изучена сравнительная эффективность воздействия высокоселективного специфического ингибитора ЦОГ2 – целебрекса и неселективного НПВП диклофенака на клинико-лабораторные показатели, содержание субпопуляций лимфоцитов, цитокинов и ФАН у больных РА. 24 пациента с РА были разделены на 2 репрезентативные группы по 12 человек в каждой: I группе пациентов было назначено пероральное лечение целебрексом в дозе 400 мг в сутки, II-ой группе – диклофенаком в дозе 150 мг в сутки в течение 4-х недель.
После лечения и в первой и во второй группах определено достоверное снижение ВАШ боли и тяжести заболевания, СИ, СС, ССК, HAQ (p<0,01). И в первой и во второй группах обнаружена тенденция к снижению TNF-α, СОЭ и СРП (p> 0,05). В обеих группах не выявлено достоверной динамики IFNγ, лимфоцитов, Ig, ЦИК, РФ, лейкоцитов, ФАН, гемоглобина, (p 0,05). Не определено достоверной взаимосвязи между терапией и клиническим эффектом в соответствии с критерием х2, х2=0,18; р=0,67, что соответствует данным литературы о сопоставимости НПВП по эффективности, но различию по переносимости этих лекарственных препаратов (Е.Л.Насонов, 2008).
Выдвигается предположение, согласно которому патогенез и клинические проявления РА объясняются комбинацией дисфункции лимфоцитарного звена иммунной системы, изменением цитокинового статуса, нарушением функционирования НФ, наличием взаимосвязей между различными звеньями иммунной системы. Для раннего РА характерно увеличение относительного содержания CD25+ лимфоцитов, ФАН с незначительным ростом IFNγ. При длительности заболевания от 1 года до 10 лет выражено увеличение IFNγ, лимфоцитов, NK –клеток, НФ без изменения ФАН, снижено относительное содержание CD25+клеток. При длительности РА более 10 лет снижено содержание лейкоцитов, субпопуляций лимфоцитов, что свидетельствует о состоянии Т –иммунодефицита, при сохранении высоких уровней провоспалительных цитокинов, Ig, и ЦИК крови. У больных ОА выявлено увеличение относительного и абсолютного содержания CD16+ клеток, без изменения CD3+, CD4+, CD8+, CD19+, CD25+ лимфоцитов, ФАН, Ig, ЦИК.
Выводы
- При РА имеет место рост уровней цитокинов – TNFα и IFNγ, IgA, IgG, IgM, ЦИК, увеличение лейкоцитов и НФ без изменения ФИ и ФЧ.
- У больных РА выявлены иммунологические нарушения в виде достоверного увеличения абсолютного и относительного содержания CD16+ NK, снижения относительного содержания CD19+ В-лимфоцитов, на фоне уменьшения относительного содержания лимфоцитов крови; определена тенденция к росту абсолютного содержания CD3+, CD4+, CD8+ лимфоцитов (в том числе, и в процентном соотношении), CD25+ маркеров ранней активации лимфоцитов.
- По мере роста степени активности РА имеет место увеличение содержания IFNγ, IgA титра РФ крови, снижение относительного содержания лимфоцитов крови, усиление дисфункции НФ в виде увеличения лейкоцитов, НФ без изменения ФАН. Выявлена прямая взаимосвязь уровня TNFα с активностью РА и выраженностью суставного синдрома, а именно СС, СИ, ЧВС (F=3,45, p<0,04, r=0,39, p<0,04) без изменения субпопуляций лимфоцитов.
- При РА с системными проявлениями болезни достоверно увеличены содержание TNFα (р<0,05), экспрессия молекулярных рецепторов CD3+ Т-лимфоцитов, CD4+ Т-хелперов, CD8+ цитотоксических лимфоцитов, CD16+ NK, CD19+ В–лимфоцитов (р<0,05), абсолютное число лимфоцитов крови (р<0,005) и IgМ (р<0,05), с увеличением лейкоцитов, НФ, снижением ФЧ.
- При серопозитивных формах РА по сравнению с серонегативными выявлено достоверное увеличение TNF-α, ЦИК и IgA крови (p<0,05). При III-IV рентгенологических стадиях РА, по сравнению с I-II, определено достоверное снижение относительного содержания CD3+ Т-лимфоцитов (р<0,05) и CD19+ В - лимфоцитов (р<0,05).
- Для раннего РА характерно увеличение относительного содержания CD25+ лимфоцитов, ФАН с незначительным ростом IFNγ. При длительности заболевания от 1 года до 10 лет выражено увеличение IFNγ, лимфоцитов, NK –клеток, НФ без изменения ФАН, снижено относительное содержание CD25+ лимфоцитов. При длительности РА более 10 лет снижено содержание лейкоцитов, субпопуляций лимфоцитов при сохранении высоких уровней провоспалительных цитокинов, иммуноглобулинов и ЦИК крови.
- Выявлена прямая умеренная взаимосвязь между относительным содержанием CD25+ лимфоцитов с одной стороны и относительным содержанием CD19+ В–лимфоцитов и CD8+ цитотоксических лимфоцитов, ФАН с другой стороны и обратная умеренная связь между относительным содержанием CD25+ клеток с одной стороны и процентным содержанием CD4+ Т-хелперов, ИРИ, IFNγ и клинико-лабораторными проявлениями РА с другой, как признаки взаимосвязи иммунного и неспецифического воспаления. Относительное содержание CD3+ лимфоцитов, CD25+ лимфоцитов, уровни TNF-α и IFNγ крови отражают выраженность клинико-лабораторных и иммунологических проявлений заболевания и могут быть использованы как дополнительные диагностические маркеры.
- Терапия больных РА низкими дозами ГКС в сочетании с НПВП приводит к достоверному клиническому улучшению со снижением TNFα, IgA, ЦИК, СОЭ, СРП и увеличением относительного содержания CD19+ В–лимфоцитов и гемоглобина. Под влиянием терапии преднизолоном и диклофенаком на фоне метотрексата отмечается достоверное клиническое улучшение со снижением TNF-α, относительного содержания CD4+ Т-хелперов, ИРИ, СОЭ, СРП и увеличением гемоглобина.
- Высокоселективный специфический ингибитор ЦОГ2 – целебрекс достоверно уменьшает продолжительность утренней скованности, показатели ВАШ боли и тяжести заболевания, СИ, СС, ССК, индекс HAQ, без изменения иммунологических показателей крови.
- У больных ОА выявлено достоверное увеличение относительного и абсолютного содержания CD16+ NK, без изменения содержания CD3+, CD4+, CD8+, CD19+, CD25+ лимфоцитов, Ig, ЦИК, лейкоцитов, НФ, ФАН.
Практические рекомендации
- Определение уровней TNFα, IFNγ,относительного и абсолютного содержания CD3+, CD4+, CD8+, CD16+, CD19+, CD25+ лимфоцитов, ФАН, Ig, ЦИК крови может быть использовано в качестве дополнительных лабораторных тестов для оценки активности воспалительного процесса и эффективности терапии РА.
- Комбинация преднизолона в сочетании с диклофенаком рекомендуется при умеренной и высокой активности РА, что позволяет достигнуть выраженной клинико-лабораторной эффективности, сопровождающейся снижением TNFα, IgA, ЦИК и увеличением относительного содержания CD19+ В–лимфоцитов.
- В фазу обострения РА целесообразнее применение высоких терапевтических доз целебрекса, по сравнению с диклофенаком, в связи с более хорошей субъективной переносимостью целебрекса.
Список научных трудов, опубликованных по теме диссертации
1. Клинико-иммунологические особенности и эффективность фармакотерапии у больных с ранним ревматоидным артритом. / Иванюк М.В., Данилова Т.Г., Цыганова Л.А. // Актуальные вопросы современной ревматологии и кардиологии. - Волгоград - 2004. – C. 43-44.
2. Клиника и диагностика очень раннего ревматоидного артрита. / Иванюк М.В., Данилова Т.Г. //Научно-практическая ревматология.–2004.-№2.–С. 130.
3. Клинико-лабораторные проявления раннего ревматоидного артрита. / Иванюк М.В., Данилова Т.Г. // Фундаментальные исследования. – 2004. - №2. – C. 136.
4. Клинико-биохимические показатели при ревматоидном артрите и реактивных артритах. / Данилова Т.Г., Чаплыгина Л.Н., Иванюк М.В., Данилова Е.В. // Современные наукоемкие технологии. – 2004. - №3. – C. 59.
5. Изменения со стороны иммунной системы при ревматоидном артрите. / Иванюк М.В. // Фундаментальные исследования. – 2004. - №4. – C. 68.
6. Особенности состояния лимфоцитарной системы у больных ревматоидным артритом. / Иванюк М.В., Данилова Т.Г., Цыганова Л.А. // Медицинская иммунология. – 2004. - Том 6; №3-5. – C. 285-286.
7. Диагностика суставного синдрома при реактивных артритах и очень раннем ревматоидном артрите. / Данилова Т.Г., Иванюк М.В.,Чаплыгина Л.Н., Данилова Е.В. // Успехи современного естествознания.–2004.-№8.–C.36.
8. Эффективность эссенциале Н в терапии алкогольной болезни печени. / Данилова Т.Г., Цыбулько С.В., Данилова Е.В., Чаплыгина Л.Н., Иванюк М.В., Репкина А.М.,. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2004. - Т. 14. - №5. – C. 77.
9. Оценка уровней цитокинов у больных ревматоидным и реактивным артритами в сравнительном аспекте. / Данилова Т.Г.,Чаплыгина Л.Н., Пачкунова М.В. // Фундаментальные исследования. – 2005. - №2. – C. 42-43.
10. Уровни ФНО-α и ИФ- γ при ревматоидном артрите. / Пачкунова М.В., Данилова Т.Г.,Чаплыгина Л.Н., Цыганова Л.А. // Научно-практическая ревматология. – 2005. - №3. – C. 96.
11. Динамика уровней некоторых цитокинов у больных реактивными артритами. / Чаплыгина Л.Н, Пачкунова М.В., Данилова Т.Г., Цыганова Л.А. // Научно-практическая ревматология. – 2005. - №3. – C.136.
12. Клеточные маркеры лимфоцитов при ревматоидном артрите. / Пачкунова М.В., Данилова Т.Г., Бородулина И.М., Цыганова Л.А. // Медицинская иммунология. – 2005. – Т. 7. - №2-3. – C. 145-146.
13. Клиническое исследование некоторых цитокинов крови (ФНО-α и ИФ- γ) у больных ревматоидным артритом. / Данилова Т.Г., Пачкунова М.В., Цыганова Л.А., Чаплыгина Л.Н. // Здравоохранение и медицинская техника. - №4. – 2005. – C. 39-40.
14. Клинико-диагностическое значение молекул цитокинов(ФНО-α и ИФ- γ) у больных реактивными артритами. / Данилова Т.Г., Цыганова Л.А.,Чаплыгина Л.Н., Пачкунова М.В., Бородулина И.М. // Здравоохранение и медицинская техника. - №7. – 2005. – C. 40-41.
15. Изменение печени, желчного пузыря и поджелудочной железы у больных остеоартрозом./ Данилова Т.Г., Пачкунова М.В. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2006. – Т. 16.-№1.–C.82.
16. Оценка эффективности противовоспалительной терапии у больных ревматоидным артритом. / Пачкунова М.В., Данилова Т.Г. // Тезисы II Всероссийской конференции «Социальные аспекты ревматических заболеваний». – 2006. – C. 104.
17. Клиническое обоснование применения целебрекса при ревматоидном артрите. / Данилова Т.Г., Пачкунова М.В., Феофанова Е.В., Цыганова Л.А. // Материалы съезда терапевтов Юга России « Врач XXI века: сегодня и завтра». – М., ООО «Издательский дом «Бионика».- 2009.- C. 40.
18. Оценка клинической эффективности целебрекса в сравнительном аспекте при ревматоидном артрите. / Данилова Т.Г., Пачкунова М.В., Феофанова Е.В., Цыганова Л.А. // Материалы VI национального конгресса терапевтов. – М., ООО «Издательский дом «Бионика».- 2009.- C.75.
19. Влияние терапии целебрексом на функциональное состояние печени у больных ревматоидным артритом / Данилова Т.Г., Пачкунова М.В., Феофанова Е.В..// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2010.- Т.20. - №1.- С. 82.
20. Оценка эффективности комбинированной терапии преднизолоном и диклофенаком у больных ревматоидным артритом. / Данилова Т.Г., Пачкунова М.В., Феофанова Е.В..// Материалы V национального конгресса терапевтов. – М., ООО «Издательский дом «Бионика».- 2010.- C.75 - 76.
21. Состояние молекулярных рецепторов и ФНО-α под влиянием противоревматической фармакотерапии у больных ревматоидным артритом./ Данилова Т.Г., Пачкунова М.В. // Врач. - 2010.- №12.- С. 35 - 38.
22. Содержание ФНО-α у больных ревматоидным артритом с гепатомегалией. / Данилова Т.Г., Пачкунова М.В. // Гастроэнтерология С–Петербурга. Материалы 7-ой Научной сессии Института гастроэнтерологии и клинической фармакологии СПбГМА. – 2010. - №4. –С. 8.
23. Иммунологический профиль больных ревматоидным артритом. / Пачкунова М.В. // Фундаментальные исследования.–2011.-№1.- С.148 – 157.
24. Состояние молекулярных рецепторов и фактора некроза опухоли альфа крови в зависимости от иммунологической характеристики ревматоидного артрита. / Данилова Т.Г., Пачкунова М.В., Цыганова Л.А. // Сборник материалов II Конгресса ревматологов России. – 2011. – С. 20.
25. Исследование иммунологических показателей крови у больных ревматоидным артритом в зависимости от клинической формы заболевания. / Пачкунова М.В, Данилова Т.Г., Цыганова Л.А. // Сборник материалов II Конгресса ревматологов России. – 2011. – С. 59.
Условные сокращения и обозначения.
ВАШ - визуально-аналоговая шкала
ГКС – глюкокортикоиды
ИРИ – иммуно-регуляторный индекс
НПВП – нестероидные противовоспалительные препараты
НФ – нейтрофилы
ОА – остеоартроз
РА – ревматоидный артрит
РФ – ревматоидный фактор
CИР – суставной индекс
СРП – С-реактивный протеин
СС – суставной счет
ССК – сила сжатия кисти
ФАН – фагоцитарная активность нейтрофилов
ФИ – фагоцитарный индекс
ФЧ – фагоцитарное число
ЦИК – циркулирующие иммунные комплексы
ЧПС – число припухших суставов
АCR –Американская коллегия ревматологов
CD –кластеры дифференцировки
DAS – 4 – индекс активности заболевания
HAQ – опросник состояния здоровья
IFNγ – интерферон гамма
Ig – иммуноглобулины
NK –натуральные киллерные лимфоциты
TNF-α – фактор некроза опухоли альфа

ПАЧКУНОВА Марина Валерьевна
ПРОВОСПАЛИТЕЛЬНЫЕ ЦИТОКИНЫ, ФЕНОТИП ЛИМФОЦИТОВ И ПОКАЗАТЕЛИ ФАГОЦИТОЗА У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
14.01.22 - ревматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
