Т. Д. Тябут > Л. Н. Маслинская Белорусская медицинская академия последиплом
| Вид материала | Диплом |
- Кулага Ольга Константиновна, профессор кафедры государственного учреждения образования, 424.04kb.
- Белорусская Православная Церковь Московского Патриархата Министерство здравоохранения, 54.49kb.
- С. М. Манкевич Белорусская медицинская академия последиплом, 66.85kb.
- А. П. Василевская О. Н. Белорусская медицинская академия последиплом, 45.41kb.
- Д. А. Гричанюк Белорусская медицинская академия последиплом, 147.55kb.
- Л. М. Беляева > Е. А. Колупаева > Е. К. Хрусталева Белорусская медицинская академия, 266.67kb.
- Методические рекомендации Минск, 2000г. Основное учреждение-разработчик : Белорусская, 392.82kb.
- Министерство Здравоохранения Республики Беларусь Белорусская медицинская академия последиплом, 411.39kb.
- С. С. Сиваков А. П. Манкевич С. М. Подсачик Л. В. Заневский В. П. Савищева Л. В. Белорусская, 36.8kb.
- Г. Л. Гуревич Белорусская медицинская академия последиплом, 192.14kb.
Доклинические изменения сердечно-сосудистой системы у пациентов с ревматоидным артритом
Т.Д. Тябут
Л.Н. Маслинская
Белорусская медицинская академия последипломного образования, Минск
Резюме
Главной причиной снижения продолжительности жизни пациентов с РА являются сердечно-сосудистые осложнения, обусловленные ранним развитием атеросклеротического поражения сосудов.
Авторы сообщают, что степень поражения сосудов у пациентов с РА выше, чем в контроле и не зависит от терапии РА. Нарушения структуры и функций сердца у пациентов с РА не отличалась от контрольной группы.
^ Ключевые слова: ревматоидный артрит, атеросклероз, толщина комплекса интима-медиа сонных артерий.
Ревматоидный артрит (РА) – хроническое аутоиммунное системное заболевание с преимущественным поражением суставов. Долгое время РА рассматривали лишь в качестве тяжелого инвалидизирующего заболевания редко приводящего к смерти. Однако в последние годы появились сообщения о более высокой смертности у пациентов с РА. Европейская антиревматическая лига (EUAR) в 2009 году приняла рекомендации по снижению кардиоваскулярного риска у пациентов с воспалительными артритами. Выживаемость неадекватно леченых пациентов с РА сопоставима с таковой при сахарном диабете, инсульте, ИБС с трехсосудистым поражением коронарных артерий [1]. Подобное увеличение смертности во многом обусловлено сопутствующими заболеваниями, в первую очередь сердечно-сосудистой патологией. Риск развития сердечно- сосудистых осложнений у пациентов с РА колеблется от 1,4 до 3,69 по сравнению с общепопуляционными.
В настоящее время доказано, что снижение продолжительности жизни больных РА происходит за счет кардиоваскулярных причин (инфаркт миокарда, инсульт, застойная сердечная недостаточность, внезапная сердечная смерть)[2, 3].
Сердечно-сосудистая патология при РА зачастую протекает бессимптомно или атипично, что затрудняет диагностику. Пациенты с РА реже описывают типичные ангинозные боли. У них чаще выявляются случаи бессимптомных инфарктов миокарда или внезапной смерти.
В последние годы все больше внимания уделяется изучению вариабельности ритма сердца (ВСР) как раннего предиктора сердечно-сосудистых нарушений при РА, однако полученные в ходе исследований данные противоречивы[, 6, 7].
В ряде работ представлены данные о снижении всех показателей ВСР у пациентов с РА. Выявлены нарушения регуляторного влияния вегетативной нервной системы на сердце. Опубликованы работы о взаимосвязи параметров ВСР с показателями воспалительной активности РА. Снижение ВСР в сочетании с высокой активностью заболевания может быть фактором риска развития сердечно-сосудистой патологии[]. При высокой активности заболевания снижение ВСР может отражать выраженность воспалительного поражения суставов[]. Низкие показатели ВСР у больных РА 1-2 степени активности могут указывать на высокий риск внезапной сердечной смерти и острого инфаркта миокарда в течение ближайших 2-4 лет[6].
В то же время авторы других исследований не выявили зависимости между изменениями ВСР, активностью и длительностью заболевания []. Не обнаружено корреляционных связей между продолжительностью болезни, клиническими проявлениями, активностью РА, распространенностью сердечно-сосудистых факторов риска и наличия ИБС с одной стороны, и дисфункцией вегетативной нервной системы (ВНС) с другой стороны[7].
При РА также установлено более частое, чем в популяции, формирование атеросклеротических бляшек и увеличение толщины комплекса интима-медиа (КИМ) сонных артерий [8, 9], также выявлена связь этих изменений с маркерами воспаления [10].
Исследования последних лет показали, что поражение сердца при РА может также протекать по типу ревматоидного кардита и встречается, по данным разных авторов, от 20 до 100 % случаев [12,13]. Клинические симптомы даже морфологически доказанного поражения сердца у больных РА чаще всего бывают слабо выраженными или протекают латентно. Возможно, этим объясняется причина значительного расхождения статистических данных о частоте поражения сердца у больных РА между клиницистами (20-40%) и морфологами (44-84%)[13, 14, 15].
Имеются работы доказывающие, что основными факторами, определяющими высокий кардиоваскулярный риск, являются наличие артериальной гипертензии, гипертрофии левого желудочка и увеличение толщины КИМ и/или наличие атеросклеротических бляшек [8, 11].
Целью данной работы явилось выявление клинически бессимптомных изменений со стороны сердечно-сосудистой системы у пациенток, страдающих РА, в зависимости от варианта терапии артрита.
^ Материал и методы
За период с декабря 2007 по ноябрь 2009 г. было обследовано 108 пациенток с серопозитивным РА, проходивших лечение в ревматологическом отделении УЗ «1-я ГКБ» г. Минска и 33 практически здоровые женщины.
Пациентки с РА были осмотрены при поступлении в стационар. Диагноз ревматоидного артрита установлен на основании комплексной оценки: осмотра, анамнеза, результатов лабораторных и рентгенографического обследований пациенток в соответствии с критериями Американской ревматологической ассоциации (1987 г.).
На момент осмотра пациентки с РА получали базисную терапию, продолжавшуюся не менее двух лет до момента включения в наблюдение, назначенную амбулаторно, либо при предыдущей госпитализации в стационар. Пациентки с РА и обследованные контрольной группы не имели клинических признаков ИБС и сосудистых осложнений (инфаркта миокарда, инсульта) на момент включения в исследование и анамнестически.
Пациентки, имеющие артериальную гипертензию, принимали антигипертензивную терапию, позволяющую контролировать артериальную гипертензию и удерживать целевые уровни артериального давления.
В зависимости от проводимой терапии основного заболевания все пациентки с РА были разделены на группы:
- 1-я группа – пациентки с РА, принимающие метотрексат (МТХ).
- 2-я группа – пациентки с РА, принимающие сульфасалазин (СС).
- 3-я группа – пациентки с РА, не принимающие базисной терапии (без БПВП) и регулярно принимающие лишь нестероидные противовоспалительные препараты (НПВС).
Пациентки с РА 1-ой и 2-ой групп помимо базисной терапии по необходимости принимали НПВС.
Отдельно была обследована 4-ая группа – контрольная – практически здоровых женщин, сходных по возрасту с основной группой.
Общая характеристика обследованных пациенток, страдающих РА, и группы контроля представлена в таблице 1.
^ Таблица 1
Общая характеристика пациенток обследованных групп
| | Группа пациентов | |||
| 1-ая | 2-ая | 3-яя | 4-ая | |
| Количество человек | 47 | 35 | 26 | 33 |
| Возраст пациентов | 49,85±9,55 | 48,09±11,07 | 47,8±9,99 | 47,9±11,55 |
| Длительность РА* | 10,0 (5,0-16,0) | 6,0(3,0-14,0) | 3,0(1,0-10,0) | – |
| Длительность РА 2-5 лет** | 14(29,79%) | 17(48,6%) | 18(69,2%) | - |
| Длительность РА 6-10 лет** | 11(23,40%) | 7(20%) | 4(15,4%) | – |
| Длительность РА более 10 лет** | 22(46,81%) | 11(31,4%) | 4(15,4%) | – |
| Активность по DAS 28* | 4,92(4,42-5,65) | 4,86(4,39-5,43) | 5,06(4,61-7,72) | – |
| Средняя активность по DAS 28** | 27(57,45%) | 23(65,7%) | 14(53,8%) | – |
| Высокая активность по DAS 28** | 20(42,55%) | 12(34,3%) | 12(46,2%) | – |
| Рентгенологическая стадия** | | | | |
| 1 стадия | 2 (4,26%) | 3(8,6%) | 3(11,55%) | – |
| 2 стадия | 13 (27,66%) | 16(45,7%) | 14(53,8%) | – |
| 3 стадия | 24 (51,06%) | 13(37,1%) | 6(23,1%) | – |
| 4 стадия | 8 (17,02%) | 3(8,6%) | 3(11,55%) | – |
| Системные проявления** | 9 (19,15%) | 7(20%) | 6(23,1%) | – |
* – значения представлены как медиана (1-ый квартиль- 3-ий квартиль) выборки,
** – значения представлены как абсолютные значения (% от числа пациентов группы)
Из приведенных данных видно, что группы сопоставимы по возрасту, активности процесса по DAS 28 и рентгенологической стадии заболевания.
Критерии исключения пациенток из исследования:
- серонегативность по ревматоидному фактору;
- возраст 60 лет и старше;
- наличие клинических проявлений ИБС и сосудистых осложнений при объективном обследовании или анамнестически;
- смена базисного препарата в течение двух лет до момента включения в исследование;
- нарушение функций щитовидной железы.
^ Методы исследования
Всем обследованным основных и контрольной групп было выполнено УЗ-исследование экстракраниальных участков брахиоцефальных артерий с целью определения толщины КИМ общих сонных артерий (ОСА) и визуализации атеросклеротических бляшек (локальное утолщение КИМ ≥ 1,2 мм) в сосудах, доступных осмотру. Ультразвуковое исследование брахиоцефальных артерий выполнялось с использованием ультразвукового сканера компании Esaote Biomedica (Италия) датчиком 7,5 МГц.
Толщина КИМ ОСА (мм) определялась в трех точках (1 точка – ОСА – 10 мм до бифуркации; 2 точка – 5 мм до бифуркации ОСА; 3 точка – бифуркация ОСА), измерения проводились с двух сторон, рассчитывалось среднее значения толщины КИМ. Значение КИМ от 0,9 до 1,2 мм расценивалось как утолщение. Субклинические признаки атеросклероза регистрировались при утолщении КИМ более 0,9 мм в выше описанных точках или наличии атеросклеротических бляшек в ОСА (локальное увеличение КИМ≥1,2 мм).
Ультразвуковое исследование сердца выполнялось с использованием ультразвукового сканера компании Esaote Biomedica (Италия) датчиком 2,5/3,5 МГц по стандартному протоколу в В-режиме и М-режиме из парастернального, апикального, субкостального и супрастернального доступов.
Массу миокарда левого желудочка (ММЛЖ) рассчитывали по формуле R. Devereux [16]. Определение индекса ММЛЖ (ИММЛЖ) осуществляли по формуле: ИММЛЖ =ММЛЖ / S, где S – площадь поверхности тела (м)[17]. За нормальные значения ИММЛЖ у обследованных женщин принимали менее 100 г/м2 [18, 19].
Суточное Холтеровское мониторирование ЭКГ проводилось при помощи трехканального регистратора DigiTrak-Plus 3100A фирмы Philips c подключением электродов по методу EASI.
Расшифровка ЭКГ и анализ результатов осуществлялись на ПЭВМ с использованием программы «Holter Scanner 1810 для Windows» компании Zymed Medical Instrumentation. При анализе оценивались: количественные и качественные характеристики эктопических сокращений, наличие эпизодов депрессии (или подъема) сегмента ST, блокад проведения, оценка циркадной динамики ЧСС.
Циркадный индекс рассчитывался по формуле: ЦИ = среднедневная ЧСС/средненочная ЧСС. В норме значения ЦИ не имеют половозрастных различий и находятся в пределах 1,24 – 1,44. Увеличение показателя говорит о повышении чувствительности сердца к симпатическим влияниям. Снижение показателя до уровня 1,23–1,11 свидетельствует о начале развития вегетативной денервации сердца и формировании «ригидного» сердечного ритма[20].
Статистический анализ проводился с использованием программ Statistica 6.0 (Statsoft, США), Biostat. Применялись методы описательной статистики, непараметрические методы. Статистическая значимость показателей была определена как р<0,05. При описании признаков применялись медиана (Me) и межквартильный интервал [25-й и 75-й процентили]. При сравнении двух независимых групп по количественному признаку использовался критерий Манна-Уитни, трех групп и более – критерий Крускала–Уоллиса. Качественные показатели в 2-х несвязанных группах сравнивались в таблице сопряженности 2x2 с помощью теста χ2 с поправкой Yаtеs .
^ Результаты исследования
При УЗ-исследовании экстракраниальных участков брахиоцефальных артерий измерялась толщина КИМ ОСА и диагностировались бляшки в просвете ОСА (Таблица 2). Выявленные различия КИМ ОСА между группами были статистически значимы (Н=14,9, р<0,05). Значения толщины КИМ ОСА в группах пациентов с РА и в контроле представлены на рисунке 1.
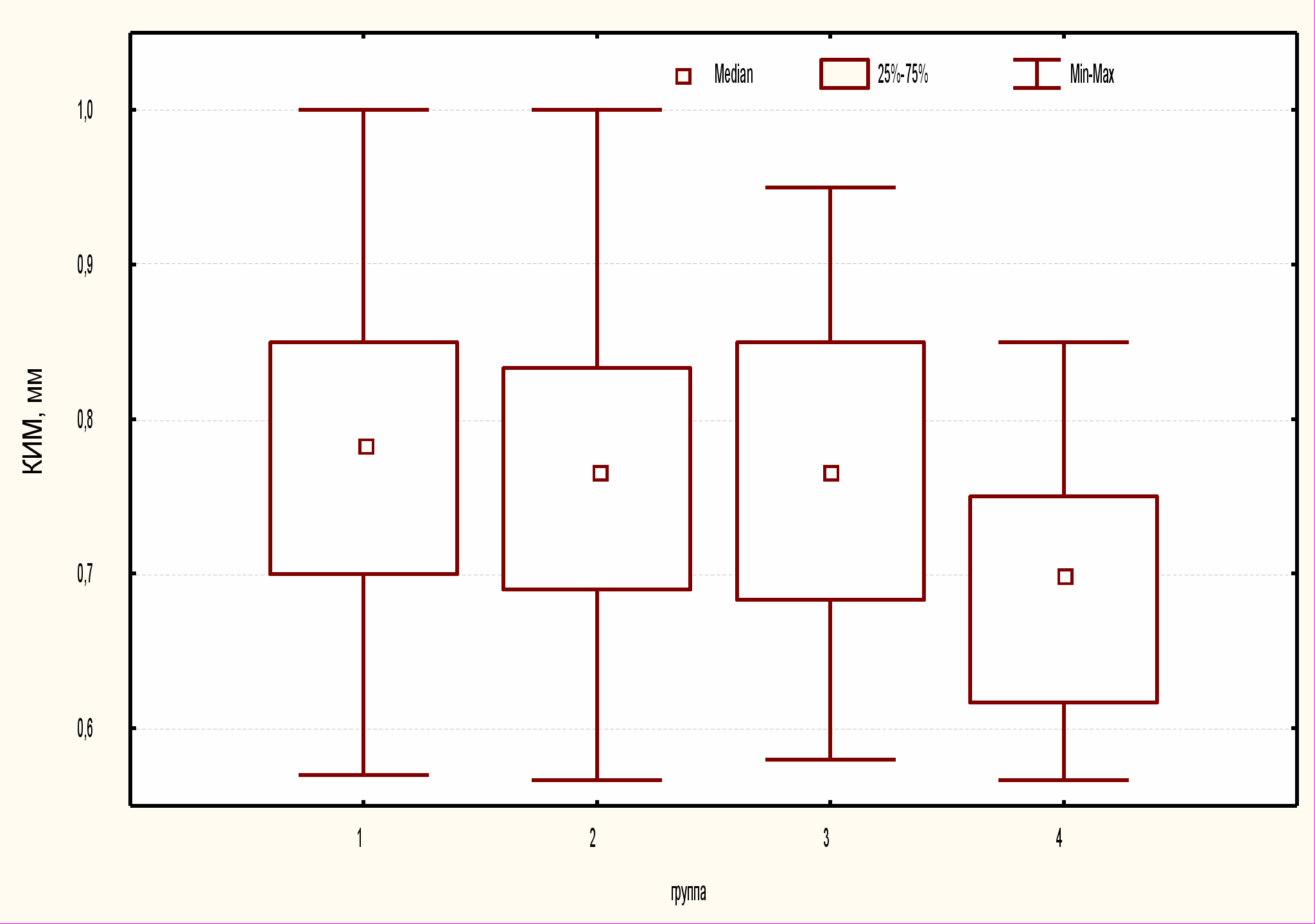
Рисунок 1
Толщина комплекса интима-медиа сонных артерий в обследованных группах
При парном сравнении (критерий Манна – Уитни) все группы пациентов с РА имели статистически значимые различия толщины КИМ с группой контроля (р<0,05), и не отличались между собой. Количество женщин, имеющих утолщенный КИМ, было больше в группах пациенток, страдающих РА, в сравнении с контролем. В группах 1, 2, 3 у большего количества женщин относительно контроля выявлены атеросклеротические бляшки. Однако при статистической обработке данных значимых различий между группами по количеству пациентов с толщиной КИМ более 0,9 мм и количеству пациентов с атеросклеротическими бляшками ОСА выявлено не было.
^ Таблица 2
Данные УЗ-исследования экстракраниальных отделов брахиоцефальных артерий пациенток с РА и контроля
| | Группа пациентов | |||
| 1-ая | 2-ая | 3-яя | 4-ая | |
| Число исследований | 47 | 35 | 26 | 33 |
| КИМ*, мм | 0,78* (0,7-0,85) | 0,77* (0,69-0,83) | 0,77* (0,68-0,85) | 0,70 (0,62-0,75) |
| КИМ более 0,9 мм | 4 (8,51%) | 3 (8,57%) | 3 (11,54%) | 0 |
| Бляшки ОСА | 14 (29,79%) | 13 (37,14%) | 7 (26,92%) | 5 (15,15%) |
* р<0,05 в сравнении с группой контроля
Проведение суточного мониторирования ЭКГ позволило выявить нарушения ритма и проводимости у пациентов с РА и в контрольной группе. Данные представлены в таблице 3.
Суправентрикулярные нарушения ритма чаще выявлялись в группе пациентов с РА, принимающих СС, в сравнении с пациентами с РА, принимающими МТХ, и пациентами, не принимающими БПВП. Желудочковые нарушения чаще отмечены в группах пациентов с РА, принимающих БПВП, в сравнении с пациентами, не принимающими БПВП.
Депрессия сегмента ST чаще отмечалась в группе пациентов с РА, принимающих СС. Однако после статистической обработки (критерий кси квадрат с поправкой Yаtеs) данных результатов значимых различий между группами выявлено не было.
^ Таблица 3
Нарушения ритма и проводимости у пациентов с РА и контрольной группе
| | Группа пациентов | |||
| 1-ая | 2-ая | 3-яя | 4-ая | |
| Число исследований | 36 | 21 | 18 | 10 |
| Суправентрику-лярные нарушения | 3 (8,3%) | 5 (23,8%) | 1 (5,5%) | 1 (10%) |
| Желудочковые нарушения | 5 (13,9%) | 4 (19,0%) | 1 (5,5%) | 0 |
| Синусовая тахикардия | 4 (11,1%) | 4 (19,0%) | 2 (11,1%) | 1 (10%) |
| Блокады | 1 (2,8%) | 0 | 0 | 0 |
| Депрессия ST | 2 (5,56%) | 3 (14,3%) | 1 (5,5%) | 0 |
Для оценки влияния терапии РА на вегетативную регуляцию сердечной деятельности был рассчитан ЦИ. Средние значения ЦИ в группах представлены в таблице 4. В группе пациенток с РА, не принимающих базисной терапии, более половины женщин имели признаки вегетативной денервации и ригидный ритм сердца. При приеме СС, низкий ЦИ был чуть меньше чем у половины пациенток в группе, при приеме МТХ – у трети. Однако при статистической обработке значимых различий по ЦИ между группами выявлено не было.
^ Таблица 4
Нарушения вегетативной регуляции сердечной деятельности в обследованных группах
| | Группа пациентов | |||
| 1-ая | 2-ая | 3-яя | 4-ая | |
| Число исследований | 36 | 21 | 18 | 10 |
| ЦИ, среднее значение | 1,25 (1,19-1,3) | 1,22 (1,19-1,36) | 1,21 (1,16-1,28) | 1,26 (1,24-1,31) |
| ЦИ ниже 1,22 | 12 (33,3%) | 10 (47,6%) | 10 (55,6%) | 2 (20%) |
При ультразвуковом исследовании сердца определялись значения массы миокарда левого желудочка (ММЛЖ) и индекса массы миокарда левого желудочка (ИММЛЖ) в обследованных группах (таб. 5). Из приведенных данных следует, что ММЛЖ и ИММЛЖ несколько выше в группах пациенток, не принимающих терапии и принимающих МТХ, в сравнении с контрольной группой и пациентками с РА, принимающими СС, однако, различия в группах статистически не значимы.
^ Таблица 5
Масса миокарда и индекс массы миокарда левого желудочка в обследованных группах
| | Группа пациентов | |||
| 1-ая | 2-ая | 3-яя | 4-ая | |
| Число исследований | 20 | 17 | 18 | 15 |
| ММЛЖ | 167,0 (153,5-188,0) | 144,0 (128,0-179,0) | 161,0 (146,5-180,5) | 140,0 (121,0-165,0) |
| ИММЛЖ | 91,05 (87,5-105,2) | 81,5 (75,3-100,0) | 92,3 (82,0-96,4) | 81,8 (76,0-98,5) |
| Гипертрофия ЛЖ | 6 (30%) | 4 (23,53%) | 4 (22,22%) | 2 (13,33%) |
Выводы
- Средняя толщина КИМ у пациентов с РА без клинических симптомов атеросклероза и ИБС достоверно выше в сравнении с контролем.
- Толщина КИМ ОСА не зависит от варианта терапии РА.
- Структурные (ММЛЖ и ИММЛЖ) и функциональные (нарушения ритма и проводимости, ЦИ) характеристики сердца в группах пациентов с РА и контроле не различались.
Заключение
У пациенток с РА наибольшее значение для ранней диагностики атеросклероза имеет оценка толщины КИМ ОСА. Изменения сосудистой стенки предшествуют структурным и функциональным изменениям сердца и являются наиболее ранним инструментальным показателем атеросклероза у пациентов с РА, что соответствует литературным данным [8,11]. Однако полученные результаты требуют продолжения поиска ранних маркеров атеросклеротического повреждения сосудов у пациентов, страдающих РА, возможно, наиболее чувствительными окажутся какие-либо из маркеров воспаления, показателей иммунного статуса или цитокинового профиля. Кроме этого, целесообразно проведение дальнейшего изучения значимости длительности заболевания, вида терапии и времени назначения базисной противовоспалительной терапии, дозы используемых базисных препаратов.
Resume
T.D. Tyabut, L.N.Maslinskaja,
Belorussian Medical Academy of Post-graduate Education
^ Preclinical changes cardiovascular system in patients with rheumatoid arthritis
The main reason for decrease of life expectancy in patients with RА has proved to be cardiovascular complications due to earlier development of atherosclerotic vessel damage.
The author informs that the damage rate of vessels in patients with RА differs than in the control and does not depend on therapy RА. Frequency of change of structure and functions hearts in patients with RА did not differ from control group.
^ Key words: rheumatoid arthritis, atherosclerosis, carotid intima-media thickness.
Литература
- Ранний ревматоидный артрит и место лефлуномида в его лечении/ Шостак Н.А.// Ревматол., гастроэнтерол. – 2006. – №7 (102).
- All-cause mortality and vascular events among patients with rheumatoid arthritis, osteoarthritis, or no arthritis in the UK General Practice Research Database/ Watson DJ [et al] // J Rheumatol. – 2003. – №30. – Р.1196-1202.
- Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis/ Solomon DH [et al]// Circulation. – 2003. – №107. – Р.1303-1307.
- Increased unrecognized coronary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study/ Maradit-Kremers H [et al]// Arthritis Rheum. – 2005. – № 52. – Р.402-411.
- Клиническое значение показателей вариабельности сердечного ритма (по данным 5-минутных и 24-часовых записей ЭКГ) у больных ревматоидным артритом/ Аничков Д.А.// Рациональная фармакотерапия в кардиологии. – 2009. – №1. – C. 77-82.
- Долгосрочный прогноз у больных ревматоидным артритом в зависимости от исходной вариабельности сердечного ритма/ Парнес Е.Я. , Красносельский М.Я. // Тер. архив. – 2005. – №9 – С.77.
- Cardiac autonomic profile in rheumatoid arthritis and systemic lupus erythematosus/ M. Aydemir [et al]// Lupus. – 2010. – Vol. 19, No. 3. – Р.255-261.
- Структурно-функциональные особенности миокарда левого желудочка и эндотелиальная дисфункция при ревматоидном артрите в зависимости от наличия артериальной гипертонии / Мясоедова Е.Е., Мясоедова С.Е. // Научно-практическая ревматология. – 2007. – № 3. – С. 15 – 20.
- Atherosclerosis in rheumatoid arthritis. Morphologic evidence obtained by carotid ultrasound/ Park Y–B [et al]// Arthritis Rheum 2002; 46: 1714–1719.
- Association between carotid atherosclerosis and markers of inflammation in rheumatoid arthritis patients and healthy subjects/ Del Rincon I [et al] // Arthritis Rheum. – 2003. – №48. – Р.1833-1840.
- Факторы кардиоваскулярного риска и особенности ремоделирования миокарда левого желудочка у больных ревматоидным артритом / Мясоедова Е.Е., Мясоедова С.Е. // Актуальные проблемы ревматологии: Материалы шестой Северо-Западной научно-практической конференции по ревматологии. – Петрозаводск, 2006. – С. 136-139.
- Ревматоидный артрит, проблемы диагностики и лечения /Сорока Н.Ф. –Минск, 2000. – c.190.
- Carrao, S. Cardiac involvement in rheumatoid arthritis: evidence of silent heart disease /Carrao S. //Eur. Heart J. – 1995. – V. 16. – Р. 253
- Echocardiographic evalution of cardiac structures in patient with rheumatoid arthritis /W. Tlustochowicz et al. //Pol. Arch. Med. Wewn. – 1997. – Vol. 97(4). – P. 352.
- Rodevand, E. Rheumatoid arthritis and heart disease /Rodevand E., Bathen J., Ostensen M.//Tiddsskr. Nor. Laegeforen. – 1999. – N 119. – Р. 223.
- Devereux, R.B. Ehocardiographic determination of left ventricular mass in man: anatomic validation of the method //Devereux R.B., Reichek N. //Circulation. – 1977. – N 55. – Р. 613.
- Эхокардиограмма: анализ и интерпретация /Струтынский А.В. – М.,2001. – 208 с.
- Масса миокарда левого желудочка, его функциональное состояние и диастолическая функция сердца у больных артериальной гипертонией при различных эхокардиографических типах геометрии левого желудочка сердца /Грачев А.В., Аляви А.Л. //Кардиология. – 2000. – № 3. – С. 31
- Структурно-функциональные изменения миокарда у больных гипертонической болезнью /Шляхто Е.В., Конради А.О., Захаров Д.В. //Кардиология. – 1999. – № 2. – С. 49.
- Холтеровское мониторирование: рук. для врачей по использованию метода у детей и лиц молодого возраста / Л.М. Макаров. – М.: Медпрактика, 2000. – 216 с.
