Новые бактериальные патогены в пищевых продуктах: экспериментальное обоснование и разработка системы контроля с применением методов микробиологического и молекулярно-генетического анализа 14. 02. 01 гигиена
| Вид материала | Автореферат |
- Чичило Олег Сергеевич Обоснование лечения пародонтита на фоне артрита с применением, 308.22kb.
- Antonio Valverde Университет Альмерии, Испания содержание метод валидации и процедуры, 785.5kb.
- Экспериментальное обоснование методов подготовки агентов для вытеснения вязкой нефти, 366.85kb.
- Обоснование и разработка эффективных методов лекарственного обеспечения на уровне высокоспециализированной, 3030.03kb.
- Научно-производственное объединение «Химавтоматика» Новый измерительный комплекс для, 111.73kb.
- Введение в курс. Цели и задачи семинара 15-10. 50 Тема №1 «Организация системы внутреннего, 55.66kb.
- Грант нш-197. 2008. 4 Роль организации и экспрессии генетического материала в наследственной, 23.51kb.
- Задач и эффективная их экспансия в новые экономические приложения, 49.14kb.
- Лекция: Этапы проектирования ис с применением uml: Основные типы uml-диаграмм, используемые, 209.83kb.
- Программа предусматривает проведение семинарских занятий, на которых проводится обсуждение, 15.08kb.
5. Разработка методологии внедрения новых диагностических систем и средств измерения в лабораторную практику микробиологического контроля пищевых продуктов.
Анализ современной методологии и новых направлений в изучении ключевых таксономических и патогенетических свойств микроорганизмов послужили основой для разработки комплексных схем выделения и идентификации эмерджентных патогенов, включающих наряду с бактериологическими и иммунологическими тестами методы молекулярно-генетического анализа нового поколения, направленных на повышение эффективности лабораторной диагностики и развитие методической базы микробиологических исследований пищевых продуктов.
Приведенный в работе подробный аналитический обзор существующих методов исследования пищевых патогенов включает не только их детальные характеристики, но и может служить отправной точкой при выборе наиболее эффективных и адекватных схем микробиологического анализа. При этом методы, основанные на новейших достижениях молекулярной биологии, находят все более широкое применение в пищевой микробиологии и при исследованиях разнообразного биологического материала. Эти методы позволяют не только выявить наличие и этиологическую роль возбудителя в возникновении инфекционной патологии, но и расшифровать природу патогенности, которая генетически заложена в исследуемом микроорганизме [Fratamico P.M., Bhunia A.K.,2005, Hill W.E., 1996, Espy M.J.,2006, Mackay I.M., 2004, Huang J. et al., 2009, Liu K. et al., 2009].
Предложенные в рамках данного исследования комплексные схемы и комбинированные методы выявления, идентификации и количественного учета эмерджентных патогенов (Enterobacter sakazakii, Listeria monocytogenes, Salmonella) позволяют создать систему их эффективного мониторинга и контроля продуктов питания на этапах изготовления и хранения, обеспечивают получение более достоверных сведений о циркуляции возбудителей на предприятиях пищевой индустрии и в окружающей среде; позволяют повысить качество лабораторной диагностики.
Данными, полученными при проведении сравнительных испытаний методов ПЦР, ДНК-рРНК гибридизации и иммуномагнитной сепарации для выделения патогенных микроорганизмов родов Salmonella, Listeria, Campylobacter и Escherichia, подтверждена необходимость их обязательной межлабораторной апробации для оценки эффективности и успешной интеграции в традиционные схемы микробиологического анализа.
Между тем молекулярно-генетические методы исследования, для которых характерны технологическая новизна, высокая инвестиционная стоимость и отсутствие официально одобренных регламентов и инструкций, не получили еще широкого распространения в пищевой микробиологии. Это определило необходимость разработки общих критериев стандартизации и гармонизации бактериологических и молекулярно-генетических методов с целью создания единой методологии внедрения современных диагностических систем и средств измерений.
Предлагаемые критерии стандартизации молекулярно-генетических методов должны обеспечивать:
аналитическую и диагностическую точность анализа с минимальным уровнем ложнопозитивных и ложнонегативных результатов;
чувствительность метода – нижний предел определения 1 КОЕ на 25 г продукта;
сходимость и межлабораторную воспроизводимость результатов исследований;
наличие реагентных, внешних и внутренних контролей;
минимальный риск контаминации ампликонами;
возможность быстрой детекции патогена (минимальная или в режиме on-line скорость проведения анализа);
доступность и низкая стоимость стандартизованных непатентованных реагентов и наборов праймеров;
простота выполнения анализа и возможность его автоматизации;
универсальность способов пробоподготовки пищевых продуктов;
возможность определения количественных уровней загрязнения данным патогеном (количественный анализ).
Применение разработанных критериев позволило провести стандартизацию и адаптацию метода идентификации бактерий Salmonella spp., Listeria spp., Listeria monocytogenes, E.coli O157:H7, Campylobacter spp., выделенных из пищевых продуктов, с использованием системы BAX® Q7 на основе полимеразной цепной реакции (ПЦР) в режиме реального времени.
Проведенная сравнительная оценка специфичности, чувствительности и воспроизводимости метода, выполненная путем тестирования 250 проб суспензий, экспериментально контаминированных штаммами листерий, кампилобактеров, сальмонелл и эшерихий, показала его пригодность и перспективность для экспресс-идентификации и подтверждения видовой принадлежности бактерий, выделенных на дифференциально-диагностических средах в виде чистых культур.
Сопоставление ПЦР-анализа на основе BAX® Q7 с культурально-биохимическими методами показало, что применение ПЦР на этапе идентификации позволяет повысить диагностическую достоверность исследования за счет снижения числа ложнопозитивных и ложнонегативных результатов и сократить общую длительность анализа. По результатам проведенной работы разработаны и введены в действие Методические рекомендации № 02.036-08 «Идентификация патогенных бактерий, выделенных при контроле пищевых продуктов, с применением системы BAX® System Q7».
С учетом специфики оснащения отечественных лабораторий проведены подбор и адаптация методов генодиагностики с использованием имеющихся в стране тест-систем и амплификаторов, предназначенных для проведения традиционной ПЦР в сочетании с электрофоретической детекцией результатов.
У
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
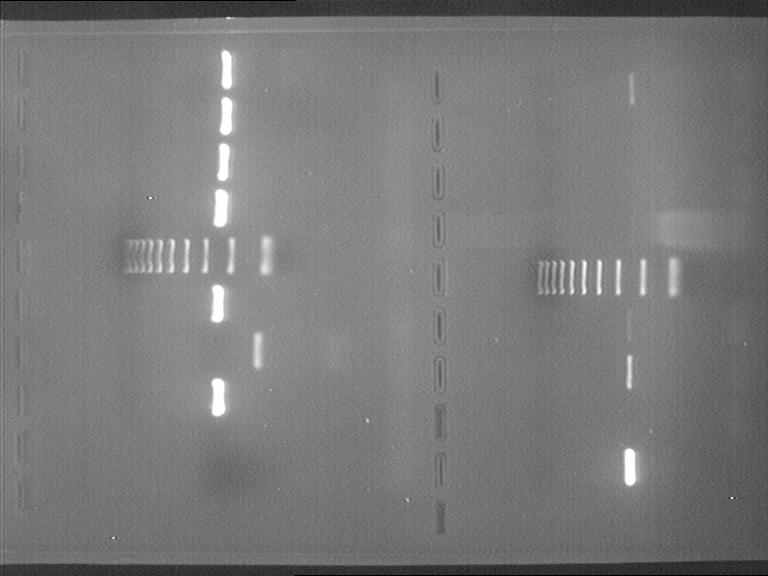
становлено, что использование отечественных тест-наборов для клинической диагностики «АмплиСенс» обеспечивает возможность проведения родовой и видовой идентификации штаммов эмерджентных патогенов, выделенных из пищевых продуктов. При этом специфичность метода идентификации L.monocytogenes составляла 100% (при исследовании в ПЦР 16 штаммов различных видов листерий (рис.13). Высокая специфичность ПЦР- метода и его преимущества выявлены и при анализе проб, содержащих смешанные ассоциации различных видов листерий, идентификация которых затруднена в связи с отсутствием различий культурально-морфологических свойств при росте на дифференциально-диагностических средах.
| 1 | L.m 766 | 11 | L.m 20 |
| 2 | L.m 20 | 12 | L.welshimeri 56 |
| 3 | L.m 53 | 13 | L.welshimeri 47 |
| 4 | L.m 61 | 14 | L.innocua 28 |
| 5 | маркер | 15 | маркер |
| 6 | L.m 63 | 16 | L.innocua 10 |
| 7 | ОК | 17 | L.m 5 |
| 8 | ПК | 18 | ОK выделения |
| 9 | - | 19 | ПК выделения |
| 10 | - | 20 | - |
| L.m. – L. monocytogenes | |||
11
12
13
14
15
16
17
18
19
20
Рис. 13. Оценка видовой специфичности метода ПЦР с электрофоретической детекцией
На основании полученных данных установлена пригодность метода ПЦР c электрофоретической детекцией для подтверждения принадлежности бактерий, выделенных на дифференциально-диагностических средах в виде чистых культур, к группе патогенных бактерий L.monocytogenes. Использование различных моделей амплификаторов отечественного и импортного производства обеспечивает в достаточной степени воспроизводимость и сопоставимость результатов испытаний, проведенных в разных лабораториях, использующих наборы «АмплиСенс L.monocytogenes».
Для осуществления основной задачи микробиологического контроля – выявления возбудителей непосредственно в пищевом продукте проведены подбор, адаптация и стандартизация методов генной диагностики, обеспечивающих с высокой степенью чувствительности экспресс-детекцию патогенных микроорганизмов на заданном уровне нормируемых показателей (1 КОЕ в 25, 50 или 100 г продукта).
На основе обобщения данных по применению ПЦР в отношении наиболее значимых эмерджентных патогенов и экспериментальной апробации ряда молекулярно-генетических методов был подобран для практической реализации вариант ПЦР с гибридизационно-флуоресцентной детекцией в реальном времени на приборе «Rotor-Gene 6000» («Corbett Research», Австралия) с использованием тест-систем «АмплиСенс® - FL» (ФГУН ЦНИИЭ Роспотребнадзора).
Для обеспечения заданных параметров чувствительности и специфичности метода ПЦР с гибридизационно-флуоресцентной детекцией (ПЦР-FRT) проведен подбор оптимальных способов предварительной пробоподготовки и селективного обогащения различных видов пищевых продуктов для детекции в них бактерий рода Salmonella и L.monocytogenes. Предложенные режимы подготовки проб обеспечивают ускорение проведения анализов в 2 – 3 раза за счет сокращения длительности предварительных этапов обогащения исследуемых образцов без снижения уровня чувствительности реакции и открываемости проб.
Апробация метода ПЦР-FRT в реальном времени на модельных образцах экспериментально контаминированных пищевых продуктов позволила определить его основные аналитические характеристики (чувствительность, специфичность, воспроизводимость) в сравнении с традиционными стандартизованными методами бактериологического анализа (табл.15).
Табл. 15
Выявление бактерий рода Salmonella в модельных системах
| Расчетная доза Salmonella spp., клеток в 25 г (см3) | Фактическое содержание Salmonella spp., КОЕ в 25 г (см3) | Результаты обнаружения Salmonella spp. (НВЧ) | |
| Методом ПЦР, клеток в 25 г (см3) | Микробиологическим методом, КОЕ в 25 г (см3) | ||
| Мясо куриное - сырье | |||
| 2,5 х 104 (n=3) | 1,4 х 104 | >1100 | >1100 |
| 2,5 х 103 (n=3) | 1,5 x 103 | 240 | 210 |
| 2,5 х 102 (n=3) | 1,6 x 102 | 21,0 | 24,0 |
| 102 (n=2) | 1,24 x 102 | 21,0 | 21,0 |
| 25 (n=2) | 17,5 | 0,92 | 1,5 |
| 10 (n=3) | 12,4 | 0,92 | 0,92 |
| Контроль (неконтаминированное мясо) | Не обнаружено | Не обнаружено | |
Проведенный сравнительный анализ использованных способов детекции позволил выявить преимущества метода ПЦР-FRT, который обеспечивал возможность обнаружения L.monocytogenes и Salmonella spp. в пороговых дозах, соответствующих требованиям норматива (отсутствие патогена в 25 г продукта).
Полученные данные подтвердили высокую эффективность выбранного формата молекулярно-генетического метода диагностики; использование метода ПЦР с гибридизационно-флуоресцентной детекцией в реальном времени для выявления эмерджентных патогенов позволяет не только повысить эффективность проводимого контроля, но и обеспечивает получение достоверных и сопоставимых результатов при существенном сокращении времени проведения анализа. Применение данного метода при микробиологическом контроле пищевых продуктов позволяет снизить трудоемкость исследований и улучшить качество проводимых анализов.
На основании полученных результатов разработаны и рекомендуются для практического внедрения комбинированные схемы микробиологического анализа пищевых продуктов на наличие патогенных микроорганизмов рода Salmonella и L.monocytogenes с применением ПЦР с гибридизационно - флуоресцентной детекцией в режиме реального времени (рис.14).
Схема анализа пищевых продуктов на наличие патогенных микроорганизмов рода Salmonella и L.monocytogenes
Пищевой продукт


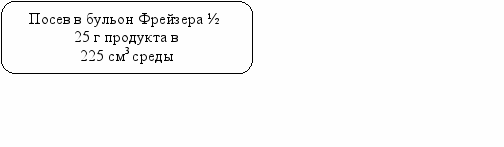

Экстракция проб с наборами «ДНК-В-сорб» или «Рибо-преп»

Рис.14. Ускоренный комбинированный метод обнаружения эмерджентных патогенов Salmonella и L.monocytogenes в пищевых продуктах
Предлагаемые методические схемы могут быть адаптированы и распространены на другие виды эмерджентных возбудителей заболеваний, имеющих близких непатогенных представителей в пределах рода, идентификация которых должна основываться на определении патогенетических признаков.
Внедрение современных гармонизированных и стандартизованных схем анализа бактериальных патогенов ознаменует переход системы микробиологического контроля пищевых продуктов на новый научно-методический уровень. Возможность использования молекулярно-генетических, иммунологических, биохимических и бактериологических методов в едином диагностическом пространстве обеспечит выбор оптимальных решений для изучения эмерджентных пищевых патогенов и повышения эффективности исследований.
ВЫВОДЫ
1. Рассмотрен феномен новых и вновь возникающих заболеваний с пищевым путем передачи («эмерджентных пищевых инфекций»), связанных с появлением новых или эволюционно измененных патогенных микроорганизмов; анализ мирового рейтинга эмерджентных пищевых патогенов позволил выделить среди них в качестве объектов научного исследования наиболее эпидемиологически значимые бактерии: Listeria monocytogenes, Salmonella, энтерогеморрагические E.coli (ЕНЕС), Campylobacter jejuni, Enterobacter sakazakii.
2. Установлено, что общим и ведущим признаком для L.monocytogenes, Campylobacter spp., EHEC, Salmonella spp. является переход их во внешнюю среду, сырье и готовую продукцию вследствие фекальной контаминации с последующим пищевым путем передачи инфекта. Уровень загрязненности сырья молочного и мясного происхождения для отдельных видов патогенов достигает значительных величин (Campylobacter spp. - 100% в мясе кур, Salmonella spp. – до 23% в сырьевых птицепродуктах, L.monocytogenes – до 12% в сыром молоке) и находится в прямой зависимости от санитарно-гигиенических условий получения, хранения и первичной переработки животноводческой продукции.
3. Впервые в РФ при исследовании детских молочных продуктов выделены колиформные микроорганизмы с измененными биологическими свойствами, детальное исследование которых позволило идентифицировать их как малоизученный вид Enterobacter sakazakii; обнаружение среди хорошо изученных популяций семейства Enterobacteriaceae нового вида E. sakazakii свидетельствует о расширении сферы влияния эмерджентных патогенов и усилении роли оппортунистических инфекций.
4. Установлено наличие филогенетических связей между таксономически родственными группами микроорганизмов родов Enterobacter, Pantoea и вновь обнаруженными возбудителями неонатальных инфекций E.sakazakii. Сформулирован новый подход к контролю продуктов для питания детей раннего возраста, включающий подсчет бактерий семейства Enterobacteriaceae и расширенную биохимическую идентификацию всех культурально - морфологических типов изолятов для исключения возможного присутствия E. sakazakii и других новых патогенов кишечной группы.
5. Теоретически обоснована таксономическая принадлежность к роду Cronobacter выделенных штаммов Е.sakazakii и Pantoea spp. Введение новых таксономических единиц расширяет перечень потенциальных патогенов, которые не входят по традиционной классификации в группу колиформных бактерий и не учитываются при оценке безопасности детских инстантных продуктов, что повышает надежность системы контроля на наличие патогенных бактерий семейства Enterobacteriaceae.
6. С учетом значимости одного из наиболее опасных эмерджентных патогенов - L.monocytogenes проведено многоплановое изучение основных закономерностей эпидемиологии, экологии и биологических свойств возбудителя, включая экспериментальное исследование поведения этих микроорганизмов в модельных системах, имитирующих условия производства пищевых продуктов и основные физико-химические параметры технологических процессов. Результаты исследования свойств 125 штаммов листерий, персистирующих в продуктах, сырье и объектах внешней среды, позволили расширить базу данных о функциональных признаках возбудителя для оценки степени микробиологического риска пищевого листериоза.
7. Изучен характер воздействия физико-химических и биологических факторов на жизнедеятельность листерий, показана их высокая устойчивость, вариабельность основных функциональных свойств и механизмов патогенности. Разработана экспериментальная модель совместного культивирования, позволившая доказать способность молочнокислых микроорганизмов проявлять антагонистические свойства в сложном биоценозе не только с листериями, но и с другими эмерджентными патогенами.
8. Впервые в системе санитарно-эпидемиологического нормирования в России обоснован и введен в действие новый гигиенический норматив безопасности: «Listeria monocytogenes в 25 г продукта не допускается». Этот показатель конкретизирован в виде дифференцированных нормативов по основным группам пищевой продукции с учетом специальных требований к продуктам, предназначенным для наиболее уязвимых групп населения по степени риска заболеваемости листериозом.
9. В свете новых данных о появлении среди известных токсических метаболитов «суперантигенов» и других модуляторов системных иммунных реакций выполнена работа по изучению условий накопления в пищевых продуктах бактериальных токсинов; проведен анализ культуральных и биохимических свойств 137 штаммов стафилококков, установлена высокая степень корреляции между способностью S.aureus продуцировать энтеротоксины и наличием ферментов коагулазы, термостабильной ДНКазы и другими факторами патогенности; изучены условия выживания энтеротоксигенных стафилокков при моделировании процессов производства и хранения пищевых продуктов; теоретически и экспериментально обоснован системный подход к исследованию пищевых продуктов на обсемененность S.aureus и наличие стафилококковых энтеротоксинов: система включает разработанный способ экстракции токсинов из различных пищевых продуктов и использование высокоразрешающих методов иммуноферментного анализа.
10. Проведены экспериментальные исследования токсигенных свойств микромицетов – продуцентов малоизученных видов микотоксинов, выявлена способность грибов Penicillium citrinum накапливать микотоксин цитринин в количествах, представляющих опасность для здоровья потребителей, при нарушениях режимов хранения продовольственного зернового сырья.
11. На основе изучения биологии эмерджентных патогенов и системных механизмов регуляции экспрессии генов факторов патогенности этих бактерий разработаны новые методические подходы, позволяющие проводить ускоренную индикацию возбудителей в различных видах пищевых продуктов с использованием высокоспецифичных комбинированных схем бактериологического и молекулярно-генетического анализа путем подбора наиболее информативных биохимических тестов и генотипирования с применением методов ПЦР и ДНК-гибридизации. Для видовой идентификации L.monocytogenes предложен комплексный метод, включающий определение диагностически значимых фенотипических тестов (подвижность, способность к гемолизу, наличие специфичных лецитиназ) в сочетании с ПЦР-анализом участков генома, кодирующих выработку фосфолипаз, факторов инвазии и цитотоксичности. Разработан и впервые в России внедрен метод выявления эмерджентных патогенов Salmonella и L.monocytogenes на основе твердофазного гетерогенного гибридизационного ДНК-РНК анализа с хемилюминесцентным детектированием.
12. Предложены принципиальная схема стандартизации и алгоритм оценки пригодности новых методов на основе комплекса критериев, обеспечивающих успешную адаптацию и интеграцию средств измерений и диагностических тест-наборов в системе микробиологического контроля пищевых продуктов. На основе предложенной методологии проведены стандартизация и адаптация метода идентификации бактерий Salmonella spp., Listeria spp., L.monocytogenes, E.coli O157:H7, Campylobacter spp., выделенных из пищевых продуктов, с использованием ПЦР в режиме реального времени в системе BAX® Q7. Для прямого обнаружения эмерджентных патогенов в пищевых продуктах апробирован и рекомендуется к практическому использованию метод ПЦР в реальном времени с гибридизационно-флуоресцентной детекцией, обеспечивающий с высокой степенью чувствительности выявление этих патогенов на заданном уровне нормируемых показателей.
