Новые бактериальные патогены в пищевых продуктах: экспериментальное обоснование и разработка системы контроля с применением методов микробиологического и молекулярно-генетического анализа 14. 02. 01 гигиена
| Вид материала | Автореферат |
- Чичило Олег Сергеевич Обоснование лечения пародонтита на фоне артрита с применением, 308.22kb.
- Antonio Valverde Университет Альмерии, Испания содержание метод валидации и процедуры, 785.5kb.
- Экспериментальное обоснование методов подготовки агентов для вытеснения вязкой нефти, 366.85kb.
- Обоснование и разработка эффективных методов лекарственного обеспечения на уровне высокоспециализированной, 3030.03kb.
- Научно-производственное объединение «Химавтоматика» Новый измерительный комплекс для, 111.73kb.
- Введение в курс. Цели и задачи семинара 15-10. 50 Тема №1 «Организация системы внутреннего, 55.66kb.
- Грант нш-197. 2008. 4 Роль организации и экспрессии генетического материала в наследственной, 23.51kb.
- Задач и эффективная их экспансия в новые экономические приложения, 49.14kb.
- Лекция: Этапы проектирования ис с применением uml: Основные типы uml-диаграмм, используемые, 209.83kb.
- Программа предусматривает проведение семинарских занятий, на которых проводится обсуждение, 15.08kb.
Применение метода ПЦР для изучения L. monocytogenes. Сравнительное изучение существующих методов детекции эмерджентных пищевых патогенов позволяет выделить в качестве наиболее перспективного направления в генодиагностике L. monocytogenes применение различных форматов постановки полимеразной реакции (ПЦР).
В работе использовали Taq-полимеразу и другие реагенты производства фирмы «Бионем». Праймеры для родовой и видовой идентификации были синтезированы в ГУ НИИЭМ им. Н.Ф. Гамалеи (табл.9). Амплификацию проводили в термоциклере «Терцик». Режимы амплификации:
для пары prs 1- prs 2 – 94С- 2 мин., 5 циклов: 94С – 5c, 42С – 5c, 72С – 5c, затем 25 циклов - 94С – 1c, 42С – 1c, 72С – 1c.
для пары Plc 1- Plc 2 - 94С – 2мин., затем 5 циклов: 94С – 5c, 55С – 5c, 72С – 5c, затем 25 циклов - 94С – 1c, 55С – 1c, 72С – 1c.
для пары Act 1- Act 2 – 94С – 2мин., затем 5 циклов: 94С – 20с., 60С – 20с., 72С – 20с и еще 30 циклов: 94С – 5с, 60С – 5с, 72С – 5с.
Таблица 9
Праймеры для идентификации L.monocytogenes
| Наименование праймера | Нуклеотидный состав праймера |
| Prs 1 | GCATTGCGTGAAGCTGGCGCAAC |
| Prs 2 | CAGAAGCATTTTCATGAAC |
| Plc 1 | AGGGGGCCATTTTGTATAAG |
| Plc 2 | ATCGTTGCTGTTTTGCTCGT |
| Act 3 | CATGCGGTCGACCAGTATTCGGCGGG |
| Act 4 | TCTGTTGGATCCCACTTATACTCCC |
Амплифицированные фрагменты ДНК анализировали гель-электрофорезом в 1% агарозном геле в трис-ацетатном буфере в присутствии 5 мкг/мл бромистого этидия. Результаты учитывали путем окраски и выявления окрашенных ампликонов в УФ-свете (254нм), оценивая молекулярную массу полученных участков ДНК в сравнении со стандартными маркерами (100 bp DNA Ladder).
В качестве объектов исследования были выбраны различные образцы мясных продуктов, полуфабрикатов, мясного сырья, и смывы с технологического оборудования и инвентаря (всего 143 пробы). По результатам первичных посевов было выделено 49 культур, которые по культурально-морфологическим и биохимическим свойствам (типичный рост на Оксфорд или ПАЛКАМ-агаре, подвижность при 220C, наличие каталазы, отсутствие ферментации маннита) были отнесены к роду Listeria. При проведении видовой идентификации выделенных культур рода Listeria 24 штамма соответствовали культуральным и биохимическим характеристикам L.monocytogenes: они ферментировали рамнозу и маннозу, но не сбраживали маннит и ксилозу, и по остальным тестам API Listeria были типичны. Из них только 9 (37,5 %) образовывали четкие зоны -гемолиза. Эти же культуры обладали выраженной лецитиназной активностью на среде с добавлением желточной эмульсии в присутствии активированного угля. Ранее было показано [Ermolaeva S. et al., 2003], что секретируемый листериями продукт, выполняющий функции авторепрессора синтеза лецитиназы, может быть устранен из среды гидрофобным сорбентом, в частности активированным углем. При этом происходит активация генов патогенности и, как следствие, увеличение уровня экспрессии лецитиназы в среду. Использование данного теста позволяет дифференцировать L.monocytogenes от другого вида – L.ivanovii, синтез фосфолипаз которым не зависит от присутствия в среде авторепрессора.
Вышеописанные культуры L. monocytogenes были выделены из смывов с оборудования и инвентаря (конвейеры, пилы, рабочие столы, разделочные ножи, доски) - 8 штаммов и из свинины-сырья - 1 культура. Штаммы листерий, не обладающие гемолитической и лецитиназной активностью, по совокупности признаков были отнесены к виду L.innocua. Кроме того, фенотипическим характеристикам этого вида соответствовали еще 23 культуры, выделенные из фарша, полуфабрикатов, сырья для производства сырокопченых и сыровяленых колбас, смывов, а также из готовых продуктов. Приведенные данные свидетельствуют о том, что наибольшее число выделенных культур листерий – 77.6% относится к виду L. innocua. Три штамма, выделенные из смывов, были идентифицированы как L. welshimeri. Листерии видов L.ivanovii, L.seeligeri, L.grayi обнаружены не были.
Для идентификации многих микроорганизмов, в том числе «пищевых» патогенов, в настоящее время наиболее надежным признается комплексный подход, основан
 ный на комбинировании молекулярно-генетических методов с тестированием наиболее специфичных фенотипических признаков рода, вида или серотипа. В отношении патогенных микроорганизмов, имеющих близких непатогенных представителей в пределах рода, к которым относятся L.monocytogenes, подбор наиболее информативных биохимических тестов и ДНК-зондов для идентификации должен основываться на определении именно патогенетических признаков, а не только метаболических свойств, большинство которых в пределах рода кодируются консервативными участками генома. При оценке фенотипа L.monocytogenes такими признаками являются подвижность, способность к гемолизу, наличие специфичных лецитиназ; при генотипировании – это индикация участков генома, определяющих выработку гемолизинов и фосфолипаз, факторов инвазии и цитотоксичности.
ный на комбинировании молекулярно-генетических методов с тестированием наиболее специфичных фенотипических признаков рода, вида или серотипа. В отношении патогенных микроорганизмов, имеющих близких непатогенных представителей в пределах рода, к которым относятся L.monocytogenes, подбор наиболее информативных биохимических тестов и ДНК-зондов для идентификации должен основываться на определении именно патогенетических признаков, а не только метаболических свойств, большинство которых в пределах рода кодируются консервативными участками генома. При оценке фенотипа L.monocytogenes такими признаками являются подвижность, способность к гемолизу, наличие специфичных лецитиназ; при генотипировании – это индикация участков генома, определяющих выработку гемолизинов и фосфолипаз, факторов инвазии и цитотоксичности. Дальнейшее изучение выделенных культур листерий проводили методом ПЦР с родоспецифическими и видоспецифическими праймерами. Для подтверждения родовой принадлежности использовали праймеры prs1 и prs2, направляющие синтез фрагмента гена, кодирующего консервативный для рода Listeria белок фосфорибозилпирофосфатсинтазу, участвующий в общем метаболизме бактериальной клетки. Подбор видоспецифических праймеров проводили путем выделения фрагментов ДНК, участвующих в кодировании наиболее значимых для L.monocytogenes факторов вирулентности. Для видовой дифференциации использовали две пары праймеров: act3-act4 – амплифицирующих участок гена, ответственного за синтез поверхностного белка АстА, индуцирующего полимеризацию актина и обеспечивающего способность к движению возбудителя в цитоплазме инфицированных клеток; plс1-plс 2, направляющих амплификацию гена PlcA – фосфатидилинозитол специфичной фосфолипазы С.
Результаты ПЦР - анализа культур полностью соответствовали данным микробиологических исследований в части родовой идентификации листерий. Положительные результаты ПЦР с видоспецифическими для L.monocytogenes парами праймеров Аct3 - Аct4 и Рlс1-Рlс2 были получены только у штаммов, обладающих лецитиназной и гемолитической активностью, что безусловно подтверждает диагностическую значимость этих тестов. Из 24 штаммов, первоначально (по данным тестирования с применением «API Listeria») отнесенных к L.monocytogenes, по результатам ПЦР-анализа подтверждена принадлежность к данному виду только 8-ми штаммов. Все они при этом обладали ß - гемолитической и лецитиназной активностью.
Применение комбинированного подхода к идентификации бактeрий рода Listeria на основе использования наиболее информативных фенотипических тестов и ПЦР-анализа с праймерами на участки генов, кодирующих факторы патогенности листерий, позволило сократить в три раза число культур, изначально признанных как L. monocytogenes по комплексу биохимических признаков. Положение о том, что только выявление участков ДНК возбудителя, кодирующих факторы патогенности, является достоверным критерием принадлежности к «эмерджентным» патогенам, было доказано также сопоставлением с другим молекулярно-биологическим методом – ДНК- гибридизации, где целевым являлся ген, кодирующий синтез листериолизина – одного из основных факторов вирулентности L.monocytogenes. Это подтверждается 100% специфичностью метода ДНК-рРНК гибридизации при определении видовой принадлежности L. monocytogenes.
Проведенные сравнительные методические исследования позволили разработать принципиально новый комплексный подход к идентификации бактeрий L. monocytogenes путем комбинирования наиболее информативных фенотипических тестов, характеризующих патогенетические свойства данного возбудителя, и ПЦР-анализа с праймерами на участки генов, направляющих экспрессию этих факторов патогенности (рис.2).

Рис.2. Биохимические и генетические тесты идентификации L. monocytogenes
Предлагаемый комбинированный метод индикации бактeрий L. monocytogenes включает следующие основные этапы:
- подготовка проб пищевых продуктов (измельчение и гомогенизация твердых субстратов в физиологическом растворе, нейтрализация продуктов до рН 7,0-7,5 1N раствором NaOH);
- первичное обогащение – инкубирование в бульоне Фрейзера ½ концентрации в течение 24 часов при температуре 30±1Сº (25 cм3 образца в 225 cм3 среды);
- вторичное обогащение – инкубирование в бульоне Фрейзера в течение 24-48 часов при температуре 36±1Сº (0,1 cм3 образца в 9 cм3 среды), или проведение IMS;
- высев на поверхность селективно-диагностических сред (ПАЛКАМ или Окфорд-агар), инкубирование в течение 24-48ч при 361ºС;
- отбор 5 характерных колоний, пересев их на триптон-соевый агар с дрожжевым экстрактом (TSYEA) и одновременно - на поверхность хромогенных сред (ALOA или Rapid L’mono или лецитин-агар) и кровяного агара; инкубирование в течение 24 ч при 361ºС;
- проведение ПЦР-анализа скультурами листерий, продуцирующими гемолизин и лецитиназу, с праймерами к генам PlcA и ActA.
В лабораториях, оснащенных системой «Люмипроб», возможно проведение экспресс-идентификации выделенных культур методом ДНК-гибридизации с хемилюминесцентной детекцией. Данный анализ может проводиться как в варианте прямого выделения возбудителя из пищевых продуктов, так и в качестве подтверждающего теста при исследовании L. monocytogenes.
Разработанная в результате проведенных исследований схема (рис.3) положена в основу арбитражного экспресс-метода выявления и видовой идентификации L.monocytogenes, который включен в проект Санитарных правил «Порядок учета и расследования пищевых отравлений и вспышек заболеваний с пищевым путем передачи».
Выделение и ускоренная идентификация L.monocytogenes
-
Н авеска продукта 25г
авеска продукта 25г
225 мл среды первичного обогащения
инкубация 24ч
при 30±1Сº
0,1 мл
9мл среды вторичного обогащения
 инкубация 24-48ч
инкубация 24-48чпри 36±1ºС
селективно-диагностическая среда
 инкубация 24-48ч при 361ºС
инкубация 24-48ч при 361ºС 


кровяной агар (-гемолиз) лецитин-агар
инкубация 24-48ч при 361ºС инкубация 24-48ч при 361ºС

Подращивание культуры для ПЦР
 инкубация 12-24ч при 36ºС
инкубация 12-24ч при 36ºСПроведение ПЦР-анализа
с
 праймерами к генам PlcA и ActA
праймерами к генам PlcA и ActAАнализ результатов и выдача ответа
Рис.3. Ускоренная идентификация L.monocytogenes
2.3. Экспериментальное изучение некоторых закономерностей выживания и размножения листерий в модельных системах
Для выявления механизма и условий выживаемости L.monocytogenes, а также с целью разработки предупредительных мер на предприятиях пищевой промышленности особое значение имеет изучение факторов, влияющих на жизнедеятельность листерий, которое может быть выполнено только путем экспериментального моделирования процессов производства и хранения различных видов продуктов.
Влияние тепловой обработки на L.monocytogenes
Многочисленные экспериментальные работы посвящены определению возможности выживания листерий в процессе пастеризации молока, поскольку чувствительность L.monocytogenes к тепловому воздействию трактуется авторами по-разному и порой противоречиво. Имеются сообщения о том, что листерии обладают повышенной устойчивостью к тепловой обработке, выдерживая общепринятые в сыроделии режимы кратковременной пастеризации молока [Карликанова Н.Р. и др., 1999]. Это положение подкрепляется известными данными о выживании L.monocytogenes в качестве факультативно интрацеллюлярного микроорганизма в фагоцитарных клетках, создающих защитную систему от внешних воздействий и тем самым снижающих чувствительность бактерий к тепловому воздействию, то есть высокая термоустойчивость L.monocytogenes объясняется их внутриклеточным паразитированием [Farber J.M., 1989].
Изучение возможности выживания листерий при тепловой обработке молока проводили, используя общепринятые в отечественном сыроделии температурные режимы пастеризации, а именно: 70 -:- 72оС с выдержкой от 20 до 25 с (режим 1); 76оС с выдержкой от 20 до 25 с (режим 2). Эффективность режимов пастеризации в значительной степени определялась исходным уровнем L.monocytogenes в молоке (рис.4). При содержании 103 КОЕ/см3 и менее повышенная температура прогрева – 76оС в течение 20с оказывалась достаточной для подавления бактериальных клеток листерий. При 72оС с той же выдержкой наблюдалась значительная инактивация листерий под влиянием тепловой обработки, однако жизнеспособные клетки в таком молоке все-таки сохранялись в небольшом количестве. При массивном исходном обсеменении молока листериями в количестве 105 и тем более 108 КОЕ/см3 регламентированные в сыроделии режимы пастеризации оказывались недостаточно эффективными, обеспечивая лишь некоторое снижение числа жизнеспособных клеток.
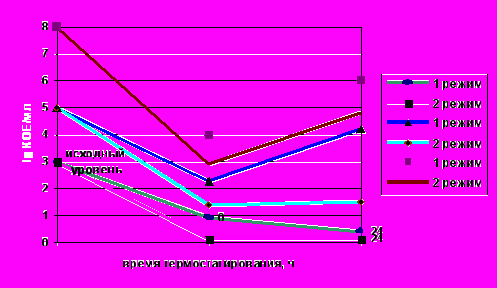
Рис.4. Влияние температурных режимов пастеризации молока на L.monocytogenes.
Более эффективной в этом отношении была двойная тепловая обработка молока, включающая первоначальную термизацию (при 65оС с выдержкой 20 – 25 с) и через 16 – 20 ч - обычную пастеризацию при 72оС в течение 20 с (рис.5). Применение двойной тепловой обработки обеспечивало бактерицидный эффект в отношении листерий даже при массивном обсеменении ими молока в количестве 105 КОЕ/см3. Такая значительная контаминация редко бывает в естественных условиях. Однако при резервировании сырого молока при низких температурах возможно увеличение числа попавших в него листерий до того уровня, который изучали в данном эксперименте. Поэтому применение термизации молока с последующей его пастеризацией создает определенные предпосылки для защиты перерабатываемого сырья от развития в нем L.monocytogenes.
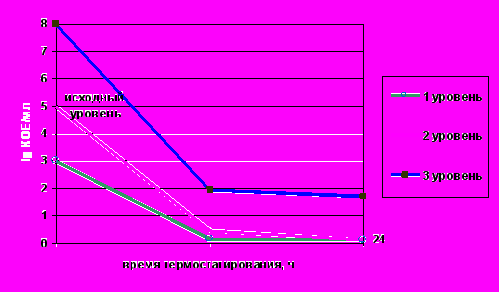
Рис.5. Влияние двойной тепловой обработки молока на L.monocytogenes
Изучение выживаемости L.monocytogenes в молоке при длительном хранении
Изучение условий роста и выживания листерий в процессе длительного хранения молока проводили с использованием двух коллекционных штамма L.monocytogenes, которые выдерживали в течение 4 – 7 мес при температуре 4 - 8оС. Наряду с определением основных культурально-морфологических признаков штаммов через 1, 2, 3 и 6 мес хранения ставили биопробу, заражая белых мышей исследуемым материалом.
Установлено очень длительное (в течение 7 месяцев и более) выживание листерий в молоке, необычное для вегетативных форм микроорганизмов. В то же время на других питательных субстратах выживаемость листерий была самой обычной и не превышала 2 – 3 месяцев.
Патогенность штаммов листерий в процессе хранения в молоке постепенно снижалась и к 6-7 месячному периоду они полностью становились непатогенными. По мере старения культур отмечались изменения их тинкториальных, морфологических и культурально-биохимических признаков: терялись подвижность и восприимчивость к окраске по Граму, при культивировании на МПА появлялись укрупненные, шероховатые R-формы, в микроскопических препаратах наблюдали некоторое увеличение размера клеток, появление цепочек или длинных нитей, а при посевах на кровяной агар – снижение или полную потерю гемолитической активности штаммов в 2 – 3 месячном возрасте. Кроме того, регистрировали некоторые сдвиги в гидролитических свойствах хранившихся культур листерий в части утраты способности ферментировать некоторые виды углеводов (галактозу, рамнозу, сахарозу).
Наблюдаемые изменения характерны для стареющих культур листерий, они являются одним из признаков изменчивости микроорганизмов и должны учитываться при установлении видовой принадлежности штаммов L.monocytogenes, выделяемых при исследованиях сырья и пищевых продуктов длительного хранения.
Чувствительность листерий к неблагоприятным воздействиям среды
Серия экспериментов по изучению воздействия некоторых факторов на рост и жизнеспособность L.monocytogenes включала наряду с тепловой обработкой оценку влияния рН среды, антагонистической активности молочнокислых бактерий или их субстратов и др.
При величине рН 5.2 обезжиренного молока, установленного добавлением молочной кислоты, происходило довольно активное развитие L.monocytogenes (увеличение числа клеток на 1.5 – 2 порядка). Почти при том же значении рН, но в гидролизате казеина с уксусной кислотой наблюдалось значительное подавление роста листерий (в среднем на 2 порядка). Практически полное ингибирование роста культуры L.monocytogenes наблюдалось при внесении ее в инактивированную культуральную среду L. acidophilus при рН 3,9 – 4,0. Это бактерицидное влияние проявлялось особенно наглядно в сравнении с жизнеспособностью листерий в обезжиренном молоке с той же кислотностью, но в присутствии молочной кислоты. Это позволяет предполагать, что наряду с низкой кислотностью в субстрате с L. acidophilus проявлялось бактерицидное действие на листерии антибактериальных веществ, продуцируемых ацидофильной палочкой.
Анализ данных о характере воздействия различных физико-химических и биологических факторов в отношении L.monocytogenes определили необходимость оценить способность листерий выживать в присутствии молочнокислых микроорганизмов, обладающих антагонистическими свойствами с использованием модели совместного культивирования в соевом субстрате, используемом в производстве новых видов ферментированных продуктов. В зараженное листериями молоко вносили заквасочные культуры лактобактерий (L.fermentum и L.rhamnosus) в количестве 104, 106 и 108 КОЕ/см3.
Результаты совместного культивирования листерий и заквасочной микрофлоры при параметрах, имитирующих нарушения технологического процесса ферментации соевого молока, показаны на рис.6. Заражение соевого молока бактериями L.monocytogenes в количестве 100 и 10 КОЕ/см3 не приводило к ингибированию возбудителя даже при высоких уровнях содержания заквасочной микрофлоры. При меньшей расчетной дозе листерий 1 КОЕ/см3 обнаружить L.monocytogenes удавалось в 66 % проб после 6 и 24 часов термостатирования. Во всех исследованных вариантах опыта снижение концентрации молочнокислых микроорганизмов и, соответственно, замедление процесса ферментации обеспечивали более благоприятные условия для выживания и накопления возбудителя.
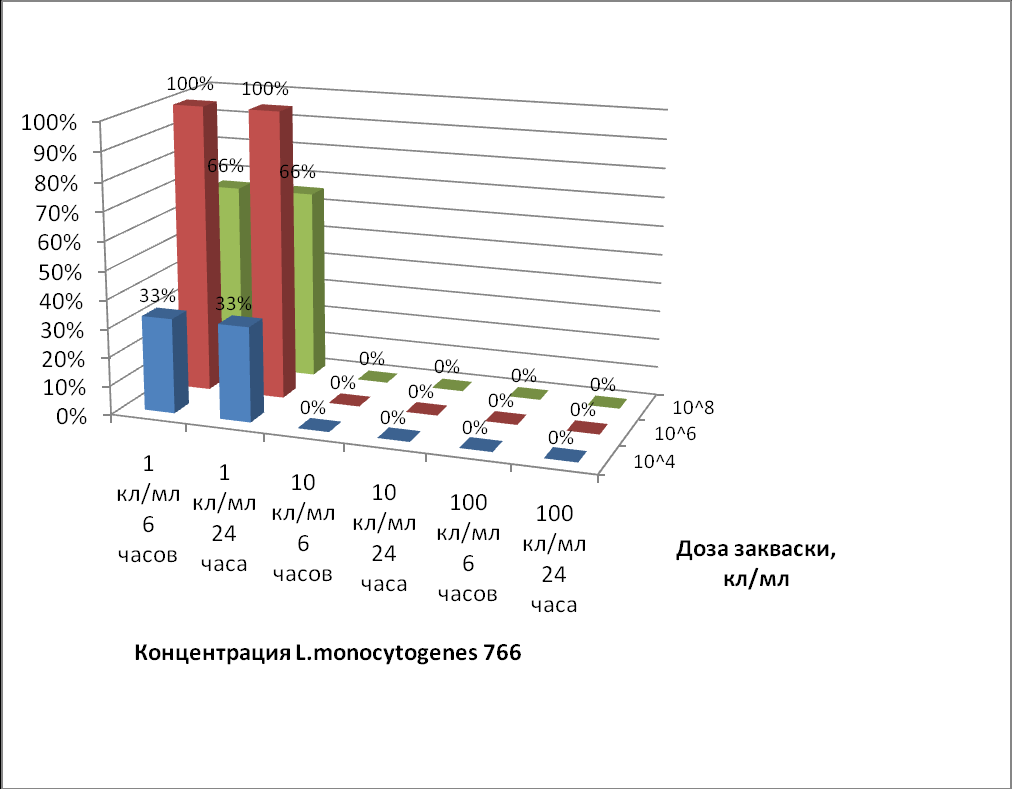
Рис. 6. Ингибирование роста листерий заквасочной микрофлорой
Используя модель «ассоциативного роста», проведено сравнительное изучение особенностей размножения не только листерий, но и других видов эмерджентных патогенов, в частности энтерогеморрагических E.coli (штамм № 1330, серотипа О157:Н7).
При экспериментальной контаминации сырья энтеротоксигенным штаммом E.coli cеротипа О157:Н7 в дозе 100 КОЕ/см3 ингибирования роста возбудителя не удавалось достигнуть как при низких, так и при высоких уровнях заквасочной микрофлоры (рис.7). При малых дозах заражения – 1 - 10 КОЕ/см3 степень выживания E.coli зависела от концентрации молочнокислых микроорганизмов в среде и активности процесса кислотообразования. Рост E. coli после 6 ч ферментации отсутствовал в 52% проб, а к концу наблюдения (24 ч) ингибировался только в тех вариантах, содержание молочнокислых микроорганизмов в которых составляло не менее 108 КОЕ/см3.
Таким образом установлено, что в процессе ферментации при заданных параметрах сквашивания и высоких уровнях заквасочной микрофлоры отмирание L.monocytogenes и E.coli О157:Н7 идет интенсивнее, чем при снижении активности заквасок, что может быть обусловлено как антагонистическими свойствами штаммов закваски в отношении патогенов, так и быстрым повышением уровня кислотности среды модельного продукта.
В целом полученные данные подтверждают предположение о высокой устойчивости эмерджентных патогенов с генетически закрепленными факторами вирулентности к воздействию внешней среды и о их способности выживать в среде с наличием технологической заквасочной микрофлоры, что указывает на необходимость более жесткого микробиологического контроля ферментированных продуктов.

Рис.7. Ингибирование роста E.coli 1330 заквасочной микрофлорой
По оси ординат - % проб, в которых после 6 или 24 ч ферментации не обнаружены L. monocytogenes и E.coli.
