Исследование гидрометаллургических процессов в многокомпонентных системах производства вторичных цветных металлов
| Вид материала | Исследование |
| Во второй главе В третьей главе Четвертая глава |
- Гост 1639-78: лом и отходы цветных металлов и сплавов общие технические условия, 1661.44kb.
- Разработка экологически чистых технологий комплексного извлечения благородных и цветных, 759.54kb.
- «производство отливок из сплавов цветных металлов», 38.25kb.
- Московский Государственный Институт Стали и Сплавов (Технологический Университет) Кафедра, 461.38kb.
- Темы рефератов по дисциплине «Материаловедение», 19.05kb.
- Исследование переходных процессов в замкнутых нелинейных системах управления 111, 347.96kb.
- Правительства Российской Федерации от 23 июля 2002 г. # 552 "Об утверждении Положения, 136.41kb.
- Извлечение цветных и редких металлов из отходов металлургического производства и нетрадиционных, 531.33kb.
- Гост 1639-93 Лом и отходы цветных металл. Общие технические условия, 1007.65kb.
- А. Б. Коростелев, А. В. Тарасов, Парецкий, 208.73kb.
В первой главе проведен анализ диаграмм состояния металлических систем, характерных для вторичных медных сплавов. Структуру вторичных сплавов изучали путем микрофотосъемки на металлографическом микроскопе с видеоокуляром HB Lab. Файлы фотоснимков обрабатывали на персональном компьютере с помощью эксклюзивной программы обработки изображений. Доказано образование промежуточных соединений, в том числе с узкими областями гомогенности.
Медные сплавы, полученные при остывании расплава, имеют зернистую структуру, состоят из беспорядочно ориентированных мелких кристаллитов размером от 10-7 до 10-3 м. Кристаллическая структура отдельных зерен, в свою очередь, не идеальна, имеет различного рода дефекты: вакансии в узлах, атомы или ионы в междоузлиях, дислокации, сдвиги и искривления решетки. Состояние поверхности усложняется наличием микротрещин.
Особенностью системы Cu-Sn-Zn является образование непрерывных рядов твердых растворов между фазами (Cu5Sn) и (CuZn) из двойных систем Cu-Sn и Cu-Zn. В системах Cu-Sn-Zn, богатых медью, в твердом растворе может находиться до 12% Sn и до 35% Zn. Повышение содержания цинка уменьшает температурный интервал кристаллизации и склонность бронзы к обратной ликвации. Даже при незначительных (0,5%) содержаниях олова среди кристаллов -твердого раствора появляются включения новой -фазы и интерметаллида, отвечающего примерному составу Cu4Sn. В сплавах Cu-Zn + фазы олово растворяется до 0,7%, при повышении его содержания начинается выделение -фазы по границам зерен.
При ионизации такого сплава в растворах, содержащих сульфат-ионы, следует ожидать пассивации свинцовых микроучастков с их постепенным выкрашиванием. При высоком содержании свинца в сплаве возможно образование поверхностно сульфатизированных металлических частиц. В сплавах медь-олово наряду с богатым по олову -твердым раствором, имеющим дендритное строение наблюдали эвтектоид . Поведение этого сплава при химическом и анодном растворении будет обусловливаться как условиями выщелачивания и электролиза, так и его фазовым составом и кристаллической структурой.
Наложение анодного потенциала вызывает перераспределение плотности тока между микроучастками, представляющими различные фазы сплава. Вызванные этим различия скорости растворения вызывают образование микронеровностей, высота которых зависит не только от размера зерен и макросостояния поверхности, но и от величины анодного потенциала и состава электролита.
Спрогнозирована взаимосвязь между химическими потенциалами компонентов и различных фаз в сплаве и соответствующими электродными потенциалами как для гомогенных, так и для гетерогенных металлических систем на медной основе.
Во второй главе рассмотрены теоретические основы химического растворения сплавов в сернокислых средах, особенности кинетики процессов (использован метод вращающегося диска), протекающих с образованием шламовых пленок. Образующиеся на поверхности сплава сплошные пленки продуктов коррозии не прекращают взаимодействия его с окислителем из-за возможности ионизации металлов и кислорода в пленке и перемещения ионов и электронов в кристаллической решетке продукта химического взаимодействия.
Продукты окисления медных сплавов (оксидные и солевые пленки) в большинстве случаев имеют ионную структуру, но обладают различными типами проводимости: ионной, электронной (Fe3O4, PbO2) и смешанной катионно-электронной (ZnO, Cu2O, NiO, FeO). Движение ионов и электронов в пленках продуктов окисления также определяется наличием разупорядоченности решетки и осуществляется по ее дефектам.
Определены несколько критериев для установления механизма исследуемых процессов, определяемых химической реакцией или массопередачей, включая внешние и внутренние диффузионные ограничения. Скорость и степень выщелачивания металлов из гомогенных сплавов отвечает химическим взаимодействиям атомов в кристаллической решетке сплава, в то время как из гетерогенных сплавов оно определяется гальваническими взаимодействиями. Разница в значениях электродных потенциалов использована для оценки селективности выщелачивания.
Особое внимание уделено составу и свойствам пленок, образующихся на поверхности растворяемых образцов. Изучали влияние начальной концентрации серной кислоты (0,025–0,2 М), температуры (290-350 К) и скорости перемешивания на селективность растворения компонентов сплавов и состав шламовых пленок.
Скорость растворения компонентов сплава пропорционально возрастает с увеличением интенсивности гидродинамического режима (остается постоянной при величинах Re>104). При начальных концентрациях серной кислоты свыше 0,2 М скорость процесса практически не изменяется. Значение экспериментальной энергии активации в интервале исследованных температур составляет 15–31 кДж/моль.
При растворении сплавов на поверхности образцов наблюдали пленки, толщина которых составляла до 10 мкм. Полуколичественный рентгенофазовый анализ показал, что при растворении сплава Cu-Sn шламовая пленка представлена гидратированными оксидами олова и меди, а также их основными сульфатами (%: 18-24 Cu, 40-65 Sn). В слабокислых растворах содержание олова (SnO2) в шламе максимальное. Пленки на медно-никелевом сплаве состояли из оксида никеля, элементной меди и ее основного сульфата (%: 60-85 Cu, 20-25 Ni). В шламах, образовавшихся на тройном сплаве, обнаружены оксид (PbO2) и сульфат свинца, оксид меди и элементная медь (%: 43-55 Cu, 12-18 Pb).
Кинетические зависимости в координатах «количество растворенного металла – продолжительность» в первые 60 мин описывались прямыми линиями, что указывало на постоянство скорости процесса, однако в дальнейшем скорость процесса несколько возрастала, что объясняется положительным влиянием накапливающихся в растворе ионов меди (II), которые играют роль дополнительного окислителя в процессе растворения сплава.
Компоненты медно-цинковых и медно-оловянных сплавов растворяются с неодинаковой скоростью, особенно при повышенных температурах. Учитывая практически однофазную природу сплавов и химический и фазовый состав образующихся пленок можно предположить развитие побочных процессов, в частности взаимодействие накапливающихся ионов меди (II) с исходным сплавом. Расчетная величина Еа при растворении цинка и олова из исследованных образцов практически одинакова - около 27 кДж/моль. На поверхности этих образцов обнаружена металлическая медь, что указывает на цементационный характер процесса. Скорости растворения при 350 К составляют
(3,2–4,8)10-8 г-ион/(см2с).
Для сплавов Cu-Zn, содержащих свинец, скорость процесса возрастает до (4,4–8,0)10-8 г-ион/(см2с), а значения Еа оказываются несколько меньшими: (до 17 кДж/моль). На поверхности образцов наблюдали, наряду с участками металлической меди, пленки сульфата свинца.
Зависимости скорости растворения компонентов бинарных сплавов от температуры и скорости вращения диска характерны для протекания процесса в диффузионной области. Определяющим актом является диффузия кислорода (окислителя) через пленку нерастворимых продуктов реакции в реакционную зону. Внутридиффузионный механизм растворения сплавов объясняет и несколько завышенные значения экспериментальной энергии активации. Дефицит кислорода становится особенно заметным при повышенных температурах; в этих условиях возрастает роль окислительной способности ионов меди, накапливающихся в процессе растворения медьсодержащего сплава.
Растворимые компоненты сплава переходят в раствор в соотношении, соответствующем составу исходного сплава, наблюдаемое предпочтительное растворение компонентов сплавов обусловлено развитием сопряженных процессов:
- накопления на поверхности образца труднорастворимого компонента сплава в форме гидратированных оксидов или основных сульфатов: SnO, SnO2, Sn(OH)2SO4 и др.;
- осаждения меди из раствора вследствие развития процесса цементации и одновременный переход в раствор электроотрицательного компонента сплава (цинка, олова и пр.);
- сорбции ионов меди гидратированными оксидами (например, SnO2H2O), содержащимися в малорастворимых продуктах электрохимических реакций;
- восстановления ионов Cu(II) до Cu(I), накопление и гидролиз последних при повышенных температурах с образованием оксида меди (I) – продукта, обнаруженного в пленках.
Присутствие в медном сплаве электроотрицательного компонента приводит к «разблагораживанию» потенциала сплава и, как следствие, к ускорению его растворения, однако образующиеся нерастворимые пленки (для медно-свинцовых, медно-оловянных сплавов) снижают скорость процесса.
В табл. 1 приведены расчетные значения критерия Пиллинга-Бедвордса для ряда труднорастворимых химических соединений, существование которых в шламовых пленках доказано результатами рентгенофазового анализа. Очевидно, что все соединения формируют сплошные пленки, способные создавать диффузионные затруднения при растворении сложных сплавов.
Таблица 1 - Значения критерия Пиллинга-Бедвордса для некоторых соединений,
существующих в шламовых пленках
| PbO | PbO2 | PbSO4 | Pb(OH)2 | SnO2 | Sn(OH)SO4 | NiO |
| 1,282 | 1,352 | 2,614 | 1,715 | 1,347 | 3,417 | 1,685 |
Проведенные исследования позволяют сформулировать следующие особенности растворения бинарных сплавов на медной основе:
- внутридиффузионная область развития процесса, в которой лимитирующей стадией является транспорт кислорода, осложненный образующимися пленками, содержащими соединения нерастворимого компонента сплава;
- более высокая скорость растворения меди из сплава, чем скорость растворения чистого металла; однако в связи с образованием нерастворимых продуктов, замедляющих скорость процесса, существуют предельные содержания второго компонента;
- с повышением температуры стационарные потенциалы сплавов становятся более электроотрицательными, возрастает роль цементационного растворения сплавов, что способствует увеличению скорости процесса.
В третьей главе при рассмотрении теоретических основ электрохимического растворения многокомпонентных медных сплавов определены взаимосвязи между различными стадиями процесса с учетом адсорбционных, химических и электрохимических явлений, что позволяет наметить реальные пути оптимизации электрохимической переработки вторичного медного сырья.
С помощью диаграмм равновесия (Е-рН) проведен термодинамический анализ системы Сu-Ме-Н2О (Ме – Zn, Sn, Pb), касающийся стабильности соединений меди и процессов, протекающих при электролизе. Установлено существование в растворе электролита ряда частиц различной степени гидратированности в зависимости от концентрации и температуры, находящихся между собой в ступенчатом равновесии. Это свободные ионы, которые гидратированы предельно (ближняя и дальняя гидратация), ионные пары, разделенные гидратной оболочкой одного или обоих противоионов в различной степени гидратированности, контактные ионные пары и их ассоциаты, представляющие элементы ячейки соответствующей твердой фазы, выделяющейся при насыщении раствора в приэлектродной зоне.
В процессе ионизации сплава Cu-Zn происходит начальное селективное растворение цинка. Образуется неравновесный, обогащенный медью слой, представляющий собой диффузионную зону с высоким градиентом концентраций, который определяет электрохимические свойства растворяющегося анода.
С увеличением доли электроотрицательного компонента до определенного предела склонность гомогенного сплава к селективному растворению изменяется незначительно, после чего следует ее быстрое возрастание. При этом обычно совершается переход от одного механизма растворения к другому. Так, в пределах -фазы для системы Cu-Zn можно наблюдать равномерный характер анодного растворения, тогда как более богатая цинком фаза может показывать склонность к селективной ионизации цинка. Такие процессы обычно сопровождаются фазовыми превращениями в поверхностном слое твердого тела, ведущими к образованию на электроде новых фаз, по кристаллической структуре и составу отличных от исходной.
Анодное растворение сплавов осложняется образованием нерастворимых пленок оксидов, гидроксидов, солей, которые тормозят процесс, причем механизм их образования и фазовый состав существенно отличается от шламовых фаз, полученных при химическом растворении. На анодный процесс накладывается влияние попутного процесса цементации с образованием на поверхности анода порошкообразного осадка. Вероятность образования на поверхности анода оксидов увеличивается с ростом плотности тока и является следствием протекания химических реакций и диффузионных ограничений. Несмотря на то, что образующиеся пленки в большинстве случаев обладают электронной проводимостью, их появление приводит к блокированию поверхности и затруднению ионизации.
Для протекания процесса в кинетической области использованный нами температурно-кинетический метод, комбинированный с методом вращающегося дискового электрода, позволил получить зависимость энергии активации электродной реакции (Еэф) от поляризации () и зависимость скорости процесса от гидродинамических условий.
Исследования показали, что во всех случаях анодного растворения сплавов в диапазоне анодных потенциалов (и соответствующих им поляризаций), где имеет место четко выраженная зависимость Еэф от (малые поляризации), скорость анодного растворения не зависит от скорости вращения дискового электрода; при больших поляризациях в области активного растворения, в пассивной и транспассивной областях эта зависимость (при ламинарном движении жидкости) сохраняется.
Предложенный подход объясняет процессы псевдоселективного растворения и растворения с фазовым превращением с единых кинетических позиций. Он позволяет определить условия протекания селективного растворения по тому и другому пути, а также установить основные параметры вероятности образования собственной фазы электрохимически положительного компонента - меди. Одновременно представляется возможным достаточно четко разграничить их термодинамические и кинетические предпосылки, имеющие прямое отношение к прогнозированию склонности сплавов к этим видам растворения.
Формирующийся в процессе электролиза медных сплавов шлам представляет собой полидисперсные частицы различной конфигурации, величины (30-50 мкм) и химического состава, содержащие в себе нерастворимые соединения, образовавшиеся в результате химических и электрохимических процессов на аноде и в объеме электролита.
Опытные данные показывают, что ионы примесей, переходящие в раствор с анодов, разряжаются на катоде не в соответствии с их электрохимическими потенциалами. Вследствие низкой концентрации все примеси разряжаются на предельном токе, процесс лимитируется доставкой ионов к электродной поверхности, т.е. количество примесей в катодном металле в первом приближении пропорционально их концентрации в растворе и обратно пропорционально плотности тока. Избыток сульфатов никеля, железа и цинка в электролите, участвующих в переносе тока, создает неблагоприятные условия для разряда ионов меди, снижая ее концентрацию в прикатодном пространстве.
Четвертая глава посвящена теоретическим основам выделения металлов и очистки растворов.
При осаждении примесей из цинковых растворов гидролитическим методом нейтрализацию проводят обычно оксидом цинка или промпродуктами, его содержащими. Поэтому вопрос о кинетических закономерностях растворения ZnO в кислых средах сложного солевого состава представляет не только технологический, но и теоретический интерес.
В результате многочисленных исследований кинетики растворения ZnO в кислой среде установлено, что механизм процесса зависит от величины pH, природы кислоты и состояния поверхности оксида цинка. Согласно данным И.А.Каковского и Б.Д.Халезова растворение ZnO протекает во внешнедиффузионной области; если [H2SO4]<30 г/дм3, то скорость процесса лимитируется диффузией кислоты к поверхности твердой фазы; при [H2SO4]=30-200 г/дм3 лимитирующей стадией является диффузия продуктов реакции.
Механизм процесса представляется нам следующим: на контакте ZnO/H2SO4 послойно образуются твердые продукты (Zn(OH)2, ZnSO43Zn(OH)2) из-за понижения кислотности в приграничном слое; растворение этих фаз лимитируется внешней диффузией из-за высоких скоростей расхода кислоты на химическое взаимодействие. В области низкой кислотности (рН>2-3) роль внутренней диффузии через слой твердых продуктов становится решающей.
Зависимость скорости растворения подчиняется закономерностям диффузионной кинетики (v=f(n1/2)) как в области разбавленных (0,05 моль/дм3), так и концентрированных (до 2 моль/дм3) растворов серной кислоты. Однако зависимость скорости растворения от концентрации серной кислоты необычна: в разбавленных растворах (менее 0,3 моль/дм3) она прямо пропорциональна концентрации, в области концентраций 0,3-2,0 моль/дм3 скорость от концентрации практически не зависит, а при дальнейшем повышении резко снижается.
При невысокой начальной кислотности (0,05 М H2SO4) характер влияния температуры на скорость реакции оценивается экспериментальной величиной Еа=12,5 кДж/моль, что косвенно указывает на протекание процесса в диффузионной области. При большой начальной кислотности (1М H2SO4)
Еа=32,2 кДж/моль, что для диффузионных процессов представляется достаточно высоким значением. Кроме значительного различия коэффициентов диффузии, причиной аномалии служит различие влияния характера влияния концентрации серной кислоты и сульфата цинка и температуры на изменение величин коэффициентов диффузии.
Методом вращающегося диска изучена кинетика растворения в H2SO4 поликристаллического ZnO. Показано, что по мере увеличения кислотности контроль скорости реакции меняется от диффузионного через смешанный к кинетическому. При 510-4 M H2SO4 скорость растворения определяется диффузией протонов (H3O+). При 0,01-0,1 M H2SO4 для ZnO контроль также остается диффузионным. При концентрации H2SO4>0,1 M и невысоких температурах реакция идет в кинетической области и ее порядок относительно концентрации протонов близок к 0,1. Линейная зависимость соблюдается и при более высоких концентрациях серной кислоты, т.е. процесс протекает в диффузионном режиме. Для слабокислого раствора (5 г/дм3) это дополнительно подтверждается совпадением экспериментально найденной величины константы скорости реакции с вычисленной теоретически.
Поскольку в отработанных электролитах переработки вторичных медных сплавов содержатся ионы Fe(II), гидролитическое осаждение которых возможно лишь вместе с ионами цинка, необходимо полное окисление железа до Fe(III). Окисление в системе «Fe-Zn-SO42--H2O» термодинамически характеризуется диаграммами Eh-pH.
Расчетная константа равновесия реакции осаждения ионов Fe(III) оксидом цинка - величина порядка 1027, т.е. железо должно осаждаться количественно. Однако процесс очистки цинковых растворов значительно затруднен, поскольку часть железа находится в двухвалентной форме или в виде сложных ионов (Fe(OH)2+, FeOH2+, FeSO4+ и др.); значительны также кинетические осложнения, особенно при низких концентрациях железа в растворе, когда резкое снижение скорости препятствует достижению равновесия.
При окислении кислородом скорость процесса увеличивается с повышением концентрации железа (первый порядок) и кислорода (первый порядок по содержанию в газовой фазе). Понижение начального рН резко замедляет процесс; наличие в растворе Cu2+ каталитически его ускоряет (порядок по Cu2+ около 0,5). Формальная кинетика описывается уравнением:
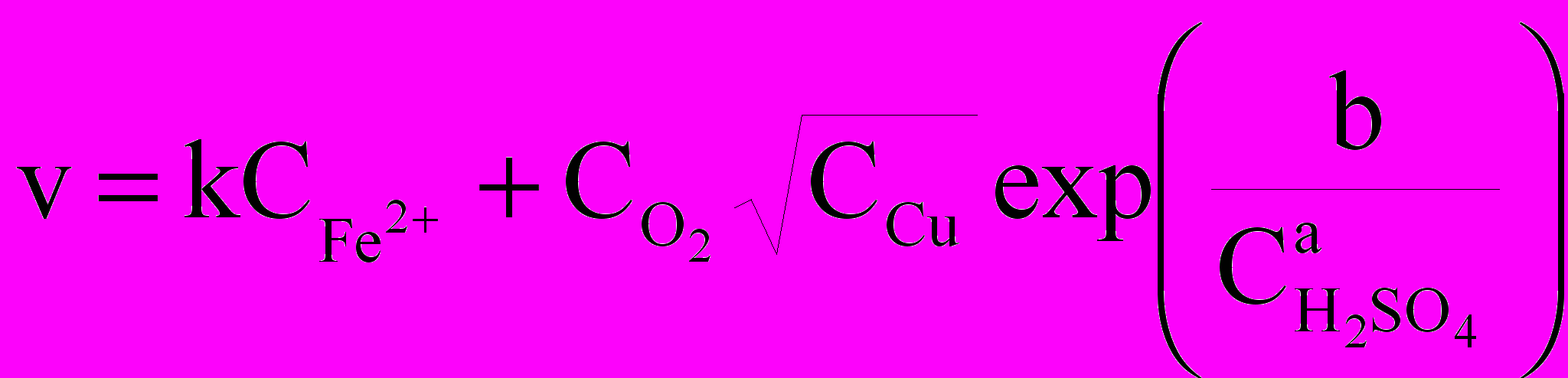 . (1)
. (1)Константа скорости растет при нагреве раствора в области низких температур и снижается в области высоких из-за уменьшения растворимости кислорода. Последняя обратно пропорциональна концентрации сульфата цинка.
Кинетическое уравнение процесса:
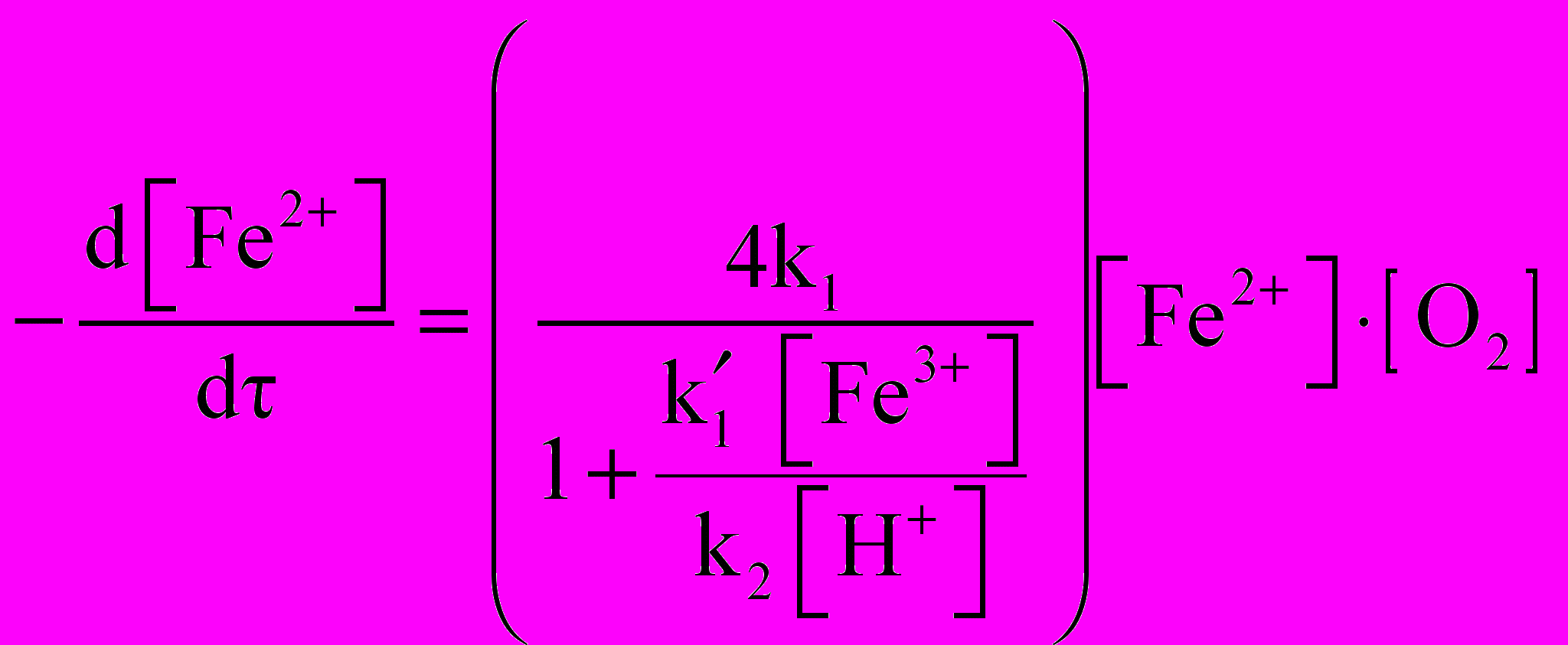 , (2)
, (2)где ki - константы равновесия соответствующих стадий, [O2] - концентрация кислорода в условиях насыщения им жидкой фазы.
Кинетика процесса гидролитического осаждения Fe(III) из сульфатных цинковых растворов до настоящего времени не получила удовлетворительного описания в аналитической форме из-за его сложности и многостадийности. При изменении внешних факторов происходит смена лимитирующей стадии.
По нашему мнению, данные о фазах, осаждаемых из растворов системы Fе2О3–SO4–Н2О, нельзя априори переносить на цинковые растворы. Указания на образование основных сульфатов и гидроксида железа при в гидрометаллургии цинка неоднозначны, так как образуется ряд соединений. Синтезированы почти все известные твёрдые продукты гидролиза Fе2(SO4)3 и методами ИК-спектроскопии и термического анализа подтверждена их индивидуальность, но лишь немногие из них образуются при осаждении Fe(III) из сульфатных растворов с нейтрализацией оксидом цинка: ярозит (R,Н3О)Fе3(ОН)6(SO4)2, аморфный основной сульфат 2Fe2O3-SO4-xH2O, как первичные продукты осаждения, и гетит FeOOH, как вторичный продукт.
Теоретические расчеты только качественно раскрывают характер влияния различных факторов на состав и фазовое состояние гидролитических осадков железа, на скорость гидролитического осаждения Fe(III) из сульфатных цинковых растворов, что необходимо как предварительная информация для построения математической модели и поиска оптимальных условий процесса.
Осаждение трехвалентного железа из растворов, содержащих другие катионы, в том числе тяжелых металлов приводит к образованию сложных, менее растворимых, чем основные соли железа, соединений, в которых часть ионов гидроксония изоморфно замещена этими катионами. Соосаждение примесей различных металлов с оксигидратом железа отвечает ряду Cu(II)>Zn(II)>Ni(II), что соответствует значениям pH начала осаждения оксигидратов данных металлов.
При очистке сульфатных цинковых растворов от электроположительных примесей большое значение приобретают методы контактного вытеснения. При кажущейся простоте процессы цементации являются чрезвычайно сложными, в связи с чем до настоящего времени в литературе нет их адекватного научного описания. Опубликованные кинетические модели являются однофакторными и позволяют описывать реальные многомерные процессы цементации лишь приблизительно.
Обобщение экспериментальных данных, например, по цементации меди цинком показывает, что зависимость интенсивности процесса от рН является параболической. Снижение скорости цементации при рН<4 связано с усилением выделения водорода в результате взаимодействия цинка с кислотой и блокированием части катодных участков цементационных элементов пузырьками водорода. При рН>4 начинает сказываться тормозящее влияние гидратных пленок на поверхности цинка.
Наименее изученным является вопрос о взаимном влиянии примесей на степень осаждения каждой из них и образовании при цементации интерметаллических соединений, имеющих большую коррозионную стойкость, чем индивидуальные компоненты и большее перенапряжение выделения водорода.
Скорость цементации прямо пропорциональна количеству образующихся контактных гальванопар и величине тока цементации. Контактное осаждение металлов, протекающее на гетерогенной поверхности, во многом аналогично электрокристаллизации. Увеличение тока цементации гальванопары Zn-Cu с ростом концентрации сульфата меди обусловлено как повышением скорости катодного процесса вследствие уменьшения концентрационной поляризации, так и увеличением скорости анодного растворения цементатора под влиянием активирующего воздействия ионов SO42-. С ростом концентрации сульфата меди средняя скорость осаждения проходит через максимум, а при достижении СCuSO4 =1 моль/дм3 порошок не образуется. Отсутствие прямой зависимости между током цементации и средней скоростью осаждения порошка можно объяснить изменением количества образующихся гальванопар.
Обзор методов очистки сульфатных цинковых растворов показывает, что хотя цементационное осаждение меди и никеля широко применяется, этот метод имеет ряд недостатков. Основной из них - высокая стоимость цинкового порошка, который при цементации расходуется в больших количествах.
Анализ исследований в области очистки цинковых растворов показал, что наиболее перспективными являются электрохимические процессы, поскольку практически все примеси более электроположительны, чем цинк. Эти методы достаточно хорошо описаны в литературе на основе технологических показателей применительно к конкретным объектам. Перенесение данных на другой состав раствора зачастую невозможно и требует дополнительных исследований. Все теоретические положения, рассмотренные нами в предыдущем разделе, касаются случаев «простого» цементационного процесса, использования активирующих добавок, механизм влияния которых недостаточно изучен. Ограничены данные по многокомпонентным системам.
Под термином «электроцементация» в ряде теоретических и прикладных работ понимается сочетание процессов цементации с электролизом путем дополнительной поляризации электродов внешним источником тока. Верхним пределом плотности тока для катодного процесса на электроде, состоящем из металла – цементатора, является защитная плотность тока, выше которой металл – цементатор перестает вытеснять из раствора металлы с более положительным потенциалом. В режиме защитной плотности тока металл–цементатор превращается в обычный инертный катод, на котором происходит осаждение металла только под действием внешнего тока. Установлено также, что величина защитной плотности тока в свою очередь является функцией ряда факторов, таких как концентрация осаждаемого металла в растворе, положение металлов (цементатора и осаждаемого) в ряду напряжений, гидродинамический режим, время протекания процесса и др. В частности, защитная плотность тока тем больше, чем больше концентрация осаждаемого металла в растворе и чем выше интенсивность гидродинамического режима.
В рассматриваемых нами сульфатных системах содержание катионов меди, никеля и кадмия на 2-3 порядка меньше концентрации цинка в растворе. Осаждение примесей протекает в режиме предельного тока, что приводит к получению рыхлых, плохо сцепленных с катодом осадков. По нашим данным, доля электроэкстракции меди в процессе электроцементации составляет 20-25%.
Условие совместного разряда ионов цинка и металла-примеси на катоде:
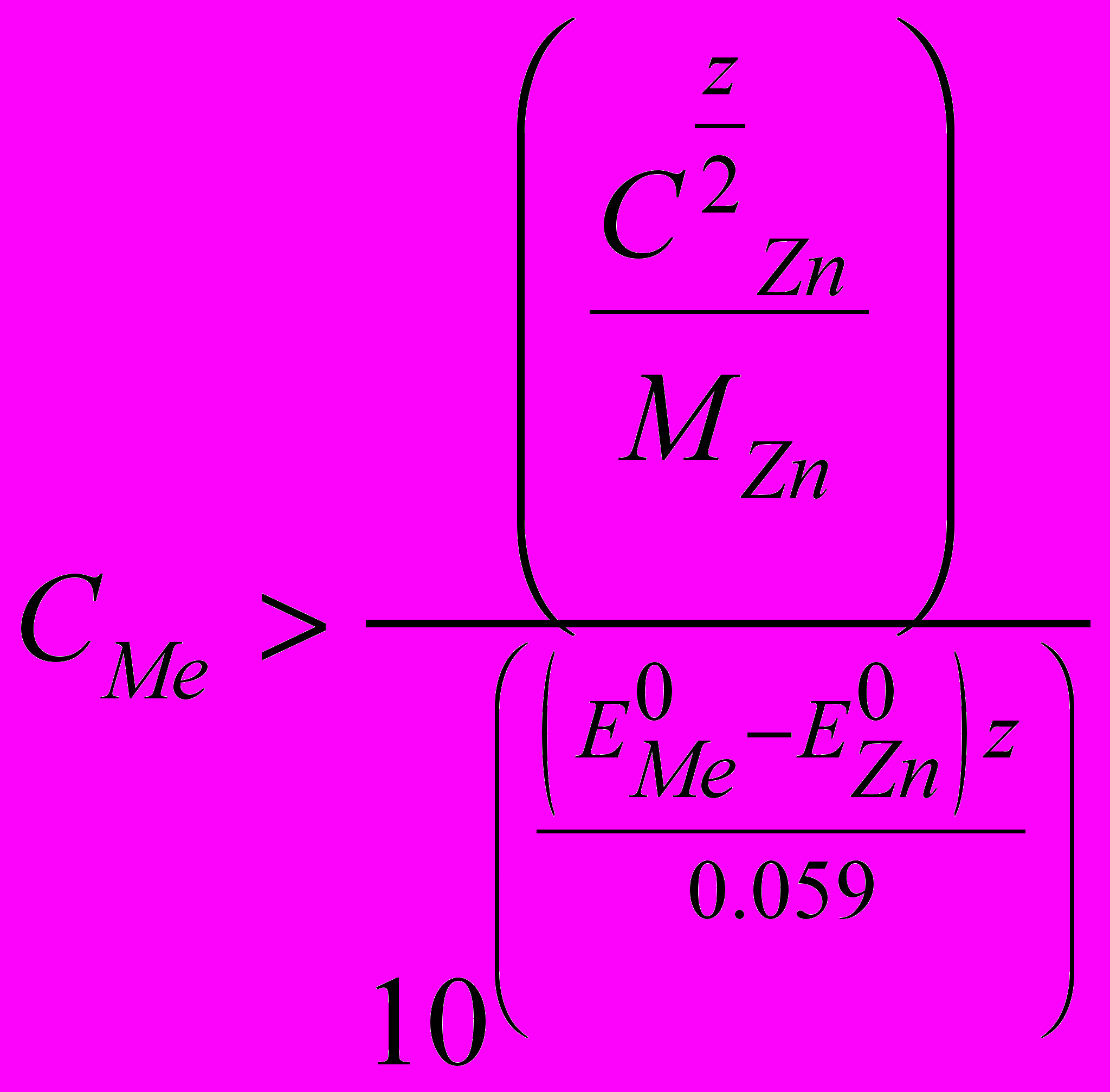 , (3)
, (3)Как только на цинковом катоде образуется некоторое количество металла-примеси, образуется новый микрокатод со своими электрическими характеристиками. Если перенапряжение водорода на вновь образованном микрокатоде ниже, чем на цинке, на нем интенсивно выделяется водород. Работа короткозамкнутых микроэлементов приводит к коррозии цинка на катоде.
С образованием при электроцементации химических соединений двух компонентов или твердых растворов, активность каждого из компонентов в твердой фазе уменьшается, равновесные потенциалы реакций восстановления сдвигаются в сторону электроположительных потенциалов. Одновременно снижается энергия активации процессов разряда. Эти эффекты (если восстановление ионов происходит не на предельном токе) могут привести к увеличению скорости процесса выделения цементируемого металла с введением добавки в электролит соли другого металла, способного к восстановлению.
Экстремальным является также влияние концентрации одних металлов на кинетику осаждения других при их совместном контактном вытеснении из растворов. Примером может служить влияние меди на скорость и полноту цементации никеля цинком, в том числе и в условиях катодной поляризации. Экспериментальное значение энергии активации процесса цементации никеля из растворов, не содержащих ионов меди, в интервале температур 373-383 K оказалось равным 79,1 кДж/моль, в то время как в присутствии меди она составила 34,3 кДж/моль. Следовательно, медь оказывает сильное активирующее влияние на осаждение никеля цементацией.
Электрохимический акт разряда ионов никеля связан с преодолением перенапряжения, достигающего 0,2 В. Это перенапряжение может быть преодолено двумя путями: смещением потенциала катодных участков в более отрицательную сторону или созданием условий, при которых ионы разряжались бы с деполяризацией. Смещение потенциала катодных участков может быть реализовано путем подбора гальванической пары с более высоким значением ЭДС, например, Сu–Zn. Деполяризация при разряде ионов никеля может быть обеспечена следующими способами: повышением температуры раствора и использованием активирующих добавок. Анализ процессов осаждения никеля в присутствии меди позволил прийти к следующему объяснению экстремального характера влияния меди:
- имеется оптимальная концентрация меди в растворе (300-500 мг/дм3), при которой скорость цементации примесей максимальна и зависит от температуры;
- при концентрациях меди выше оптимальной причиной снижения скорости цементации является образование плотных цементных осадков меди на поверхности цинка;
- при концентрациях меди ниже оптимальной причиной снижения скорости цементации никеля и кобальта является уменьшение числа гальванических пар на поверхности цинка при образовании рыхлых осадков меди, легко отрывающихся от поверхности цинковых зерен.
Прикатодное пространство обедняется ионами H+, что соответственно сказывается на увеличении pH. Предположение о возможности существования того или иного соединения можно сделать исходя из диаграмм Пурбэ (далее E-pH), которые были построены с помощью пакета для термодинамических расчетов HSC 4.0. Для моделирования выбраны следующие системы:
- Cu-H2O, с содержанием 2 г/дм3 Cu;
- Ni-H2O, с содержанием 0,2 г/дм3 Ni;
- Zn-H2O, с содержанием 100 г/дм3 Zn;
- Cu-Ni-Zn-H2O, с содержанием, г/дм3 : 2 Cu, 0,2 Ni, 100 Zn.
Для расчета активности иона в растворе или активностей ионов в растворе смеси ионов использовали программу IonCalc. Результаты расчета равновесных потенциалов для различных систем представлены в табл. 2.
Таблица 2 - Равновесные потенциалы
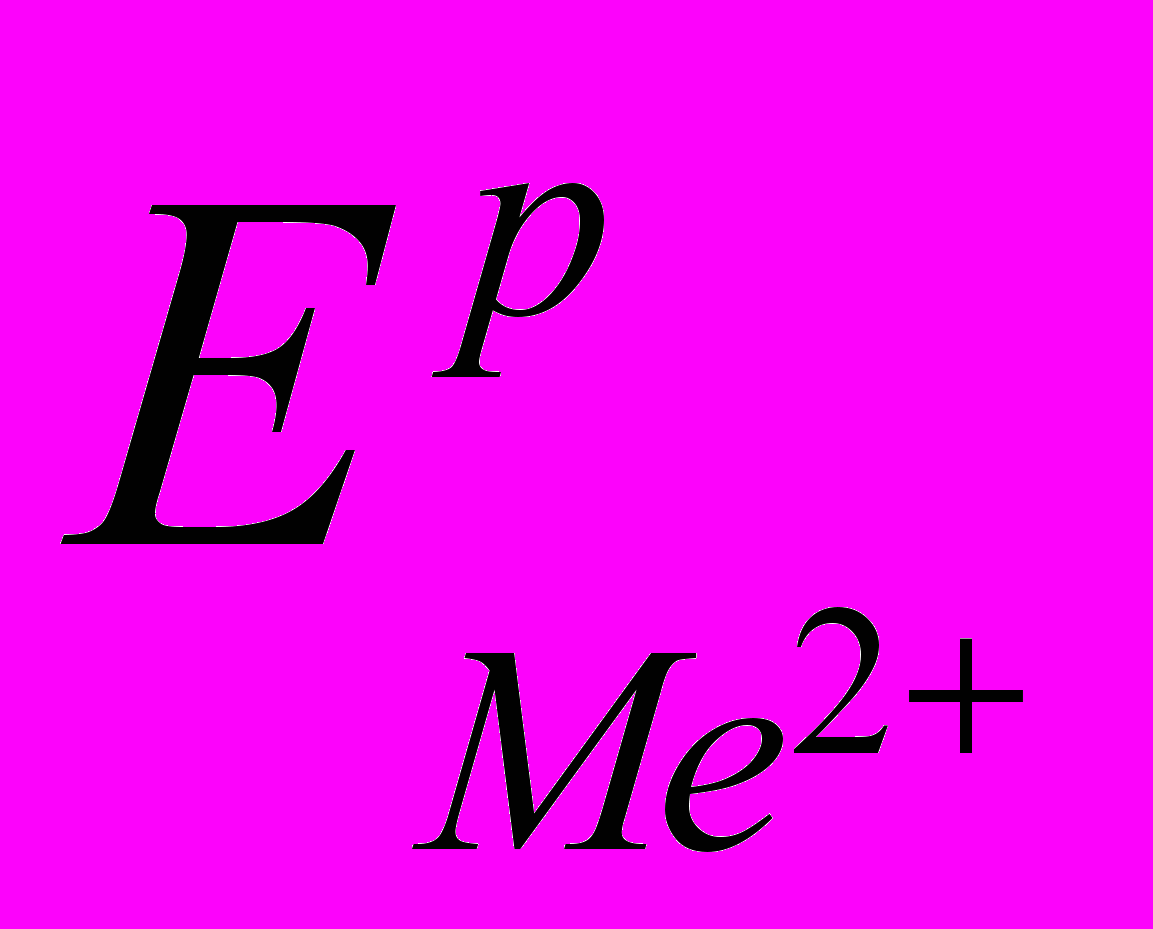 , В
, В | Ион | Температура раствора, К | ||
| 298 | 323 | 348 | |
| Отдельные системы | |||
| Cu2+ | 0,283 | 0,278 | 0,273 |
| Ni2+ | -0,329 | -0,335 | -0,342 |
| Zn2+ | -0,781 | -0,783 | -0,784 |
| Система Cu-Zn | |||
| Cu2+ | 0,269 | 0,263 | 0,258 |
| Zn2+ | -0,782 | -0,784 | -0,785 |
| Система Ni-Zn | |||
| Ni2+ | -0,348 | -0,357 | -0,365 |
| Zn2+ | -0,781 | -0,783 | -0,785 |
| Система Cu-Ni-Zn | |||
| Cu2+ | 0,269 | 0,263 | 0,258 |
| Ni2+ | -0,348 | -0,357 | -0,365 |
| Zn2+ | -0,782 | -0,784 | -0,785 |
Приведенный расчет равновесных потенциалов учитывает изменение активности ионов в многокомпонентном растворе, что позволяет более точно рассчитать смещение потенциалов в сложных системах при осаждении меди из растворов сложного состава.
Одним из наиболее рациональных способов определения фазового состава катодных осадков, полученных из многокомпонентных электролитов, является метод их анодного растворения при контролируемом потенциале с регистрацией пиков анодного тока. По величине, форме и потенциалам пиков на поляризационной кривой можно судить о составе осажденной полиметаллической системы.
Использован модельный подход к решению данной задачи. Основная идея - в точке квазиравновесия сумма катодных токов равна сумме анодных. Равновесие кажущееся, так как при обмене зарядами на границе фаз равновесие действительно соблюдается, а природа обменивающихся зарядов разная. Принято допущение, что все процессы протекают на одной и той же поверхности, поскольку медь с никелем образует непрерывный ряд твердых растворов. Когда сплав контактирует с сульфатным цинковым раствором, то в общем случае равновесия не возникает; лишь специально подобрав состав раствора, можно достичь равновесия по обоим компонентам. Очевидно, что это относится как к твердым растворам и интерметаллидам, так и к сплавам типа механической смеси. Поэтому, в отсутствие внешнего тока устанавливается смешанный (компромиссный) потенциал, причем один из компонентов переходит в раствор (селективно растворяется), второй (более электроположительный в данных условиях) осаждается, а также может внедряться в чужую решетку. При этом происходит изменение состава поверхности, которое через какое-то время может привести к установлению равновесия.
Расчет равновесных потенциалов растворения сплавов выполнен с применением программного пакета инженерных расчетов MathCAD.
Расчет производили для 4 случаев протекания процесса:
- ионизация обоих металлов контролируется замедленным переносом заряда (активационный контроль);
- смешанная кинетика для меди и активное растворение для никеля;
- смешанная кинетика для меди и режим пассивации для никеля;
- смешанная кинетика для меди и режим пассивации для никеля с учетом доли поверхности, занятой компонентами сплава.
Исходные данные:
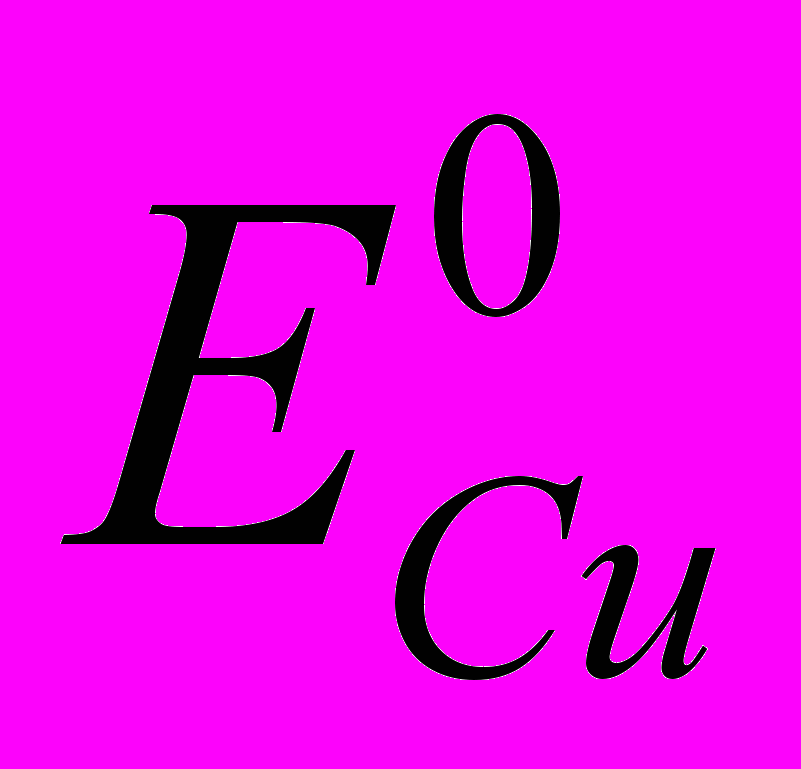 0,337 В;
0,337 В; 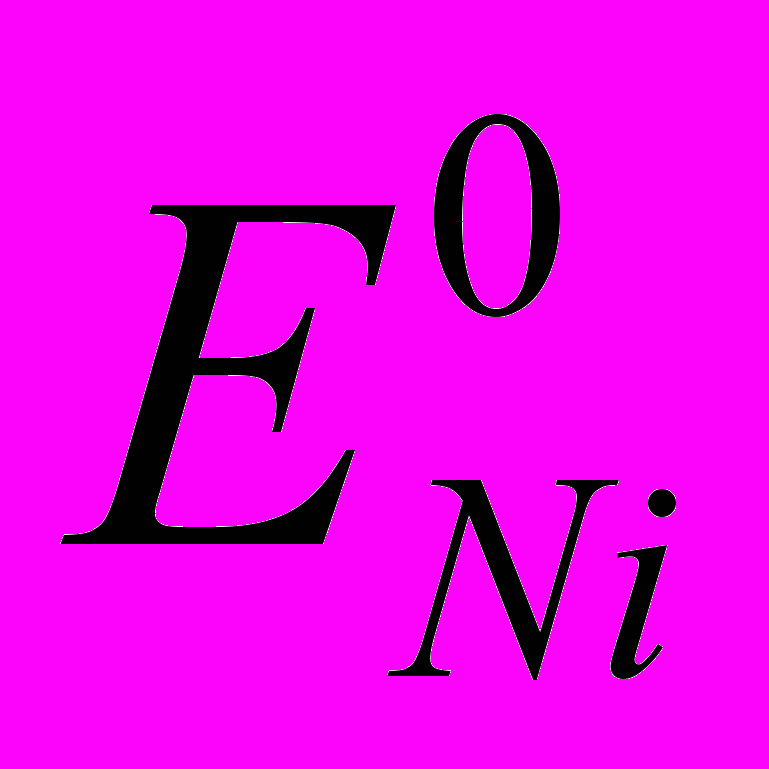 -0,250 В; T 298 К; C0Cu 0,5 моль/дм3; C0Ni 0,1 моль/дм3;
-0,250 В; T 298 К; C0Cu 0,5 моль/дм3; C0Ni 0,1 моль/дм3; St 1000; ksCu 8,110-7 м/с; ksNi 2.710-12 м/с; Cu 0,38; Ni 0,28.
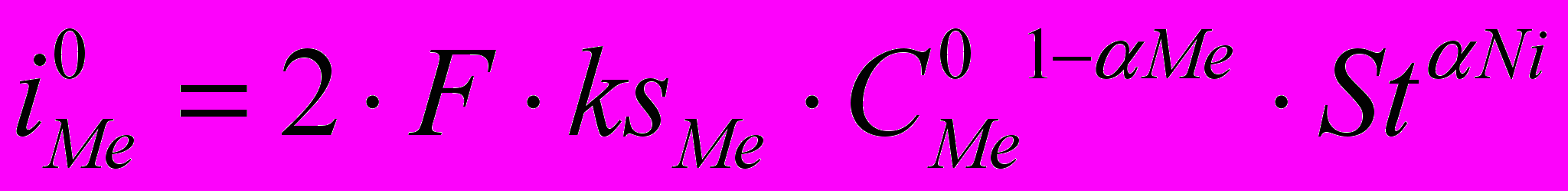 , (4)
, (4)Расчет токов обмена, дает для меди и никеля i0Cu 99,626 А/м2,
i0Ni 9,92910-5 А/м2.
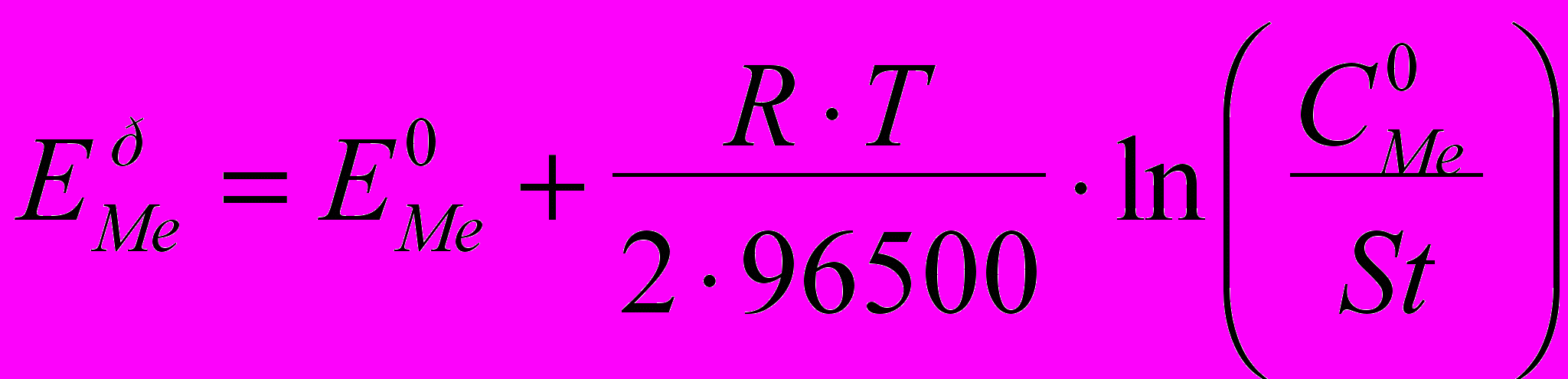 , (5)
, (5)Равновесные потенциалы равны:
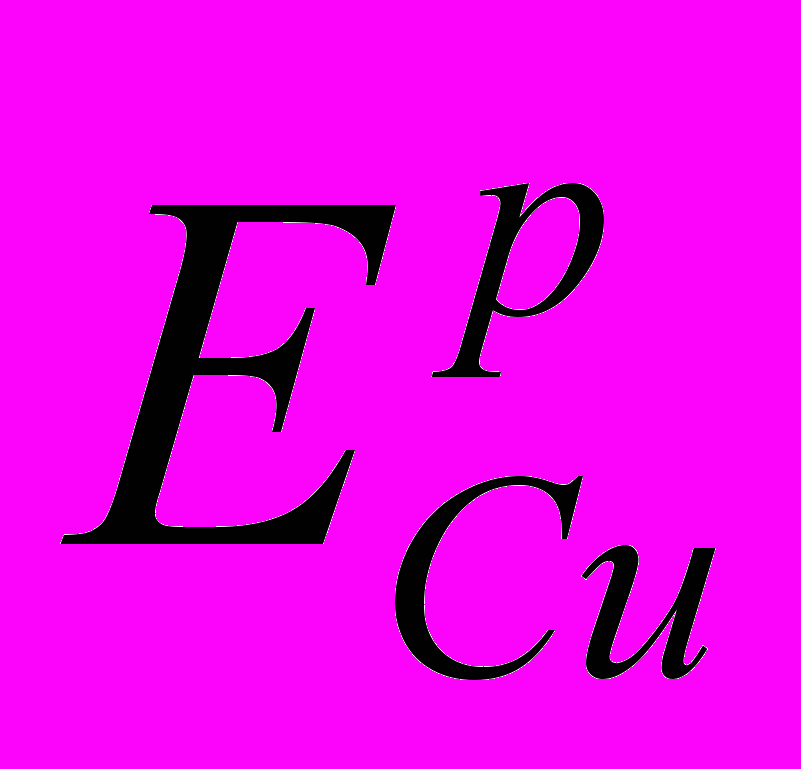 =0,328 В,
=0,328 В,  i=-0,280 В.
i=-0,280 В.Для катодного процесса:
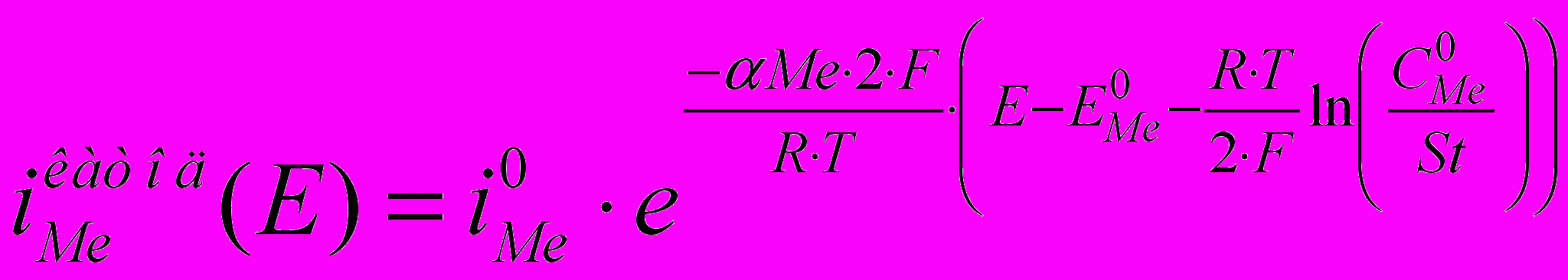 , (6)
, (6)Для анодного процесса:
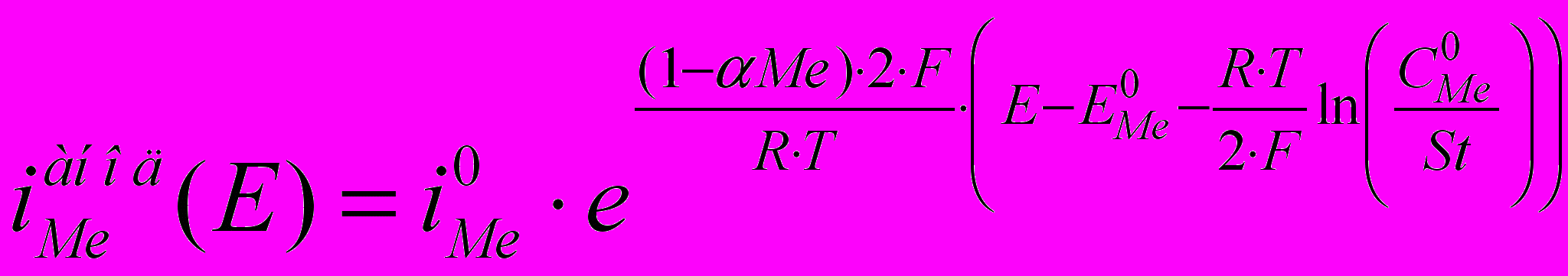 , (7)
, (7)Суммарный процесс:
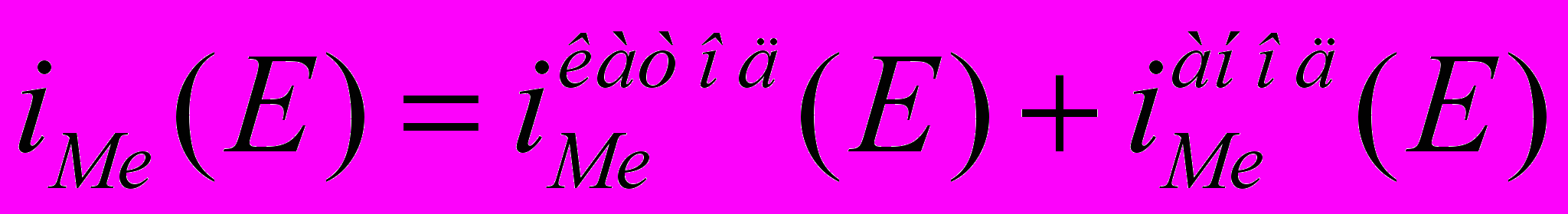 , (8)
, (8)