Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01. 06 Биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат диссертации |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы серебра в коллоидных растворах и их применение, 25.84kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
- Ю. М. Дедков, М. Г. Слотинцева Сб. «Свойства и применение платиновых металлов и сплавов, 100.81kb.
- Координационные взаимодействия глюкозамина, хитозана и их гидрохлоридов с ионами d-металлов, 403.45kb.
- Доцента кафедры Хиээ ланской, 49.44kb.
- Метод биосорбции тяжелых металлов из промышленных сточных вод с использованием пивоваренных, 350.37kb.
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Строения металлов и их свойства, 394.29kb.
[Ag+(-) … Qr(+)] Ag0 + Qr+ (II)
Ag0 + Ag+ Ag2+ + Ag0 + … Agkl+ (III)
Вначале образуется комплекс кверцетина с катионом серебра (I), затем этот комплекс распадается с образованием атома серебра и окисленного кверцетина (II), затем атомы и ионы серебра ассоциируют с образованием наночастиц (III). Жирным шрифтом выделены компоненты, которые удается обнаружить по их характерным полосам поглощения в мицеллярном растворе. Индексы (-) и (+) указывают на смещение электронной плотности в комплексе от кверцетина к иону металла.
Р
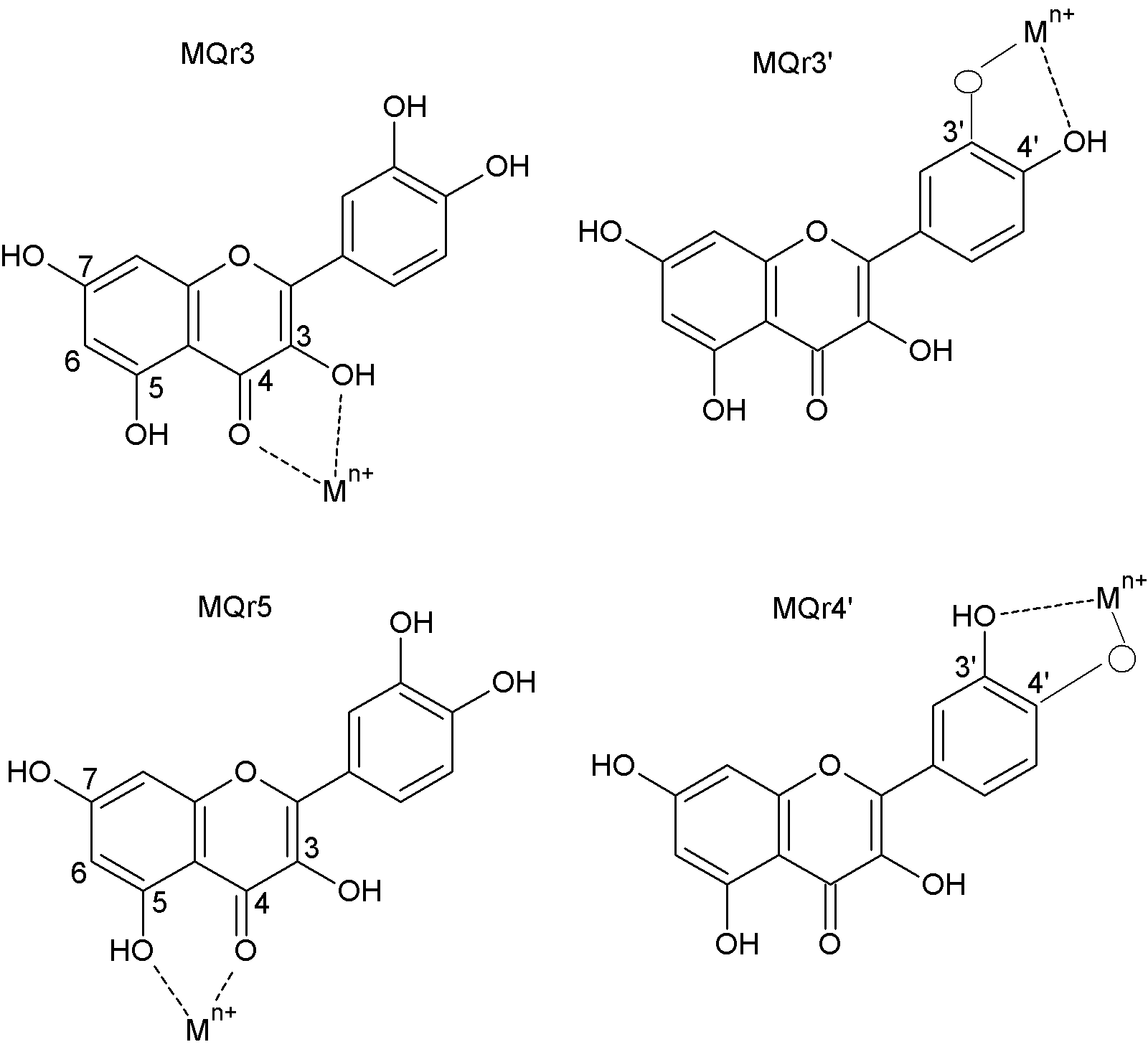 ис.20. Возможные виды комплексов кверцетина с ионами металлов (по данным А.Д.Рошаль и Т.В Сахно, 2001).
ис.20. Возможные виды комплексов кверцетина с ионами металлов (по данным А.Д.Рошаль и Т.В Сахно, 2001).Анализ полученных результатов позволяет также высказать предположения о структуре комплекса. Можно заключить, что он образуется не через 3’ и 4’ кислороды катехиновой группы (в кольце В, рис.3), поскольку, как известно из литературы, при этом наблюдается изменение спектра поглощения (батохромный сдвиг полосы I), которое в нашем случае отсутствует. Об этом же свидетельствует тот факт, что замена кверцетина на морин приводит к быстрому формированию наночастиц серебра; при этом изменение спектров поглощения аналогично регистрируемому для кверцетина. Поскольку отличие структуры морина от кверцетина заключается в удалении друг от друга ОН групп в кольце В, в силу чего образование комплекса с кислородами при С3’ и C4’ оказывается невозможным (рис.3), можно предположить, что с обоими флавоноидами комплекс образуется через кислороды при С3 и С4, или С4 и С5. Эта версия подтверждается результатами теоретического анализа вероятности образования комплексов с ионами металлов 5- гидроксифлавонов, в том числе кверцетина. Показано (Рошаль и Сахно, 2001), что для кверцетина возможно образование 4-х видов комплексов (рис.20) – двух видов хелатов с участием карбонильной группы при С4 и гидроксильных групп у С3 (MQr3) либо С5 (MQr5) и двух видов хелатов с участием гидроксильных групп у С3’ и С4’ (MQr3’ и MQr4’). На основании результатов расчетов энтальпий образования комплексов кверцетина с ионами разных металлов и геометрических соображений (оценок размеров полостей между кислородами в положениях С4 и С5 или С4 и С3) авторами сделан вывод о том, что, во-первых, образование комплексов типа MQr3’ и MQr4’ маловероятно, и во-вторых, что тип образующегося здесь комплекса (MQr3 или MQr5) определяется размерами и электронным строением иона металла, причем для ионов большого размера предпочтительно образование комплекса MQr3. Из этих данных вытекает, что в нашем случае более вероятно образование комплекса типа MQr3. Однако из этого не следует, что комплекс ионов Ag+ через кислороды при С3’ и С4’ в принципе невозможен. Как вытекает из аналогичных экспериментов с рутином, в этом случае на промежуточной стадии наблюдается батохромный сдвиг полосы I, характерный для образования комплекса именно с катехиновой группой в кольце В.
4.2. Наночастицы золота
Анализ изменений спектров поглощения в процессе синтеза наночастиц золота позволяет заключить, что здесь реализуется та же последовательность событий, что и описанная выше для синтеза наночастиц серебра. Вначале образуется комплекс [Au3+(δ-) …Qr (δ+)] также через атомы кислорода в положениях С3 и С4 или С4 и С5. В комплексе (вероятно, через ряд промежуточных стадий) происходит восстановление ионов золота до атомов, затем ассоциация атомов и ионов с образованием наночастиц. Учитывая, что с рутином, для которого невозможно образование комплекса типа MQr3, синтез наночастиц золота реализовать не удается, можно предположить, что для иона золота более вероятно связывание с молекулой Qr через атомы кислорода в положениях С3 и С4.
4.3. Наночастицы меди и цинка
Спектрофотометрическое исследование взаимодействия ионов меди и цинка с кверцетином в мицеллярных растворах показало, что при введении водных растворов простых солей (сульфатов или нитратов) наблюдается батохромный сдвиг полосы I, свидетельствующий об образовании комплекса типа MQr3’ или MQr4’ , однако далее процесс не идет и образования наночастиц не происходит. Мы предположили, что причиной этого является нестабильность однозарядных ионов Cu+ и Zn+ (которые образуются на первой стадии восстановления соответствующих двухзарядных ионов), вследствие чего они не могут образовать комплекс с кверцетином, в котором идет восстановление до атома. Как было известно из литературы, такую проблему можно решить путем введения агента, образующего прочные комплексы с однозарядными ионами; в качестве такого агента мы использовали аммиак, заменив для этого простые ионы металлов на комплексные аммиак-содержащие ионы. И действительно, при введении в мицеллярный раствор Qr аммиачных солей меди или цинка
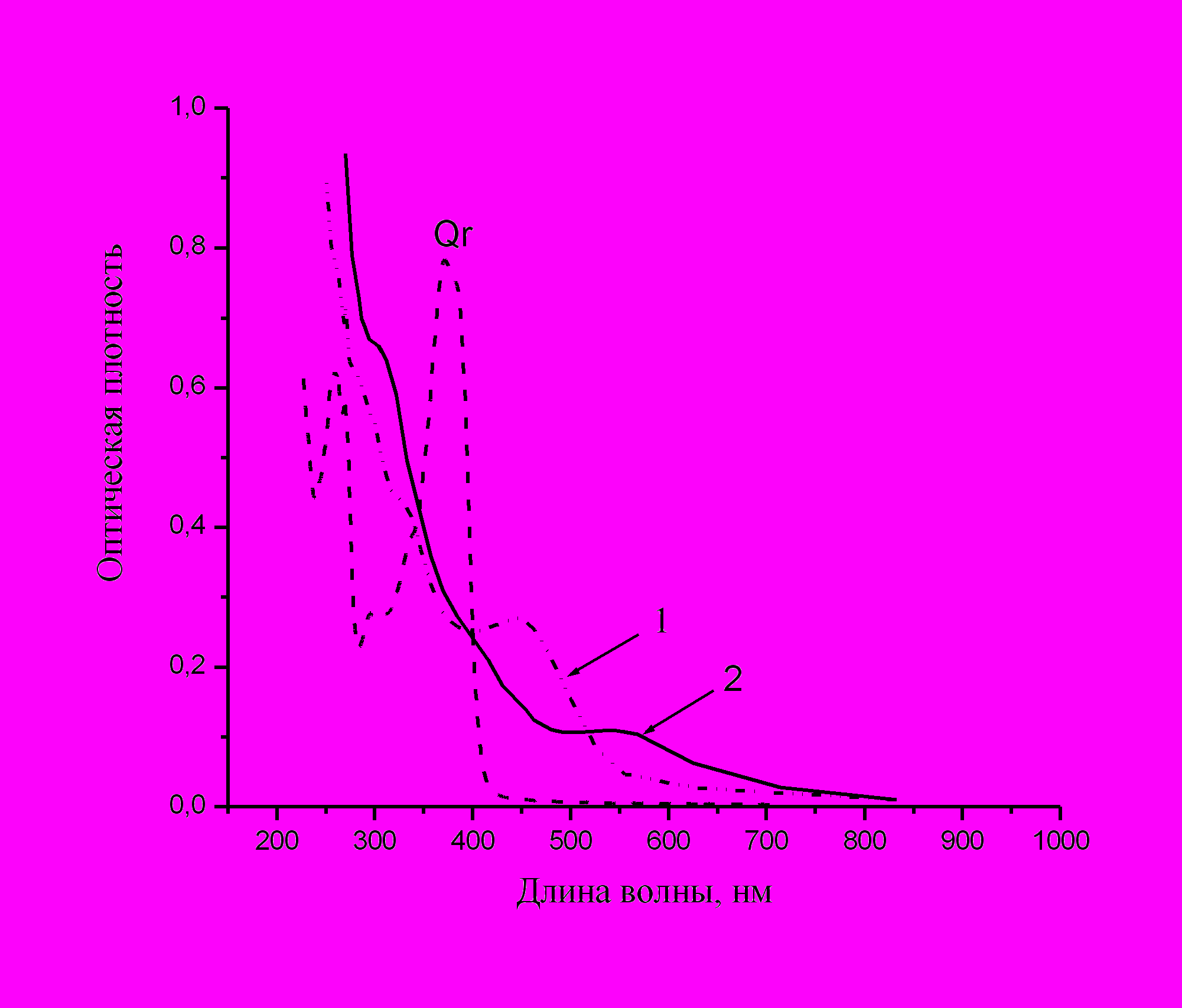
Рис. 21. Формирование наночастиц Cu. Изменение спектра мицеллярного раствора Qr через 2 мин (1) и 30 мин (2) после введения аммиачной соли меди до концентрации 4 мМ, w = 3.7.
(тетрааминсульфатов или тетрааминнитратов) наблюдается вначале образование комплекса, а затем наночастиц. Эти события отражаются в соответствующих изменениях спектров поглощения мицеллярного раствора Qr. Типичная картина для меди показана на рис.21. Вначале наблюдается батохромный сдвиг обеих полос кверцетина, свидетельствующий об образовании комплекса, затем полоса I исчезает и появляется полоса наночастиц (545-555 нм). Комплекс распадается с образованием двух продуктов – окисленного кверцетина (полоса 320-330 нм) и наночастиц. При стандартных условиях синтез идет достаточно быстро, так что уже через 2 мин не видна полоса I исходного кверцетина и появляется слабое поглощение в области полосы наночастиц. Для выявления стадий, предшествующих образованию наночастиц, как и в случае серебра, требуется замедлить процесс, например, уменьшая концентрации реагентов.
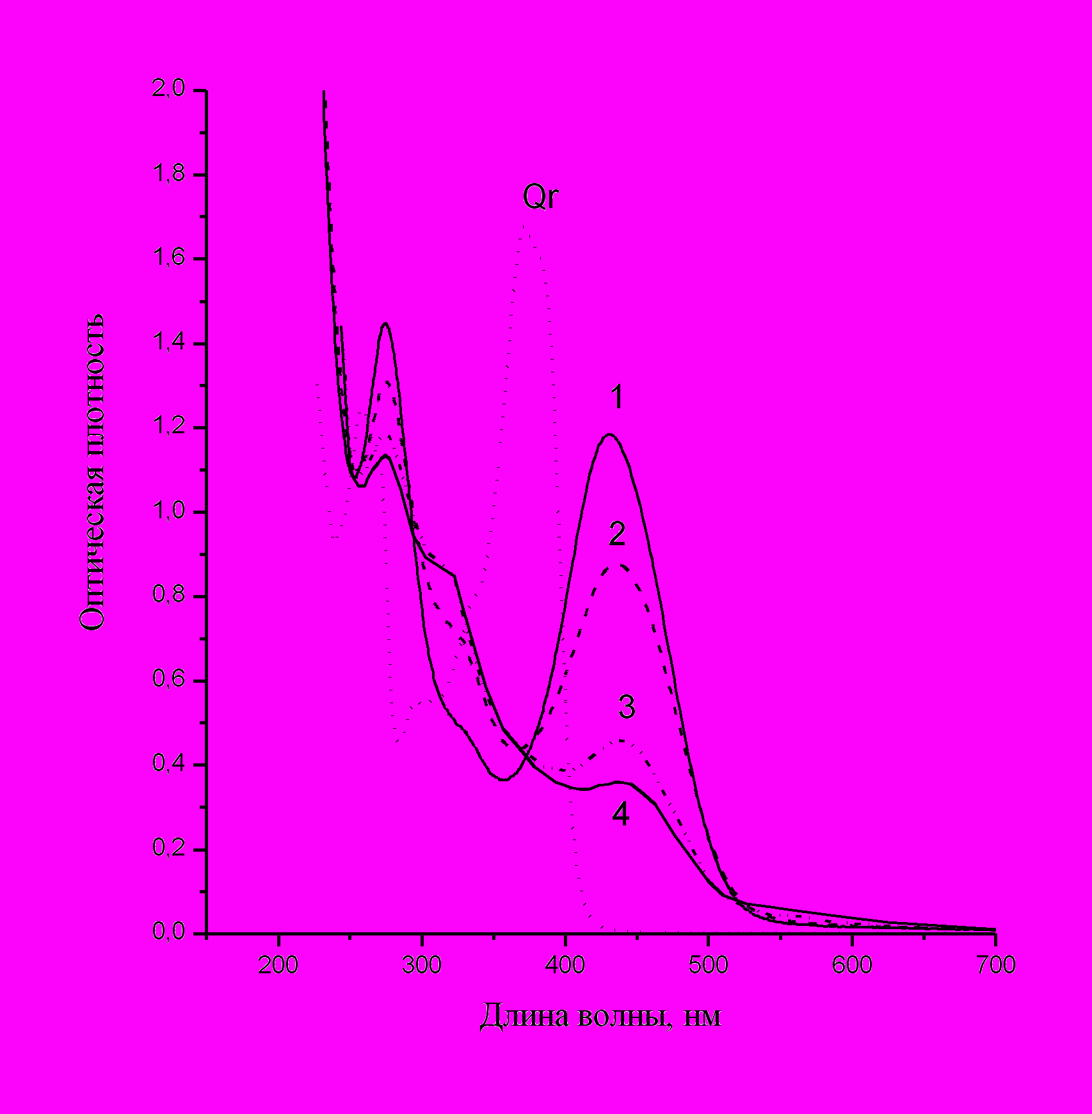
Рис.22. Пример кинетики формирования наночастиц цинка.Показаны изменения спектра мицеллярного раствора Qr через 5 мин (1), 30 мин (2), 70 мин (3) и 100 мин (4) после введения аммиачной соли цинка, w = 3.7.
Подобная же картина наблюдается и при введении в мицеллярный раствор кверцетина раствора соли цинка (рис.22). Здесь процесс синтез протекает медленнее, чем в случае меди, так что для выявления промежуточных стадий специального замедления не требуется. Предположительно это обусловлено меньшей степенью связывания кверцетина с ионами цинка; такое различие отмечалось в исследованиях взаимодействии с этими ионами кверцетина, иммобилизованного в полимерных пленках (Sakaguchi T., Nakajima A., 1987). На рисунке отчетливо видна изобестическая точка (378 нм), отражающая прямую связь между распадом комплекса и образованием продукта окисления кверцетина (появление выраженного плеча при 330 нм). Полоса наночастиц Zn лежит в области 270-280 нм; ее можно выделить путем вычитания спектров комплекса и оставшегося кверцетина из конечного спектра, полученного после завершения реакции. Таким образом, в обоих случаях формирование наночастиц идет через образование комплекса.
Нами были определены коэффициенты экстинкции комплексов Qr с простыми и комплексными аммиак-содержащими катионами металлов путем вычитания спектра оставшегося Qr из спектра мицеллярного раствора после введения соли металла в условиях, когда в нем отсутствуют наночастицы и содержатся только комплекс Qr с ионами металла и не прореагировавший кверцетин. Процедура вычитания проиллюстрирована на примере мицеллярного раствора Qr с ионами [Cu(NH3)4]2+ (рис.23) Здесь же показан характерный вид спектра комплекса. Во всех случаях, кроме сульфата меди, в спектре комплексов присутствуют две полосы, сдвинутые в красную сторону относительно соответствующих полос Qr; для сульфата меди удается выделить лишь одну длинноволновую полосу.
Р
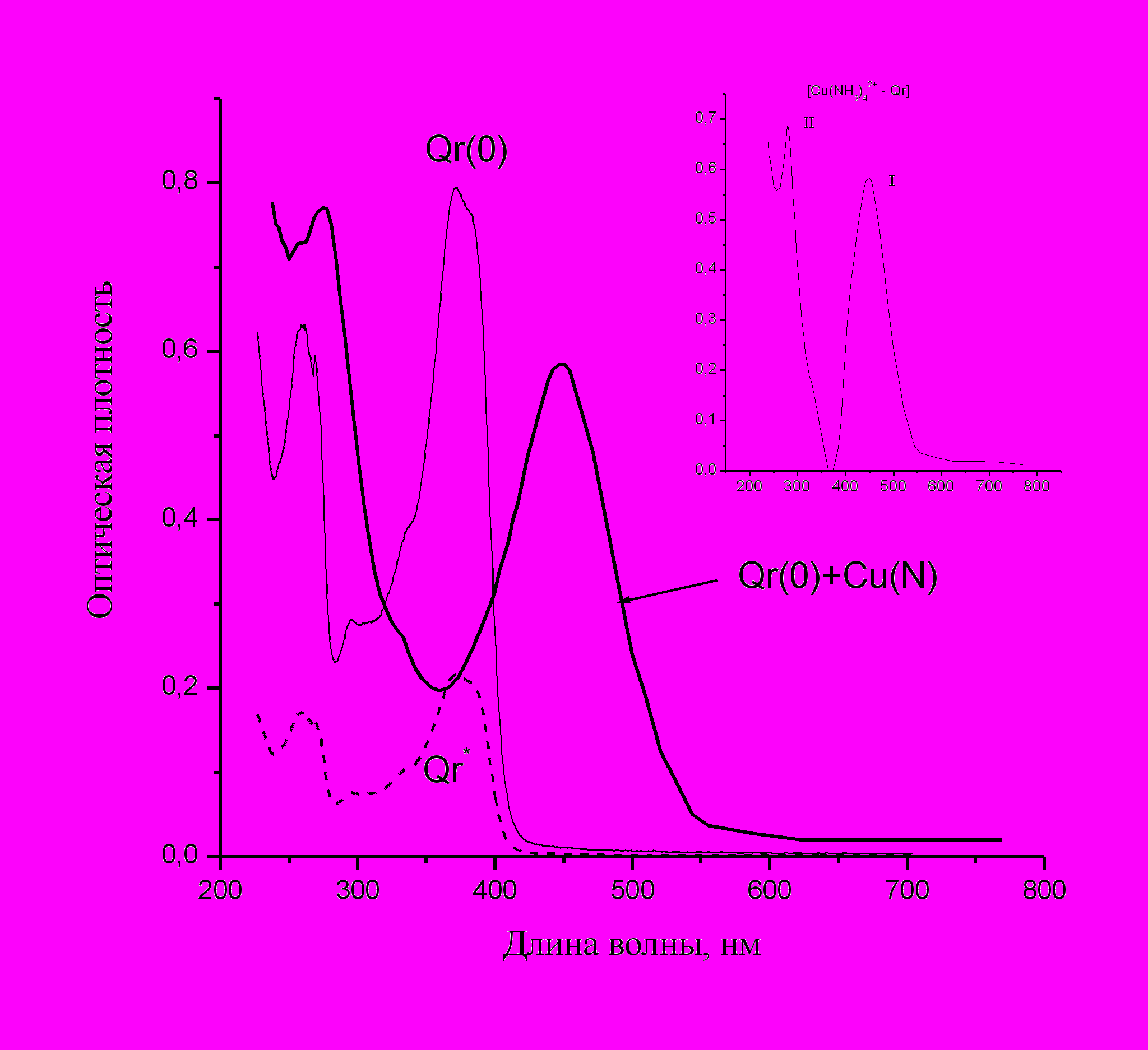 ис.23. Выделение спектра комплекса кверцетина с ионами [Cu(NH3)4]2+ из суммарного спектра системы Qr(0) + Cu(NH3)4 SO4. Спектр комплекса (на вставке) получен путем вычитания спектра не прореагировавшего кверцетина (Qr*) из спектра, снятого через 2 мин после введения соли металла (Qr(0) + Cu(N)).
ис.23. Выделение спектра комплекса кверцетина с ионами [Cu(NH3)4]2+ из суммарного спектра системы Qr(0) + Cu(NH3)4 SO4. Спектр комплекса (на вставке) получен путем вычитания спектра не прореагировавшего кверцетина (Qr*) из спектра, снятого через 2 мин после введения соли металла (Qr(0) + Cu(N)). Коэффициенты экстинкции кверцетина, рутина, и комплексов кверцетина с металлами по полосе I приведены в таблице 1. Сравнение с доступными литературными данными по оптическим свойствам комплексов переходных металлов с флавоноидами в водных растворах показывает, что полученные нами значения коэффициентов экстинкции близки к найденным для комплексов меди в водном растворе с рутином (1-2*104 л/моль [Мельникова Н.Б., Иоффе И.Д., Царева Л.А. 2002]) и кверцетином (2 104 л/моль [Mira L., Fernandez M.T. et al 2002.]). Изменения спектров при взаимодействии ионов меди с рутином и морином свидетельствуют о том, что здесь возможно образование комплексов двух типов – с кислородами при С3’ и С4’ в кольце В (Ru), или с кислородами при С3 и С4 в кольце С (Mo).
Таблица 1. Положения полос поглощения и коэффициенты экстинкции
рутина, кверцетина и его комплексов с ионами меди и цинка в мицеллярных
растворах. Приведены данные для сульфатов (S) и тетраамминсульфатов (N)
__________________________________________________________
Наименование maxI maxII I 10-4, л/моль см
__________________________________________________________
Рутин 364 258 2,32
Кверцетин 372 258 2,8
[Cu2+…Qr] S 422 - 3,73
[Cu2+…Qr]N 450 278 2,84
[Zn2+…Qr]S 416 265 3,06
[Zn2+…Qr]N 432 279 2,65
________________________________________________________
Обобщая приведенные выше сведения о механизме взаимодействия флавоноидов с ионами металлов в мицеллярном растворе можно заключить, что здесь выделяются две основные стадии: (1) образование комплекса и (2) распад комплекса в конечном счете на атомы металла (с последующим образованием наночастиц) и флавоноид в окисленной форме. При этом возможно образование комплексов с разной структурой (рис.20), различающейся фрагментами молекулы флавоноида, образующими связи с ионами металлов – либо через атомы кислорода при С3 и С4 в кольце С (наночастицы Ag и Au с Qr и наночастицы Cu с Mo), либо через атомы кислорода при С3’ и С4’ в кольце В (наночастицы Cu и Zn с Qr и Ru).
5. Водные растворы наночастиц металлов
При разработке различных вариантов применения наночастиц оказалось важным получать их стабильные дисперсии не только в органическом растворителе (в нашем случае, в углеводородах), но и в полярных средах, прежде всего в воде. Есть все основания полагать, что стабильные наночастицы металлов в водных растворах найдут полезные применения в медицине и биотехнологии. Большое значение для разработки медицинских приложений наночастиц, а также для определения степени токсичности различных наноматериалов для человека и других живых организмов имеют исследования механизмов биологического действия наночастиц металлов, которые могут проводиться только на водных дисперсиях.
Для расширения круга возможных применений наночастиц, полученных методом биохимического синтеза, была разработана методика получения водных дисперсий наночастиц из их мицеллярных растворов. Нами описаны две процедуры приготовления таких дисперсий: (1) центрифугирование двухфазной системы мицеллярный раствор/вода и (2) смешение мицеллярного раствора с водой и последующее отстаивание. В первом случае удается получить водную дисперсию наночастиц с малым содержанием АОТ, но здесь оказывается малой и концентрация наночастиц; кроме того, технически сложно получать достаточно большие количества раствора наночастиц, приемлемые для прикладных исследований. Поэтому изучение свойств и разработка различных вариантов применения водных дисперсий наночастиц проводилась с использованием второй из упомянутых процедур. Таким путем получены водные дисперсии наночастиц серебра, золота, меди и цинка.
Т
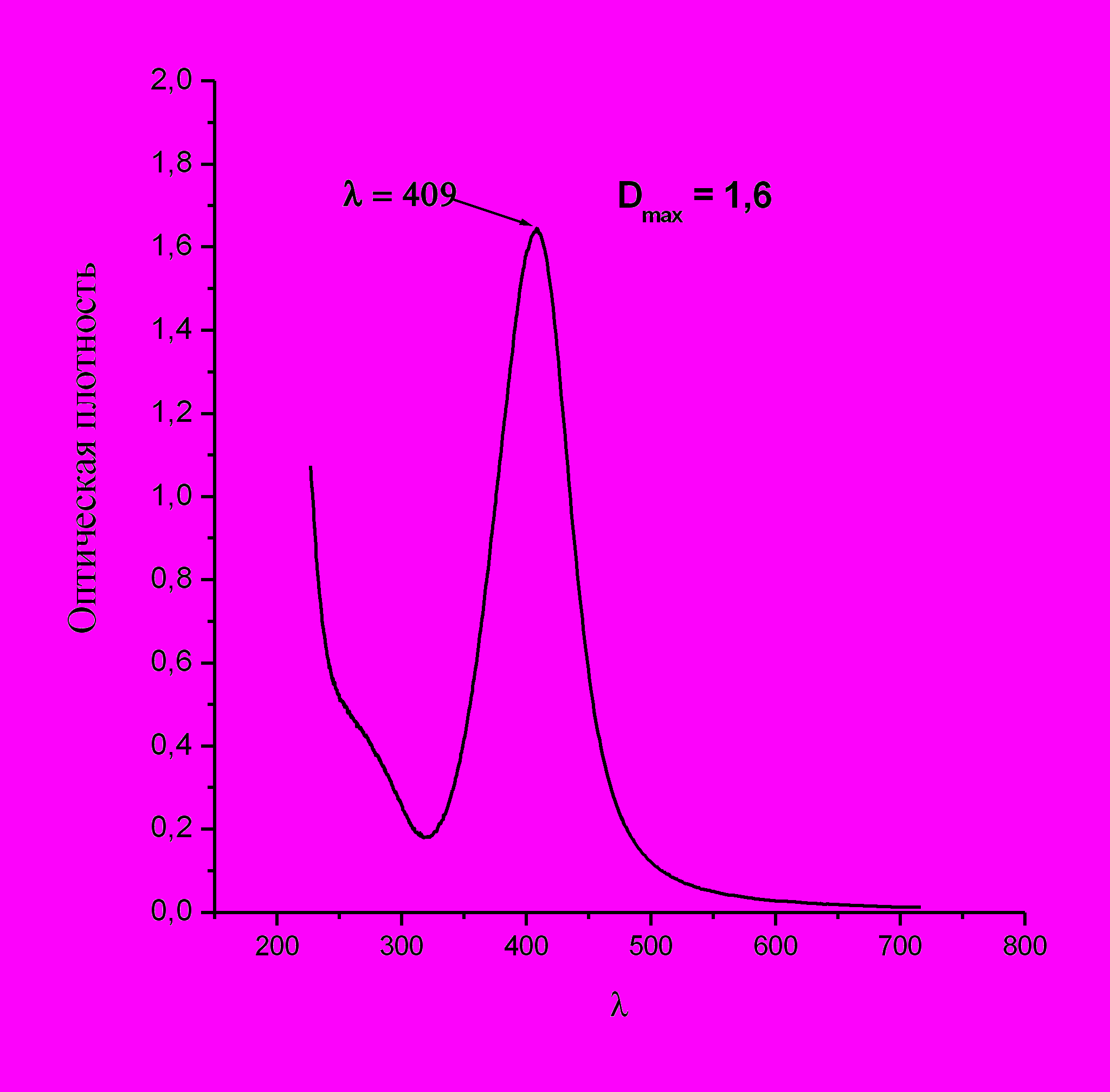 ипичный спектр поглощения водного раствора наночастиц серебра показан на рис.24. Максимум полосы поглощения наночастиц лежит в интервале 400 – 420 нм, в согласии с известными из литературы положениями максимума для наночастиц серебра в водных растворах.
ипичный спектр поглощения водного раствора наночастиц серебра показан на рис.24. Максимум полосы поглощения наночастиц лежит в интервале 400 – 420 нм, в согласии с известными из литературы положениями максимума для наночастиц серебра в водных растворах.Рис.24. Характерный вид спектра поглощения водной дисперсии наночастиц серебра.
Пример электронной микрофотографии и гистограмма распределения по размерам показаны на рис.25. Средний размер частиц по данным ТЕМ практически совпадает с найденным для соответствующих мицеллярных растворов, но разброс по размерам часто оказывается больше. При измерениях методом ФКС, как и в случае мицеллярных растворов, размеры оказываются обычно больше
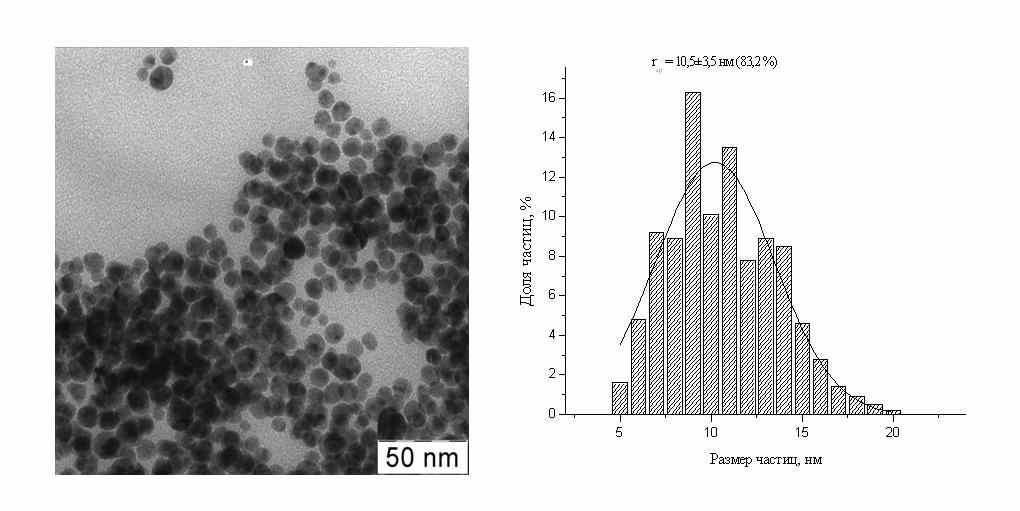
Рис.25. Электронная микрофотография и распределение по размерам в водном растворе наночастиц серебра.
найденных по электронным микрофотографиям. Возможно, что увеличение среднего размера в этом случае обусловлено присутствием агрегатов АОТ, который в избытке переходит в водную дисперсию из мицеллярного раствора. Помимо концентрации и размеров наночастиц, концентрация АОТ в водной дисперсии является важным параметром при разработке некоторых вариантов применения этих растворов (например, в качестве добавок к косметическим средствам) а также для исследований биологических эффектов наночастиц, поскольку этот ПАВ может быть токсичным для биологических объектов. Для контроля этого параметра нами была поставлена методика определения концентрации анионных ПАВ в воде (ГОСТ Р 51211-98) и разработаны процедуры, позволяющие существенно уменьшить концентрацию АОТ в водной дисперсии наночастиц серебра, что давало возможность устранить побочные эффекты действия этого ПАВ (см. раздел 7).
6. Адсорбционные свойства наночастиц
Нанесение наночастиц на твердые поверхности производилось путем адсорбции их из раствора с целью получения различных модифицированных материалов со специальными свойствами, для применения в технике и медицине. Для каждого вида материала подбирались условия, обеспечивающие достаточно высокие скорость адсорбции и плотность покрытия наночастицами, а также его достаточную устойчивость при предполагаемых условиях эксплуатации. Тип раствора, из которого наносятся наночастицы, зависит от свойств поверхности адсорбента. При этом в основном выполняются общие закономерности, известные из теории адсорбции – из неполярной среды с полярными примесями адсорбция этих примесей активно идет на гидрофильных поверхностях, а из полярной среды с неполярными примесями – на гидрофобных. Мицеллярный раствор с этой точки зрения является неполярной средой, в которой наночастицы в обратных мицеллах можно рассматривать как полярный компонент; такой раствор использовали для нанесения на стекло, металлы, ткани, порошки оксидов металлов, силикагель и другие материалы с полярными группами на поверхности. Водный раствор – полярная среда, в которой наночастицы в мицеллах из АОТ представляют неполярный компонент; из таких растворов наночастицы хорошо адсорбировались на активированном угле, углеродных тканях, а также на других материалах, поверхности которых обладают преимущественно гидрофобными свойствами.
Контроль скорости адсорбции производили методом спектрофотометрии – по изменению интенсивности характерной полосы поглощения наночастиц в растворе, из которого они наносятся на данный материал. Количество наночастиц, адсорбированных на материале, оценивали в количестве нанесенного металла на единицу веса материала (обычно в мг/г) или (если известна удельная поверхность образца) – в количестве металла на единицу площади поверхности (мг/см2). При нанесении из монодисперсных растворов определялась также плотность покрытия (число наночастиц на единицу площади поверхности образца).
Для определения оптимальных условий, позволяющих получить заданные скорость адсорбции и плотность покрытия, а также обеспечить высокую степень извлечения наночастиц из раствора, изучали влияние на эти параметры различных факторов –
концентраций наночастиц и АОТ в мицеллярном или водном растворе, специфики поверхности адсорбента, его происхождения (например, для активированного угля – источника его получения) и др. В отдельных случаях удавалось определить удельную поверхность адсорбента по результатам измерений адсорбции АОТ из мицеллярного раствора. Практическое значение таких исследований можно проиллюстрировать на примере получения силикагеля с нанесенными наночастицами серебра (рис. 26).
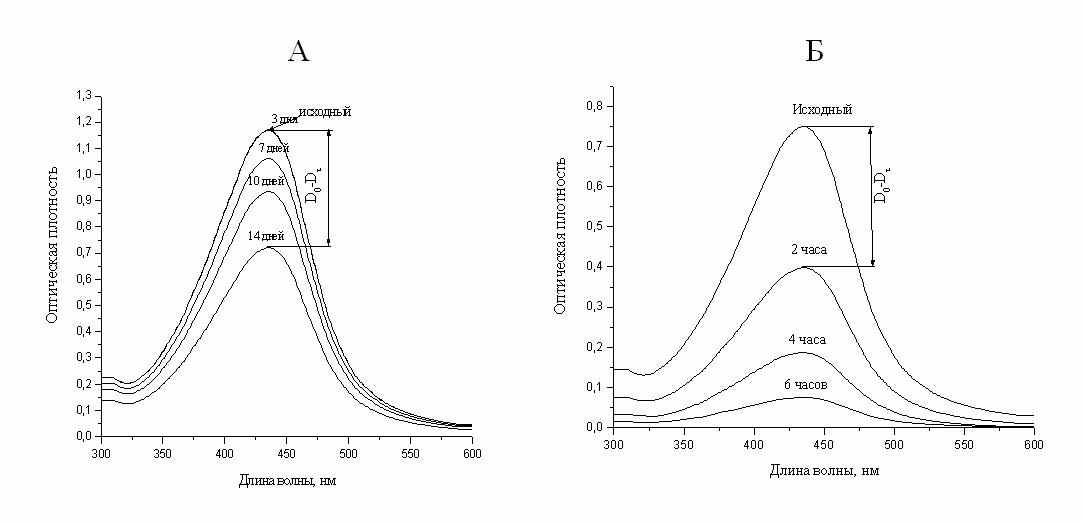
Рис. 26. Изменение концентрации наночастиц серебра в мицеллярном растворе при адсорбции на
силикагеле из стандартного раствора на неподготовленной поверхности (А) и из раствора
оптимизированного состава на предварительно подготовленной поверхности (Б).
Здесь показаны изменения концентрации наночастиц при адсорбции из стандартного мицеллярного раствора на неподготовленной поверхности и из раствора с оптимизированными концентрациями наночастиц и АОТ на предварительно подготовленной (увлажненной) поверхности силикагеля. В первом случае за 2 недели удается осадить менее 50% наночастиц, тогда как во втором случае всего за 6 часов можно добиться практически полного извлечения наночастиц из раствора.
Работы по модификации твердых материалов проводились с наночастицами серебра, меди и цинка. На сегодняшний день наиболее востребованными оказались материалы, модифицированные наночастицами серебра. Нами получены различные ткани и изделия из тканей, порошки оксидов, образцы металлов, активированный уголь, силикагель, полимерные мембраны и другие материалы с различными плотностями покрытия наночастицами. Примеры таких материалов показаны на рис.27 и 28. Нанесение наночастиц серебра приводит к появлению характерной красно-коричневой или желтой окраски, интенсивность которой зависит от плотности покрытия. Лабораторные исследования позволили установить высокую антимикробную активность таких материалов; некоторые примеры результатов испытаний приведены в следующем разделе.


Рис.27. Фото образцов ткани (хлопок) с нанесенными наночастицами серебра.
Рис.28. Фото образцов силикагеля с нанесенными наночастицами серебра. Плотность покрытия увеличивается слева направо.
Помимо антимикробных свойств, наночастицы серебра могут проявлять также каталитическую активность. Данные по каталитической активности наночастиц серебра, меди и других металлов приведены в разделе 8.
7. Биологические эффекты наночастиц
Известно, что наночастицы металлов, прежде всего серебра, являются популярным объектом перспективных прикладных разработок в различных областях химии, техники и медицины и в то же время, уже находят применение в практике – в производстве различных товаров (косметики, одежды, бытовой техники, игрушек и др.). Поэтому в исследованиях биологического действия наночастиц металлов на организмы растений, животных и человека весьма актуальным становится определение степени токсичности наночастиц как в виде растворов, так и в составе различных материалов. Помимо данных, необходимых для определения стандартов, обеспечивающих безопасность использования наночастиц и модифицированных ими материалов, определение токсичности может дать полезные сведения как о механизмах действия наночастиц на живые организмы, лежащих в основе их лечебных и патологических эффектов, так и для разработки различных вариантов их применения в биологии, биотехнологии и медицине.
В исследованиях, проводившихся нами в этом направлении с наночастицами серебра, получены данные, отражающие их антимикробные свойства и токсические эффекты по отношению к другим биологическим объектам разных уровней организации.
7.1. Антимикробные свойства наночастиц серебра
Испытания антимикробной активности наночастиц серебра проводились в ряде компетентных учреждений – в Институте им. Гамалеи РАМН, в Институте им.А.Н. Сысина РАМН, в Институте вирусологии им. Д.И.Ивановского РАМН, в НИИ генетики и селекции промышленных микроорганизмов Государственного научного центра (ГНЦ), в Московском городском центре дезинфекции (МГЦД). Для экспериментов использовались как растворы наночастиц, так и модифицированные наночастицами материалы.
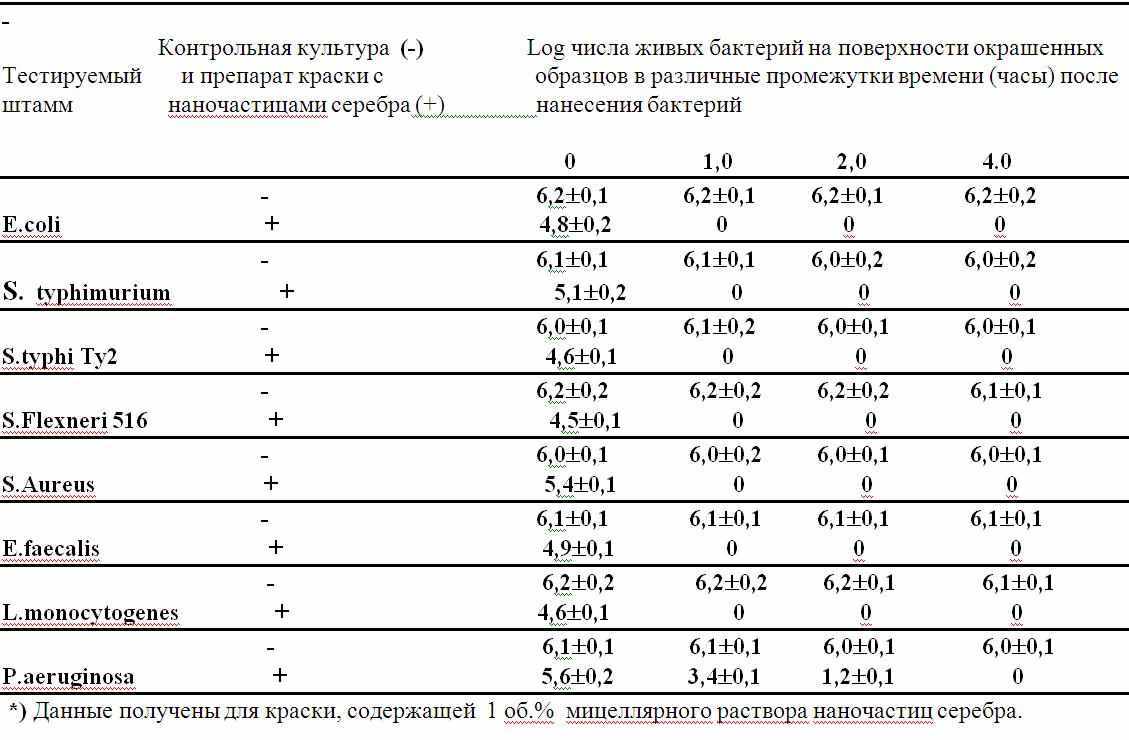
Мицеллярные растворы наночастиц вводили в качестве малых добавок к лакокрасочным материалам (ЛКМ) разного состава на основе органических растворителей. Полученные модифицированные краски наносили на образцы дерева или других материалов; после высыхания на их поверхность наносили взвеси бактерий и через разные промежутки времени делали смывы, в которых определяли число жизнеспособных бактерий. Было показано, что ЛКМ с наночастицами серебра обладают выраженным бактерицидным действием по отношению к ряду патогенных бактерий, распространенных в бытовых условиях, тогда как контрольные краски без наночастиц такого эффекта не обнаруживают. Пример результатов испытаний в Институте им. Гамалеи приведен в таблице 2. Аналогичный результат был получен в натурных испытаниях, проводившихся в камерах СИЗО «Матросская Тишина». Было показано также, что введение наночастиц в краску возможно путем нанесения их на порошковые материалы, входящие в состав ЛКМ, например, на оксид алюминия.
Таблица 2. Динамика бактерицидного действия наночастиц серебра, внесенных в краску, на штаммы бактерий: E.coli ATCC 25922, Salmonella typhimurium TMLR 66, Salmonella typhi Ty 2, Shigella flexneri 516, Staphilococcus aureus Wood-46, Enterococcus faecalis CG 110, Listeria monocyntogenes EGD, Pseudomonas aeruginosa 508. *)
Водные растворы наночастиц испытывали как в виде добавок к ЛКМ на водной основе, так и путем введения в водные растворы, содержащие взвеси штаммов болезнетворных бактерий в разных концентрациях. В последнем случае эффект наночастиц оценивался путем отбора проб через разные промежутки времени и сравнения числа КОЕ с таковым для контрольных растворов с бактериями без наночастиц. Во всех случаях было обнаружено, что растворы наночастиц обладают значительной антибактериальной или антивирусной активностью.
В качестве примера на рис.29 приведены данные, полученные в НИИ генетики ГНЦ на бактериях E.coli в водной среде. Видно, что при значительной начальной концентрации бактерий (3* 108 кл/мл), при небольшом времени экспозиции обеспечивается высокий уровень инактивации (90-100%) в широком диапазоне разведений исходного водного раствора наночастиц (до 75 раз).
Р
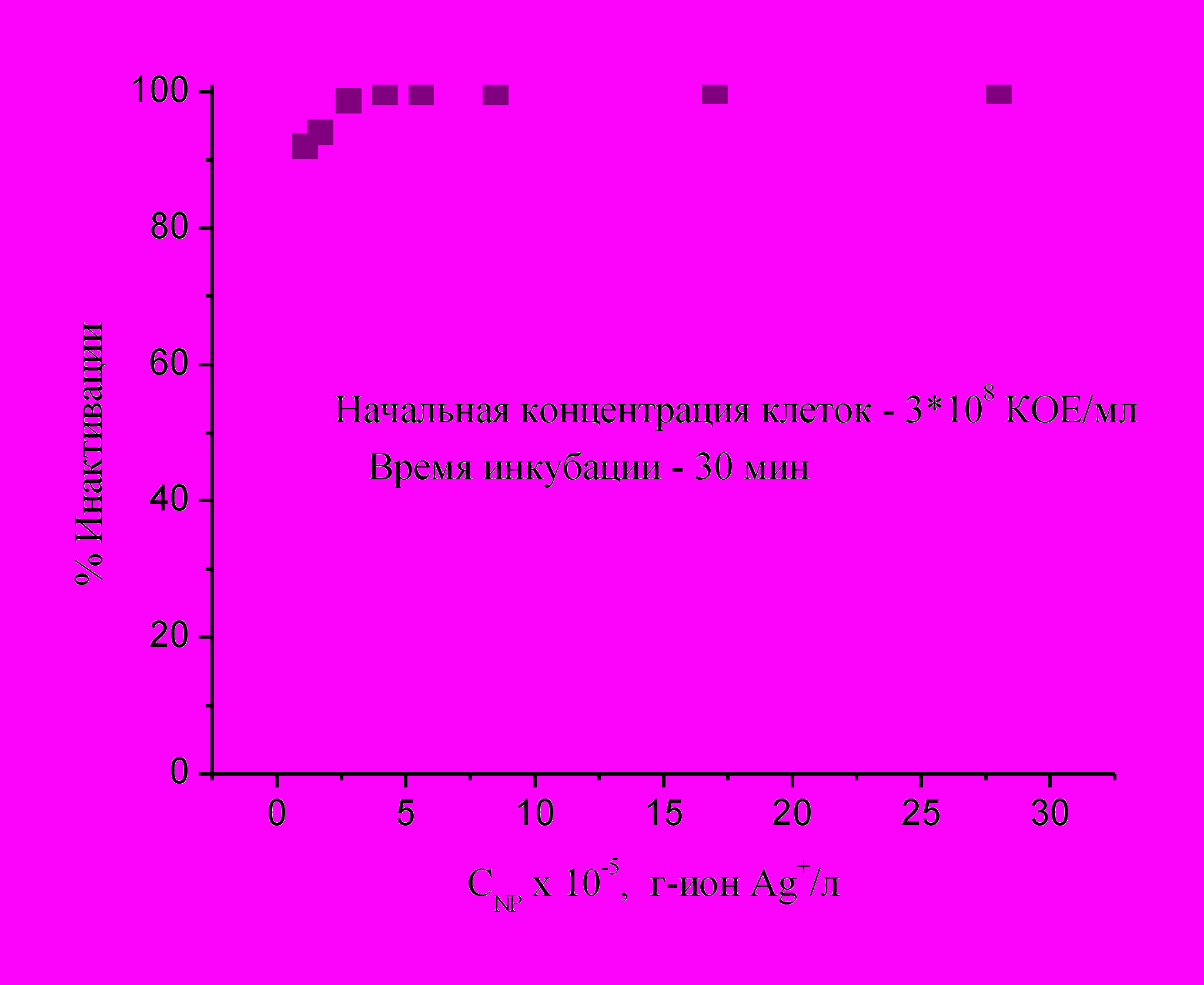 ис.29. Бактерицидное действие водной дисперсии наночастиц серебра. Зависимость уровня инактивации бактерий E.coli от концентрации наночастиц серебра в водной среде. Данные НИИ генетики ГНЦ.
ис.29. Бактерицидное действие водной дисперсии наночастиц серебра. Зависимость уровня инактивации бактерий E.coli от концентрации наночастиц серебра в водной среде. Данные НИИ генетики ГНЦ.В подобных же экспериментах в Институте им. Сысина действие наночастиц на бактерии E.coli сравнивалось с действием ионов Ag+ (вводившихся в виде нитрата серебра) в соответствующих концентрациях. Было показано, что динамика инактивации бактерий более интенсивна под действием наночастиц, чем ионов серебра; такой же результат был получен в опытах на колифагах MS-2 (вирусах бактерий). Высокий уровень бактерицидной активности наночастиц при введении в водную среду был продемонстрирован также в МГЦД на E.coli и S. Aureus. Для двух последних видов была определена нижняя граница концентрации наночастиц в водной среде (3-5 мкг/мл), при которой достигается 100% гибель бактерий. Упомянутые выше и другие данные испытаний водных растворов наночастиц Ag позволяют заключить, что такие растворы обладают сильно выраженным антимикробным действием и могут рассматриваться как основа для создания дезинфицирующих средств нового типа, более эффективных и более безопасных для человека, чем широко используемые дезинфектанты на основе хлора и его производных или четвертичных аммониевых соединений.
Твердые материалы и полимерные пленки с наночастицами серебра. Испытания на антибактериальную активность проводились на тканях, активированном угле, металлических пластинах, полиамидных мембранах и полимерных пленках на основе производного хитина, содержащих наночастицы Ag .
Ткани (шерсть, хлопок, лен и др.) вносили в водную среду с бактериями E.coli или помещали в чашки Петри на поверхность питательной среды с этими же бактериями. Антимикробное действие ткани оценивали по степени угнетения роста бактерий через разное время инкубации по сравнению с контрольными образцами той же ткани без наночастиц. Было показано, что в обоих случаях ткани с наночастицами Ag оказывают сильное угнетающее действие на рост бактерий (данные НИИ генетики ГНЦ). Были определены также условия стирки таких тканей, при которых практически полностью сохраняется первоначальная плотность покрытия наночастицами. Дальнейшая работа в этом направлении может позволить получать ткани и изделия из них для применения в медицине (например, для пошива халатов или специальной одежды с биоцидными свойствами) или для широкого потребления при изготовлении товаров, для которых могут быть востребованы биоцидные свойства.
Активированный уголь с нанесенными наночастицами серебра испытывали в Институте им. Сысина на колонках, через которые в течение недели непрерывно пропускали водопроводную воду с внесенными в нее бактериями E.coli или колифагами (MS-2) до концентраций, заметно превышающих предельно допустимые нормы. На выходе отбирали пробы воды, высевали на питательную среду и определяли величины КОЕ. Параллельно такую же работу проводили с углем без наночастиц. Было найдено, что для угля с наночастицами имеет место значительное снижение числа жизнеспособных микроорганизмов по сравнению с контролем, причем снижение было стабильным в течение всего времени эксперимента. Это означает, что наночастицы не вымываются с такого угля током воды, в отличие от углей, пропитанных солями серебра, для которых было обнаружено быстрое вымывание ионов серебра.
Металлические пластины с нанесенными наночастицами Ag испытывали в Институте им. Гамалеи на антимикробную активность против штамма Legionella pneumophila Philadelphia. Это бактерия, вызывающая легионеллез - серьезное заболевание, часто возникающее в результате вдыхания кондиционированного воздуха. Пластины были изготовлены из нержавеющей стали, поскольку из этого материала изготавливают емкости для чистой воды, которые используют в кондиционерах, и в которых преимущественно и накапливается большая концентрация этих бактерий. Было установлено, что на поверхности пластин с наночастицами уже через час инкубации наступает полная гибель бактерий, тогда как в контроле их исходная концентрация (107 кл/мл) не уменьшается и через сутки. Таким образом, можно полагать, что обработка таких емкостей в кондиционерах позволит существенно уменьшить риск заболеваний легионеллезом.
Полиамидные мембраны с наночастицами Ag были получены нами путем нанесения из водного раствора. Работа проводилась с образцами мембран, предоставленных предприятием «Технофильтр» (г. Владимир) и используемых в фильтрующих устройствах для очистки воды. Антимикробная активность мембран оценивалась в ОАО НИИ «Медполимер» по числу колоний и типов микроорганизмов, выросших на мембране через разное время после фильтрации водопроводной воды. Пример результатов испытаний мембран, модифицированных наночастицами Ag, приведен в таблице 3. Для сравнения показаны данные, полученные в тех же условиях на стандартных полимерных мембранах фирмы «Миллипор».
Таблица 3. Результаты микробиологических испытаний полиамидных мембран (ММПА+ - 0,2), покрытых наночастицами серебра. Данные ОАО «НИИ медполимер» (г. Москва)
| № обр-ца | Наименование образца | Рост бактерий во времени | Рост под испытуемой мембраной | ||||
| 1 сут | 2-4 сут | 4-6 сут | 7-8 сут | 9-10 сут | |||
| 1 | Серебросодержащие с плотностью покрытия 0,16 мг/г | нет | нет | нет | 3 | новых нет | чисто |
| 2 | Серебросодержащие с плотностью покрытия 0,33 мг/г | нет | нет | нет | 7 | новых нет | чисто |
| 3 | Серебросодержащие с плотностью покрытия 2,22 мг/г | нет | нет | нет | 2 | новых нет | чисто |
| 4 | GS (Миллипор 0,22 мкм) | 34 | 40 | 49 | Рост продолжается | Рост прекратился | 2 |
Как видно из таблицы, на мембранах, модифицированных наночастицами серебра, при разных плотностях покрытия наночастицами в течение первых шести суток после фильтрации наблюдается отсутствие роста колоний. Такой результат свидетельствует о существенно более высокой антимикробной активности полученных нами полимерных мембран по сравнению с мембранами фирмы «Миллипор». Предполагается продолжить работы в этом направлении с целью создания новых фильтрующих устройств для получения обеззараженной воды.
Полимерные пленки с наночастицами Ag были получены путем введения малых добавок водного раствора наночастиц в водный раствор биодеградируемого полимера (производного хитина). Испытания таких пленок на антимикробную активность проводились в НИИ им. Гамалеи на бактериях Staphillococcus aureus и Salmonella typhimurium. Результат показан в таблице 4.
Таблица 4. Динамика взаимодействия штаммов сальмонеллы и стафилококка, взятых в различных концентрациях, с пленками, содержащими наночастицы серебра или без них.
| Тестируемый штамм, доза | Обозначение пленок с различным содержанием серебра | Lg числа живых бактерий в исследуемых пленках в промежутки времени (ч) | |||
| 1 | 3,0 | 6,0 | 24,0 | ||
| Salmonella typhimurium TMLR66 106 KOE | Исходная культура | 6,1 | 6,1 | 6,1 | 6,1 |
| ХИТ-10.А, 0 % Ag | 6,1 | 5,7 | 5,2 | 2,8 | |
| ХИТ-10.В, 0.03 % Ag | 5,0 | 4,0 | 2,7 | 0 | |
| ХИТ-10.С, 0.06 % Ag | 0 | 0 | 0 | 0 | |
| Staphilococcus aureus Wood 46 106 КОЕ | Исходная культура | 6,0 | 6,0 | 6,0 | 6,0 |
| ХИТ-10.А, 0 % Ag | 6,0 | 5,8 | 4,9 | 3,2 | |
| ХИТ-10.В, 0.03 % Ag | 5,0 | 4,1 | 3,0 | 0 | |
| ХИТ-10.С, 0.06 % Ag | 0 | 0 | 0 | 0 | |
| Salmonella typhimurium TMLR66 104 KOE | Исходная культура | 4.0 | 4.0 | 4.0 | 4.0 |
| ХИТ-10.А, 0 % Ag | 4,0 | 3,7 | 3,4 | 1,5 | |
| ХИТ-10.В, 0.03 % Ag | 2,8 | 1,8 | 0 | 0 | |
| ХИТ-10.С, 0.06 % Ag | 0 | 0 | 0 | 0 | |
| Staphilococcus aureus Wood 46 104 КОЕ | Исходная культура | 4,0 | 4,0 | 4,0 | 4,0 |
| ХИТ-10.А, 0 % Ag | 4,0 | 3,8 | 3,3 | 1,6 | |
| ХИТ-10.В, 0.03 % Ag | 2,9 | 1,9 | 0 | 0 | |
| ХИТ-10.С, 0.06 % Ag | 0 | 0 | 0 | 0 | |
Видно, что пленки, содержащие малые добавки наночастиц серебра, обладают значительной антимикробной активностью в отношении исследуемых бактерий, при больших концентрациях бактериальных клеток во взвеси, контактирующей с пленкой (104 и 106 КОЕ/мл), причем эта активность существенно выше, чем отмеченная для контрольных пленок из того же полимера без наночастиц. Это позволяет предположить, что созданный нами полимерный материал может найти применение в медицине (например, при лечении повреждений кожи).
- 7.2 Токсические эффекты наночастиц серебра
Изучение влияния наночастиц металлов на функции живых систем разных уровней организации, в том числе токсических эффектов, представляет сегодня новое научное направление, в котором имеются как достижения, так и проблемы, связанные прежде всего с особенностями наночастиц как объекта исследования и вытекающими из них трудностями методического характера. Одним из важнейших условий успешного решения поставленных здесь задач является наличие металлических наночастиц с воспроизводимыми характеристиками, стабильных в водном растворе, содержащем минимальные концентрации других биологически активных компонентов, что позволяет проводить эксперименты с корректно поставленными контрольными опытами и минимально возможными побочными эффектами. Метод биохимического синтеза имеет в этом отношении хорошие перспективы, поскольку он обеспечивает возможность получения стабильных водных растворов наночастиц заданного среднего размера с узким распределением и с известной, достаточно малой концентрацией стабилизатора (АОТ), биологический эффект которого можно независимо определять в контрольных опытах.
К настоящему времени получены результаты исследований на нескольких биологических объектах – плазмодии низшего гриба Physarum polycephalum, одноклеточных водорослях Chlorella vulgaris, семенах растений, организме млекопитающих и культурированных клетках человека. Действие водных растворов наночастиц сравнивалось с действием растворов АОТ в тех же концентрациях, в которых этот ПАВ присутствует в растворе наночастиц, а также с действием ионов Ag+ , вводившихся в виде водных растворов нитрата серебра. Таким образом, оказывалось возможным (1) выделить биологический эффект наночастиц серебра в совокупном действии наночастиц и АОТ и (2) выяснить, является ли эффект наночастиц следствием действия ионов серебра, что важно для выяснения механизма действия наночастиц. Ниже приведено несколько примеров полученных результатов.
Плазмодий слизевого гриба Physarum Polycephalum
Исследования проводились совместно с Институтом теоретической и экспериментальной биофизики РАН. Плазмодий Physarum polycephalum является удобным тест-объектом для изучения явлений хемотаксиса – двигательной реакции клеток на неблагоприятные химические воздействия из окружающей среды. Он представляет собой многоядерную протоплазму, окруженную общей мембраной и обладающую способностью к неограниченному росту и амебоидному движению. В экспериментах определялось действие наночастиц на двигательную активность и рост плазмодия. Сравнивалось угнетающее действие (характеризующее степень токсичности) водных растворов наночастиц Ag, АОТ и ионов Ag+; эксперименты проводились в водных растворах (уровень двигательной активности тяжа плазмодия), а также на чашках Петри и на пластинках с питательной средой (рост плазмодия).
В
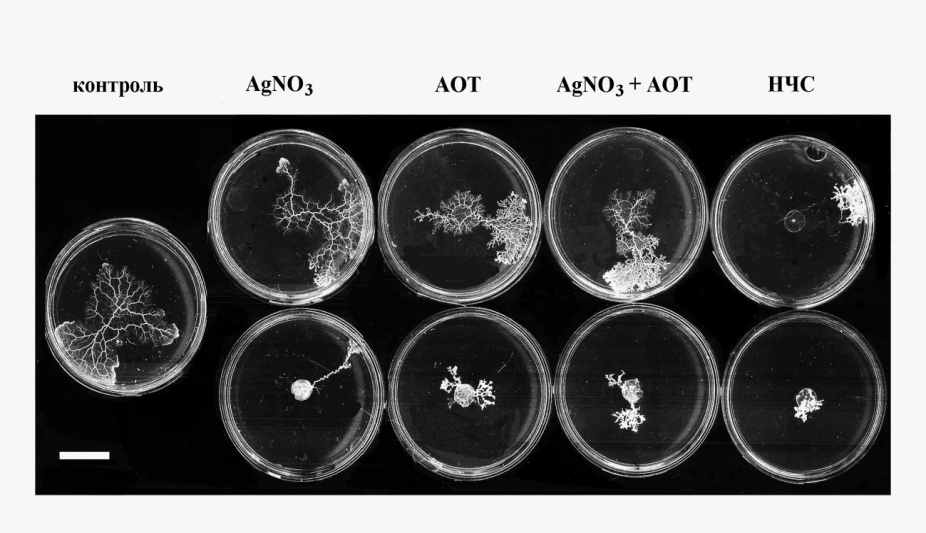 нескольких сериях экспериментов с наночастицами диаметром 8-10 (± 4-6) нм на чашках Петри было показано, что, во-первых, наночастицы Ag в концентрациях ≥ 10-4 M (10.8 мкг/мл) вызывают быструю гибель плазмодия и, во-вторых, при концентрациях, не вызывающих гибели плазмодия (≤ 10-5 M или 1.08 мкг/мл) наночастицы более токсичны, чем AOT, ионы Ag+ или смесь AOT + Ag+ в концентрациях, равных тем, которые вводятся с водным раствором наночастиц. Пример показан на рис.30.
нескольких сериях экспериментов с наночастицами диаметром 8-10 (± 4-6) нм на чашках Петри было показано, что, во-первых, наночастицы Ag в концентрациях ≥ 10-4 M (10.8 мкг/мл) вызывают быструю гибель плазмодия и, во-вторых, при концентрациях, не вызывающих гибели плазмодия (≤ 10-5 M или 1.08 мкг/мл) наночастицы более токсичны, чем AOT, ионы Ag+ или смесь AOT + Ag+ в концентрациях, равных тем, которые вводятся с водным раствором наночастиц. Пример показан на рис.30.Рис. 30. Распространение плазмодия на агаровой подложке в контроле и в присутствии НЧС, AgNO3 и АОТ. Верхний ряд: AgNO3 – 10-5 М, АОТ – 2.5 * 10-3 %, НЧС – 10-5 М. Нижний ряд: AgNO3 – 10-4 М, АОТ – 2.5 * 10-2 %, НЧС – 10-4 М. Время – 6 час после помещения на подложку стандартных образцов плазмодия. Масштабный отрезок – 1 см.
Видно, что при концентрации наночастиц C(НЧС) = 10-4 M во всех случаях рост плазмодия не происходит, а при C(НЧС) = 10-5 M наблюдается заметное различие в росте плазмодия на среде, содержащей наночастицы, и на трех средах, содержащих нитрат серебра, АОТ и их смесь в соответствующих концентрациях. Ясно также, что «чистый» контроль без всяких добавок неотличим от варианта с AgNO3, и лишь незначительно отличается от двух других случаев, содержащих АОТ. Этот результат подтверждает вывод, сделанный нами ранее в исследованиях на бактериях кишечной палочки, о большей эффективности наночастиц по сравнению с ионами Ag+ в тех же концентрациях. Такой же вывод был сделан другими авторами в исследованиях на бактериях, животных клетках и эмбрионах рыб.
Данные, полученные в исследованиях уровня двигательной активности плазмодия в водном растворе и роста на питательной среде позволили построить следующий ряд сравнительной эффективности: AgNO3 << AOT< AgNO3 +AOT << наночастицы Ag. Таким образом, исследование хемотаксиса на плазмодии показало, что в случае наночастиц токсическое действие серебра многократно усилено, причем эффект усиления не сводится к дестабилизирующему действию на клеточную мембрану поверхностно-активного вещества (АОТ), образующего оболочку мицеллы. Кроме того, более высокая эффективность наночастиц по сравнению с ионами серебра позволяет предположить, что биологическое действие наночастиц не сводится к действию ионов серебра, но может включать иной механизм, в котором важную роль играют сами наночастицы металла.
Проводились также эксперименты с водными растворами наночастиц разного размера с узким распределением: 5.5±2.0 нм и 9.2±2.7 нм. Было обнаружено, что, при одинаковой общей концентрации наночастиц серебра в питательной среде, отрицательная реакция плазмодия более сильно выражена для наночастиц меньшего размера. Результат иллюстрируется рис.31. Зародыш плазмодия помещали на границе между двумя
полосками агара (разделенными промежутком 1 мм), содержащими наночастицы разного размера.
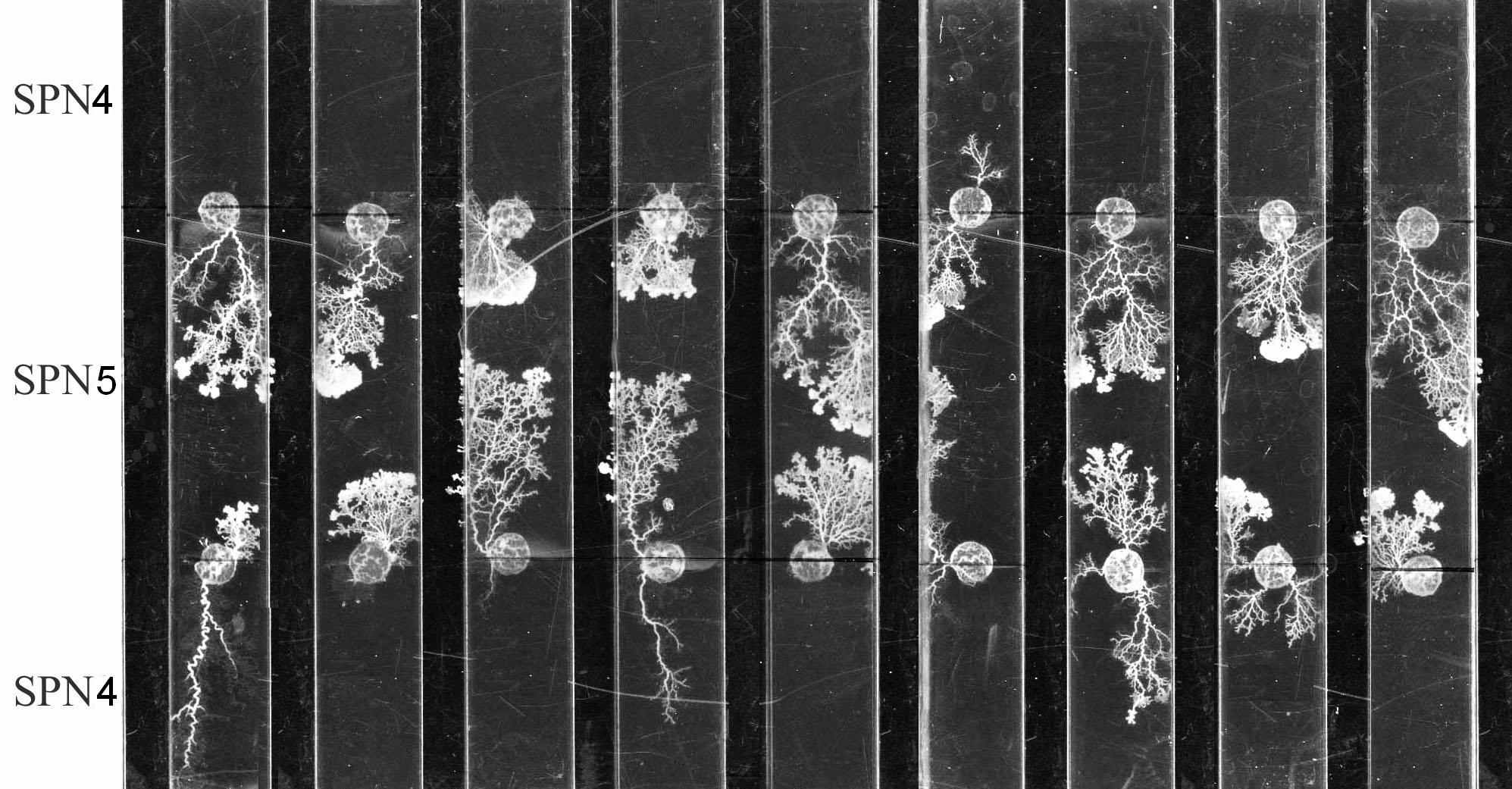
Рис.31. Реакция плазмодия на присутствие наночастиц серебра разного размера
Видно, что рост плазмодия происходит почти исключительно в сторону среды с наночастицами большего размера (SNP5), то есть наблюдается явное «избегание» наночастиц меньшего размера (SNP4). Это подтверждает имеющиеся в литературе данные о большей токсичности наночастиц серебра малого размера. Возможно, влияние размера связано с различием в числе наночастиц на единицу объема среды. В нашем случае это число различается примерно на порядок: SNP4 - 1.48 x 1014; SNP5- 3.16 x 1013 (частиц/мл).
В целом полученные здесь результаты позволяют заключить, что хемотаксис является чрезвычайно чувствительным тестом в исследованиях токсичности наночастиц. Данные, полученные на плазмодии Physarum polycephalum, позволяют рекомендовать подобные тесты для выявления следовых количеств вредных веществ на любых про- или эукариотических клетках, способных к хемотаксису.
Одноклеточная водоросль Chlorella vulgaris
Токсичность наночастиц Ag исследовалась на живых клетках культуры микроводоросли методом микроэлектрофореза на приборном комплексе «Цито-эксперт», в сотрудничестве с Инженерно-техническим центром (лабораторией биотестирования, г.Ижевск). Токсичность наночастиц оценивалась по изменению амплитуды колебаний клеток в переменном электрическом поле, обусловленному уменьшением их поверхностного заряда, который является показателем жизнеспособности клеток. Клетки водоросли в дистиллированной воде инкубировали с наночастицами при различных концентрациях в интервале 10-8 – 10-4 M (0.00108 – 10.8 мкгAg/мл) заданное время, затем определяли индекс токсичности T = (Ac – Acell)/Ac , где Ac and Acell – средние амплитуды колебаний, найденные для контрольной (клетки без наночастиц) и экспериментальной суспензии, соответственно. Независимо определялась токсичность ионов Ag+ и смеси Ag+ +АОТ в соответствующих концентрациях, аналогично тому, как описано выше в экспериментах с плазмодием. Результат показан на рис. 32.
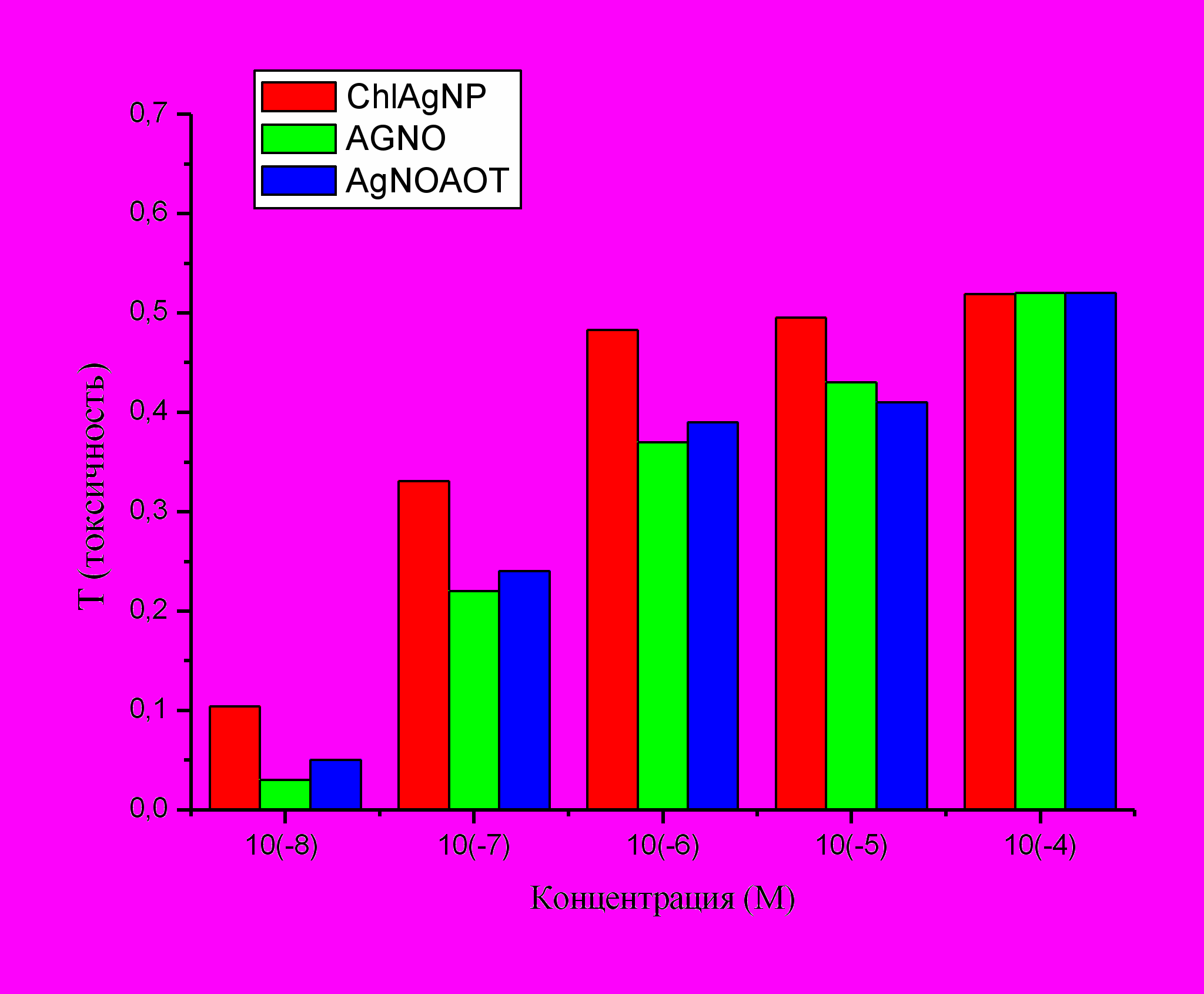
Рис.32. Токсичность наночастиц (AgNP), AgNO3 и смеси AOT + AgNO3 для клеток водоросли Chlorella vulgaris.
Токсичность наночастиц вначале возрастает с увеличением их концентрации, затем остается постоянной в интервале 0.108 мкг/мл (10-6 M) - 10.8 мкг/мл; достигнутый уровень токсичности равен примерно ½ максимального (Т=1). Почти при всех исследованных концентрациях (кроме 10-4 M) наночастицы Ag более токсичны, чем ионы Ag+ или Ag+ + AOT при тех же концентрациях, что и введенные с наночастицами, в согласии с данными, полученными на плазмодии. Таким образом, и в этом случае действие наночастиц не сводится к действию ионов серебра. Одинаковая токсичность всех трех агентов при наибольшей концентрации (10-4 М) объясняется, скорее всего, тем, что клетки уже нежизнеспособны, подобно тому, что наблюдалось при этой концентрации на плазмодии.
Семена растений
Исследовалось действие наночастиц Ag на всхожесть семян арабидопсиса ( Arabidopsis thaliana) и сои (Glycine max); данные получены в Институте общей генетики им. Н.И.Вавилова РАН. Оба растения являются известными тест-объектами для изучения влияния различных факторов на генетические характеристики растительных организмов. Сравнивалось влияние водного раствора наночастиц размером 9±6 нм и растворов АОТ в соответствующих концентрациях. Концентрация наночастиц и АОТ в исходном растворе составляла 5*10-3 М и 15*10-3 М, соответственно. Семена предварительно замачивали в дистиллированной воде в течение 24-х часов, затем заливали растворами наночастиц или АОТ и инкубировали еще 24 часа, затем отмывали дистиллятом и ставили на проращивание в стандартных условиях. Оказалось, что присутствие АОТ практически не влияло на всхожесть семян, то есть цитолитический эффект отсутствовал. В случае наночастиц снижение всхожести наблюдалось при концентрациях выше 1*10-3 М (108 мкг/мл), а при более низких концентрациях эффект отсутствовал. Результат эксперимента с семенами арабидопсиса показан на рис.32.
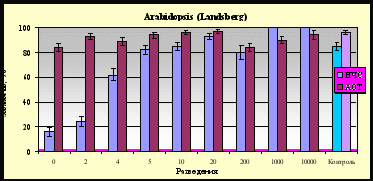 Рис. 32. Всхожесть семян Arabidopsis thaliana при действии наночастиц серебра (НЧС) и АОТ.
Рис. 32. Всхожесть семян Arabidopsis thaliana при действии наночастиц серебра (НЧС) и АОТ. Из полученных данных вытекает, что при наиболее высоких концентрациях в исследованном диапазоне водная дисперсия наночастиц серебра более токсична, чем раствор АОТ, что согласуется с рядом токсичности, найденным для плазмодия. Другое следствие состоит в том, что для исследованных семян в широком диапазоне концентраций (5*10-7 - 1*10-3 М) водный раствор наночастиц серебра не токсичен, что указывает на возможность его использования для обработки семян с целью защиты их от поражения патогенными бактериями. В отличие от результатов, полученных на бактериях E.coli, плазмодии и клетках хлореллы, для семян обнаружено сильное цитотоксическое действие ионов Ag+, причины которого пока не выяснены.
Организм млекопитающих
И
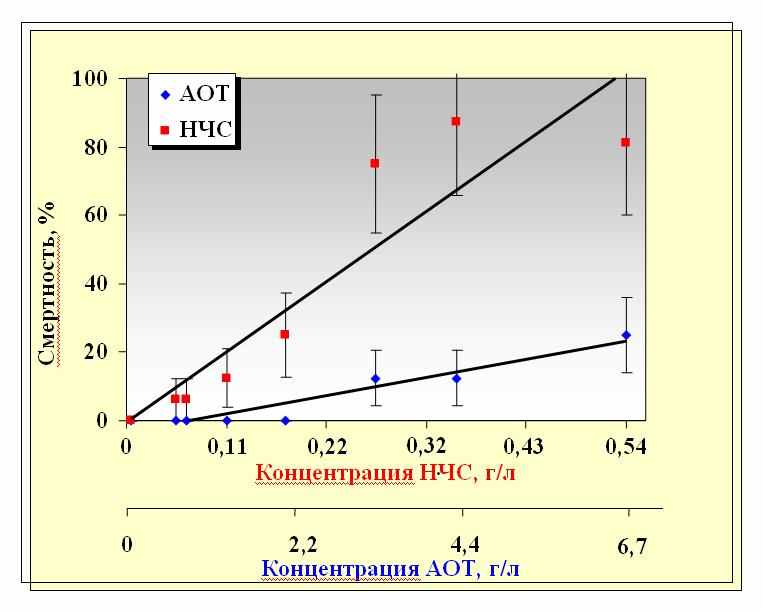 сследовалось действие водных растворов наночастиц Ag на длительность жизни мышей линии BALB в возрасте 3-4 мес. (данные Института общей генетики им. Н.И.Вавилова РАН). В задачу исследования входило:1) определение процента выживаемости мышей в зависимости от концентрации введенного раствора наночастиц серебра (НЧС) и 2) установление дозы раствора, вызывающей 50% гибели животных в течение 30 дней после введения (ЛД50/30). Работа проводилась с тем же раствором наночастиц, что и в опытах на семенах растений. Раствор наночастиц (0.2 мл) вводился однократно внутрибрюшинно в различных разведениях; минимальная концентрация наночастиц составляла 0,05*10-3 М. Действие наночастиц сравнивалось с действием растворов АОТ и нитрата серебра в эквивалентных концентрациях. Определение выживаемости проводилось по стандартной методике в течение 30-ти дней после введения растворов. Результаты показаны на рис.33.
сследовалось действие водных растворов наночастиц Ag на длительность жизни мышей линии BALB в возрасте 3-4 мес. (данные Института общей генетики им. Н.И.Вавилова РАН). В задачу исследования входило:1) определение процента выживаемости мышей в зависимости от концентрации введенного раствора наночастиц серебра (НЧС) и 2) установление дозы раствора, вызывающей 50% гибели животных в течение 30 дней после введения (ЛД50/30). Работа проводилась с тем же раствором наночастиц, что и в опытах на семенах растений. Раствор наночастиц (0.2 мл) вводился однократно внутрибрюшинно в различных разведениях; минимальная концентрация наночастиц составляла 0,05*10-3 М. Действие наночастиц сравнивалось с действием растворов АОТ и нитрата серебра в эквивалентных концентрациях. Определение выживаемости проводилось по стандартной методике в течение 30-ти дней после введения растворов. Результаты показаны на рис.33.Рис. 33. Смертность мышей при инъекции препарата НЧС и раствора АОТ в зависимости концентрации.
Из анализа полученных данных вытекает, что процент гибели был выше в группе с введением наночастиц серебра, чем при введении АОТ. На основании регрессионного анализа данных по выживаемости была определена доза раствора, вызывающая 50% гибели животных. Величина ЛД50/30 составила для наночастиц Ag (2, 75 ±0,66)10-3 М, а для АОТ – (32,6±17,1) *10-3 М. Полученные результаты указывают на достаточно сильный и зависимый от концентрации наночастиц летальный эффект при инъекции у мышей, независимо от пола животных. Существенное различие в величинах ЛД50/30 для наночастиц и АОТ свидетельствует также о меньшей токсичности ПАВ по сравнению с раствором наночастиц, в согласии с выводами, сделанными в ходе исследований плазмодия и семян растений. Введение раствора нитрата серебра не вызывало гибели мышей при всех исследованных концентрациях, что указывает на существенно меньшую токсичность ионов, чем наночастиц серебра, а также на то, что токсическое действие наночастиц не сводится к действию ионов серебра.
Культуры клеток человека
Исследовали действие водных растворов наночастиц Ag на культуры клеток опухолей человека (линии HeLa и U937). Работа проводилась в НИИОПП РАМН с целью получения сведений о механизме действия наночастиц металлов на клетки человека, а также для выяснения возможности использования наночастиц серебра в качестве лекарственного средства в терапии онкологических заболеваний. Клетки снимали с матрасов в логарифмической фазе роста стандартным образом и переносили в 96 луночные планшеты. Через сутки к клеткам добавляли водный раствор наночастиц в разных концентрациях или контрольные растворы (Ag+ , АОТ или смеси Ag+ + АОТ), инкубировали в стандартных условиях роста культур заданное время, после чего клетки отмывали и определяли цитотоксичность исследуемых агентов двумя способами – по уровню функциональной активности митохондрий (МТТ-тест) и внутриклеточных ферментов (ФДА/ПИ –тест). Определялась также возможность переноса наночастиц через клеточную мембрану путем эндоцитоза посредством блокирования активного транспорта (инкубация клеток при 4оС). Было обнаружено, что для обоих типов клеток токсичность наночастиц выше, чем соответствующих концентраций АОТ, ионов Ag+ и смеси Ag+ + АОТ, что может говорить о наличии специфической составляющей в действии наночастиц, в согласии с выводами, сделанными на других исследованных объектах.
Методом лазерной конфокальной микроскопии после инкубации с наночастицами было зафиксировано проникновение агрегатов наночастиц внутрь клетки. Возможно, что оно происходит путем эндоцитоза, поскольку блокирование активного транспорта приводит к частичному снижению цитотоксичности; однако это не исключает другие способы проникновения наночастиц.
8. Каталитические свойства наночастиц
Каталитические свойства наночастиц меди изучались на кафедре химической кинетики и катализа химического факультета МГУ. Определялась каталитическая
активность наночастиц в реакции изомеризации дихлорбутенов:
CH2Cl-CHCl-CH=CH2 (3,4-ДХБ) CH2Cl-СН2-CH=CH2Cl (1,4-ДХБ) (3)
Эта реакция является одной из промежуточных стадий получения синтетического каучука (хлоропрена). В промышленном производстве каучука в качестве катализатора для этой стадии применяется нафтенат меди, однако он имеет неудовлетворительные экономические и экологические показатели. Поскольку известно, что изомеризация дихлорбутенов катализируется не только солями, но и соответствующими металлами, представляло интерес исследовать каталитическую активность наночастиц меди, поскольку можно было предположить, что существенное увеличение удельной поверхности при переходе к наночастицам может привести к заметному повышению эффективности медного катализатора по сравнению с таковой, определяемой для кристаллической меди. Исследовались наночастицы меди как в мицеллярном растворе, так и на твердых носителях (оксиде алюминия и силикагеле). Результаты одной из серий экспериментов приведены в таблице 5.
Таблица 5. Активность металлсодержащих катализаторов в изомеризации дихлорбутенов (промежуточная стадия синтеза хлоропрена).
Катализатор to C Активность,
моль прод./моль мет. час
Наночастицы Cu (МР)
На воздухе 100 230
Без кислорода 110 340
Наночастицы Cu/SiO2 (0.03%)
На воздухе 100 760
Без кислорода 100 1500
Наночастицы Cu/Al2O3 (0.1%)
На воздухе 100 700
