Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических методов 03. 02. 03 микробиология 03. 01. 06 биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат диссертации |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Общая биология и микробиология, 206.6kb.
- Биосенсорные материалы на основе полимерных пленок с иммобилизованными производными, 232.46kb.
- Разработка и внедрение технологии промышленного производства и системы управления качеством, 660.17kb.
- Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01., 843.88kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
- Грант нш-197. 2008. 4 Роль организации и экспрессии генетического материала в наследственной, 23.51kb.
- Обзор методов идентификации людей, 100.6kb.
- Разработка лабораторных экспресс-методов и технологии производства иммунодиагностических, 571.84kb.
- Рабочая программа дисциплины «Адаптивная изменчивость организмов» Код дисциплины, 90.26kb.
На правах рукописи
Мастиленко Андрей Владимирович
РАЗРАБОТКА ИДЕНТИФИКАЦИИ BORDETELLA
BRONCHISEPTICA НА ОСНОВЕ ИММУНОХИМИЧЕСКИХ И
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕТОДОВ
03.02.03 – микробиология
03.01.06 – биотехнология
(в том числе бионанотехнологии)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Саратов – 2011
Работа выполнена в Федеральном государственном
образовательном учреждении высшего профессионального образования
«Ульяновская государственная сельскохозяйственная академия»
Научные руководители: доктор биологических наук, профессор
Васильев Дмитрий Аркадьевич
кандидат ветеринарных наук, доцент
Васильева Юлия Борисовна
Официальные оппоненты: доктор биологических наук, профессор
Тихомирова Елена Ивановна
доктор биологических наук
Заднова Светлана Петровна
Ведущая организация: Федеральное государственное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», г. Москва.
Защита диссертации состоится «16» июня 2011 года в 14 часов на заседании диссертационного совета Д 220.061.04 при ФГОУ ВПО «Саратовский государственный аграрный университет имени Н.И. Вавилова» по адресу: 410005, Саратов, ул. Соколовая, 335, диссертационный зал.
С диссертацией можно ознакомиться в научной библиотеке ФГОУ ВПО «Саратовский ГАУ имени Н.И. Вавилова».
Автореферат диссертации разослан «12» мая 2011 г. и размещен на сайте: www.sgau.ru
Отзывы на автореферат направлять по адресу: 410012, г. Саратов, Театральная пл., 1, ученому секретарю диссертационного совета.
Ученый секретарь диссертационного совета
доктор биологических наук, профессор Л.В. Карпунина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В настоящее время бордетеллез является широко распространенным заболеванием животных во многих странах мира (Baker, 2003). Однако в Российской Федерации до настоящего времени исследования в этой области не проводились.
Bordetella bronchiseptica является возбудителем хронических и, довольно часто, асимптоматических инфекций респираторного тракта (трахеобронхита) животных. Возбудитель поражает животных всех возрастных групп, но наиболее тяжелые последствия развиваются у молодых особей. Тяжесть заболевания связана с присутствием у B. bronchiseptica факторов патогенности: адгезинов (филаментозного гемагглютинина, пертактина и фимбрий) и токсинов (дермонекротического, аденилатциклазы-гемолизина и липополисахарида) (Woolfrey et al., 1991; Gueirard et al., 1995).
Инфекционный агент долго сохраняется в окружающей среде, поэтому чаще всего его обнаруживают в местах скученности животных (питомники, фермы, частные хозяйства) (Bemis, 1977). Возможность трансмиссии возбудителя из природных эпизоотических очагов к животным, содержащимся в фермерских хозяйствах, и, как следствие, значительных экономических потерь в малом и среднем сельскохозяйственном бизнесе вследствие гибели или снижения продуктивности животных, обусловливают необходимость выявления B. bronchiseptica и проведение противоэпидемических мероприятий. В связи с этим актуальным является разработка методов индикации и идентификации B. bronchiseptica.
Цель работы - разработка методических приемов индикации и идентификации B. bronchiseptica, основанных на иммунохимических и молекулярно-генетических методах.
Задачи работы:
- Провести сравнительный анализ иммунохимических методов изучения антигенного состава B. bronchiseptica с целью идентификации.
- Адаптировать метод полимеразной цепной реакции для молекулярно-генетической идентификации B. bronchiseptica.
- Подобрать праймеры для выявления специфических участков ДНК B. bronchiseptica, а также идентификации участка генома представителей рода Bordetella.
- Определить специфичность полимеразной цепной реакции при индикации B. bronchiseptica.
- Разработать схему мультиплексной ПЦР для одновременного обнаружения нескольких специфичных участков ДНК B. bronchiseptica.
- Определить чувствительность ПЦР при выявлении возбудителя бордетеллеза.
- Разработать схему проведения ПЦР с регистрацией в режиме «реального времени» для количественной оценки ДНК B. bronchiseptica.
Научная новизна. Впервые в Российской Федерации проведен сравнительный анализ антигенного состава B. bronchiseptica с гипериммунными сыворотками в реакциях радиальной иммунодиффузии по O. Ouchterlony (1948), встречного электрофореза по G. Bedarida et al. (1969) и иммуноэлектрофореза по P. Grabar и C. Williams, описанному Х. Фримель (1979). Показана высокая чувствительность метода иммуноэлектрофореза для изучения антигенной структуры B. bronchiseptica при использовании иммунной сыворотки с низким титром. На примере использования разработанных систем праймеров к участкам генов BfrA и BfrZ доказана высокая специфичность и чувствительность полимеразной цепной реакции при идентификации B. bronchiseptica. Подобраны и оптимизированы соотношения систем праймеров для одновременного выявления 3 специфичных участков генома B. bronchiseptica в мультиплексном формате ПЦР. Предложена схема проведения ПЦР с регистрацией в режиме «реального времени» для количественной оценки содержания ДНК B. bronchiseptica в биоматериале.
Практическая значимость работы. Метод иммуноэлектрофореза при проведении антигенной идентификации B. bronchiseptica позволяет использовать его для контроля состава и специфичности антигенов при разработке и производстве биопрепаратов, а подобранные и оптимизированные системы праймеров – в производстве ПЦР-систем, основанных на амплификации специфических участков генома B. bronchiseptica для диагностики бордетеллеза.
Разработаны «Методические рекомендации по выявлению Bordetella bronchiseptica с помощью полимеразной цепной реакции», утвержденные ректором УГСХА от 10 ноября 2010 г. и подтвержденные актом комиссионных испытаний, проведенных на базе ООО «Медицинский Центр «Академия» (г. Ульяновск). Материалы диссертационной работы используются в учебном процессе при чтении лекций по микробиологии и биотехнологии, а также при проведении практических занятий для студентов и аспирантов в Ульяновской государственной сельскохозяйственной академии.
Основные положения, выносимые на защиту:
- Иммуноэлектрофорез по методу P. Grabar и C. Williams, описанному Х. Фримель (1979), позволяет идентифицировать 8 антигенов B. bronchiseptica, 5 из которых являются видоспецифичными.
- При использовании праймеров к участкам генов BfrA и BfrZ может быть проведена индикация B. bronchiseptica в биологическом материале.
- Чувствительность метода ПЦР с праймерными системами к участкам генов BfrA, BfrZ и Cytochrom–C–oxidase генома B. bronchiseptica составляет 5,5х103, а участка гена 16S rRNA – 5,5х102 бактериальных клеток/мл.
- Мультиплексный формат ПЦР с системами праймеров к участкам BfrA, BfrZ и Cytochrom–C–oxidase дает возможность одновременно идентифицировать 3 гена: BfrA и BfrZ – специфичных для B. bronchiseptica, а также Cytochrom–C–oxidase – специфичного для B. bronchiseptica, B. pertussis и B. parapertussis.
- Применение метода ПЦР с регистрацией в режиме «реального времени» с интеркалирующим красителем SYBR Green I позволяет проводить количественную оценку содержания ДНК B. bronchiseptica в биологическом материале.
Работа выполнена на кафедре микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы и в Научно-исследовательском центре микробиологии и биотехнологии ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия».
Апробация работы
Материалы диссертации были представлены на: Всероссийских научно-практических конференциях Ульяновской ГСХА (Ульяновск, 2008; 2009), Конференции молодых ученых «Актуальные проблемы инфекционной патологии ветеринарной медицины» (Покров, 2009), VII Всероссийской научно-практической конференции с международным участием «Молекулярная диагностика – 2010» (Москва, 2010).
Публикации
По теме диссертации опубликовано 8 работ, из них 2 статьи в журналах, рекомендованных ВАК РФ.
Структура и объем диссертации
Диссертация состоит из введения, двух глав: обзора литературы и собственных исследований, включающей объект, материалы и методы исследований, результаты исследований и их обсуждение, а также заключения, выводов и списка использованных литературных источников. Работа изложена на 144 страницах, содержит 15 таблиц и 28 рисунков. Список использованных литературных источников включает 207 наименований, в том числе 190 зарубежный.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Объект, материалы и методы исследований
Штаммы: в работе были использованы 5 референс-штаммов B. bronchiseptica из коллекции музея Научно-исследовательского инновационного центра микробиологии и биотехнологии Ульяновской государственной сельскохозяйственной академии (№ 1, 7, 214, 22067, 8344) и штамм B. parapertussis (№ 119), которые в соответствии с паспортными данными, обладали типичными для бактерий этих видов морфологическими, культуральными и биохимическими свойствами. Также были использованы 37 штаммов B. bronchiseptica, выделенные из клинических образцов биоматериала от собак и кошек в ветеринарных клиниках Ульяновской области.
Для определения специфичности иммунохимических методов и ПЦР использовали 13 бактериальных культур: P. aeruginosa, P. putida, A. hydrophila, E. coli, Y. enterocolytica, Y. pseudotuberculosis, O. rhinotracheale, S. pyogenes, S. epidermidis, L. acidophilus, S. aureus, B. subtilis из музея Научно-исследовательского инновационного центра микробиологии и биотехнологии Ульяновской государственной сельскохозяйственной академии. Все штаммы обладали типичными биологическими свойствами.
Питательные среды и реактивы: для проведения иммунохимических исследований были использованы: агароза «Biotechnology Grade AM-0710-0,1» (Helicon, г. Москва), буфер трис-борат для электрофореза (ДНК-Технология, г. Москва), краситель Amido Black 10B (Diffco), 10% лимонная кислота, стандартный раствор альбумина с молекулярной массой 65 кДа (Serva Feinbiochemica, Германия). Для проведения иммунизации кроликов был использован полный адъювант Фрейнда.
При выполнении этапа выделения бактериальной ДНК были использованы наборы: «Проба-ГС» (сорбентная методика очистки ДНК), «Проба-НК» (фенольно-хлороформная преципитирующая методика выдеделения ДНК), «Проба-Рапид» (термический лизис с использованием бычьего альбумина для удаления ионов) (НПФ «ДНК-Технология», г. Москва), «ДНК-экспресс» (термический лизис с использованием бычьего альбумина для удаления ионов), «Выделение ДНК из биопроб» (сорбентная методика очистки ДНК) (НПФ «Литех», г. Москва), «Пробоподготовка универсальная» (сорбентаная методика) (ООО «ИзоГен», г. Москва), «ДНК-сорб-А-М – вариант 100» (сорбентная методика) («ИнтеЛабСервис», г. Москва). Для проведения амплификации были использованы наборы «GenPak@ PCR Core» (ТУ 9398-001-73867468-2005, ООО «Лаборатория Изоген», г. Москва), «Набор реагентов для проведения ПЦР-РВ с Taq-ДНК-полимеразой в присутствии красителя SYBR Green I» (ООО «Синтол», г. Москва). Для проведения электрофоретической детекции продуктов амплификации ПЦР были использованы готовые 2,3% агарозные гели с навеской трис-боратной буферной смеси (НПФ «ДНК-Технология», г. Москва), минеральное масло для ПЦР. Праймеры были синтезированы в НПФ «Литех» и ООО «Синтол» (г. Москва).
Методы: в работе использовали общепринятые микробиологические методы выделения, идентификации и индикации бактерий (Васильев и др., 2004; Лабинская, 2004) и соответствующие им среды и реагенты. Основные биохимические свойства штаммов B. bronchiseptica исследовали с использованием тест–системы, разработанной в НИИЭМ им. Пастера, г. Санкт-Петербург. Режимы инкубирования посевов составляли 24-72 часа при 37ºС. Исследования с использованием бактериальных штаммов проводили согласно ГОСТ Р 51446-99, ГОСТ Р 51426-99, ГОСТ Р 26670-9. Морфологические свойства определяли при помощи световой микроскопии окрашенных по Граму мазков, которые готовили из 24-72 часовых бульонных и агаровых культур B. bronchiseptica. Иммунологические методы исследования включали в себя гипериммунизацию лабораторных животных для получения иммунных сывороток. Иммунохимические методы включали: получение антигенов B. bronchiseptica с помощью ультразвукового дезинтегратора и их электрофорез, который проводили по методике, описанной Л.А. Остерманом с модификацией применяемого буфера; встречный электрофорез по схеме, описанной G. Bedarida et al. (1969), реакцию иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979). Иммунодиффузию для выявления особенностей антигенов посредством реакции преципитации в геле проводили по методу O. Ouchterlony (1948). Молекулярно-генетические методы исследования включали в себя выделение нуклеиновых кислот (ДНК) из культур, проведение полимеразной цепной реакции с системами праймеров детекцию с помощью горизонтального электрофореза и в режиме «реального времени» (Real Time PCR) с интеркалирующим красителем SYBR Green I. Статистические методы включали расчет чувствительности и специфичности ПЦР в сравнении с микробиологическим методом по методу А. Петри и К. Сэбин (2002). Расчеты произведены с помощь программного обеспечения Microsoft Exell 2002 (10.2701.2625).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Сравнительный анализ иммунохимических методов для изучения
антигенного состава Bordetella bronchiseptica
При решении одной из задач данной работы были получены комплексные антигены разрушенных с помощью ультразвука бактериальных клеток. Затем была проведена иммунизация кроликов и получена гипериммунная сыворотка. После этого был проведен сравнительный анализ иммунохимических методов для изучения антигенного состава B. bronchiseptica.
Получение антигенов Bordetella bronchiseptica
Антигены B. bronchiseptica изолировали экстракцией микробных клеток в стерильном 0,9 % NaCl с последующей ультразвуковой дезинтеграцией. При их получении были использованы различные режимы дезинтеграции. Оптимальным оказался режим: частота 23 кГц, амплитуда колебаний 5 микрон, в течение 1 минуты на 1 мл суспензии бактериальной массы с постоянным охлаждением в смеси спирта со льдом. Контроль полного разрушения бактериальных клеток при выборе режима дезинтеграции был проведен с помощью окрашенных по Граму препаратов дезинтеграта, а наличие антигенов контролировалось электрофоретическим разделением белков в агарозном геле. В качестве контроля при электрофорезе был использован стандартный раствор сывороточного альбумина с молекулярной массой 65 кДа.
Электрофорез антигенов B. bronchiseptica после ультразвуковой дезинтеграции проводили в 2,0 % агарозном геле в трис-боратном буфере (рН-8,3) с режимом 25 В/см в течение 30 минут. После электрофореза гель окрашивали красителем 1% Amido Black 10B в течение 60 минут. После этого пластину геля помещали в промывающий раствор, содержащий 10 % лимонную кислоту на 24 часа для просветления фона. Затем гель документировали и анализировали количество полученных полос антигена (рис. 1).
В результате экспериментов был подобран оптимальный режим дезинтеграции бактериальных клеток, позволяющий полностью разрушить бактериальные клетки и максимально сохранить антигены B. bronchiseptica. При этом режиме дезинтеграции (частота 23 кГц, амплитуда колебаний 5 микрон, в течение 1 минуты на 1 мл суспензии бактериальной массы с постоянным охлаждением в смеси спирта со льдом) при электрофорезе в 2 % агарозном геле и использовании трис-боратного буфера было определено 7 антигенов. Также был определен диапазон расположения антигенов в агарозном геле с соответствующим режимом электрофореза, что необходимо для проведения реакции иммуноэлектрофореза.

 - 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
- 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 +
Рис. 1. Электрофореграмма антигенов B. bronchiseptica: 1-12 – штаммы B. bronchiseptica; 13-15 – альбумин (65 кДа)
Получение гипериммунной сыворотки
После выбора оптимального режима дезинтеграции микробных клеток, была получена бактериальная масса в количестве 50 мл. Затем была проведена ее ультразвуковая дезинтеграция для последующей иммунизации кроликов. Для стандартизации схемы иммунизации в дезинтеграте было определено количество белка, которое после дезинтеграции составило 6,2 мг/мл. Для удобства расчетов вводимого кроликам препарата количество белка было доведено до 5,0 мг/мл путем разведения исходного состава дезинтеграта стерильным 0,9 % р-ром NaCl. Иммунизацию кроликов проводили в/в по схеме, представленной в таблице 1.
Таблица 1 - Схема гипериммунизации кроликов
-
№
Интервал (дни)
Кол-во антигена
(мг белка/мл)
Кол-во антигена (мл)
Кол-во полного адъюванта Фрейнда (мл)
1
-
5,0
1,0
1,0
2
5
10,0
2,0
1,0
3
5
15,0
3,0
1,0
4
5
20,0
4,0
-
Кровь получали через 10 дней после последней иммунизации из ушной краевой вены.
Определение титра гипериммунной сыворотки
После проведения иммунизации кроликов и получения сыворотки в реакции диффузной преципитации был определен титр антител. Условия проведения реакции: 2 % агарозный гель, время диффузии – 24 часа при комнатной температуре во влажной камере.
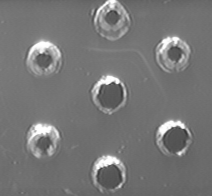
В результате исследования был определен исходный титр антител сыворотки, полученной при иммунизации животных комплексными антигенами B. bronchiseptica составил 1:8 (рис. 2).
2
7 3
1
6 4
5
Рис. 2. Титр антител иммунной сыворотки. Лунки: 1 – раствор антигенов B. bronchiseptica 22067; 2-7 – последовательные двукратные разведения
иммунной сыворотки, начиная с разведения 1:2
Двойная радиальная иммунодиффузия антигенов
B. bronchiseptica по методу O. Ouchterlony (1948)
Для двойной радиальной иммунодиффузии был использован 2% агарозный гель на трис-боратном буфере (рН-8,3). Гель такой концентрации обладает достаточно хорошей разрешающей способностью для качественного выявления образующихся преципитатов. Результаты представлены на рисунке 3.

1 2 3 4 5
6 7 8 9
Рис. 3. Двойная радиальная иммунодиффузия по О. Ouchterlony. Лунки:
1– B. bronchiseptica 36; 2– B. bronchiseptica 37; 3– B. bronchiseptica 45;
4– B. bronchiseptica 48; 5– B. bronchiseptica 59; 6-9 – иммунная сыворотка
В результате проведенных экспериментов мы определили количество образуемых преципитатов в ходе реакции двойной радиальной иммунодиффузии по O. Ouchterlony (1948) с комплексными антигенами B. bronchiseptica и преципитирующей иммунной кроличьей сыворотки. Было получено 5 линий преципитации с комплексными антигенами различных штаммов B. bronchiseptica; также обнаружено 3 линии преципитации с комплексными антигенами B. parapertussis, т.е. лишь 2 антигена B. bronchiseptica, выявляемых при использовании данного иммунохимического метода, являются видоспецифичными.
Встречный электрофорез по методу G. Bedarida et al. (1969)
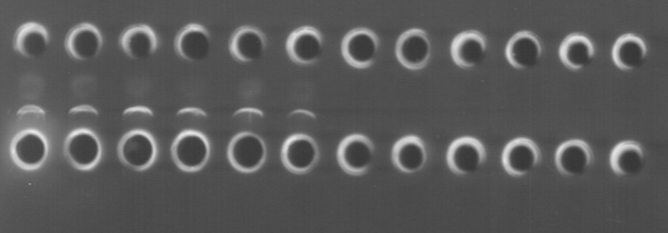
Электрофорез проводился в трис-боратном буфере (рН-8,3). В качестве поддерживающей среды в данной работе был использован 1,5% агарозный гель. В геле были вырезаны 2 ряда лунок: верхний - для антигена, нижний – для иммунной сыворотки. Ряды лунок располагались на расстоянии 1 см друг от друга. В первый ряд лунок были внесены антигены (дезинтегрированные суспензии клеток B. bronchiseptica), во второй ряд, расположенный под первым – иммунная сыворотка, полученная при гипериммунизации кроликов. Затем проводился электрофорез с режимом 25 В/см, 100 mA, в течение 20 минут. После этого гель вынимали из электрофоретической камеры, промывали в 0,9% NaCl в течение 30 минут для отмывки несвязавшихся антигенов и антител. После этого наблюдали преципитаты в проходящем свете (рис. 4). При слабых преципитатах пластину геля оставляли в растворе 0,9% NaCl на 24-48 часов.
1 2 3 4 5 6 7 8 9 10 11 12
13 14 15 16 17 18 19 20 21 22 23 24
Рис. 4. Встречный электрофорез. Лунки: 1– B. bronchiseptica 1; 2– B. bronchiseptica 7; 3– B. bronchiseptica 214; 4– B. bronchiseptica 59; 5– B. bronchiseptica 22067; 6– B. parapertussis 119; 7– P. aeruginosa; 8– A. hydrophila; 9– E. coli; 10– Y. enterocolytica; 11– Y. pseudotuberculosis; 12– S. aureus; 13-24 – иммунная сыворотка
В результате использования метода встречного электрофореза по G. Bedarida et al. (1969) были получены четкие преципитаты, образованные с антигенами дезинтегрированных культур Bordetella bronchiseptica, а также с антигенами B. parapertussis. С антигенами культур грамотрицательных (P. aeruginosa, A. hydrophila, E. coli, Y. enterocolytica, Y. pseudotuberculosis) и грамположительных (S. aureus) бактерий преципитации не наблюдалось. Таким образом, было показано, что данный метод с применением иммунной сыворотки к комплексным антигенам B. bronchiseptica не позволяет провести видовую идентификацию антигенов возбудителя бордетеллеза.
Иммуноэлектрофорез по методу P. Grabar и C. Williams,
описанному Х. Фримель (1979)
Сначала был проведен собственно электрофорез антигенов в агарозном геле в течение 30 минут. Толщина геля составляла 3-4 мм. Затем в канавку, параллельную миграции антигенов, была помещена гипериммунная сыворотка. Для равномерной диффузии пластина с гелем находилась во влажной камере в течение 24-48 часов. После этого линии преципитации наблюдали в боковом освещении на темном фоне (рис. 5). Гели документировали и проводили анализ.
В результате данного эксперимента было идентифицировано 8 антигенов B. bronchiseptica, полученных с помощью ультразвуковой дезинтеграции бактериальной массы. Стоит заметить, что антигены различных штаммов возбудителя имели значительное сходство, что подтверждается количеством и расположением линий преципитации. В опытах с комплексными антигенами B. parapertussis было определено 3 идентичных линии преципитации, что подтверждает наличие общих антигенов с B. bronchiseptica.
В рамках решения задачи сравнения иммунохимических методов при анализе антигенного состава возбудителя бордетеллеза были проведены эксперименты иммуноэлектрофореза комплексных антигенов грамотрицательных и грамположительных бактерий с гипериммунной сывороткой.
Антигены культур грамотрицательных ( P. aeruginosa, P. putida, E. coli, O. rhinotracheale, Y. enterocolytica, Y. pseudotuberculosis) и грамположительных (S. pyogenes, S. epidermidis, L. acidophilus, B. subtilis) бактерий были получены путем ультразвуковой дезинтеграции с режимом, описанном в разделе «Получение гипериммунной сыворотки». Электрофорез антигенов всех культур вышеуказанных бактерий и последующую иммунодиффузию проводили по методике, описанной в данном разделе.
В результате данных исследований было определено, что иммунная сыворотка к антигенам B. bronchiseptica образует с комплексными антигенами грамотрицательных бактерий 3 линии преципитации, тогда как при иммуноэлектрофорезе с антигенами B. bronchiseptica было образовано 8 четких линий преципитации. Также следует отметить, что титр иммунной сыворотки, использованной для иммуноэлектрофореза, составил 1:8, что доказывает высокую чувствительность этого метода при анализе антигенной структуры B. bronchiseptica.
Таким образом, мы провели сравнительный анализ трех иммунохимических метода для выбора оптимальной схемы при изучении антигенного состава B. bronchiseptica. Мы установили, что иммунохимические методы являются достаточно эффективными и позволяют в короткие сроки провести анализ антигенного состава B. bronchiseptica.
 - 1 +
- 1 + иммунная сыворотка к Bordetella bronchiseptica
2
иммунная сыворотка к Bordetella bronchiseptica
3
Рис. 5. Иммуноэлектрофореграмма. Лунки: 1– B. bronchiseptica 169;
2 – B. bronchiseptica 101; 3 – B. bronchiseptica 71
Использование двойной радиальной иммунодиффузии по O. Ouchterlony (1948) позволяет обнаружить 5 антигенов B. bronchiseptica, однако 3 идентичных линии преципитации были образованы и с антигенами B. papapertussis, т.е. только 2 выявляемых в этой реакции антигена являются видоспецифичными для возбудителя бордетеллеза.
Использование встречного электрофореза по методу G. Bedarida et al. (1969) с применением полученной ранее кроличьей иммунной сыворотки не позволяет провести видовую идентификацию антигенов B. bronchiseptica.
В опытах иммуноэлектрофореза мы обнаружили 8 антигенных комплекса инфекционного агента, взаимодействующих с кроличьей иммунной сывороткой, причем 3 идентичных линии преципитации были образованны и с антигенами других грамотрицательных бактерий (P. aeruginosa, P. putida, E. coli, O. rhinotracheale, Y. enterocolytica, Y. pseudotuberculosis), т.е. 5 линий преципитации являются видоспецифичными для B. bronchiseptica.
В результате сравнительного анализа трех иммунохимических метода (двойной радиальной иммунодиффузии по O. Ouchterlony (1948), встречного электрофореза по методу G. Bedarida et al. (1969) и иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979)) мы показали, что наиболее эффективным является иммуноэлектрофорез. При использовании преципитирующей кроличьей сыворотки, полученной при иммунизации комплексными антигенами B. bronchiseptica, метод иммуноэлектрофореза позволяет выявить 8 антигенов, 3 из которых являются общими для грамотрицательных бактерий других видов, а 5 – являются видоспецифичными для возбудителя бордетеллеза.
Предлагаемая нами схема анализа антигенной структуры B. bronchiseptica включает: 1) получение антигенов с помощью ультразвука с режимом дезинтеграции - частота 23 кГц, амплитуда колебаний 5 микрон, в течение 1 минуты на 1 мл суспензии бактериальной массы с постоянным охлаждением в смеси спирта со льдом; 2) гипериммунизацию лабораторных животных для получения иммунных сывороток по схеме, отображенной в табл. 1; 3) реакцию иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979).
Помимо иммунохимических методов анализа антигенного состава B. bronchiseptica существуют молекулярно-генетические методы, позволяющие выявлять специфические фрагменты ДНК инфекционных агентов. Наиболее широко в настоящее время используется полимеразная цепная реакция.
Разработка методики молекулярно-генетической идентификации
Bordetella bronchiseptica с помощью полимеразной цепной реакции
Идентификация участков генов BfrA и BfrZ
генома Bordetella bronchiseptica
В библиотеке баз данных GeneBank (США), EMBL (Европейская молекулярно-биологическая библиотека), DDBJ (Японская база данных нуклеотидных последовательностей) были найдены два уникальных гена BfrA и BfrZ системы TonB-комплекса наружных мембранных протеинов-рецепторов железа B. bronchiseptica. Затем выбранные мишени-гены были проверены системой BLAST на предмет совпадения с ДНК известных микроорганизмов и оказалось, что аналогичных нуклеотидных последовательностей другие виды микроорганизмов не имеют. На наиболее консервативные участки выбранных мишеней, с использованием приложения Primer BLAST были положены праймеры, отвечающие общепринятым требованиям. В итоге праймеры, теоретическая специфичность и фрагменты амплифицируемых участков представлены в таблице 2.
Таблица 2 - Характеристика праймеров
| Анализируемый ген | Праймеры 5’-3’ | Размер ампликона |
| BfrA | (f) CCTTCCAGCACCTGGCGGTACGAGTTGCTCC | 528 п.о. |
| (r) CCCCGTGCCGGGGTGCCTGGACCTGGGCG | ||
| BfrZ | (f) GGACGACCAGGATCACATCTTCC | 298 п.о. |
| (r) GCTTTCCTGGTAGTTGGCGTAGG | ||
| Cytochrom–C–oxidase | (f) GCATTGCTCCATCCTGTTGTGCG | 168 п.о. |
| (r) GATGGGTTATCTGAGCGCGC | ||
| 16S rRNA | (f) CTACGGGGGAAAGCGGGGGA | 711 п.о. |
| (r) GACCGTACTCCCCAGGCGGT |
Проверка работоспособности и специфичности праймеров, а также оптимизация режима проведения ПЦР были проведены на 5 музейных штаммах B. bronchiseptica и штамме B. parapertussis, а также на 37 клинических образцах. Была определена универсальная программа амплификации (табл. 3) и концентрация праймеров – 10 pmol на реакцию объемом 25 мкл.
Таблица 3 - Программа для амплификации ДНК
| № цикла | Шаг | Температура | Длительность | Количество повторов |
| 1 | 1 | 95˚С | 5 мин | 1 |
| 2 | 1 2 3 | 95˚С 60˚С 72˚С | 10 сек 20 сек 20 сек | 35 |
| 3 | 1 | 72˚С | 2 мин | 1 |
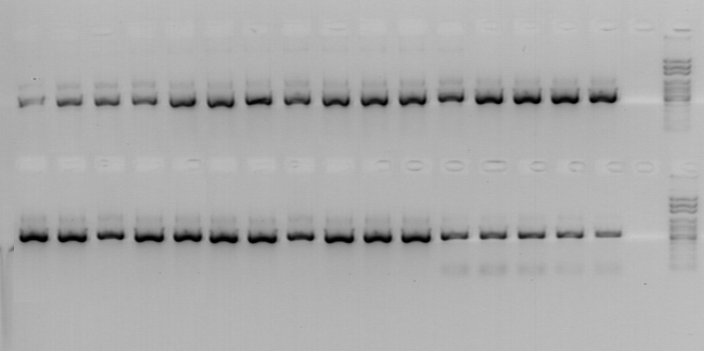
На рисунке 6 представлены окончательные результаты этих экспериментов.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
Рис. 6. Электрофореграмма продуктов амплификации участка
гена BfrA. 1-16, 19-34 – штаммы B. bronchiseptica; полученные
из клинического материала; 17, 35 - отрицательный контроль;
18, 36 – маркер молекулярного веса
Идентификация участка гена Сytochrom-C-oxidase, общего для
генома B. bronchiseptica, B. pertussis и B. parapertussis, а также
участка гена 16S rRNA, общего для рода Bordetella
Одним из наиболее важных моментов при бордетеллезной инфекции является невозможность быстрого выявления возбудителя микробиологическими методами. Сложность биохимической и серологической идентификации B. bronchiseptica подтолкнула нас к разработке систем праймеров, которые могли бы с высокой точностью идентифицировать бактерию, относящуюся к роду Bordetella. Мы разработали систему, которая выявляет специфичный для B. bronchiseptica, B. parapertussis и B. pertussis ген, кодирующий фермент цитохром-С-оксидазу (Cytochrom–C–oxidase). Так как B. parapertussis и B. pertussis вызывают заболевания у человека, то вероятность их обнаружения в биологическом материале, полученном от животных сводится к минимуму. Уникальность же гена Cytochrom–C–oxidase по сравнению с известными последовательностями ДНК других видов микроорганизмов позволяет использовать его в качестве мишени при проведении мультиплексной ПЦР для индикации B. bronchiseptica. Также, была создана система праймеров, позволяющая идентифицировать общий для рода Bordetella ген, кодирующий 16S субъединицу бактериальных рибосом (16S rRNA). Его выявление при проведении ПЦР открывает перспективы индикации представителей рода Bordetella, а также, при возможных мутационных изменениях ранее исследованных генов BfrA и BfrZ, позволяет обнаружить соответствующие штаммы B. bronchiseptica в биологическом материале, полученном от животных.
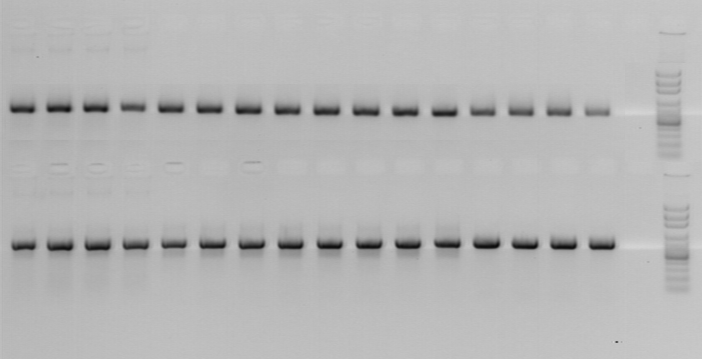
Были определены праймеры, теоретическая специфичность и фрагменты амплифицируемых участков которых представлены ранее в таблице 2. Затем была проведена полимеразная цепная реакция (рис. 7).
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
Рис. 7. Электрофореграмма продуктов амплификации участка
гена 16S rRNA. 1-16, 19-34 – штаммы B. bronchiseptica, полученные
из клинического материала; 17, 35 - отрицательный контроль;
18, 36 – маркер молекулярного веса
Использование ПЦР с регистрацией в режиме «реального времени»
для индикации и количественного определения содержания ДНК
B. bronchiseptica
Нами были проведены эксперименты с применением современной технологии – ПЦР с регистрацией в режиме «реального времени» (Real Time) с интеркалирующим красителем SYBR Green I на термоциклере «ДТ-322» по программе амплификации (табл. 4), позволяющей одновременно совмещать амплификацию и детекцию (по каналу Fam/SYBR Green I: max поглощения-494 нм, max испускания-521 нм).
Таблица 4 - Программа для амплификации ДНК
| № цикла | Шаг | Температура | Длительность | Детекция | Количество повторов |
| 1 | 1 | 95˚С | 5 мин | | 1 |
| 2 | 1 2 | 95˚С 60˚С | 10 сек 40 сек | * | 35 |
Технология ПЦР в «реальном времени» позволяет при наличии стандартных образцов определить концентрацию бактериальных клеток. В качестве стандартов ДНК были использованы 24-часовые культуры B. bronchiseptica 22067 с определенным значением КОЕ/мл.
Результаты количественной ПЦР с регистрацией в режиме «реального времени» представлены в таблице 5.
Таблица 5 - Количественный ПЦР-анализ с системой праймеров
к участку гена BfrZ
| Номер лунки | Идентификатор пробы | Ct, Fam | Cp, Hex | Концентрация, копий ДНК/мл |
| A1 | Стандарт 1 | 18,2 | - | 5,5×106 |
| A3 | Стандарт 2 | 21,9 | - | 5,5×105 |
| A5 | Стандарт 3 | 28,4 | - | 5,5×103 |
| A7 | P.aeruginosa | - | - | - |
| A8 | B.parapertussis 119 | - | - | - |
| B1 | E.coli | - | - | - |
| B3 | B.bronchiseptica1 | 13,4 | - | 1,4×108 |
| B4 | B.bronchiseptica 7 | 14,0 | - | 9,1×107 |
| B6 | B.bronchiseptica 22067 | 20,9 | - | 9,1×105 |
| B7 | B.bronchiseptica 8344 | 17,8 | - | 7,4×106 |
| B8 | B.bronchiseptica 10608 | 19,8 | - | 2,0×106 |
| D5 | B.bronchiseptica 83449 | 12,2 | - | 6,8×108 |
| D6 | B.bronchiseptica 8344bj | 28,7 | - | 2,3×103 |
Использование мультиплексного формата ПЦР для
идентификации B. bronchiseptica
Для многокомпонентного формата ПЦР было решено использовать 3 системы праймеров (к участкам генов BfrA, BfrZ и Cytochrom–C–oxidase) (рис. 8). Количество и соотношение праймеров были подобраны экспериментальным путем: по 10 pmol праймеров системы для участков генов BfrA и BfrZ и по 30 pmol для участка гена Cytochrom–C–oxidase. Также следует отметить, что была использована универсальная программа амплификации, представленная ранее в таблице 3.
В результате были подобраны условия проведения ПЦР в мультиплексном формате, что позволяет в одной пробирке идентифицировать наличие ДНК B. bronchiseptica по трем различным критериям: видовых генов (BfrA и BfrZ) а также наличие участка гена, являющегося общим для B. bronchiseptica, B. pertussis и B. parapertussis. Такая комбинация праймерных систем значительно повышает специфичность идентификационного теста.
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15Рис. 8. Электрофореграмма мультиплексной ПЦР к участкам генов
BfrA, BfrZ и Cytochrom–C–oxidase. 1-13 – штаммы B. bronchiseptica,
выделенные из клинического материала; 14 – отрицательный контроль;
15– маркер молекулярного веса
Определение чувствительности ПЦР для идентификации
Bordetella bronchiseptica с разработанными системами праймеров
При определении аналитической чувствительности нами были приготовлены последовательные 10-ти кратные разведения из исходной бактериальной взвеси B. bronchiseptica, содержащей 5,5×109 клеток/мл. Исходная концентрация была определена по стандарту мутности и подсчету КОЕ.
Результаты определения чувствительности представлены на рисунке 9. Были определены пределы чувствительности для всех систем праймеров, использованных в данной работе: для участка гена BfrA генома B. bronchiseptica - 5,5×103 бактериальных клеток/мл; для участка гена BfrZ генома B. bronchiseptica - 5,5×103 бактериальных клеток/мл; для участка гена 16S rRNA генома Bordetella spp. - 5,5×102 бактериальных клеток/мл; для участка гена Cytochrom–C–oxidase генома Bordetella complex (bronchiseptica+pertussis+parapertussis)- 5,5×103 бактериальных клеток/мл.
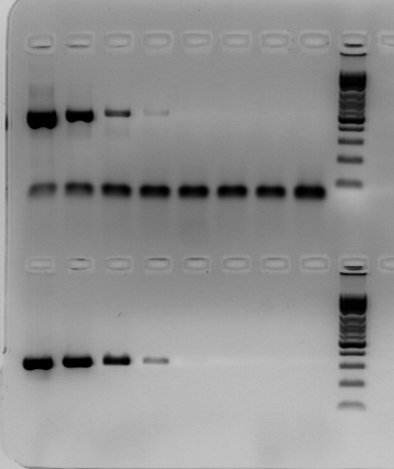
1 2 3 4 5 6 7 8 9
Рис. 9. Электрофореграмма определения чувствительности ПЦР с праймерами к участку гена BfrZ (бактериальных клеток/мл): 1– 5,5×106; 2– 5,5×105; 3– 5,5×104; 4– 5,5×103; 5– 5,5×102; 6– 5,5×101; 7– 5,5×100; 8– отрицательный контроль; 9– маркер молекулярного веса
При выполнении данной работы были использованы как штаммы B. bronchiseptica, так и штаммы других бактерий. Была оценена надежность метода ПЦР по сравнению с классическим микробиологическим методом – «золотым стандартом». Один штамм B. bronchiseptica, идентифицированный микробиологическим методом (бактериологическим посевом), в ПЦР был отрицательным.
В соответствии с методом, рекомендованным А.Петри и К.Сэбин (2003) были построены таблицы данных качественных признаков: положительный тест «+» и отрицательный тест «-» (табл. 6).
Таблица 6 - Оценка чувствительности и специфичности ПЦР
| | B. bronchiseptica обнаружена (кол-во штаммов) | B. bronchiseptica не обнаружена (кол-во штаммов) |
| ПЦР-исследование (участки генов BfrA, BfrZ, Cytochrom–C–oxidase и 16S rRNA) | 37 | 13 |
| Микробиологический метод | 38 | 12 |
Оценка чувствительности: доля «+» штаммов, точно идентифицированных микробиологическим методом = 37/38 = 0,97 (= 97%). Оценка специфичности: доля «-» штаммов, точно идентифицированных микробиологическим методом = 12/13 = 0,92 (= 92%).
Таким образом, мы получили результаты ПЦР-исследования с высокой степенью чувствительности и специфичности.
Разработанные методические подходы с применением иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979) позволяют проводить анализ антигенной структуры B. bronchiseptica, а использование полимеразной цепной реакции идентификацию инфекционного агента в биологическом материале.
ВЫВОДЫ
- Анализ антигенного состава B. bronchiseptica по методу P. Grabar и C. Williams, описанному Х. Фримель (1979) выявляет 8 линий преципитации, 3 из которых также обнаруживаются у грамотрицательных бактерий других видов (P. aeruginosa, P. putida, E. coli, O. rhinotracheale, Y. enterocolytica, Y. pseudotuberculosis), а 5 выявляются только у возбудителя бордетеллеза.
- Использование праймерных систем: Pr1-1 (5’ ccttccagcacctggcggtacgagttgctcc 3’) и Pr1-2 (5’ ccccgtgccggggtgcctggacctgggcg 3’) для гена BfrA ДНК B. bronchiseptica, Pr3-1 (5’ggacgaccaggatcacatcttcc 3’) и Pr3-2 (5’ gctttcctggtagttgg-cgtagg 3’) для гена BfrZ ДНК B. bronchiseptica позволяет проводить индикацию возбудителя в биоматериале.
- Доказана высокая специфичность ПЦР с указанными парами праймеров при идентификации B. bronchiseptica – во всех исследуемых штаммах B. bronchiseptica (5 референс-штаммов и 37, выделенных из клинического материала) обнаружено наличие специфических участков генов BfrA и BfrZ. Штаммы B. parapertussis и других грамотрицательных бактерий в реакциях ПЦР с этими системами праймеров дали отрицательный результат.
- Показана возможность одновременного выявления 3-х участков генов: BfrA и BfrZ – специфичных для B. bronchiseptica и Cytochrom–C–oxidase – специфичного для B. bronchiseptica, B. pertussis, B. parapertussis. Определены соотношения этих праймерных систем в реакции – 1:1:3 соответственно.
- Определена чувствительность ПЦР-исследования с подобранными системами праймеров: для участка гена BfrA генома B. bronchiseptica - 5,5х103 бактериальных клеток/мл; для участка гена BfrZ генома B. bronchiseptica - 5,5х103 бактериальных клеток/мл; для участка гена 16S rRNA генома Bordetella spp. - 5,5х102 бактериальных клеток/мл; для участка гена Cytochrom–C–oxidase генома Bordetella complex (B. bronchiseptica, B. pertussis, B. parapertussis) - 5,5х103 бактериальных клеток/мл.
- Использование метода ПЦР с регистрацией в режиме «реального времени» с интеркалирующим красителем SYBR Green I позволило провести количественную оценку содержания ДНК B. bronchiseptica в биоматериале. В экспериментах данной работы они составили от 2,3×103 до 6,8×108 копий ДНК/мл для участка гена BfrZ.
Практические предложения
- Предложено использование иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979) для изучения антигенного состава B. bronchiseptica. Предлагаемая нами схема анализа антигенной структуры B. bronchiseptica включает: а) получение антигенов с помощью ультразвука с режимом дезинтеграции - частота 23 кГц, амплитуда колебаний 5 микрон, в течение 1 минуты на 1 мл суспензии бактериальной массы с постоянным охлаждением в смеси спирта со льдом, б) гипериммунизацию лабораторных животных для получения иммунных сывороток, в) реакцию иммуноэлектрофореза по методу P. Grabar и C. Williams, описанному Х. Фримель (1979). Этот метод позволяет выявить 8 антигенов, причем 3 из них являются общими для грамотрицательных бактерий других видов, а 5 являются видоспецифичными для возбудителя бордетеллеза.
- Предложено использование полимеразной цепной реакции с подобранными системами праймерами к фрагментам генов BfrA и BfrZ генома B. bronchiseptica с аналитической чувствительностью 5,5х103 бактериальных клеток/мл в качестве молекулярно-генетического метода индикации и идентификации возбудителя. ПЦР рекомендовано проводить согласно «Методическим рекомендациям для выявления Bordetella bronchiseptica с помощью полимеразной цепной реакции».
- Предложена методика проведения ПЦР с регистрацией в режиме «реального времени» с интеркалирующим красителем SYBR Green I для количественного определения содержания ДНК B. bronchiseptica в биологическом материале.
- Предложена методика проведения ПЦР в мультиплексном формате для одновремнного выявления 3 специфических фрагмента ДНК B. bronchiseptica, один из которых является общим для представителей рода Bordetella. Эта методика позволяет повысить специфичность метода при выявлении возбудителя.
Список работ, опубликованных по теме диссертации
- Никульшина Ю.Б. Культивирование Bordetella bronchiseptica на различных селективных средах / Ю.Б. Никульшина, Д.Г. Сверкалова, Д.А. Васильев, А.В. Мастиленко, Д.Н. Хлынов // Актуальные вопросы аграрной науки и образования: Материалы Международной научно-практической конференции, 20-22 мая, 2008. –Ульяновск, 2008. – С. 57-59.
- Васильев Д.А. К вопросу о бактериологической диагностике бордетеллеза / Д.А. Васильев, Д.Г. Сверкалова, Ю.Б. Никульшина, А.В. Мастиленко // Актуальные вопросы аграрной науки и образования: Материалы Международной научно-практической конференции, 20-22 мая, 2008. –Ульяновск, 2008. – С. 92-94.
- Сверкалова Д.Г. Создание транспортной и накопительной сред для Bordetella bronchiseptica / Д.Г. Сверкалова, А.В. Мастиленко, Д.Н Хлынов, Ю.Б. Никульшина, Д.А. Васильев // Актуальные вопросы аграрной науки и образования: Материалы Международной научно-практической конференции, 20-22 мая, 2008. –Ульяновск, 2008. – С. 134-136.
- Васильев Д.А. Разработка методики выявления специфического участка ДНК Bordetella bronchiseptica с помощью ПЦР в режиме «реального времени» / Д.А. Васильев, А.В. Мастиленко, Д.Г. Сверкалова, Ю.Б. Никульшина // Современный мир, природа и человек: Сборник научных трудов. – Томск, 2009. – С. 115-117.
- Васильев Д.А. Разработка методики идентификации Bordetella bronchiseptica с помощью полимеразной цепной реакции в режиме «реального времени» / Д.А. Васильев, А.В. Мастиленко, Ю.Б. Васильева, Д.Г. Сверкалова // Актуальные проблемы инфекционной патологии ветеринарной медицины: Материалы конференции молодых ученых, посвященной памяти члена-корреспондента. РАСХН Вишнякова И.Ф. 70-летию со дня рождения, 3-4 декабря, 2009. – Покров, 2009. – С. 78-80.
- Васильев Д.А. Использование количественной ПЦР для идентификации Bordetella bronchiseptica / Д.А. Васильев, А.В. Мастиленко, Ю.Б. Васильева, Д.Г. Сверкалова // Молекулярная диагностика – 2010: Сборник трудов VII Всеросиийской научно-практической конференции с международным участием, 24-26 ноября, 2010. – Москва, 2010. – С.68-70.
- Васильев Д.А. Выделение и идентификация Bordetella bronchiseptica от животных / Д.А. Васильев, А.В. Мастиленко, Д.Г. Сверкалова, Ю.Б. Васильева // Естественные и технические науки. – 2010. – №5(49). – С. 233-235.
- Васильев Д.А. Применение полимеразной цепной реакции при идентификации возбудителя бордетеллеза животных / Д.А Васильев, А.В. Мастиленко, Д.Г. Сверкалова, Ю.Б. Васильева // Естественные и технические науки. – 2010. – №5(49). – С. 230-232.
