Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01. 06 Биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат диссертации |
| Научно- практическая значимость работы 1.2. Общая схема синтеза 1.3. Основные материалы и методы исследования Примеры синтеза наночастиц металлов Рис.3 (слева). Рис.4 (сверху). |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы серебра в коллоидных растворах и их применение, 25.84kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
- Ю. М. Дедков, М. Г. Слотинцева Сб. «Свойства и применение платиновых металлов и сплавов, 100.81kb.
- Координационные взаимодействия глюкозамина, хитозана и их гидрохлоридов с ионами d-металлов, 403.45kb.
- Доцента кафедры Хиээ ланской, 49.44kb.
- Метод биосорбции тяжелых металлов из промышленных сточных вод с использованием пивоваренных, 350.37kb.
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Строения металлов и их свойства, 394.29kb.
Научно- практическая значимость работы
Известно, что свойства внутренней среды обратных мицелл при малых степенях гидратации близки к свойствам внутренней среды клеточных органелл и компартментов живой клетки. Таким образом, установленный в работе факт формирования наночастиц металлов при взаимодействии флавоноидов с ионами металлов в обратных мицеллах демонстрирует принципиальную возможность образования кластеров и наночастиц в результате взаимодействия флавоноидов с ионами металлов в живых организмах. Отсюда следует, что система обратных мицелл может служить адекватной моделью для изучения механизмов биологической активности флавоноидов, включающей их взаимодействия с ионами металлов. В частности, полученные в работе данные о коэффициентах экстинкции и структуре комплексов флавоноидов с ионами металлов в обратных мицеллах могут быть полезны для углубления понимания процессов, лежащих в основе антиоксидантного действия флавоноидов в биологических системах.
Установлено, что, как растворы наночастиц, так и модифицированные ими материалы представляют несомненный интерес для практического применения. Показано, в частности, что водные дисперсии наночастиц серебра могут использоваться для создания жидкого дезинфицирующего средства нового типа, обладающего существенными преимуществами по сравнению с рядом известных дезинфектантов. Обнаружена значительная каталитическая активность для наночастиц меди в реакции изомеризации дихлорбутенов (одной из стадий получения синтетического каучука), а также для наночастиц серебра, меди и других металлов в реакциях органического синтеза, используемых при получении различных красителей, отбеливателей, добавок к топливам и другой продукции одного из отечественных предприятий (завод «Пигмент», г.Тамбов). Было зафиксировано существенное увеличение скорости процесса, выхода и качества продуктов по ряду показателей.
Полученные в работе результаты по биологическим эффектам наночастиц серебра на объектах разного уровня организации могут быть использованы, во-первых, для выработки рекомендаций по выбору действующих концентраций наночастиц серебра с целью применения их в медицине (для диагностики или в виде лекарственных препаратов) и, во-вторых, для разработки санитарных норм при определении допустимых концентраций наночастиц металлов в окружающей среде и в материалах, с которыми контактирует человек.
Основные положения, выносимые на защиту:
1. Создан оригинальный метод синтеза наночастиц металлов в растворах, позволяющий получать наночастицы малого размера (не более 25 нм), стабильные на воздухе в течение длительного времени, что позволяет проводить систематические исследования их свойств и разрабатывать варианты их практического применения.
2. Исследован механизм взаимодействия восстановителей (флавоноидов) с ионами металлов в обратных мицеллах. Показано, что синтез наночастиц идет через стадию образования комплекса флавоноида с ионами металла в водном ядре обратной мицеллы.
3. Разработана технология получения водных растворов наночастиц металлов из их мицеллярных растворов.
4. Разработана технология нанесения наночастиц металлов из мицеллярных и водных растворов на различные твердые материалы.
5. Предложены различные варианты применения растворов наночастиц серебра и модифицированных ими жидкофазных и твердых материалов.
Личный вклад автора. Автору принадлежит решающая роль на всех этапах работ по синтезу наночастиц, получению их водных растворов, исследованию механизма взаимодействия флавоноидов с ионами металлов и адсорбционных свойств наночастиц металлов в растворах – от постановки задачи, планирования и проведения экспериментов, до анализа, обсуждения и оформления полученных результатов. В исследованиях биологических эффектов и каталитических свойств наночастиц в большинстве случаев автору принадлежит ведущая роль в постановке задачи, планировании экспериментов, а также в анализе, обсуждении и оформлении полученных результатов. В некоторых случаях планирование и оформление и во всех случаях проведение экспериментов в этих исследованиях осуществлялось специалистами соответствующих учреждений и предприятий.
Апробация работы. Результаты работы докладывались на VII Всероссийской конференции «Органические реагенты в аналитической химии» (Саратов, 1999), VII симпозиуме «Физика и химия полиметиновых красителей» (Москва, 1999), Международной конференции по наукоемким технологиям (Москва, 1999), International Conference «Colloids 2000» (Hungary, Szegel, 2000), II Всероссийском совещании «Высокоорганизованные каталитические системы" (Москва, 2000), XII Симпозиуме по современным проблемам химической физики (Туапсе, 2000), VII Международном Фрумкинском симпозиуме (Москва, 2000), X International Symposium on Relation between Homogeneous and Heterogeneous Catalysis. (Lyon, France, 2001), VII Международном симпозиуме «:Metal Ions in Biology and Medicine» (Санкт-Петербург, 2002), VI Всероссийской (международной) конференции «Физикохимия ультрадисперсных (нано-) систем (Томск, 2002), I и V Международных Конгрессах «Биотехнология - состояние и перспективы развития» (Москва, 2002 и 2009), Научных сессиях МИФИ (Москва, 2003, 2004), I и II Всероссийских (международных) научно-практических конференциях «Нанотехнологии - производству» (Фрязино, 2004, 2005), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007), V международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности» (Санкт-Петербург, 2008), Международном симпозиуме «Biological Motility: achievements and perspectives» (Пущино, 2008), I Международной летучей школе «Наноматериалы и нанотехнологии в живых системах» (Красновидово, 2009), 4-th International Conference «Environmental effects of nanoparticles and nanomaterials» (Vienna, Austria, 2009), II и III Международных форумах по нанотехнологиям «Rusnanoforum - 2009, 2010» (Москва, 2009, 2010), Международном семинаре «Дни Horiba в России» (Санкт-Петербург, 2010). Результаты прикладных разработок представлялись также на нескольких международных выставках: Экватек-2002, Интерлакокраска-2003, 2004, 2009.
Объем и структура работы. Диссертационная работа изложена на 224-х страницах основного текста, содержит 76 рисунков, 18 таблиц и состоит из введения, литературного обзора, описания предпосылок и основ биохимического синтеза, включая материалы и методы исследования и примеры синтеза наночастиц (1 глава), изложения и обсуждения результатов исследований процесса формирования и свойств наночастиц (7 глав), описания возможностей применения наночастиц (1 глава), выводов и списка литературы (256 наименований).
Публикации По материалам работы имеется 53 публикации, из них 2 обзора, 19 статей, 4 патента и 28 тезисов докладов.
Работа выполнена при участии МГУ им. М.В.Ломоносова (кафедра химической кинетики и катализа химического факультета), Института теоретической и экспериментальной биофизики РАН (Пущино), НИИ экологии человека и гигиены окружающей среды им. А.Н.Сысина РАМН (Москва), НИИ генетики и селекции промышленных микроорганизмов ГНЦ (Москва), Тамбовского государственного технического университета (кафедра химической технологии органических веществ), Института общей генетики им. Н.И.Вавилова РАН (Москва).
Работа проводилась при поддержке РФФИ (грант 01-03-32783), комплексной программы РАН «Наноматериалы и супрамолекулярные системы» на 2003 г., ФЦП на 2009-2013 годы по лоту «Проведение научных исследований коллективами научно-образовательных центров в области биомедицинских и ветеринарных технологий жизнеобеспечения и защиты человека и животных», по теме «Инновационные технологии получения новых биологически активных субстанций с повышенной эффективностью терапевтического и диагностического действия и наноразмерных лекарственных форм созданных субстанций и известных медицинских препаратов», а также нескольких частных компаний, заинтересованных во внедрении наночастиц металлов.
Основное содержание работы
- Биохимический синтез в обратных мицеллах.
- 1.1. Предпосылки метода. Сравнение с другими химическими методами.
- 1.1. Предпосылки метода. Сравнение с другими химическими методами.
Биохимический синтез относится к группе химических методов получения наночастиц металлов в растворах, основанных на восстановлении ионов металла до атомов в условиях, благоприятствующих формированию наночастиц. В этой группе синтез наночастиц проводится в молекулярных (водных или неводных) растворах или в обратных мицеллах – в тройной системе: водный раствор соли металла/ПАВ/неполярный растворитель. В последнем случае реакция восстановления и формирование наночастиц протекают в водном ядре мицеллы, образованной молекулами ПАВ (поверхностно-активного вещества). Восстановителями наиболее часто служат (1) неорганические (гидразин, борогидрид натрия) или органические (формальдегид, глюкоза, цитраты и др.) вещества, традиционно используемые в этом качестве в химии, (2) сольватированный электрон, генерируемый ионизирующим излучением, (3) фотоэлектроны, возникающие под действием УФ или лазерного излучения и (4) электроны, генерируемые на катоде в ходе электролиза растворов, содержащих соли соответствующих металлов. Во всех случаях используются стабилизаторы, которые обеспечивают устойчивость системы, предотвращая агрегацию наночастиц. Стабилизаторами обычно служат природные (желатин, крахмал, агар-агар и др.) или синтетические полимеры и ПАВ; в некоторых случаях роль стабилизатора может играть восстановитель.
Сравнительный анализ разных вариантов химического синтеза показывает, что система обратных мицелл имеет ряд преимуществ перед молекулярным раствором. Во-первых, агрегация наночастиц здесь происходит, как правило, значительно медленнее, то есть, время жизни наночастиц в обратно-мицеллярном (далее мицеллярном) растворе существенно увеличивается по сравнению с молекулярным раствором. Во-вторых, варьируя параметры мицеллярного раствора (в частности, задавая диаметр водного ядра мицеллы), оказывается возможным достаточно надежно контролировать размеры, получаемых наночастиц. Таким образом, синтез в обратных мицеллах позволяет получать дисперсии наночастиц со сравнительно узким распределением по размерам, что весьма существенно для исследования их свойств, в том числе «размерных эффектов».
Другой важный вывод вытекает из результатов применения не традиционных химических, а природных биологических восстановителей, содержащихся, главным образом, в водных экстрактах из растений или супернатантах культур бактерий. Было показано, в частности, что водные экстракты из семян люцерны, чечевицы, листьев хны и герани, почек и цветков гвоздики, из некоторых грибов, супернатанты культур кишечной палочки и золотистого стафилококка способны эффективно восстанавливать ионы благородных металлов (золота и серебра) в водном растворе с образованием наночастиц, стабилизированных либо самим восстановителем, либо другими веществами (белками, полисахаридами), присутствующими в том же растворе. Как неоднократно отмечалось в литературе, такой способ имеет ряд преимуществ перед традиционными методами, главными из которых являются мягкие условия синтеза и отсутствие в растворе, содержащем наночастицы, более или менее ядовитых побочных продуктов или примесей в самих наночастицах, которые неизбежно появляются при использовании основных химических восстановителей. Поэтому такое «биологическое» восстановление как основа для получения металлических наночастиц имеет хорошие перспективы применения в биологии, медицине и других областях, где важно обеспечить минимальную токсичность растворов наночастиц металлов для живых организмов.
В биохимическом синтезе сочетаются преимущества системы обратных мицелл и биологических восстановителей. В основе метода лежит восстановление ионов металлов в обратных мицеллах природными биологически активными веществами – растительными пигментами из группы флавоноидов. Используются три представителя этой группы- кверцетин, рутин и морин; первые два хорошо известны как вещества, обладающие выраженной антиоксидантной и радиопротекторной активностью и применяемые в медицине в качестве лекарственных средств и пищевых добавок. Изучение механизмов биологического действия флавоноидов (главным образом, путем изучения их реакций в водных растворах) позволило установить, что во многих случаях наблюдаемые эффекты обусловлены способностью этих веществ образовывать прочные комплексы с ионами металлов (главным образом, меди и железа), играющих важную роль в процессах перекисного окисления липидов. Наша идея состояла в том, что можно использовать эту способность флавоноидов для синтеза наночастиц металлов, если взаимодействие флавоноидов с ионами металлов будет происходить в водном ядре обратной мицеллы, то есть в среде, существенно отличающейся по свойствам от молекулярного раствора и, как известно из литературы, благоприятствующей образованию наночастиц в других вариантах химического синтеза. И действительно, реализация этой идеи позволила получить наночастицы золота, серебра, меди и других металлов.
Название «биохимический синтез» не вполне корректно, поскольку оно рождает аналогию с процессами биосинтеза, протекающими в живой клетке и являющимися одним из направлений исследований в биохимии, тогда как по существу речь идет о химической реакции восстановления ионов металла до атомов биологическими молекулами, которая запускает процесс агрегации атомов и ионов, то есть собственно синтез наночастиц. Аналогичная трудность возникает при формальном рассмотрении названий методов, использующих биологические восстановители («биовосстановление», «зеленый синтез», тот же «биохимический синтез»), о которых говорилось выше. В нашем случае из различных вариантов названия, обсуждавшихся на начальном этапе развития метода, со временем прочно утвердился лишь один - «биохимический синтез в обратных мицеллах» - поскольку в нем отражается основное отличие, с одной стороны, от химических методов, использующих небиологические восстановители в обратных мицеллах, и, с другой стороны, от химических методов, использующих биологические восстановители в водных растворах. В публикациях и докладах используется обычно сокращенный вариант – «биохимический синтез», с соответствующими пояснениями о сущности метода, если это оказывается необходимым.
По сравнению с другими химическими методами, биохимический синтез обладает рядом преимуществ, важных для практического применения металлических наночастиц. Сравнение с методами, использующими традиционные химические восстановители, выявляет следующие преимущества. Во-первых, при биохимическом синтезе образование наночастиц идет в растворе на воздухе, тогда как во многих других известных вариантах для получения наночастиц необходимо создавать вакуум или атмосферу инертного газа. Это обстоятельство, а также другие особенности процедуры синтеза позволяют избежать усложнений, необходимых в других методах (дополнительных синтезов, применения дорогостоящего или энергоемкого оборудования и др.), что значительно удешевляет конечный продукт. Во-вторых, оказывается возможным получать наночастицы, стабильные в растворе на воздухе в течение длительного времени (до нескольких лет), что весьма существенно как для исследования их свойств, так и для прикладных разработок. В то же время, известно, что в других случаях время жизни наночастиц часто не превышает нескольких дней. В-третьих, для некоторых металлов удается повысить степень превращения ионов металла в наночастицы по сравнению с достигаемой другими методами и уменьшить расход восстановителя, что важно, опять-таки, с экономической точки зрения. В-четвертых, применение природных восстановителей делает метод более экологически безопасным.
При биологическом восстановлении в водном растворе синтез также идет на воздухе, технологически не сложен, наночастицы в большинстве случаев стабильны в растворе на воздухе, раствор не содержит ядовитых примесей, так что здесь присутствуют почти все преимущества биохимического синтеза по сравнению с традиционными химическими методами, перечисленные выше. Однако имеются и проблемы, в силу которых этот способ получения наночастиц оказывается менее пригодным для практических целей, чем биохимический синтез. Во-первых, в большинстве случаев водный раствор, в котором образуются наночастицы, имеет сложный состав и неизвестно, какое вещество является восстановителем и в какой концентрации оно присутствует в растворе. Кроме того, состав раствора обычно плохо воспроизводим, поскольку он зависит от свойств биообъекта, которые, в свою очередь, могут существенно зависеть от его предыстории (например, для листьев растения – от условий (почвы, климата и т.д.), в которых оно выращено, фазы его развития, времени года). Во-вторых, для таких частиц характерно очень широкое распределение по размерам, что затрудняет исследования влияния размера частиц на их биологическую активность. В-третьих, скорость формирования и выход наночастиц часто бывают невелики, так что сложно быстро получить раствор с высокой концентрацией наночастиц, что требуется во многих вариантах применения.
- В биохимическом синтезе эти недостатки отсутствуют, но это не означает, что метод является универсальным и может применяться без каких-либо ограничений. Например, наночастицы в обратных мицеллах (в мицеллярных растворах) взвешены в органическом растворителе, что делает невозможным применение их в водных средах. Но эта проблема была решена путем разработки технологии приготовления водных растворов наночастиц из их мицеллярных растворов (см. раздел 5). Таким образом, удалось сохранить преимущества биохимического синтеза в обратных мицеллах и в то же время расширить поле исследований свойств наночастиц и спектр возможных применений.
- 1.2. Общая схема синтеза
Синтез проводится в обратных мицеллах из АОТ – анионного ПАВ, которое наиболее часто применяется для создания обратно-мицеллярных систем, поскольку оно хорошо растворимо во многих неполярных растворителях и позволяет получать стабильные обратные мицеллы в широком диапазоне концентраций ПАВ и степеней гидратации w = [H2O]/[ПАВ]. Строение обратной мицеллы в системе Н2О/АОТ/н-алкан в общем виде показано на рис.1. Для обычно используемой нами системы Н2О/АОТ/изооктан во всем диапазоне степеней гидратации (0.5
Р
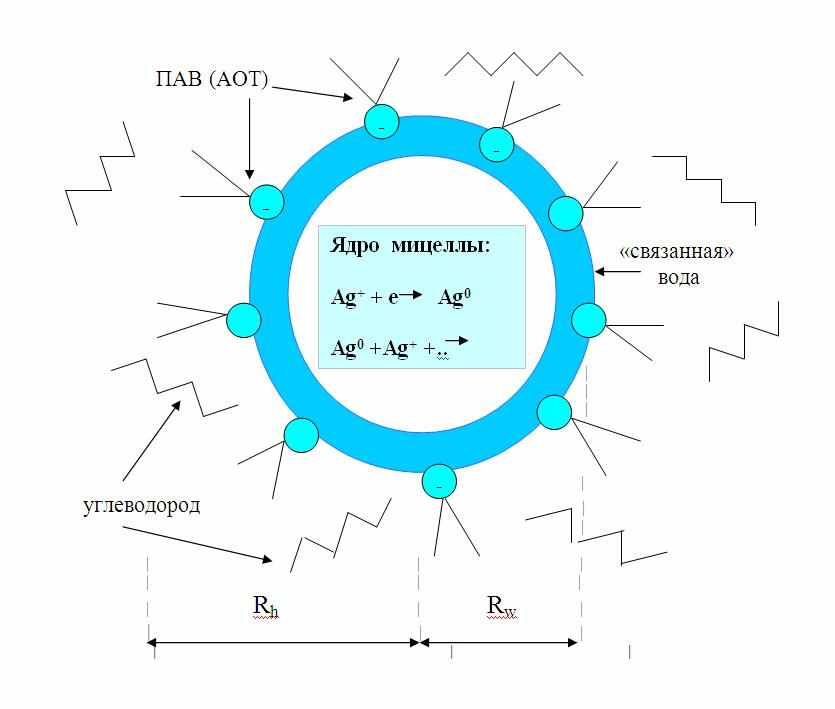 ис.1. Строение обратной мицеллы. Rh и Rw - соответственно, гидродинамический радиус и радиус водного ядра. «Связанная» вода – жестко структурированная вода в пограничном слое, где сказывается организующее влияние полярных головок ПАВ. При малых степенях гидратации (w<4), наиболее часто используемых в биохимическом синтезе, вся вода в ядре мицеллы является связанной. Восстановление ионов металла в ядре мицеллы показано на примере иона Ag+.
ис.1. Строение обратной мицеллы. Rh и Rw - соответственно, гидродинамический радиус и радиус водного ядра. «Связанная» вода – жестко структурированная вода в пограничном слое, где сказывается организующее влияние полярных головок ПАВ. При малых степенях гидратации (w<4), наиболее часто используемых в биохимическом синтезе, вся вода в ядре мицеллы является связанной. Восстановление ионов металла в ядре мицеллы показано на примере иона Ag+. О
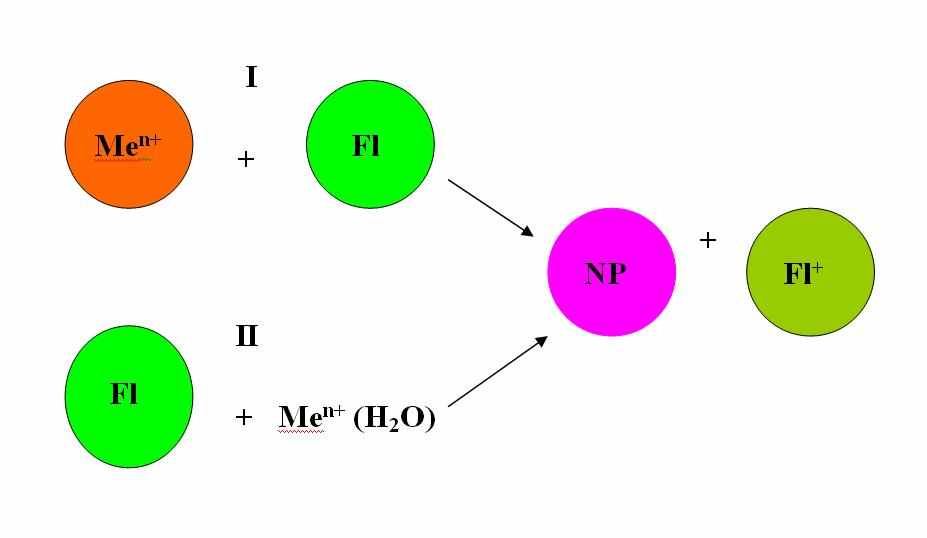 бщая схема биохимического синтеза показана на рис.2. Возможны два основных пути процесса: смешение предварительно отдельно приготовленных мицеллярных растворов флавоноида и соли металла (I) и введение водного раствора соли металла непосредственно в мицеллярный раствор флавоноида (II). В первом случае для приготовления мицеллярного раствора флавоноида используется его концентрированный раствор в этаноле или пропаноле. Во втором случае порошок флавоноида солюбилизируется в растворе АОТ/жидкий углеводород. В обоих случаях конечными продуктами являются наночастицы в водном ядре мицеллы и флавоноид в окисленной форме.
бщая схема биохимического синтеза показана на рис.2. Возможны два основных пути процесса: смешение предварительно отдельно приготовленных мицеллярных растворов флавоноида и соли металла (I) и введение водного раствора соли металла непосредственно в мицеллярный раствор флавоноида (II). В первом случае для приготовления мицеллярного раствора флавоноида используется его концентрированный раствор в этаноле или пропаноле. Во втором случае порошок флавоноида солюбилизируется в растворе АОТ/жидкий углеводород. В обоих случаях конечными продуктами являются наночастицы в водном ядре мицеллы и флавоноид в окисленной форме. Рис.2. Общая схема биохимического синтеза. Fl и Fl+ - флавоноид в молекулярной и окисленной форме, соответственно. NP – наночастица.
Для каждого металла требовалась специальная работа по подбору условий (концентраций реагентов, концентрации АОТ, степени гидратации, состава соли металла), которые обеспечивали высокую скорость образования и стабильность наночастиц, а также достаточно высокую степень превращения ионов металла в наночастицы. По наблюдениям, сделанным на начальном этапе работ по биохимическому синтезу, при использовании варианта I скорость реакции и выход наночастиц, как правило, оказывались меньше, чем при выборе варианта II, поэтому в дальнейшем наночастицы получали почти исключительно по этому последнему варианту. Вследствие особенностей оптических свойств комплексов флавоноидов с ионами металлов и металлических наночастиц, процесс формирования наночастиц сопровождается характерными изменениями окраски раствора, что часто позволяет визуально фиксировать момент начала синтеза и приблизительно оценивать скорость процесса.
1.3. Основные материалы и методы исследования
Для получения наночастиц использовали кверцетин (Qr), рутин (Ru) и морин (Mo) производства фирм Merck, Sigma-Aldrich или Acros, соли металлов (нитраты или сульфаты) марки х.ч. и золотохлористоводородную кислоту (ЗХВК), все отечественного производства, водный раствор аммиака, нормальные углеводороды (С6 – С8, чаще всего изооктан эталонный, Химмед), АОТ (бис-(2-этилгексил)сульфосукцинат натрия) производства фирм Acros или Aldrich. Растворы солей металлов и ЗХВК готовили на деионизованной воде, полученной с помощью прибора «Водолей» (НПО “Химприбор”, Москва). Для приготовления водных дисперсий наночастиц использовали дистиллированную воду. Контроль рН и ионного состава воды проводили методом потенциометрии на приборе «Экотест-2000» («Эконикс», Москва). Растворы аммиачных солей металлов готовили путем введения водного раствора аммиака в водный раствор соли металла до полного растворения выпадающего осадка гидроокиси металла и образования комплексных аммиак-содержащих катионов серебра ([Ag(NH3)2]+), и других металлов ([Cu(NH3)4]2+, [Zn(NH3)4]2+ , [Cо(NH3)4]2+ ,[Ni(NH3)4]2+ ) Соответственно, получали растворы диамминнитрата серебра и тетраамминнитратов или тетраамминсульфатов двухвалентных металлов, которые затем вводили в мицеллярный раствор флавоноида до заданной степени гидратации. Мицеллярные растворы флавоноидов готовили по разработанной нами стандартной методике. Вначале готовили раствор АОТ в углеводороде, затем в нем солюбилизировали флавоноид, взятый в виде порошка. При необходимости АОТ и флавоноиды предварительно подвергали сушке для уменьшения содержания гидратационной воды. Концентрацию флавоноидов в растворе определяли методом спектрофотометрии; для этого предварительно находили их коэффициенты экстинкции в мицеллярном растворе.
Контроль формирования и стабильности, а также исследования оптических и адсорбционных свойств наночастиц осуществляли путем измерения спектров оптического поглощения с использованием спектрофотометров Specord M40 (Carl Zeiss, Германия) и Helios-α (Thermo Electronics, Великобритания). Размеры частиц в растворе определяли методом фотонной корреляционной спектроскопии (ФКС) на приборах Coulter N4 MD (Coulter Electronics, США) и Horiba LB 550 (Horiba, Япония). Микрофотографии наночастиц получали методом просвечивающей электронной микроскопии (ТЕМ). Для этого использовали электронный микроскоп LEO912 AB OMEGA с ускоряющим напряжением 120 кВ (Carl Zeiss, Германия), доступный в центре коллективного пользования биологического факультета МГУ.
- Примеры синтеза наночастиц металлов
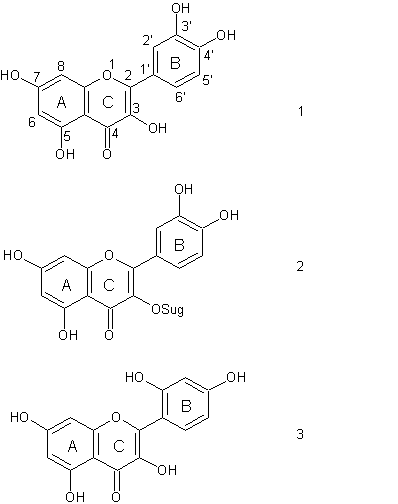
Растительные пигменты группы флавоноидов, в том числе используемые нами кверцетин, рутин и морин – это низкомолекулярные полифенольные соединения, основой которых является трехкольцевая структура: два ароматических кольца (А и В), соединенных между собой гетероциклом (С), содержащим кислород (рис.3).
М
 ицеллярные растворы этих флавоноидов, как и их водно-спиртовые или водные растворы, имеют две основные полосы поглощения в УФ области спектра (рис.4): полосу I и полосу II в интервале, соответственно, 360-380 нм и 240-270 нм. Полосы поглощения обусловлены π – π* переходами в двух хромофорных системах: полоса I – в кольце В, сопряженном с трехуглеродным фрагментом кольца С, полоса II – в кольце А, с
ицеллярные растворы этих флавоноидов, как и их водно-спиртовые или водные растворы, имеют две основные полосы поглощения в УФ области спектра (рис.4): полосу I и полосу II в интервале, соответственно, 360-380 нм и 240-270 нм. Полосы поглощения обусловлены π – π* переходами в двух хромофорных системах: полоса I – в кольце В, сопряженном с трехуглеродным фрагментом кольца С, полоса II – в кольце А, с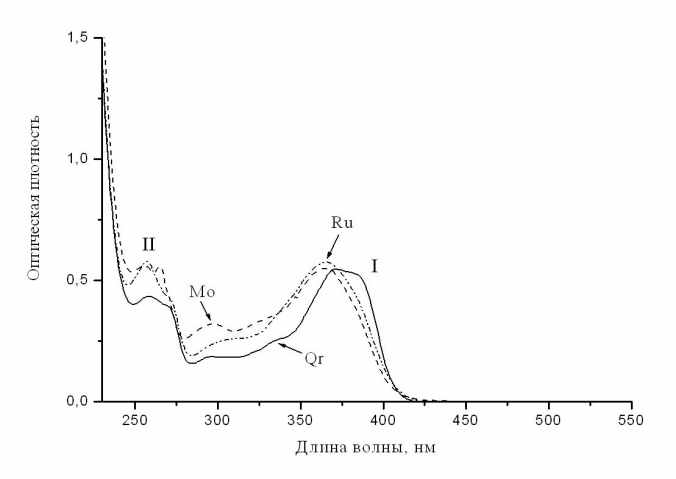 опряженном с кольцом С.
опряженном с кольцом С.Рис.3 (слева). Структура молекул флавоноидов, используемых в биохимическом синтезе. 1 – кверцетин, 2 - рутин, 3 – морин. Sug – дисахарид, состоящий из остатков глюкозы и рамнозы.
Рис.4 (сверху). Спектры оптического поглощения флавоноидов – кверцетина (Qr), рутина (Ru) и морина (Mo) в мицеллярных растворах. I и II - две основные полосы поглощения.
Введение водных растворов солей металлов в мицеллярные растворы флавоноидов с последующим встряхиванием в течение нескольких минут приводит к более или менее быстрым изменениям окраски и спектра поглощения растворов, отражающим различные стадии взаимодействия флавоноидов с ионами металлов, завершающиеся образованием наночастиц. Синтез наночастиц осуществлялся главным образом на растворах кверцетина; проводились также эксперименты с рутином и морином для выяснения влияния различий в структуре флавоноидов на процесс формирования наночастиц. Ниже приведено несколько примеров синтеза наночастиц.
