Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01. 06 Биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат диссертации |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы серебра в коллоидных растворах и их применение, 25.84kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
- Ю. М. Дедков, М. Г. Слотинцева Сб. «Свойства и применение платиновых металлов и сплавов, 100.81kb.
- Координационные взаимодействия глюкозамина, хитозана и их гидрохлоридов с ионами d-металлов, 403.45kb.
- Доцента кафедры Хиээ ланской, 49.44kb.
- Метод биосорбции тяжелых металлов из промышленных сточных вод с использованием пивоваренных, 350.37kb.
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Строения металлов и их свойства, 394.29kb.
Наночастицы серебра
Введение водного раствора соли серебра в мицеллярный раствор Qr, после встряхивания в течение 1-3-х мин приводит к резкому изменению окраски раствора – от бесцветной или бледно-желтой до красно-коричневой разной интенсивности или почти черной, в зависимости от концентрации образующихся наночастиц. В спектре поглощения исчезают обе полосы Qr и появляется новая полоса в видимой области с максимумом в интервале 420-440 нм, характерным для наночастиц серебра в обратных мицеллах. Эта новая полоса постепенно растет и через 1-4 суток оптическая плотность в максимуме полосы (Dmax) достигает наибольшей величины (Dоmax). В последующие несколько недель оптическая плотность отклоняется от Dоmax не более чем на 10%, так что значение Dоmax считается соответствующим завершению процесса формирования наночастиц (стационарная стадия). Типичное изменение спектра поглощения мицеллярного раствора Qr после введения раствора соли серебра показано на рис.5. Интенсивная окраска раствора позволяет визуально контролировать стабильность наночастиц и приблизительно оценивать изменения их концентрации.
Р
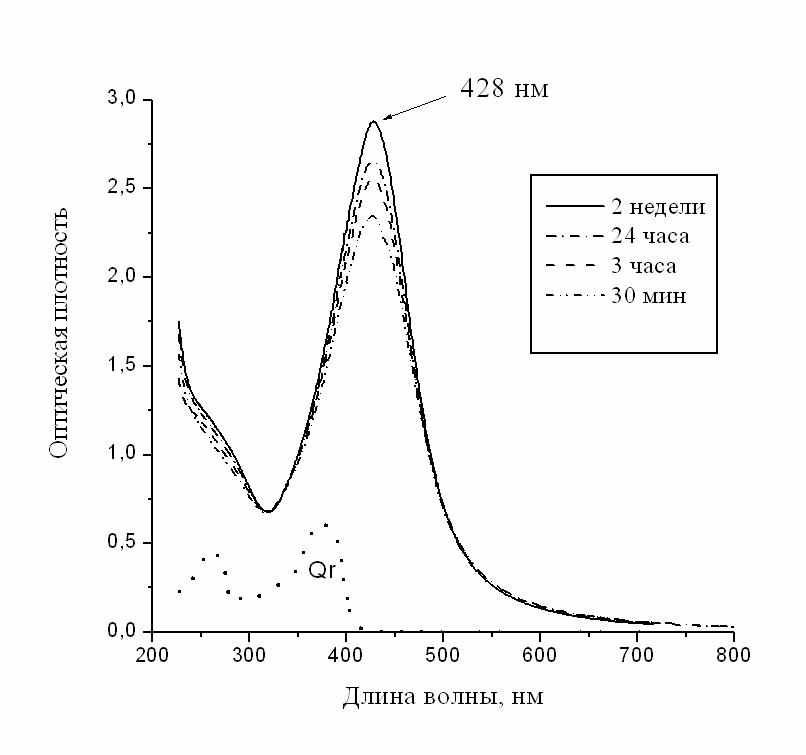 ис.5. Характерный вид изменения спектра мицеллярного раствора кверцетина после введения водного раствора соли серебра. C(Qr) = 0.236 mM, C(Ag) = 3 mM (концентрация введенной соли металла), С(АОТ) = 0.15 М, w = 3.7. Для сравнения приведен спектр исходного раствора кверцетина. Здесь и на последующих рисунках приведены спектры, снятые при длине оптического пути 1 мм.
ис.5. Характерный вид изменения спектра мицеллярного раствора кверцетина после введения водного раствора соли серебра. C(Qr) = 0.236 mM, C(Ag) = 3 mM (концентрация введенной соли металла), С(АОТ) = 0.15 М, w = 3.7. Для сравнения приведен спектр исходного раствора кверцетина. Здесь и на последующих рисунках приведены спектры, снятые при длине оптического пути 1 мм. Концентрация наночастиц в растворе измеряется в единицах либо молярной концентрации (эквивалентной концентрации соли металла), либо весовой концентрации (весовое содержание металла в виде наночастиц); последнюю находят путем пересчета из молярной концентрации с использованием атомного веса металла. Для определения молярной концентрации из спектра поглощения необходим коэффициент экстинкции наночастиц, который для большинства металлов неизвестен, поскольку, как правило, сложно определить, какая часть введенных в раствор ионов металла превратилась в наночастицы. Для нескольких металлов (Ag, Au, Cu) коэффициенты экстинкции можно найти в литературе, однако они могут зависеть от метода получения наночастиц и поэтому для надежного определения концентрации желательно иметь коэффициенты экстинкции, найденные для своей экспериментальной системы. Такая работа была проделана нами для наночастиц Ag (см. раздел 4).
Для прикладных исследований была разработана стандартная процедура, позволяющая получать растворы с концентрациями наночастиц порядка нескольких миллимолей (нескольких сотен мг/л) и средними размерами в интервале 8-10 нм. На рис. 6 показан пример электронной микрофотографии и соответствующего распределения по размерам в стандартном мицеллярном растворе.
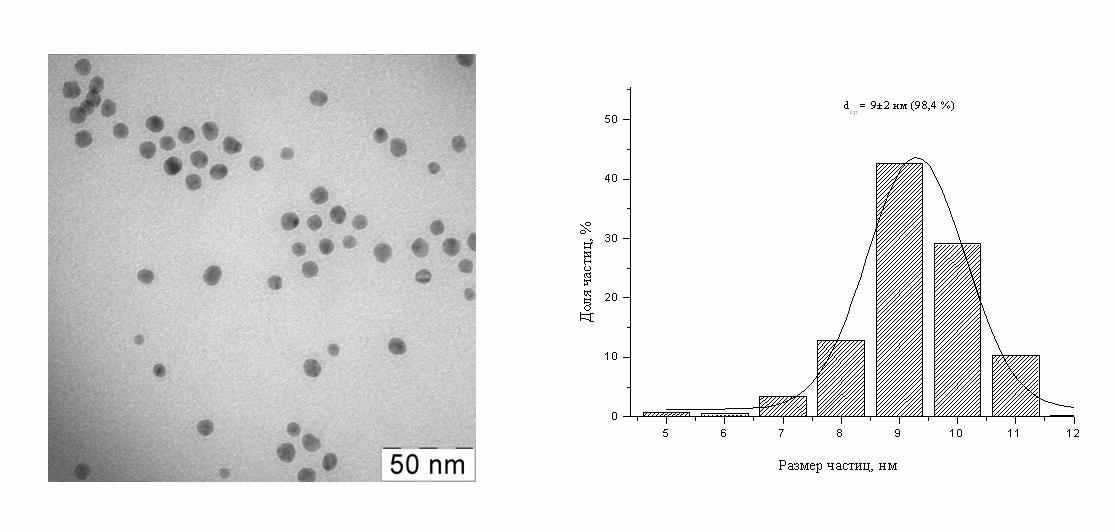 Рис.6. Электронная микрофотография и гистограмма распределения по размерам в стандартном мицеллярном растворе наночастиц серебра. w=3.7.
Рис.6. Электронная микрофотография и гистограмма распределения по размерам в стандартном мицеллярном растворе наночастиц серебра. w=3.7. Частицы сферические, средний размер 9 нм, разброс по размерам ± 2 нм. Анализ электронных дифрактограмм показывает, что наночастицы имеют кристаллическую структуру с параметрами решетки, близкими к таковым для кристаллов золота. На рис.7 приведена типичная гистограмма для стандартного раствора, полученная методом ФКС.
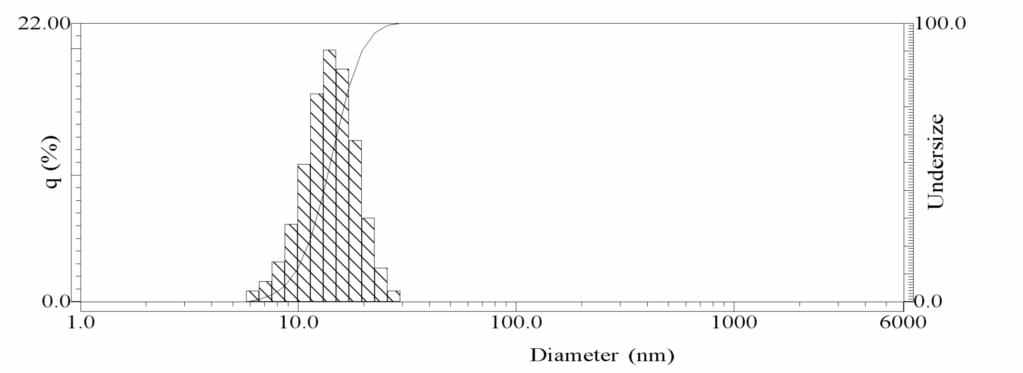
Рис.7. Типичная гистограмма распределения частиц по размерам в стандартном мицеллярном растворе наночастиц серебра, полученная методом ФКС. Средний размер частиц – 14.1 нм.
Средний размер частиц здесь, как правило, оказывается несколько больше, чем дает электронная микроскопия. Такое увеличение среднего диаметра (или гидродинамического радиуса) по сравнению с данными электронной микроскопии наблюдалось для частиц разной природы – латексов, липосом, наночастиц металлов и оксидов. Связывалось это, главным образом, с тем, что метод ФКС чрезвычайно чувствителен к присутствию частиц большего размера, поскольку они наиболее сильно рассеивают свет и потому даже их относительно небольшой численный вклад в общее количество частиц может приводить к заметному увеличению измеряемого среднего размера.
Для различных специальных целей можно получать наночастицы других средних размеров (в интервале 5 – 25 нм), а также других форм; в последнем случае имеются в виду смеси наночастиц разной формы (сферы, треугольники, шестигранники и др.). Наночастицы в мицеллярном растворе сохраняются в течение длительного времени (до нескольких лет). При этом возможны небольшие изменения концентрации, а также среднего размера и формы наночастиц; последние отражают, вероятно, медленно текущие процессы кристаллообразования, агрегации наночастиц и диссоциации этих агрегатов.
Наночастицы золота
В
 ведение водного раствора HAuCl4 в мицеллярный раствор Qr приводит к изменению цвета раствора и формированию полосы наночастиц. Скорость процесса, размеры и форма наночастиц зависят от параметров системы (концентраций реагентов и АОТ, степени гидратации). При w ≥ 2 в течение 1-2-х мин раствор приобретает красно-фиолетовую окраску;
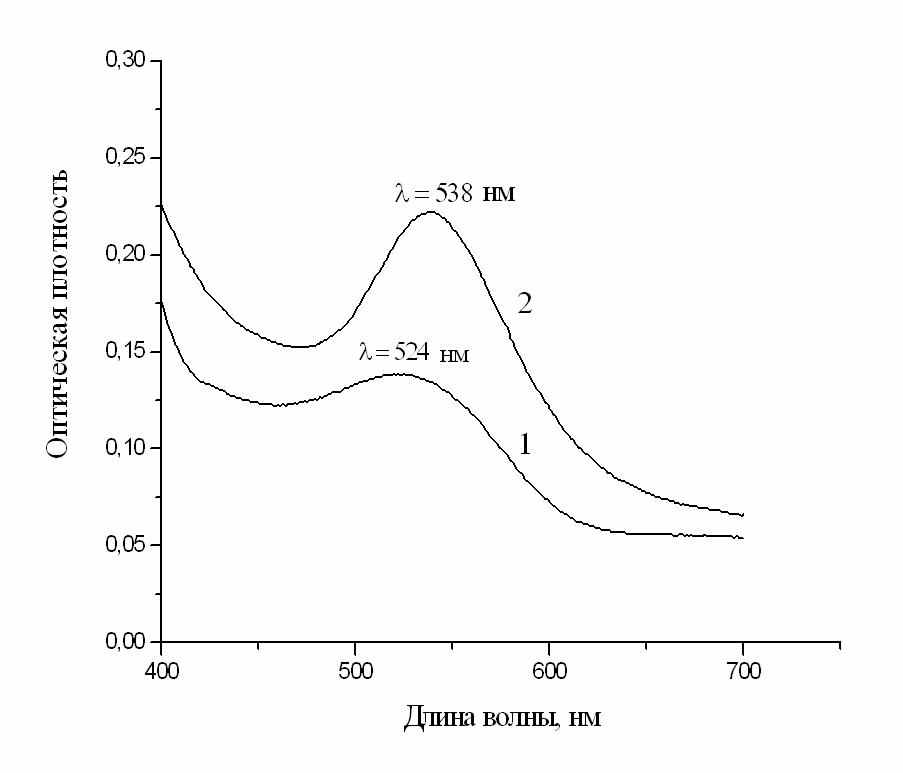
ведение водного раствора HAuCl4 в мицеллярный раствор Qr приводит к изменению цвета раствора и формированию полосы наночастиц. Скорость процесса, размеры и форма наночастиц зависят от параметров системы (концентраций реагентов и АОТ, степени гидратации). При w ≥ 2 в течение 1-2-х мин раствор приобретает красно-фиолетовую окраску; Рис.8. Спектры поглощения мицеллярных растворов наночастиц золота разного цвета: 1-красного, 2- красно-фиолетового.
в течение последующих 10-15-ти мин интенсивностьокраски усиливается, затем изменения цвета прекращаются и этот красно-фиолетовый раствор сохраняется в течение нескольких лет. При меньших степенях гидратации изменения цвета происходят медленнее; вначале появляется ярко-красная (рубиновая) окраска, которая видна первые 5-10 мин. Затем постепенно проявляется фиолетовый оттенок, через 40-60 мин раствор приобретает устойчивый красно-фиолетовый цвет. Пример спектров красного (w=0.75) и красно-фиолетового (w=2) растворов показан на рис.8. Максимумы поглощения в обоих случаях лежат в области характерного максимума наночастиц золота: для красного раствора – при 523-526 нм, для красно-фиолетового – при 537-538 нм.
Известно, что цвет золей золота зависит от размера частиц; частицы красного золя меньше, чем синего или фиолетового. Это наблюдение соответствует результатам наших определений размеров частиц методом ТЕМ. На рис.9 и 10 показаны микрофотографии наночастиц, соответственно, красного и красно- фиолетового золя.
В
 первом случае частицы сферические, имеют размеры в интервале 3-5 нм, то есть представляют собой практически монодисперсный образец. Во втором случае частицы явно
первом случае частицы сферические, имеют размеры в интервале 3-5 нм, то есть представляют собой практически монодисперсный образец. Во втором случае частицы явноРис.9. Электронная микрофотография наночастиц золота в красном мицеллярном растворе.
большего размера, с заметным разбросом; анализ гистограммы в Гауссовом приближении дает 16 ± 8 нм.

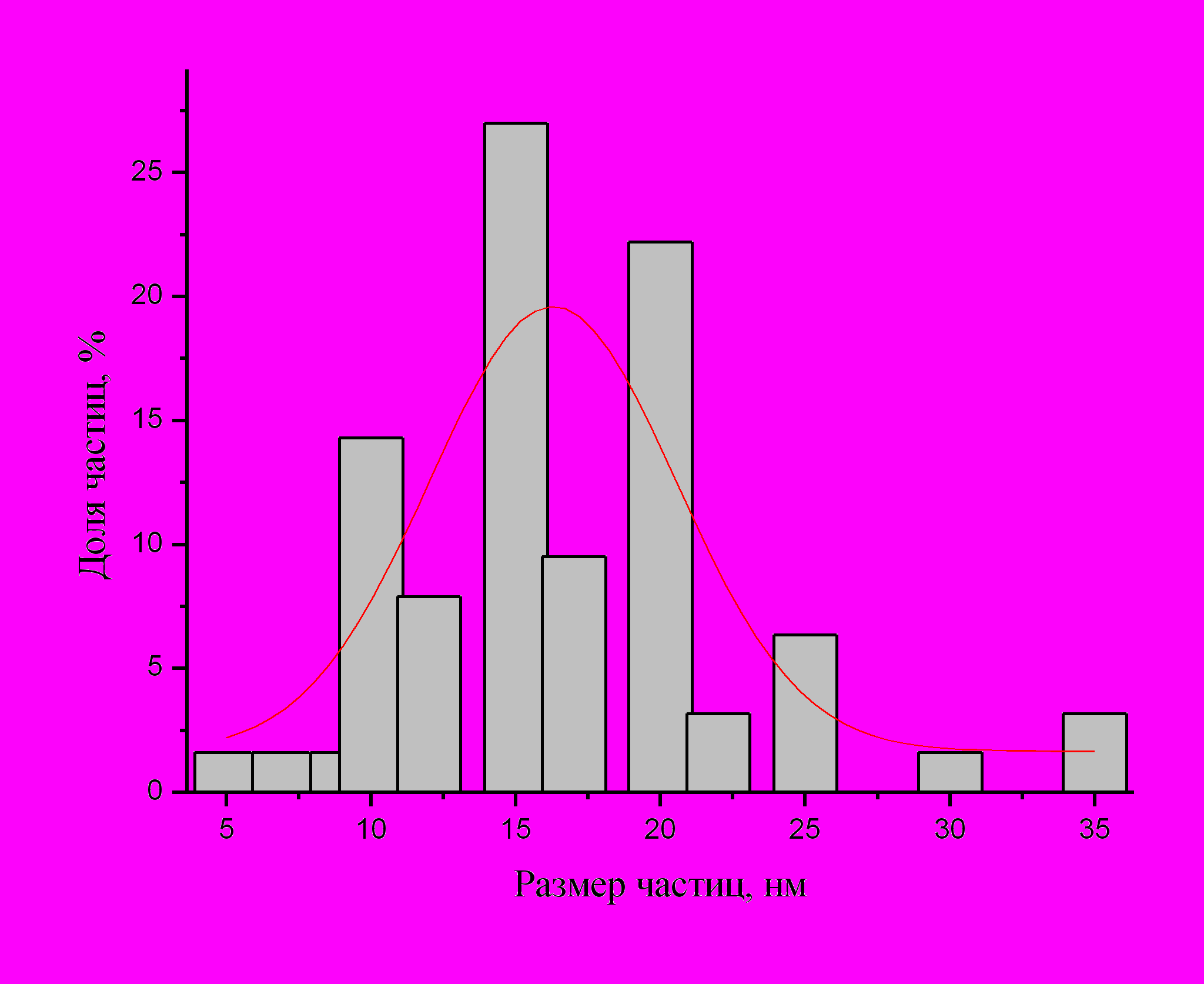
Рис.10. Электронная микрофотография и гистограмма распределения частиц по размерам в красно-фиолетовом мицеллярном растворе наночастиц золота.
Кроме того, здесь образуются частицы разных форм – помимо сферических, имеются также треугольные, пятиугольные, шестиугольные и цилиндрические частицы; пример частиц разной формы крупным планом показан на рис.11. На многих фотографиях выявляется также кристаллическая структура наночастиц, что подтверждается
Р
 ис.11. Электронная микрофотография наночастиц золота разной формы, присутствующих в красно-фиолетовом растворе.
ис.11. Электронная микрофотография наночастиц золота разной формы, присутствующих в красно-фиолетовом растворе. соответствующими дифрактограммами.
Исследование красно-фиолетовых растворов наночастиц золота методом ФКС дает завышенные значения размеров частиц, причем расхождение с данными ТЕМ здесь, как правило, больше, чем для наночастиц серебра. Это может быть следствием более значительного вклада крупных частиц, либо влияния отклонений формы частиц от сферической, которая предполагается в методе ФКС при расчете гидродинамического радиуса по уравнению Стокса-Эйнштейна.
Наночастицы меди и цинка
Введение водных растворов аммиачных солей меди и цинка (тетраамминсульфатов или тетраамминнитратов) в мицеллярный раствор Qr приводит к резким изменениям окраски, свидетельствующим об образовании вначале комплекса кверцетина с ионами металла, а затем наночастиц. В случае меди раствор наночастиц медно-красный; максимум полосы поглощения лежит при 550±5 нм, в области, характерной для поглощения этих наночастиц (550-570) нм. Типичный спектр поглощения показан на рис.12.
Р
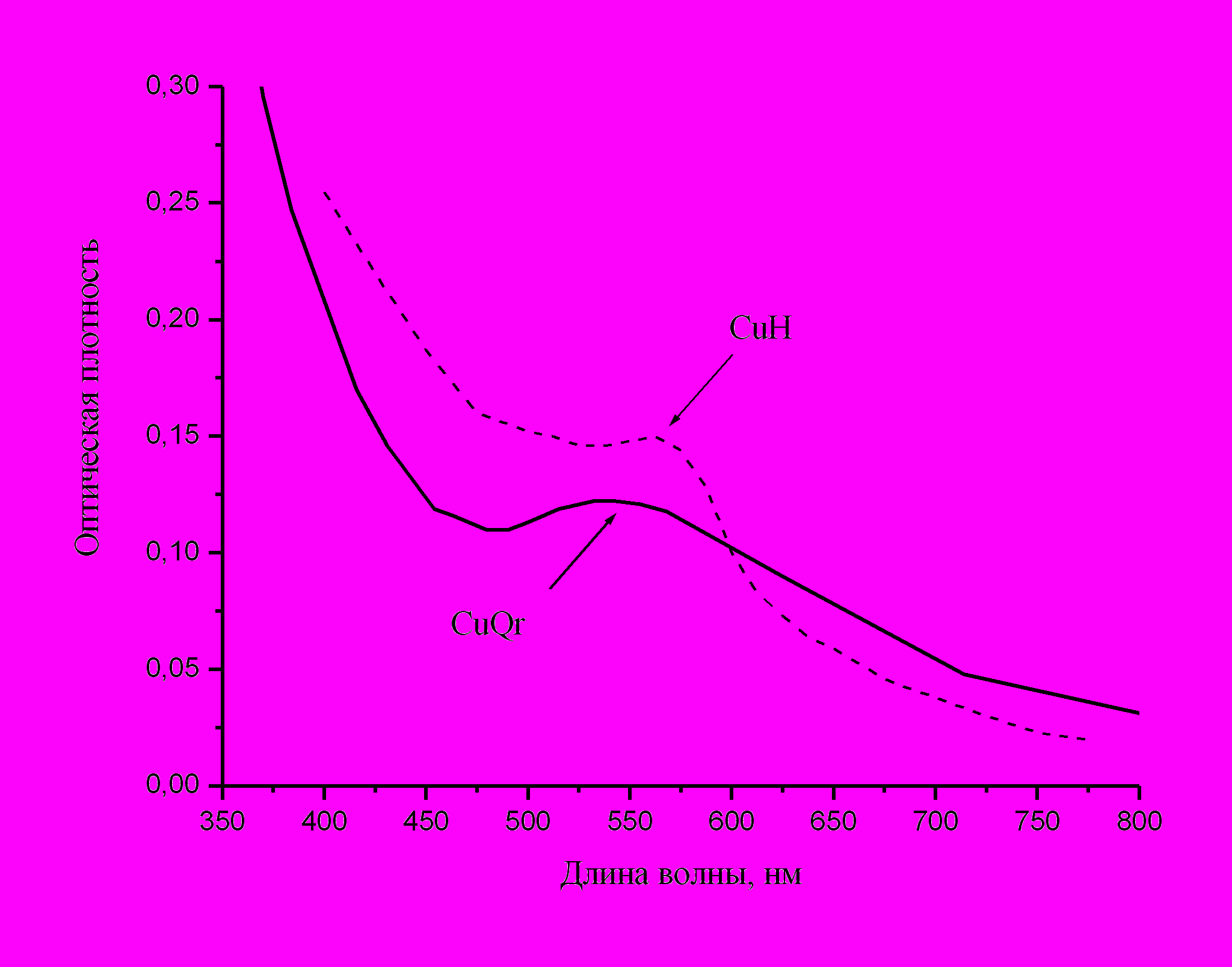 ис.12.. Спектр поглощения наночастиц меди, полученных биохимическим синтезом (CuQr) на стационарной стадии, w = 3.7. Для сравнения показан спектр наночастиц меди, полученных в обратных мицеллах восстановлением гидразином (CuH) при w = 4 [Lisiecki I., Pileni M.-P., 1995].
ис.12.. Спектр поглощения наночастиц меди, полученных биохимическим синтезом (CuQr) на стационарной стадии, w = 3.7. Для сравнения показан спектр наночастиц меди, полученных в обратных мицеллах восстановлением гидразином (CuH) при w = 4 [Lisiecki I., Pileni M.-P., 1995]. Сравнение со спектром наночастиц меди, полученных восстановлением гидразином в обратных мицеллах при близкой степени гидратации показывает, что положение максимума практически одинаково, но в нашем случае полоса наночастиц выражена более четко, возможно вследствие более высокой степени превращения ионов меди и соответственно, более низкой оптической плотности в УФ области спектра засчет уменьшения концентрации не восстановленных ионов металла. Поглощение при 800 нм (характеризующее концентрацию оксида меди в растворе) в обоих случаях незначительно; это показывает, что при биохимическом синтезе достигается столь же малая степень окисления наночастиц кислородом воздуха, как и при использовании традиционного химического восстановителя. Электронная микрофотография наночастиц меди показана на рис.13.
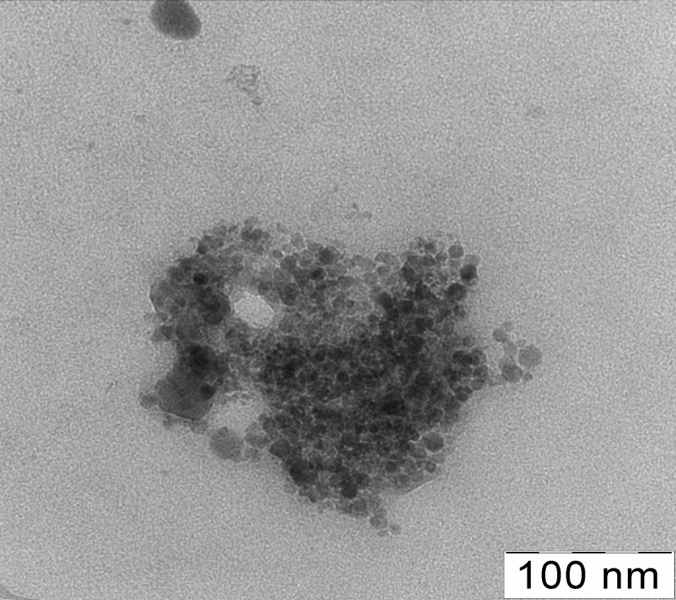
Рис.13. Электронная микрофотография наночастиц Cu в мицеллярном растворе. Наночастицы приблизительно сферические. Средний размер не превышает 15 нм.
Раствор наночастиц цинка темно-бурый, полоса поглощения в интервале 260-280 нм, характерном для наночастиц этого металла. На рис.14 показаны микрофотография и гистограмма распределения частиц по размерам для мицеллярного раствора.
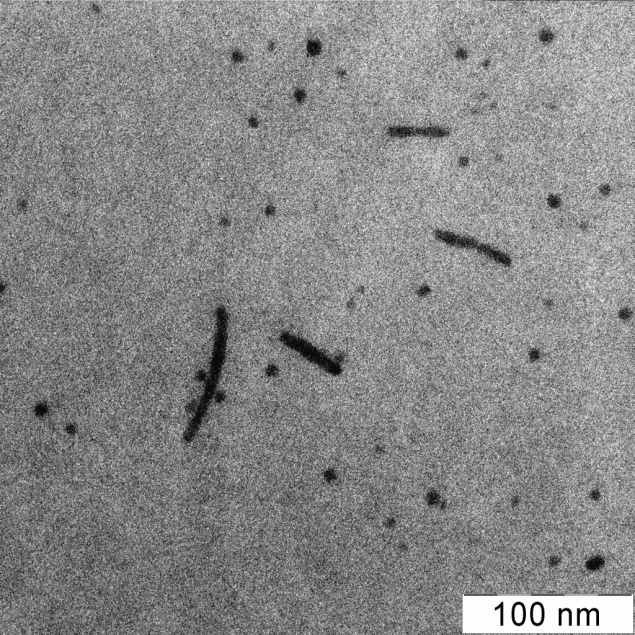
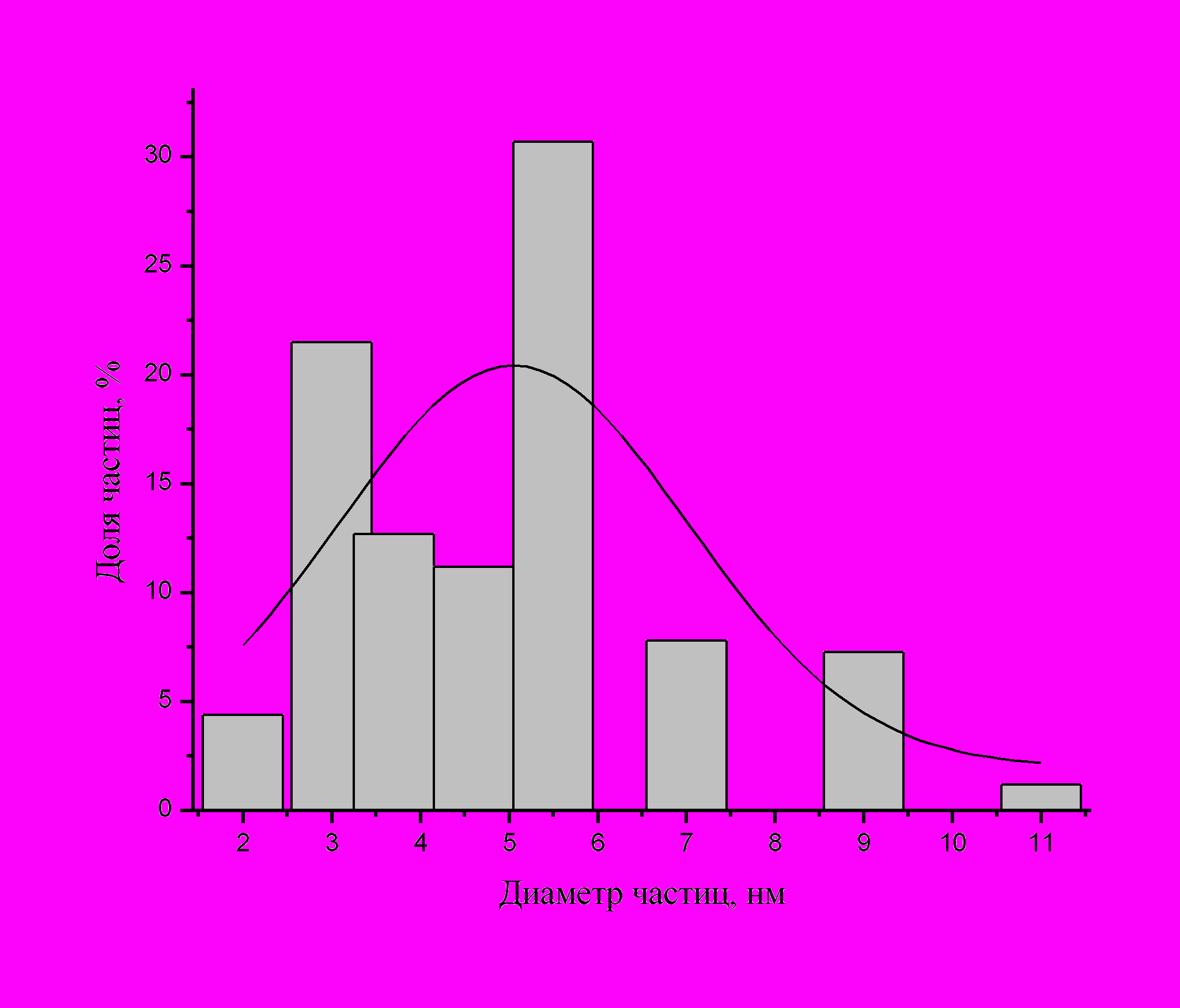
Рис.14. Электронная микрофотография и гистограмма распределения частиц по размерам в мицеллярном растворе наночастиц цинка. Средний размер (сферических) частиц 5.05 ± 3.94 нм.
Видно, что частицы в основном сферические, малого размера; более 80% частиц имеют диаметр 2-7 нм. Обработка гистограммы в приближении распределения Гаусса дает средний размер 5.05 ±3.94 нм. Имеются также стержнеобразные частицы толщиной около 5-ти нм и длиной 30-50 нм.
- Основные направления исследований
Н
 а рис.15 представлены основные направления, в которых проводились работы по синтезу и исследованию свойств наночастиц металлов. Нашими основными объектами являлись (1) мицеллярные растворы наночастиц серебра, золота, меди, цинка, кобальта и никеля и (2) водные растворы наночастиц серебра, золота, меди и цинка, получаемые из их мицеллярных растворов по разработанной нами технологии.
а рис.15 представлены основные направления, в которых проводились работы по синтезу и исследованию свойств наночастиц металлов. Нашими основными объектами являлись (1) мицеллярные растворы наночастиц серебра, золота, меди, цинка, кобальта и никеля и (2) водные растворы наночастиц серебра, золота, меди и цинка, получаемые из их мицеллярных растворов по разработанной нами технологии. Рис.15. Основные направления исследований процесса формирования и свойств наночастиц металлов, получаемых методом биохимического синтеза.
На мицеллярных растворах проводились исследования влияния различных факторов на скорость формирования, выход, размеры и стабильность наночастиц, а также механизма взаимодействия флавоноидов с ионами металлов в обратных мицеллах, лежащего в основе синтеза наночастиц.
Результаты этих работ использовались при получении водных растворов и в исследованиях различных свойств наночастиц. На мицеллярных растворах исследовались каталитические свойства наночастиц серебра, меди, кобальта и никеля, адсорбционные и антимикробные свойства наночастиц серебра и меди. На водных растворах исследовались адсорбционные свойства и биологическое действие наночастиц серебра; последнее включало как антимикробную активность, так и токсические эффекты на других живых организмах. На основе изучения адсорбционных свойств были получены различные твердые материалы с нанесенными наночастицами, которые также использовались для исследований антимикробной или каталитической активности наночастиц.
Прежде чем дать здесь краткое описание содержания работ в каждом из направлений, необходимо определить главную линию или общий принцип, которому были подчинены наши исследования. Как должно быть ясно из цели нашей работы, создание нового направления в области синтеза наночастиц металлов было ориентировано прежде всего на получение практических результатов. Поэтому следует иметь в виду, что большинство вопросов, которые ставились и решались в ходе наших работ, были более или менее непосредственно подчинены требованиям, обусловленным конкретной прикладной задачей или запросами потребителей (частных компаний или государственных предприятий), заинтересованных в применении растворов наночастиц для модификации своей продукции или разработки новых образцов.
3. Влияние различных факторов на скорость формирования, выход, размеры и стабильность наночастиц
Скорость формирования, выход, размеры и стабильность наночастиц зависят от концентраций соли металла и флавоноида, концентрации АОТ, степени гидратации, состава соли металла. Так, скорость формирования и выход наночастиц увеличиваются с увеличением концентрации соли металла; при этом увеличиваются средний размер частиц и ширина распределения. Два последних параметра увеличиваются также с увеличением степени гидратации; при w превышающей некоторое пороговое значение уменьшается стабильность системы. Изменение концентрации АОТ мало влияет на скорость формирования и выход наночастиц; однако чрезмерное уменьшение его концентрации приводит к уменьшению стабильности системы. Влияние концентрации АОТ на размеры частиц зависит от концентрации ионов металла: так, для наночастиц Ag при большой концентрации ионов серебра оно не проявляется, при малой их концентрации увеличение концентрации АОТ приводит к уменьшению среднего размера частиц. Существенным параметром является также состав соли металла. Заметное увеличение скорости формирования и выхода наночастиц наблюдается при переходе от простой соли серебра (нитрата) к комплексной (диамминнитрату). Для других металлов – меди, цинка, кобальта и никеля – наночастицы образуются лишь при взаимодействии флавоноидов с тетраамминнитратами этих металлов, но не с простыми солями, независимо от природы аниона (сульфаты или нитраты).
З
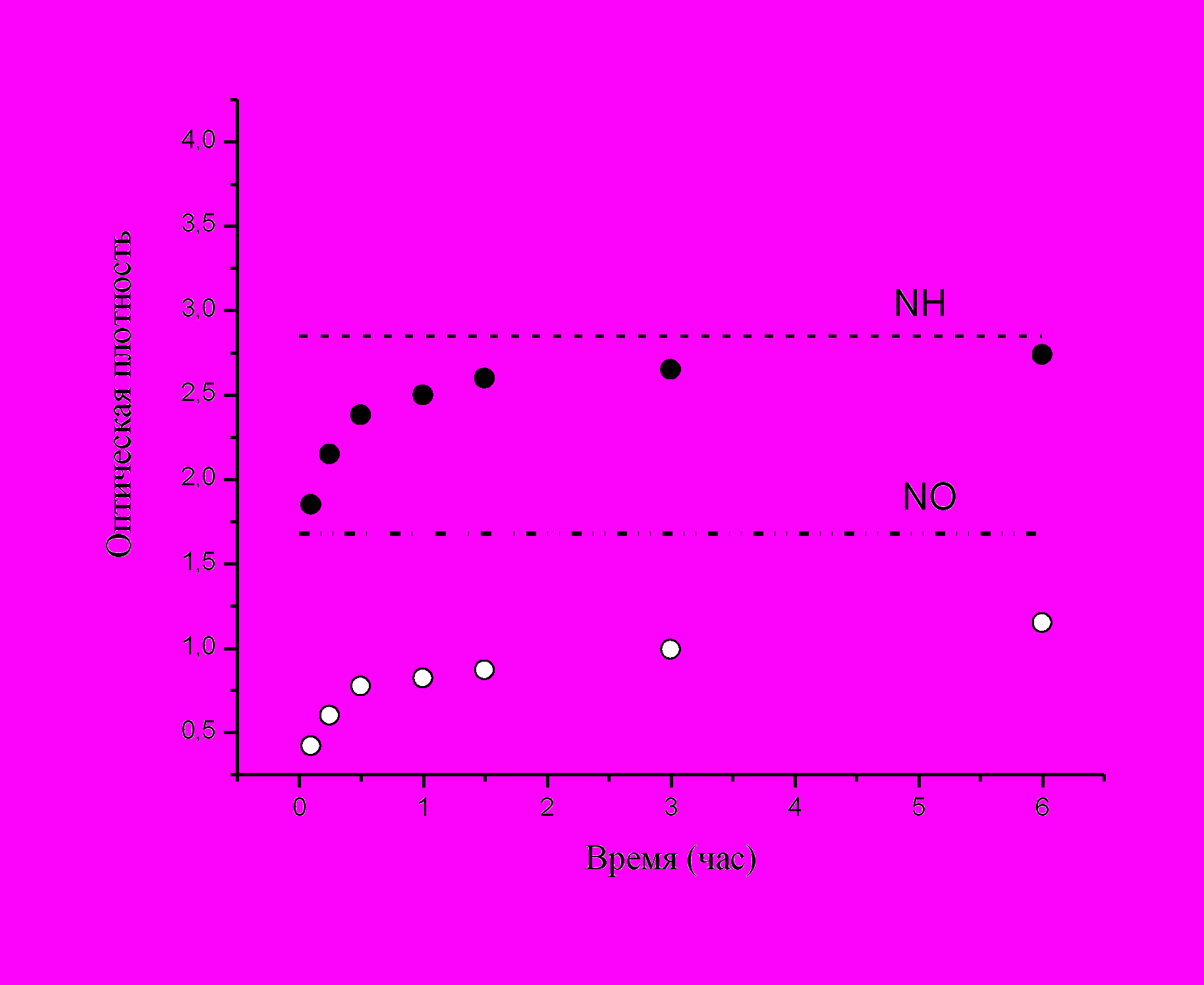 десь мы приводим два примера, иллюстрирующие (1) влияние состава соли серебра на скорость формирования и выход наночастиц и (2) влияние степени гидратации на размеры и ширину распределения наночастиц серебра в мицеллярном растворе. На рис.16 показаны зависимости степени превращения от времени для разных солей серебра при одинаковой начальной концентрации соли в мицеллярном растворе. Видно, что скорость роста концентрации и выход наночастиц
десь мы приводим два примера, иллюстрирующие (1) влияние состава соли серебра на скорость формирования и выход наночастиц и (2) влияние степени гидратации на размеры и ширину распределения наночастиц серебра в мицеллярном растворе. На рис.16 показаны зависимости степени превращения от времени для разных солей серебра при одинаковой начальной концентрации соли в мицеллярном растворе. Видно, что скорость роста концентрации и выход наночастицРис.16. Изменение значений Dmax в течение первых 6-ти часов формирования наночастиц из нитрата (о) и диамминнитрата () серебра при одинаковой концентрации этих солей в мицеллярном растворе (3мМ) и одинаковых значениях других параметров системы. Штриховыми линиями показаны значения Dmax, достигаемые на стационарной стадии (D0max) с нитратом (NO) и диамминнитратом (NH).
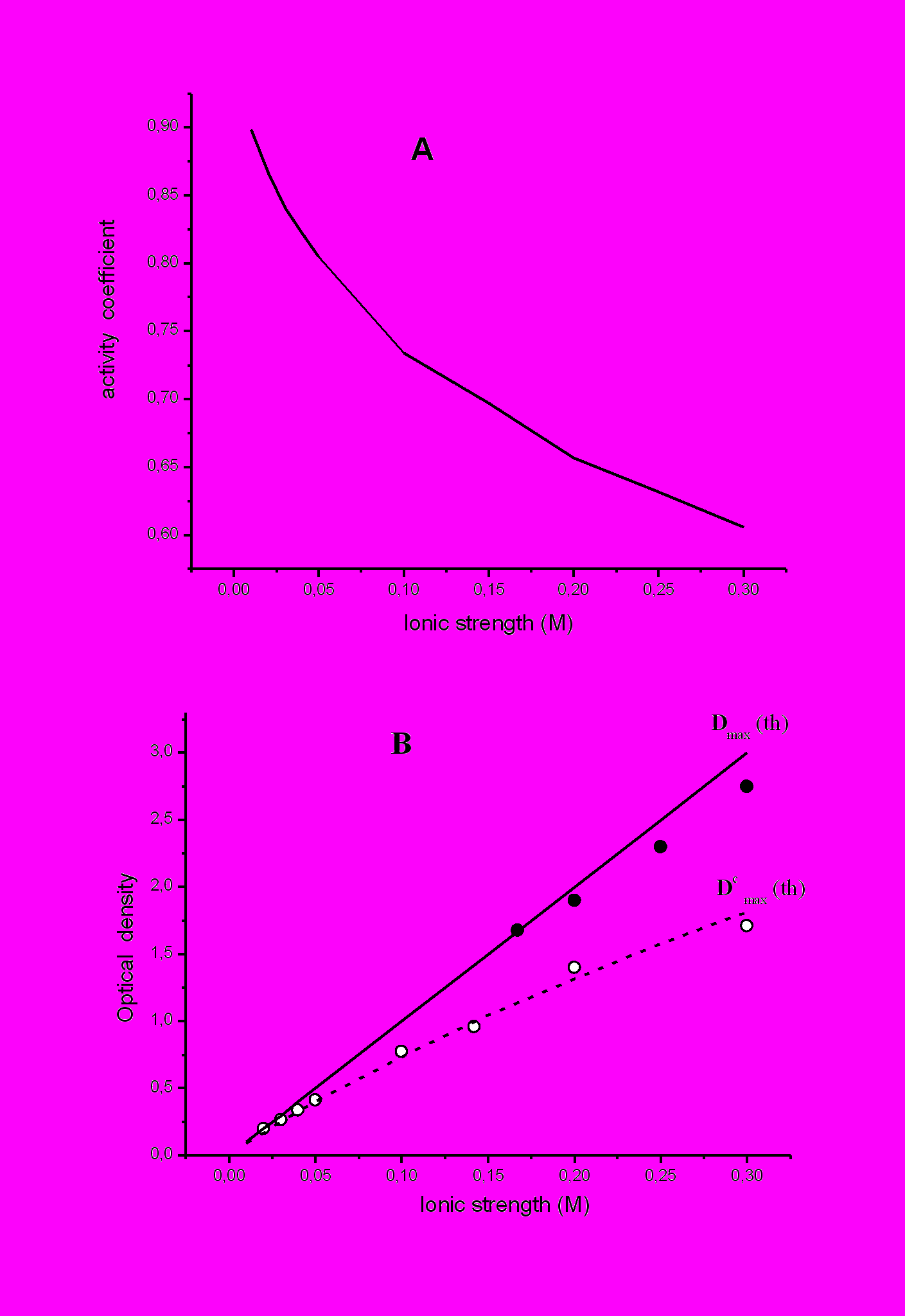 (отношения концентраций наночастиц на стационарной стадии к концентрации соли металла, пропорциональные значениям D0max) существенно больше в случае аммиачной соли, [Ag(NH3)2]NO3, чем в случае простого нитрата, AgNO3. Выяснение природы такого различия показало (рис.17), что наиболее вероятной причиной ускорения формирования наночастиц при использовании аммиачной соли серебра (при концентрациях соли серебра в исходном водном растворе, не превышающих 0.3M) можно считать увеличение эффективной концентрации вводимых ионов металла вследствие различия в коэффициентах активности двух исследованных солей.
(отношения концентраций наночастиц на стационарной стадии к концентрации соли металла, пропорциональные значениям D0max) существенно больше в случае аммиачной соли, [Ag(NH3)2]NO3, чем в случае простого нитрата, AgNO3. Выяснение природы такого различия показало (рис.17), что наиболее вероятной причиной ускорения формирования наночастиц при использовании аммиачной соли серебра (при концентрациях соли серебра в исходном водном растворе, не превышающих 0.3M) можно считать увеличение эффективной концентрации вводимых ионов металла вследствие различия в коэффициентах активности двух исследованных солей. Рис.17. Проявление неидеальности водного раствора нитрата серебра. А – зависимость коэффициента активности () от концентрации раствора AgNO3 , рассчитанная по теории Дебая-Гюккеля в интервале 0.01-0.1 М и по уравнению Гиббса-Дюгема в интервале 0.1-0.3 М. В – Сравнение теоретических (линии) и экспериментальных (точки) зависимостей значений Dmax на стационарной стадии от концентрации соли серебра в исходном водном растворе. Сплошная линия – идеальный раствор ( = 1). Штриховая линия – раствор, в котором изменяется как на рис.17А.о – нитрат, - диамминнитрат
На рис.18 приведены гистограммы распределения по размерам для наночастиц серебра, полученных при одинаковых концентрациях кверцетина, соли металла, АОТ и степенях гидратации w =3.7 (a) и 10 (б). Видно, что в первом случае средний размер и ширина распределения (4.6 ± 1.8 нм) существенно меньше, чем во втором (10.35 ± 2.5 нм). Такое различие имеет значение, например, для исследований влияния размера наночастиц на их биологическую активность.
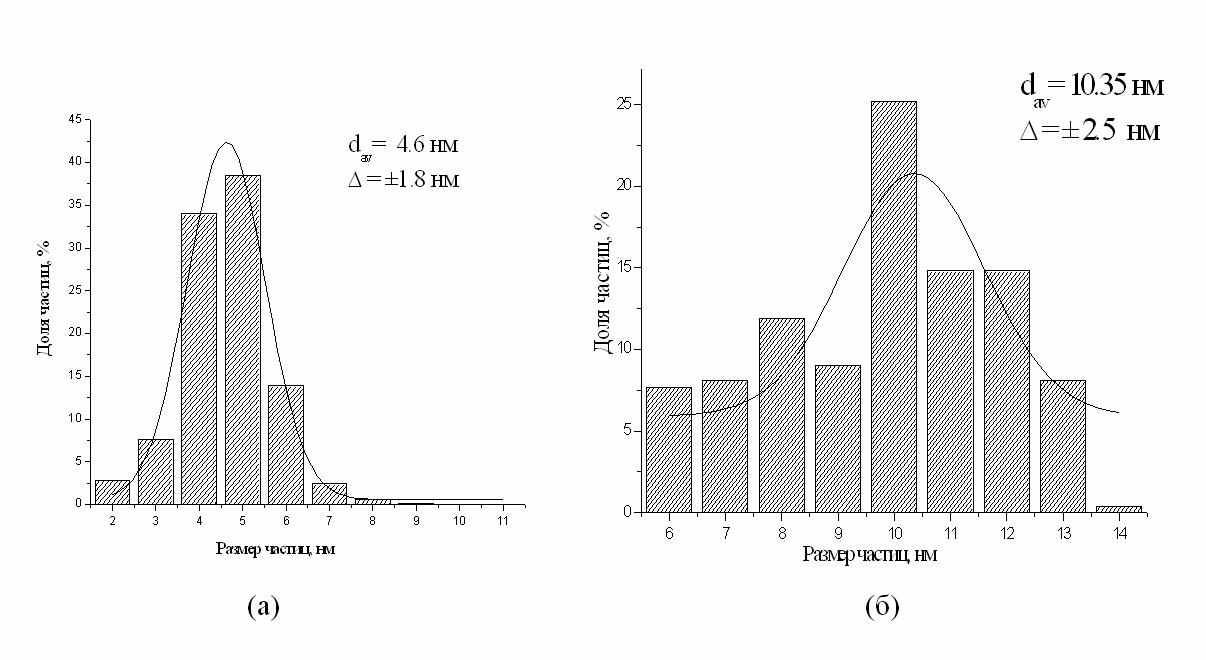
Рис. 18. Влияние степени гидратации на средний размер и ширину распределения в мицеллярном растворе наночастиц серебра. Наночастицы получены при одинаковых концентрациях кверцетина, АОТ и ионов серебра и при w = 3.7 (a) и 10 (б)
Определение влияния названных выше факторов позволяет находить их сочетания, обеспечивающие возможность получения стабильных растворов наночастиц определенного размера (c узким распределением) и заданной концентрации.
4. Механизм взаимодействия флавоноидов с ионами металлов
Исследование механизма взаимодействия флавоноидов с ионами металлов при биохимическом синтезе представляет интерес как для совершенствования процедуры получения и определения концентрации наночастиц в растворе, так и для углубления понимания процессов, лежащих в основе превращений ионов металлов в живом организме, в том числе процессов агрегации – дезагрегации (переходов ионов металлов в кластеры и наночастицы и обратно). Восстановление ионов металла в результате взаимодействия с флавоноидами в обратных мицеллах есть первая стадия процесса формирования наночастиц; как известно, выяснение механизма восстановления ионов металла является одной из основных задач в исследовании механизма формирования наночастиц металлов при химическом восстановлении в жидких средах. В литературе рассматриваются два основных механизма восстановления ионов металла в растворе при формировании наночастиц – (1) перенос электронов от молекул восстановителя к иону металла с образованием промежуточного комплекса, причем перенос электрона в комплексе катализируется поверхностью растущей металлической частицы и (2) перенос электронов от молекул (или ионов) восстановителя непосредственно к ионам металла, который осуществляется также при участии поверхности растущей частицы. В последнем случае растущая частица играет роль микроэлектрода, на котором происходит как окисление восстановителя, так и восстановление ионов металла; при достаточно больших размерах частицы оба процесса могут быть пространственно разделены (электрохимический механизм, см. [Смирнов В.В. и др. Химическое осаждение металлов в водных растворах. Минск: Изд-во «Университетское», 1987]).
Учитывая известную способность флавоноидов образовывать комплексы с ионами металлов в водных растворах, естественно было предположить, что при биохимическом синтезе реализуется первый механизм. Однако это предположение требовало проверки, поскольку хорошо известно также, что одна и та же реакция в водном растворе и в обратных мицеллах может протекать по разным механизмам, вследствие чего различными оказываются скорость, образующиеся продукты и другие характеристики реакции. Такие факты установлены в исследованиях в области мицеллярного катализа и действия ферментов в обратных мицеллах (мицеллярной энзимологии) для различных (в том числе окислительно-восстановительных) реакций.
В нашем случае требовалось выяснить, прежде всего, идет ли формирование наночастиц в обратных мицеллах через стадию образования комплекса флавоноида с ионами металла. С практической точки зрения решение этого вопроса давало возможность определить коэффициент экстинкции наночастиц и, следовательно, их концентрацию в мицеллярном растворе. Как мы уже упоминали выше, определение коэффициента экстинкции в случае наночастиц осложняется тем, что, как правило, неизвестно, какая часть изначально введенных ионов металла перешла в наночастицы. В случае образования комплекса он, как промежуточный продукт, может присутствовать в мицеллярном растворе наночастиц; поэтому для определения концентрации наночастиц важно было определить стехиометрию и концентрацию комплекса. Для этого, в свою очередь, необходимо было найти коэффициент экстинкции комплекса. Ниже дано краткое изложение полученных нами результатов.
4.1. Наночастицы серебра
При стандартной процедуре биохимического синтеза наблюдается быстрое формирование и рост полосы наночастиц, так что выявить промежуточные стадии оказывается невозможным. Выделение стадии образования комплекса можно было осуществить в условиях, когда взаимодействие Qr с ионами Ag+ протекает достаточно медленно, так чтобы можно было наблюдать формирование полосы комплекса без одновременного появления полосы наночастиц. В серии экспериментов на мицеллярных растворах с малыми концентрациями реагентов было показано, что образованию комплекса отвечает появление полосы 295 нм. Выделение этой полосы удалось осуществить при проведении реакции с мицеллярным раствором Qr, приготовленным не на предварительно дегидратированном (как при получении стандартных растворов), а на слабо гидратированном АОТ. При введении ионов Ag+ в полученный таким образом мицеллярный раствор Qr, происходит постепенное уменьшение интенсивности поглощения обеих полос кверцетина и одновременно усиление полосы 295 нм. Процесс завершается образованием хорошо оформленной полосы 295 нм и небольшого плеча в области 370-380 нм, обусловленного присутствием остатка кверцетина. Характерный вид спектра мицеллярного раствора, содержащего преимущественно комплекс [Ag…Qr] показан на рис.19. Спектры типа показанного на рис.19 использовали для определения коэффициента экстинкции комплекса по формуле, вытекающей из известного закона Бугера-Ламберта-Бера:
* = Dmax(295)/(C0Qr -CtQr) * l (1)
где C0Qr - начальная концентрация кверцетина, CtQr - его конечная концентрация в растворе, l – длина оптического пути. Величину CtQr можно определить графически по разности оптических плотностей () при длине волны, равной max полосы I кверцетина (I max), используя найденный ранее коэффициент экстинкции для этой полосы1 при соответствующей степени гидратации: CtQr = Δ/I l. По данным пяти определений при разных концентрациях серебра и кверцетина * = (1.98 ± 0.05) * 104 л/моль см.
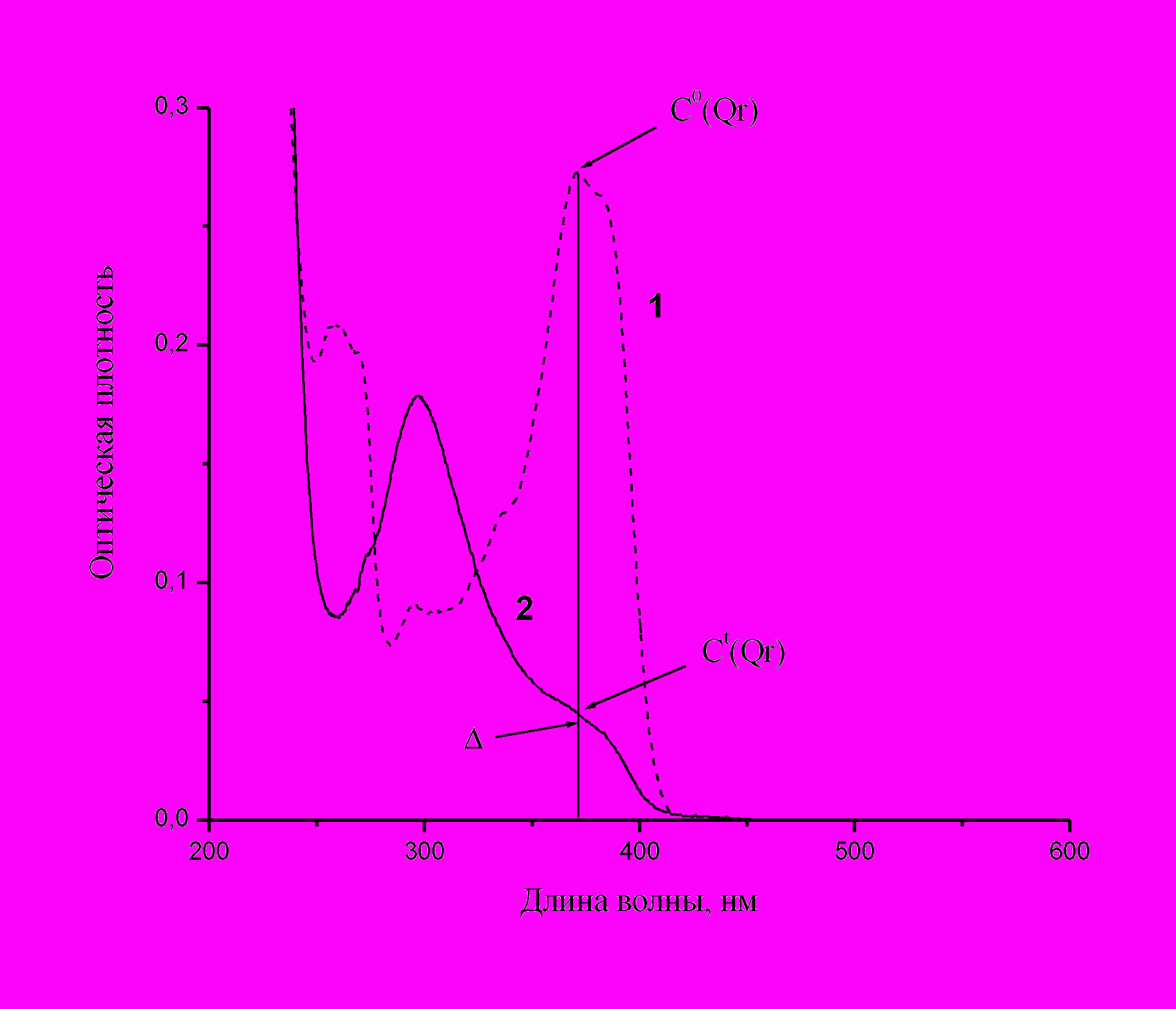 Рис.19. Определение коэффициента экстинкции комплекса Ag-Qr в мицеллярном растворе. 1 – спектр исходного раствора Qr, 2 – конечная стадия образования комплекса. C0(Qr) и Ct(Qr) – концентрация кверцетина, соответственно, в исходном растворе и на конечной стадии образования комплекса. - разность оптических плотностей при I max между спектром 2 и продолжением полосы комплекса в области 350-400 нм.
Рис.19. Определение коэффициента экстинкции комплекса Ag-Qr в мицеллярном растворе. 1 – спектр исходного раствора Qr, 2 – конечная стадия образования комплекса. C0(Qr) и Ct(Qr) – концентрация кверцетина, соответственно, в исходном растворе и на конечной стадии образования комплекса. - разность оптических плотностей при I max между спектром 2 и продолжением полосы комплекса в области 350-400 нм.Для определения стехиометрии комплекса рассчитывали максимальное (равновесное) количество кверцетина, перешедшее в комплекс при введении равного или меньшего количества ионов Ag+. Для этого использовали спектры, полученные при малых концентрациях реагентов через несколько суток после введения ионов серебра, когда изменения полос поглощения полностью прекращались. Во всех исследованных случаях количество Qr, перешедшее в комплекс, оказалось близким к начальной концентрации ионов Ag+. Отсюда вытекает, что ионы серебра и кверцетин в комплексе находятся в соотношении 1:1.
Используя известные коэффициент экстинкции и стехиометрию комплекса, определяли коэффициент экстинкции наночастиц Ag. Для этого эксперимент проводили в условиях, когда в результате взаимодействия с ионами Ag+ кверцетин полностью переходит в комплекс, а ионы серебра либо связаны в комплекс, либо присутствуют в виде наночастиц. Коэффициент экстинкции наночастиц находили из соотношения:
NP = Dmax(λNP max) /C ( AgNO3 (s)) * l (2)
где Dmax(λNP max) – оптическая плотность в максимуме полосы поглощения наночастиц, C ( AgNO3 (s)) – концентрация ионов Ag+, присутствующих в растворе в виде наночастиц. По результатам нескольких экспериментов с разными соотношениями концентраций кверцетина и ионов Ag+ для наночастиц серебра получен коэффициент экстинкции NP = (1.03 ± 0.08) * 104 л/моль* см. По литературным данным, несколько меньшие значения NP (7-8 * 103 л/моль*см) были определены для мицеллярного и водного растворов наночастиц серебра, синтезированных с другими восстановителями. Найденный нами коэффициент экстинкции был подтвержден также путем сравнения экспериментальных спектров наночастиц серебра и рассчитанных по теории Ми при размерах частиц, измеренных на стационарной стадии методом ФКС.
Определение коэффициентов экстинкции комплекса и наночастиц серебра позволяет находить их концентрации в мицеллярном растворе, полученном при различных параметрах системы (концентрациях исходных реагентов, АОТ, степени гидратации), а также изменения концентрации наночастиц при адсорбции их из раствора на твердых материалах.
Опираясь на полученные данные, можно предложить следующую вероятную последовательность реакций, протекающих при взаимодействии кверцетина с ионами серебра в мицеллярном растворе:
Ag+ + Qr [Ag+(-) … Qr(+)] (I)
