Рабочая программа учебной дисциплины согласовано утверждаю директор цдп идно тпу проректор-директор фти
| Вид материала | Рабочая программа |
- Рабочая программа учебной ф тпу 1 21 / 01 дисциплины утверждаю: Директор иип, 107.44kb.
- Учебной ф тпу 1 21 / 01 дисциплины утверждаю: Директор имм кириллов Н. П. Деловой этикет, 232.59kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 360.66kb.
- Рабочая программа учебной дисциплины ф тпу 1 -21/01, 102.93kb.
- Рабочая программа по литературе Зиновой, 238.71kb.
- А. М. Булатова п г. т. Кукмор Согласовано: Утверждаю: Заместитель директора по ур директор, 133.13kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 389.67kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 214.59kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 540.5kb.
- Рабочая программа учебной дисциплины нф тпу утверждаю, 156.27kb.
СТП ТПУ 2.4.01-02
 ТПУ 18.08-21/41
ТПУ 18.08-21/41Рабочая программа учебной
дисциплины
СОГЛАСОВАНО УТВЕРЖДАЮ
Директор ЦДП ИДНО ТПУ Проректор-директор ФТИ
___________ Е.А. Кулинич _________ В.П. Кривобоков
« » 2010 г. « » 2010 г.
РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ
ХИМИЯ
для слушателей Естественнонаучной школы (ЕНШ) ФТИ
ВИДЫ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ И ВРЕМЕННОЙ РЕСУРС:
Лекции и практические занятия 112 час.
Контрольные работы 20 час.
Консультации 6 час.
ВСЕГО АУДИТОРНЫХ ЗАНЯТИЙ 138 час.
САМОСТОЯТЕЛЬНАЯ РАБОТА 138 час.
ФОРМА ОБУЧЕНИЯ очная
ВИД ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ:
Рубежный контроль. (Домашние задания, контрольные работы) ИТОГОВАЯ АТТЕСТАЦИЯ : Выпускная контрольная работа, олимпиада
ОБЕСПЕЧИВАЮЩЕЕ ПОДРАЗДЕЛЕНИЕ: кафедры общей и неорганической химии ТПУ
РУКОВОДИТЕЛЬ ЕНШ _____________ Кузнецов С.И.
РАЗРАБОТЧИК:
доцент кафедры общей и неорганической химии
ТПУ ____________ Е.М. Князева
2010 г.
1. Рабочая программа по химии составлена на основе федерального компонента государственного стандарта основного общего образования.
РАССМОТРЕНА и ОДОБРЕНА на заседании обеспечивающей кафедры общей и неорганической химии ТПУ
п

 ротокол № .
ротокол № .(дата)
Разработчик:
доцент кафедры общей и неорганической химии
ЕНМФ ТПУ ____________(Е.М. Князева)
2. Рабочая программа СОГЛАСОВАНА с методическим советом ЦДП ТПУ.

 Председатель методического совета ЦДП
Председатель методического совета ЦДП (подпись) (И.О. Фамилия)
АННОТАЦИЯ
Химия
Центр довузовской подготовки ТПУ
Доцент, к.х.н. Князева Елена Михайловна
Телефон (3822) 415-235, E-mail: elka04@ mail.ru
Цель. Рабочая программа разработана для слушателей, углубленно изучающих химию в Центре довузовской подготовки Томского политехнического университета, с целью приобретения знаний, умений и навыков, необходимых для поступления и дальнейшего обучения в Высших учебных заведениях.
Содержание. Дисциплина содержит основные концепции и законы химии, периодический закон, теорию строения вещества, основы термодинамики и кинетики, закономерности поведения веществ в растворах, окислительно-восстановительные реакции, основы электрохимических процессов, химию элементов групп периодической системы, а также основы органической химии.
Класс 11 (2 семестр - зачет)
Всего 138 ч., в т.ч. лекций и практических занятий - 112 ч.
ЦЕЛИ И ЗАДАЧИ УЧЕБНОЙ ДИСЦИПЛИНЫ
В результате изучения дисциплины “Химия” школьники должны приобрести такие знания, умения и навыки, которыми они смогут воспользоваться при сдаче Единого государственного экзамена, олимпиады, а также любых видов вступительных испытаний в высшие учебные заведения.
Целью изучения курса “Химия” слушателями ЦДП ТПУ является
-формирование современного химического мировоззрения и навыков самостоятельной работы;
- освоение важнейших знаний об основных понятиях и законах химии, химической символике;
- овладение умениями наблюдать химические явления, производить расчеты на основе химических формул веществ и уравнений химических реакций;
- развитие познавательных интересов и интеллектуальных способностей, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
- воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Для достижения этой цели проводятся аудиторные занятия (лекции и практические занятия) и организуется самостоятельная работа слушателей по выполнению индивидуальных домашних заданий. На этих занятиях реализуются задачи приобретения школьниками следующих знаний, умений и навыков:
слушатель ЦДП ТПУ будет: 1) знать периодическую систему и строение атомов элементов; 2) уметь на основании строения атомов элементов определять виды химической связи и прогнозировать свойства веществ; 3) уметь применять современные методы описания химической связи (метод валентных связей, гибридизации) для характеристики свойств молекул; 4) знать строение комплексных соединений и уметь характеризовать их свойства; 5) знать строение вещества в конденсированном состоянии; 6) иметь навыки расчета различных способов выражения концентрации растворов и решения комплексных расчетных задач; 7) уметь применять для решения практических задач свойства растворов; 8) знать основы термодинамики, химического равновесия и химической кинетики; 9) уметь применять эти законы при решении технологических задач; 10) уметь уравнивать реакций окислительно-восстановительные реакции и предсказывать состав продуктов при их протекании; 11) уметь описывать процессы гидролиза солей; 12) знать химию элементов групп периодической системы; 13) знать основы органической химии.
Часть I. ОБЩАЯ ХИМИЯ
СОДЕРЖАНИЕ ТЕОРЕТИЧЕСКОГО РАЗДЕЛА ДИСЦИПЛИНЫ
Раздел 1. Общая химия
- Основные понятия и законы химии. (4 час.)
Место и роль химии в системе наук, в научном мировоззрении. Основные понятия в химии: атом, химический элемент, изотопный состав атомов химических элементов, молекула, простые и сложные вещества. Аллотропия. Абсолютные и относительные массы атомов и молекул. Моль, молярная масса. Валентность.
Фундаментальные и частные законы. Закон сохранения массы-энергии; постоянства состава, кратных отношений, Авогадро.
- Окислительно-восстановительные реакции (4 час.)
Окислительно-восстановительные реакции. Понятия: степень окисления, окислитель, восстановитель. Окислительно-восстановительная двойственность, примеры соединений. Классификация ОВР. Метод электронного баланса - метод уравнивания окислительно-восстановительных реакций.
- Растворы (6 час.)
Способы выражения концентрации растворов: массовая доля растворённого вещества, молярная концентрация. Перерасчёт одного способа выражения концентрации в другой.
Типы растворов. Теория электролитической диссоциации. Константа и степень диссоциации. Сильные и слабые электролиты. Ионное произведение воды, водородный показатель. Практическое определение рН с помощью индикаторов.
Ионные реакции, условия их протекания. Гидролиз солей. Типы гидролиза. Условия смещения равновесия гидролиза. Практическое применение гидролиза.
1.4. Классификация и номенклатура
неорганических соединений (24 час.)
Простые вещества: металлы и неметаллы. Положение металлов и неметаллов в периодической системе. Изменение металлических свойств по периодам и группам. Характерные физические и химические свойства металлов и неметаллов. Отношение металлов к воде, щелочам и кислотам.
Оксиды. Классификация и номенклатура оксидов, способы их получения, химические свойства. Изменение кислотно-основных свойств оксидов по периодам и группам, в зависимости от степени окисления металла. Применение оксидов.
Гидроксиды: кислотные, основные, амфолиты. Основания растворимые в воде и труднорстворимые. Номенклатура оснований, графические формулы. Основные способы получения оснований, химические свойства. Изменение кислотно-основных свойств гидроксидов по периодам и группам. Амфолиты, диссоциация амфолитов в воде, химические свойства. Классификация кислот, номенклатура, графическое изображение. Способы получения кислот (на примере серной и азотной). Химические свойства, применение кислот.
Соли средние, кислые, основные. Номенклатура солей. Оксосоли, двойные соли, кристаллогидраты. Получение и химические свойства солей. Цепочки взаимных превращений.
1.5 . Строение вещества (16 час.)
Строение атома. Характеристика элементарных частиц, составляющих атом. Состав ядра. Изотопы.
История развития представлений о строении атома. Теоретические и экспериментальные основы современной теории строения атома - квантовой механики. Гипотеза Луи де Бройля, принцип неопределенности Гейзенберга. Вероятностный характер законов микромира. Квантовые числа. Атомные орбитали, энергетические уровни и подуровни, основные принципы их заполнения: принцип наименьшей энергии, принцип Паули, правило Гунда. Электронные формулы атомов, валентные электроны.
Периодический закон и периодическая система Д. И. Менделеева. Периодический закон Д.И. Менделеева. История открытия. Периодическая система, периоды малые и большие, группы и подгруппы. Связь электронного строения атома с его положением в периодической системе. Свойства атомов, периодически изменяющиеся в зависимости от атомного номера: радиусы атомов и ионов, энергия ионизации, электроотрицательность, степени окисления.
Химическая связь и строение молекул. Основные особенности химического взаимодействия и механизм образования химической связи. Типы связей: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Типы кристаллов: атомные, ионные, молекулярные, металлические, их особенности. Влияние типа химической связи на химические свойства веществ. Основные характеристики химической связи: энергия связи, длина связи, валентный угол, характеристики полярности связи: дипольный момент и степень ионности.
Ковалентная связь. Особенности её проявления. Метод валентных связей, его основные положения. Обменный и донорно-акцепторный механизмы образования ковалентной связи. Свойства ковалентной связи: насыщаемость и направленность. Теория гибридизации и пространственная структура молекул.
Ионная связь. Свойства ионной связи: ненасыщаемость и ненаправленность.
Особенности химической связи в металлах. Водородная связь, её влияние на свойства веществ.
Комплексные соединения. Строение комплексных соединений (КС), классификация и номенклатура КС. Поведение комплексных соединений в растворах.
1.6. Закономерности протекания химических реакций. (24 час.)
Химическая термодинамика. Система термодинамических (ТД) понятий: ТД система, химическая фаза и компонент, гомо- и гетерогенные системы, тепловой эффект образования вещества и химической реакции. Методы расчета тепловых эффектов..
Химическое равновесие. Обратимые и необратимые химические реакции. Химическое равновесие с позиций термодинамики и кинетики. Признаки истинного химического равновесия. Закон действия масс для равновесия. Константа равновесия. Принцип Ле Шателье, его практическое значение.
Химическая кинетика. Система основных понятий химической кинетики: гомогенные, гетерогенные; простые и сложные реакции; механизм химических реакций; лимитирующая стадия.
Скорость химической реакции. Закон действия масс для скоростей простых реакций. Кинетические уравнения. Зависимость скорости химической реакции от температуры. Основные положения теории активных столкновений. Энергия активации. Понятие о катализе. Гомогенный и гетерогенный катализ. Катализаторы. Их влияние на механизм реакции. Роль катализаторов в химической технологии.
Электрохимические процессы. Стандартные электродные потенциалы, их измерение с помощью водородного электрода. Ряд напряжений, его свойства.
Электролиз растворов и расплавов веществ. Порядок разрядки ионов на электродах. Количественные закономерности электролиза (законы Фарадея). Применение электролиза.
Коррозия металлов, ее электрохимические основы. Способы устранения коррозии.
Раздел 2. Органическая химия (40час.)
2.1. Предмет органической химии
Основные положения теории строения А.М. Бутлерова. Изомерия. Структурные формулы. Образование и разрыв ковалентных связей.
2.2. Углеводороды. Состояние гибридизации атомных орбиталей углерода в алканах, алкенах, алкинах, аренах. Алканы, циклоалканы, номенклатура, способы получения, химические свойства. Природные источники углеводородов. Галогенопроизводные алканов и циклоалканов. Механизм радикального галогенирования алканов.
2.3. Алкены, номенклатура, структурная и пространственная изомерия. Способы получения алкенов, химические свойства. Присоединение галогенов, галогеноводородов, воды. Правило Марковникова. Качественные реакции на двойные связи. Диены, особенности их строения и свойст. Полимеризация алкенов, диенов, полимеры. Применение алкенов.
2.4. Алкины, изомерия, номенклатура. Получение ацетилена и его гомологов. Химические свойства алкинов, реакции присоединения, реакция Кучерова. Кислотный характер алкинов с концевой тройной связью, качественная реакция.
2.5. Арены. Бензол и его гомологи. Электронное истолкование понятия «ароматичность», структурная формула бензола. Изомерия и номенклатура ароматических соединений. Механизм электрофильного замещения водорода в ароматическом ядре на примере реакций галогенирования, нитрования. Влияние заместителей.
2.6. Спирты и фенолы, строение, изомерия, номенклатура. Способы получения спиртов, физические и химические свойства, применение. Многоатомные спирты. Способы получения фенола, физические и химические свойства, применение. Взаимное влияние гидроксогруппы и ароматического ядра. Кислые свойства фенолов. Качественные реакции.
2.7. Альдегиды и кетоны. Карбонильная функциональная группа и ее строение. Способы получения, химические свойства, применение. Реакция «серебряного зеркала».
2.8. Карбоновые кислоты. Строение карбоксильной группы. Одно- и многоосновные, предельные и непредельные, ароматические карбоновые кислоты. Кислотность. Отдельные представители. Образование сложных эфиров. Жиры, состав, строение, свойства.
2.9. Углеводы. Классификация, состав, строение. Глюкоза, альдегидная и циклическая формы, нахождение в природе, реакции. Дисахариды, полисахариды.
2.10. Амины, строение, номенклатура, изомерия. Получение аминов, физические и химические свойства. Основность аминов, влияние заместителей. Аминокислоты.
Раздел 8. Неорганическая химия (20 час.)
2.1. Щелочные металлы, их характеристика на основании положения в периодической системе и строения атомов. Соединения натрия и калия в природе, их применение. Калийные удобрения.
2.2. Общая характеристика элементов главной подгруппы второй группы периодической системы. Кальций, его соединения в природе, их применение. Жесткость воды и способы ее устранения.
2.3. Алюминий, характеристика свойств элемента и его соединений на основе положения в периодической системе и строении атома. Амфотерность оксида и гидроксида алюминия. Соединения алюминия в природе, его роль в технике.
2.4. Железо, его оксиды и гидроксиды, зависимость их свойств от степени окисления элемента. Химические реакции, на которых основано производство чугуна и стали. Роль железа и его сплавов в технике.
2.5. Водород, его особое положение в периодической системе, физические и химические свойства. Получение водорода в лаборатории и промышленности, его применение.
2.6. Галогены, их общая характеристика. Соединения галогенов в природе. Хлор, его физические и химические свойства. Получение хлора. Хлороводород, его получение, свойства. Соляная кислота и ее соли. Применение хлора и его соединений.
2.7. Общая характеристика элементов главной подгруппы шестой группы периодической системы. Кислород, его физические и химические свойства. Аллотропия кислорода. Получение кислорода в лаборатории и в промышленности. Роль кислорода в природе и применение в технике. Вода, строение молекулы воды, ее физические и химические свойства. Сера, ее физические и химические свойства. Серная кислота, ее свойства. Химические основы производства серной кислоты контактным способом.
2.8. Общая характеристика элементов главной подгруппы пятой группы периодической системы. Фосфор, его аллотропные модификации, физические и химические свойства. Оксид фосфора (V), фосфорная кислота и ее соли. Фосфорные удобрения. Азот, его физические и химические свойства. Аммиак, его промышленный синтез, физические и химические свойства. Соли аммония. Оксиды азота. Азотная кислота, ее соли. Азотные удобрения.
2.9. Общая характеристика элементов главной подгруппы четвертой группы периодической системы. Углерод, его аллотропные модификации. Химические свойства углерода. Оксиды углерода (II) и (IV), их химические свойства. Угольная кислота и ее соли. Кремний, его физические и химические свойства. Оксид кремния (IV), кремниевая кислота. Соединения кремния в природе, их использование в технике.
Примеры контролирующих материалов по темам курса
| Входной контроль 1. Дать название веществам NH4Cl, Na2S, HNO2, Na2SO3, CuOHCl |
| 2. Рассчитать объем, занимаемый 20 г оксида углерода (IV) |
| 3. Определить класс соединения: Сr2O3, HF, CuOHCl, Cu(OH)2, H2SO3 |
| 4. Написать полную электронную формулу атома германия. |
| 5. Zn + 2HCl = ZnCl2 + H2 Какой объем водорода выделится при взаимодействии 30 г цинка с 200 г 10%-ного соляной кислотой? |
| Контроль по теме «Строение атома» 1. Укажите число протонов, нейтронов и электронов в атомах: 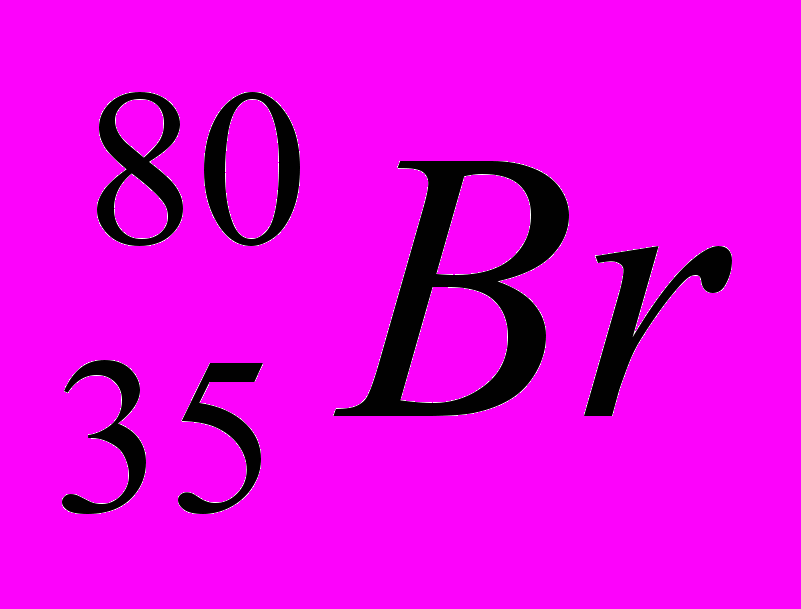 , , 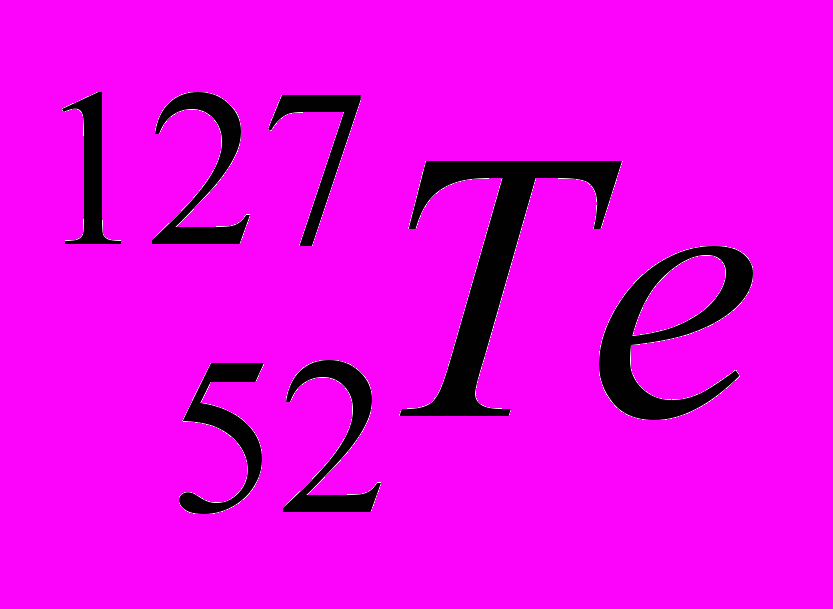 |
| 2. Запишите полную и краткую электронные формулы атома сурьмы, валентные электроны, электронно-графическую формулу для валентных электронов, последний электрон охарактеризуйте 4 квантовыми числами. |
| 3. Покажите валентные возможности атома теллура с помощью электронно-графических формул. Напишите формулы двух его оксидов и гидроксидов. |
| 4. Укажите типы оксидов: Al2O3, MnO2, SO2, Cl2O, CaO, WO3, CuO, ZnO, CO |
| 5. Укажите характерные степени окисления: Se, Sr, Fe, Zn, Br |
| 11 класс Контроль по теме «Химическая связь» 1. Определить типы химической связи в веществах: AlCl3, Al, Cl2, NaCl, HCl, Na2O |
| 2. Определить вид ковалентной связи (полярная, неполярная) в молекулах: фтор, фтороводород, аммиак, метан, азот. |
| 3. Наиболее сильные кислотные свойства проявляет соединение: H2O, H2S, HF, HCl |
| 4. Определить типы гибридизации АО углерода в молекулах: гексан, гексен-1, этаналь, бутадиен |
| 5. Показать образование молекулы этена. |
Контроль по темам: «Термохимия» и «Хим. равновесие»1. Сколько теплоты выделится при сгорании 1 м3метана: СН4(г) + 2О2 (г) = СО2(г) + 2Н2О(г) + 878 кДж |
| 2. При взаимодействии водорода с кислородом: Н2 + 1/2О2 = Н2О + 241 кДж выделилось 60 кДж теплоты. Масса образовавшейся воды (г) равна |
| 3. Начальные концентрации азота и водорода в реакции N2 + 3H2  2NH3 соответственно равны 1,5 и 2,5 моль/л. В некоторый момент, концентрация аммиака стала равной 0,5 моль/л. Концентрация N2 в этот момент равна… 2NH3 соответственно равны 1,5 и 2,5 моль/л. В некоторый момент, концентрация аммиака стала равной 0,5 моль/л. Концентрация N2 в этот момент равна… |
| 5. Для обратимой реакции С(к) + Н2О(г)  CO(г) + Н2(г) - 132 кДж установите соответствие между изменением условий и направлением смещения равновесия. CO(г) + Н2(г) - 132 кДж установите соответствие между изменением условий и направлением смещения равновесия. увеличение температуры увеличение давления увеличение концентрации СО введение катализатора |
ЛИТЕРАТУРА
- О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Макеев. – Общая химия. - М.: Просвещение, 2005. – 384 с.
- О.С. Габриелян, И.Г. Остроумов, А.А. Карцова. – Органическая химия. - М.: Просвещение, 2003. – 368 с.
- Врублевский А.И. – Химия элементов.- Мн.: Юнипресс, 2002. – 544 с.
- Г.Е. Рудзитес, Ф.Г. Фельдман. - Основы общей химии. М.: Просвещение, 1992. – 160 с.
- Г.Е. Рудзитес, Ф.Г. Фельдман. - Химия: Органическая химия. М.: Просвещение, 1993. – 160 с.
- Химия: Справочные материалы: Книга для учащихся. Под ред. Ю.Д. Третьякова, Н.Н. Олейнткова и др. М.: Химия, 1981. – 287 с.
- Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. М.:Новая волна. 2005.
- Еремин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В. Химия: Учебники для 8, 9 классов общеобразовательных учреждений. М.: Мир и Образование. 2005.
- Ахметов Н.С. Неорганическая химия: Учебное пособие для учащихся 8-9 кл. школ с углубленным изучением химии. Т. 1. Т. 2. М.: Просвещение, 1992.
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. Для поступающих в ВУЗы. М.: Высшая школа. 2000.
- Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Новая волна, 2004.
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в ВУЗы. М.: Дрофа. 1999.
Документ СМК
Дата создания 25.09. 2010.
стр. из
Разработчик С.И. Кузнецов
