Методическое пособие к лабораторным работам по физической и коллоидной химии для студентов биологических факультетов
| Вид материала | Методическое пособие |
- Методические указания к электронным лабораторным работам по курсу физической химии, 2388.82kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 277.1kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 240.13kb.
- Настоящее учебное пособие подготовлено для студентов факультетов физической культуры., 2524.83kb.
- Календарно-тематический план лекций по физической и коллоидной химии для студентов, 67.53kb.
- Методическое пособие по лабораторным работам для студентов специальности 201400 «аудиовизуальная, 446.61kb.
- Методическое пособие по выполнению (подготовке) и защите для студентов отделений, 810.13kb.
- Учебно-методическое пособие для студентов биологических факультетов специальности 011600, 1207.48kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Учебно-методическое пособие для иностранных студентов. Волгоград 2004, 415.65kb.
Устройство, в котором энергия химической реакции непосредственно превращается в электрическую энергию, называется гальваническим элементом.
Гальванический элемент состоит из двух соприкасающихся друг с другом растворов электролитов, в которые погружены металлические пластинки — электроды, соединенные между собой внешним проводником. Гальванический элемент, дающий электрический ток, находится в неравновесном состоянии. С уменьшением силы тока разность потенциалов между электродами возрастает. Если сила тока бесконечно мала и система практически находится в состоянии равновесия, элемент этот работает обратимо. Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой (эдс).
Элемент называется необратимым, если в системе хотя бы один из процессов является термодинамически необратимым.
В качестве обратимого гальванического элемента рассмотрим элемент Якоби — Даниеля, который состоит из медного и цинкового электродов, погруженных соответственно в растворы CuSO4 и ZnSO4. Схематически этот элемент изображается следующим образом:
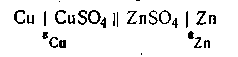
Здесь поверхность раздела двух фаз, между которыми имеет место скачок потенциала, обозначена вертикальной линейкой. Двойная линейка означает, что в месте соприкосновения двух растворов скачок потенциала, обусловленный различной скоростью диффузии ионов (так называемый диффузионный потенциал), снят и его можно не учитывать при вычислении эдс этого элемента. Металл с большей величиной стандартного потенциала (положительный электрод) принято писать слева, а с меньшей величиной (отрицательный электрод)—справа.
Общий вид гальванического элемента Якоби — Даниеля показан на рис. 4.10. В пористом сосуде 1 находится раствор CuSO4, в который погружен медный электрод. Этот сосуд помещен в стеклянную банку 2, содержащую цинковый электрод, находящийся в растворе ZnSO4.
На границе раздела фаз металл — жидкость образуется двойной электрический слой, при этом поверхность металла заряжается отрицательно, прилегающий слой — положительно. При разомкнутой цепи процесс растворения цинка быстро достигает равновесного состояния и приостанавливается. Если цинковый электрод соединить каким-либо проводником с медным электродом, будет наблюдаться совершенно иная картина (рис. 4.11).
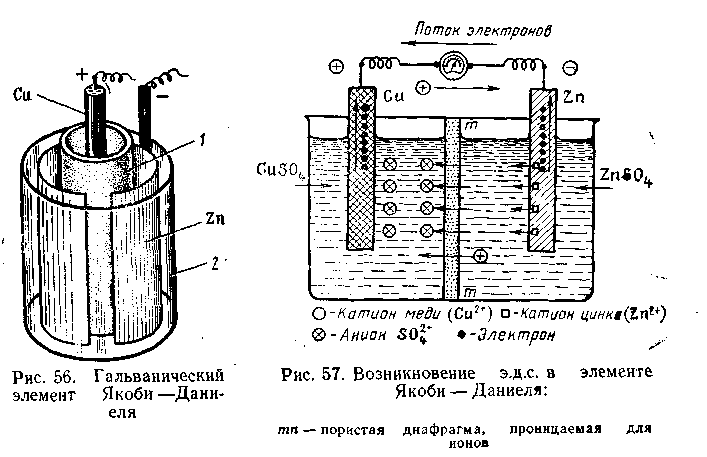
Рис.4.10 Гальванический элемент Якоби - Даниэля
Рис. 4.11 Возникновение э.д.с. в элементе Якоби – Даниэля
mn – пористая мембрана, проницаемая для ионов
В этом случае избыточные электроны с цинкового электрода потекут на медный, и во внешней цепи возникнет электрический ток, который можно измерить c помощью гальванометра. Электроны, перешедшие на медь, нейтрализуют осадившиеся на ней из раствора CuSO4 ионы Сu2+, превращая их в электронейтральные атомы меди.
Остающиеся свободными сульфат-ионы через пористые стенки сосуда 1 проникают во внешнюю жидкость и, соединяясь с катионами Zn2+ металлического цинка, дают ZnSO4. С другой стороны, катионы цинка в процессе работы гальванического элемента также диффундируют из сосуда 2 через пористую перегородку в сосуд 1, замещая там перешедшие на медную пластинку катионы Сu2+. В результате этого раствор CuSO4 в сосуде 1 постепенно превращается в ZnSO4.
По мере удаления по внешней цепи с цинковой пластинки избытка электронов все новые количества катионов Zn2+ будут переходить в раствор. Гальванический элемент будет работать до тех пор, пока весь цинковый электрод не растворится, т. е. перейдет в состояние катионов Zn2+. После этого электрический ток прекращается.
При работе гальванического элемента происходит одновременный перенос электричества по двум цепям: внешней (поток электронов по проволоке) и внутренней (поток катионов в жидкой фазе элемента). Как видно из рис. 4.11, цинк для внешней цепи играет роль катода (посылает во внешнюю цепь отрицательно заряженные электроны), а для внутренней цепи — анода (посылает во внутреннюю цепь положительно заряженные катионы). Медь для внешней цепи играет роль анода (акцептор электронов), а для внутренней — роль катода (акцептор электронов).
Гальваническая цепь может быть составлена из пар самых разнообразных металлов, из которых каждый погружен в раствор своей соли. Например:
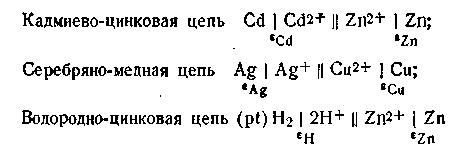
Э.д.с. всех гальванических элементов слагается из величин потенциалов, возникающих на всех границах раздела. Без учета диффузионного потенциала основное уравнение э.д.с. будет иметь вид
 | 4.91 |
Э.д.с. любого гальванического элемента равна разности его электродных потенциалов.
Уравнение (4.91) широко используется в электрохимии, и на нем основаны все расчеты, связанные с работой гальванических элементов.
В качестве примера рассмотрим, чему будет равняться э.д.с. только что рассмотренного гальванического элемента Якоби — Даниеля, если концентрации (активности) ионов цинка и меди равны между собой, т. е. аZn2+ = αCu2+ наглядности расчета запишем эту цепь:
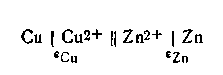
На основании уравнения (4.91) э.д.с. этой цепи будет равна:
 | 4.92 |
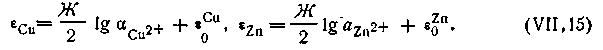 | 4.93 |
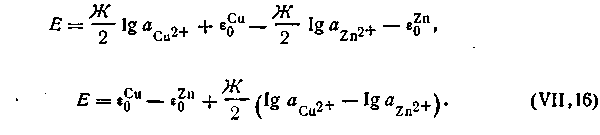 | 4.94 |
 | 4.95 |
Подставляя численные значения
 и
и 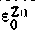 , получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно - цинкового элемента.
, получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно - цинкового элемента.§ 67. Диффузионный потенциал. Биологическое значение диффузионных и мембранных потенциалов.
Говоря о гальваническом элементе, мы рассматривали только границу раздела металл — раствор его соли. Теперь обратимся к границе раздела между растворами двух различных электролитов. В гальванических элементах на границах соприкосновения растворов могут возникать так называемые диффузионные потенциалы. Они возникают также и на границе раздела между растворами одного и того же электролита в том случае, когда концентрация растворов неодинакова. Причина возникновения потенциала в подобных случаях заключается в неодинаковой подвижности ионов в растворе.
Скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами называется диффузионным потенциалом. Значение диффузионного потенциала зависит, как показывает опыт, от различия подвижностей ионов, а также от различия концентраций соприкасающихся растворов.
Диффузионный потенциал можно определить экспериментально, а также вычислить. Так, значение диффузионного потенциала (εД), возникающего при соприкосновении растворов различной концентрации одного и того же электролита, дающего однозарядные ионы, вычисляется по формуле
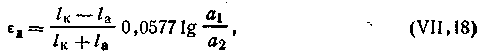 | 4.96 |
Если соприкасаются между собой два бинарных электролита, дающие однозарядные ионы и имеющие равные концентрации, диффузионный потенциал вычисляется по следующей формуле:
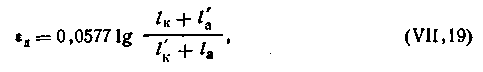 | 4.97 |
При точных вычислениях э.д.с. гальванических цепей обязательно должна вводиться поправка на величину диффузного потенциала, включая между растворами электролита насыщенный раствор хлорида калия. Так как подвижность ионов калия и хлора примерно одинаковы (l K+ = 64,4 ·10-4 и l Cl- = 65,5 · 10-4 См·м2), то диффузионный потенциал, вызываемый таким электролитом, практически будет равен нулю.
Д
 иффузионные потенциалы могут возникать и в биологических объектах при повреждении, например, оболочек клеток. При этом нарушается избирательность их проницаемости и электролиты начинают диффундировать в клетку или из нее — в зависимости от разности концентраций. В результате диффузии электролитов возникает так называемый потенциал повреждения, который может достигать величин порядка 30—40 милливольт. Причем поврежденная ткань заряжается отрицательно по отношению к неповрежденной.
иффузионные потенциалы могут возникать и в биологических объектах при повреждении, например, оболочек клеток. При этом нарушается избирательность их проницаемости и электролиты начинают диффундировать в клетку или из нее — в зависимости от разности концентраций. В результате диффузии электролитов возникает так называемый потенциал повреждения, который может достигать величин порядка 30—40 милливольт. Причем поврежденная ткань заряжается отрицательно по отношению к неповрежденной.Диффузионный потенциал может сильно возрасти, если растворы электролитов различных концентраций разделить специальной мембраной, проницаемой только для ионов одного какого-то знака.
В ряде случаев возникновение мембранного потенциала связано с тем, что поры мембраны не соответствуют размерам ионов определенного знака. Мембранные потенциалы весьма стойки и могут без изменения сохраняться долгое время. В тканях растительных и животных организмов, даже внутри одной клетки, имеются мембранные и диффузионные потенциалы, обусловленные химической и морфологической неоднородностью внутриклеточного содержимого. Различные причины, изменяющие свойства микроструктур клетки, приводят к освобождению и диффузии ионов, т. е. к появлению различных биопотенциалов и биотоков. Роль этих биотоков в настоящее время еще до конца не изучена, но имеющиеся экспериментальные данные свидетельствуют об их важном значении в процессах саморегуляции живого организма.
§ 68. Концентрационные цепи.
Известны гальванические элементы, в которых электрическая энергия образуется не за счет химической реакции, а за счет разницы концентраций растворов, в которые опущены электроды из одного и того же металла. Такие гальванические элементы называются концентрационными (рис. 4.12). В качестве примера можно назвать цепь, составленную из двух цинковых электродов, погруженных в растворы ZnSO4 различной концентрации:
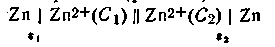
В этой схеме С1 и С2— концентрации электролитов, причем C1>C2 Поскольку металл обоих электродов один и тот же, стандартные потенциалы их (εoZn ) также одинаковы. Однако из-за различия концентрации катионов металла равновесие
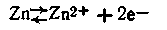
в растворе в обоих полуэлементах неодинаково. В полуэлементе с менее концентрированным раствором (С2) равновесие несколько сдвинуто вправо, т. е.
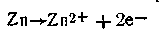
В этом случае цинк посылает в раствор больше катионов, что приводит к возникновению на электроде некоторого избытка электронов. По внешней цепи они перемещаются ко второму электроду, погруженному в более концентрированный раствор сульфата цинка ZnSO4.
Таким образом, электрод, погруженный в раствор большей концентрации (C1), зарядится положительно, а электрод, погруженный в раствор меньшей концентрации, зарядится отрицательно.
В процессе работы гальванического элемента концентрация С1 постепенно уменьшается, концентрация С2 увеличивается. Элемент работает до тех пор, пока сравняются концентрации у анода и катода.
Вычисление э.д.с. концентрационных элементов рассмотрим на примере цинкового концентрационного элемента.
Допустим, что концентрация C1 = l моль/л, а С2 = 0,01 моль/л. Коэффициенты активности Zn2+ в растворах этих концентраций соответственно равны: f1 = 0,061, а f2 = 0,53. Для вычисления э.д.с. цепи воспользуемся уравнением (4.91). На основании уравнения Нернста можем написать
 | 4.98 |
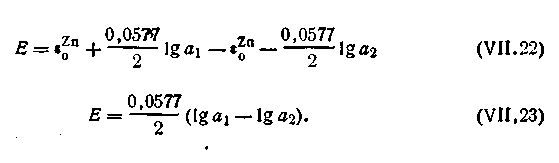 | 4.99 |
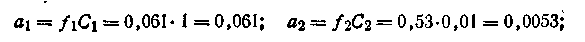
получим
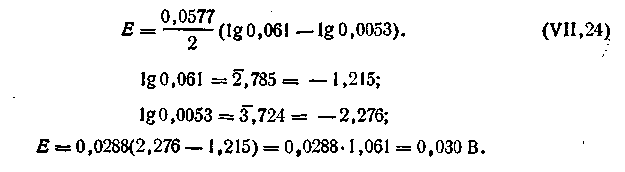 | 4.100 |
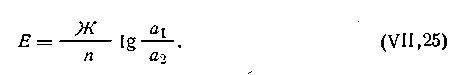 | 4.101 |
§ 69. Электроды сравнения.
Как уже отмечалось, потенциалы различных электродов измеряются по отношению к потенциалу нормального водородного электрода. Наряду с водородным в электрохимии в настоящее время широко применяется другой электрод сравнения — так называемый каломельный электрод, который, как показал опыт, обладает постоянным и хорошо воспроизводимым потенциалом.
В
одородный электрод. Благородные металлы, например золото, платина и некоторые другие, обладают прочной кристаллической решеткой, и их катионы не переходят в раствор из металла. Следовательно, такие металлы не имеют на границе металл — раствор своего характерного скачка потенциала. Однако, если на поверхности этих металлов адсорбируются вещества, которые способны окисляться или восстанавливаться, эти металлы с адсорбированными веществами уже представляют собой системы, находящиеся в равновесии с раствором. Если веществом, адсорбирующимся на поверхности благородного металла, является газ, электрод называется газовым.
Таким образом, платиновая пластинка или проволока, поглотившая молекулярный водород и опущенная в раствор, содержащий ионы водорода, представляет собой водородный электрод. Поскольку сама платина не участвует в электродной реакции (ее роль сводится лишь к тому, что она поглощает водород и, будучи проводником, делает возможным перемещение электронов от одного электрода к другому), химический
символ платины в схеме водородного электрода обычно заключают в скобки: (Pt)H2|2H+.
Существуют различные конструкции сосудов для водородного электрода, две из которых показаны на рис. 4.13.
На поверхности водородного электрода устанавливается равновесие:
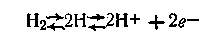
В результате этих процессов на границе между платиной и раствором ионов водорода образуется двойной электрический слой, обусловливающий скачок потенциала. Величина этого потенциала при данной температуре зависит от активности водородных ионов в растворе и от количества поглощенного платиной газообразного водорода, которое пропорционально его давлению:
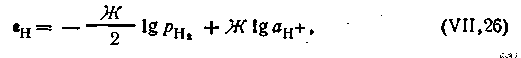 | 4.102 |
Электрод, состоящий из платины, насыщенной водородом под давлением в 101,325 кПа и погруженной в водный раствор с активностью ионов водорода, равной единице, называется нормальным водородным электродом.
По международному соглашению потенциал нормального водородного электрода условно принят равным нулю, с этим электродом сопоставляют потенциалы всех других электродов.
В самом деле, при Рн2,— 101.325 кПа выражение для потенциала водородного электрода будет иметь вид
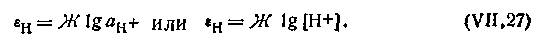 | 4.103 |
Таким образом, при насыщении водородного электрода водородом под давлением в 101,325 кПа потенциал его зависит только от концентрации (активности) водородных ионов в растворе. В связи с этим водородный электрод может применяться на практике не только как электрод сравнения, но и как индикаторный электрод, потенциал которого находится в прямой зависимости от присутствия Н+-ионов в растворе.
Приготовление водородного электрода представляет значительные трудности. Нелегко добиться, чтобы давление газообразного водорода при насыщении платины равнялось точно 101,325 кПа. Кроме того, газообразный водород должен поступать для насыщения со строго постоянной скоростью, к тому же для насыщения необходимо применять совершенно чистый водород, так как уже весьма малые количества примесей, особенно H2S и H3As, «отравляют» поверхность платины и тем самым препятствуют установлению равновесия Н2↔2Н++2е-. Получение водорода высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике чаще применяется более простой каломельный электрод, обладающий устойчивым и отлично воспроизводимым потенциалом.
Каломельный электрод. Неудобства, связанные с практическим применением водородного электрода сравнения, привели к необходимости создания других, более удобных электродов сравнения, одним из которых является каломельный электрод.
Для приготовления каломельного электрода на дно сосуда наливают тщательно очищенную ртуть. Последнюю сверху покрывают пастой, которая получается растиранием каломели Hg2Cl2 с несколькими каплями чистой ртути в присутствии раствора хлорида калия КСl. Поверх пасты наливают раствор КСl, насыщенный каломелью. Металлическая ртуть, добавляемая в пасту, предохраняет от окисления каломели до HgCl2. В ртуть погружают платиновый контакт, от которого уже идет медная проволока к клемме. Каломельный электрод схематически записывается следующим образом: Hg|Hg2Cl2, KC1. Запятая между Hg2Cl2 и КСl означает, что между этими веществами нет поверхности раздела, так как они находятся в одном растворе.
Рассмотрим, как работает каломельный электрод. Каломель, растворяясь в воде, диссоциирует с образованием ионов Hg+ и Сl-:
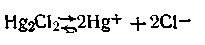
В присутствии хлорида калия, содержащего одноименный с каломелью ион хлора, растворимость каломели снижается. Таким образом, при данной концентрации КСl и данной температуре концентрация ионов Hg+ постоянна, чем, собственно, и обеспечивается необходимая устойчивость потенциала каломельного электрода.
Потенциал (εк) в каломельном электроде возникает на поверхности соприкосновения металлической ртути с раствором ее ионов и может быть выражен следующим уравнением:
 | 4.104 |
Каломель Hg2Cl2 трудно растворима в воде. При 298 К ее произведение растворимости
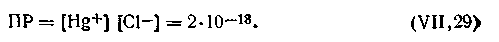 | 4.105 |
Из уравнения (4.105)
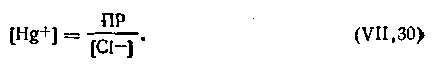 | 4.106 |
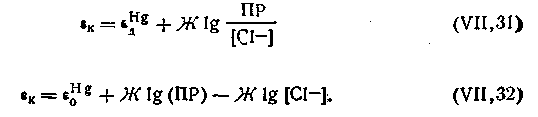 | 4.107 |
 | 4.108 |
В насыщенном растворе КСl при 291 К потенциал каломельного электрода εк=0,2503 В; в случае 1 н. раствора КСl εк —0,2864 В, в 0,1 н. КСl εк=0,3380 В. В практике чаще всего применяют каломельные электроды двух типов — с однонормальным раствором КСl и с насыщенным раствором этой соли.
Пользуясь каломельным электродом, можно опытным путем определить потенциал любого электрода. Так, для определения потенциала цинкового электрода составляют гальваническую цепь из цинка, погруженного в раствор ZnSO4, и каломельного электрода
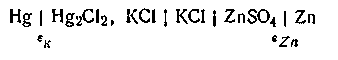
Допустим, что экспериментально определенная э.д.с. этой цепи дает величину E=1,0103 В. Потенциал каломельного электрода εк=0,2503 В. Потенциал цинкового электрода E=εк—εZn, откуда εZn=εK-Е, или eZn = 0,2503—1,0103 = —0,76 В.
Заменяя в данном элементе цинковый электрод медным, можно определить потенциал меди и т. д. Таким образом можно определить потенциалы почти всех электродов.
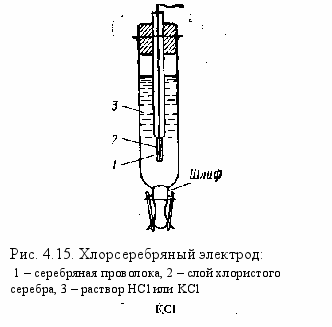
Хлорсеребряный электрод. Помимо каломельного электрода, в лабораторной практике в качестве электрода сравнения широкое распространение получил также хлорсеребряный электрод. Этот электрод представляет собой серебряную проволоку или пластинку, припаянную к медной проволоке и впаянную в стеклянную трубку. Серебро электролитически покрывают слоем хлорида серебра и помещают в раствор КСl или НС1.
Потенциал хлорсеребряного электрода, так же как и каломельного, зависит от концентрации (активности) ионов хлора в растворе и выражается уравнением
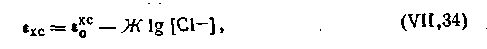 | 4.109 |
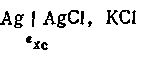
Потенциал этого электрода возникает на границе раздела серебро-раствор хлористого серебра.
При этом имеет место следующая электродная реакция:
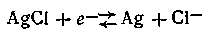
Ввиду чрезвычайно малой растворимости AgCl потенциал хлорсеребряного электрода имеет положительный знак по отношению к нормальному водородному электроду.
В 1 н. растворе КСl потенциал хлорсеребряного электрода по водородной шкале при 298 К равен 0,2381 В, а в 0,1 н. растворе εxc = 0,2900 В и т. д. По сравнению с каломельным электродом хлорсеребряный электрод имеет значительно меньший температурный коэффициент, т. е. его потенциал в меньшей степени изменяется с температурой.
