Методическое пособие к лабораторным работам по физической и коллоидной химии для студентов биологических факультетов
| Вид материала | Методическое пособие |
СодержаниеИзобразите схему строения мицеллы этого золя Опыт 6. Взаимная коагуляция золей. Единица измерения |
- Методические указания к электронным лабораторным работам по курсу физической химии, 2388.82kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 277.1kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 240.13kb.
- Настоящее учебное пособие подготовлено для студентов факультетов физической культуры., 2524.83kb.
- Календарно-тематический план лекций по физической и коллоидной химии для студентов, 67.53kb.
- Методическое пособие по лабораторным работам для студентов специальности 201400 «аудиовизуальная, 446.61kb.
- Методическое пособие по выполнению (подготовке) и защите для студентов отделений, 810.13kb.
- Учебно-методическое пособие для студентов биологических факультетов специальности 011600, 1207.48kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Учебно-методическое пособие для иностранных студентов. Волгоград 2004, 415.65kb.
Изобразите схему строения мицеллы этого золя
Опыт 5. Получение коллоидов методом диспергирования.
Пептизация почвы раствором щелочи.
В два химических стакана помещают по 1 г почвы, в один стакан приливается 10 см3 0,1н NaOH, в другой стакан столько же дистиллированной воды. Растворы кипятят 3-5 минут, затем охлаждают и отфильтровывают в пробирки. При сравнении окрасок делают выводы об образовании при кипячении с NaOH золя Fe(OH)3. Напишите схему строения мицеллы полученного золя.
Опыт 6. Взаимная коагуляция золей.
При смешивании двух золей, частицы которых заряжены противоположно, может наступить взаимная коагуляция. Эта коагуляция лучше всего происходит при равенстве общего количества противоположных зарядов золей (возможна взаимная нейтрализация частиц), но может отсутствовать при значительном избытке одного из золей, так в этом случае происходит перезарядка частиц золя, взятого в меньшем количестве.
В шесть пробирок наливают указанные в табл. количества золей гидрата окиси железа и берлинской лазури. Содержимое пробирок перемешивают и через 10 мин. Отмечают интенсивность коагуляции золей в каждой пробирке. Результаты наблюдений заносят в табл. 6.8.
Таблица 6.8
| Реактивы, см3 | № пробирок | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Золь гидрата окиси железа | 4,0 | 3,5 | 3,0 | 2,5 | 2,0 | 1,5 |
| Золь берлинской лазури | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 |
| Интенсивность коагуляции | | | | | | |
Опыт 7. Коагуляция коллоидов и проверка правила знака и зарядности.
По 5 см3 исследуемого золя, полученного согласно заданию в опыте 2 или опыте 4, наливают в 4 пробирки и по каплям, до помутнения, добавляют заранее приготовленные растворы:
а) для золя, полученного в опыте 2,:
в первую пробирку – K3[Fe(CN)6],
во вторую пробирку – Na 2SO4,
в третью пробирку – KCl;
Степень помутнения определяют в сравнении с контролем (4-я пробирка). Отмечают объемы электролитов, пошедших на коагуляцию. Данные заносят в табл. 6.9
Таблица 6.9 Данные для определения порога коагуляции
| №№ п/п | Электролит | W3, см3 | Сэл, кмоль/м3 | Vэл, см3 | γ, кмоль/м3 | Отношение |
| 1 | K3[Fe(CN)6] или Na3PO4 | 5 | | | | γ3/γ1 = |
| 2 | NaSO4 | 5 | | | | γ3/γ2 = |
| 3 | KCl | 5 | | | | γ3/γ3 = 1 |
Порог коагуляции рассчитывают по формуле (6.19).
СЭ*VЭ
= ———— 6.19
WЭ
где Сэ — концентрация электролита, кмоль/м3;
V э —объем электролита, м3;
Wэ —объем золя, м3;
Делением большого порога коагуляции на меньшее находят соотношение коагулирующей способности ионов различной степени окисления.
Сделайте вывод о справедливости правила Шульца-Гарди.
Опыт 8. Защитное действие желатина на золь Fe(ОН)3.
В две пробирки наливают по 5 см3 золя, полученного в опытах 2 или 4. В одну из них добавляют 1 см3 1%-ного раствора желатина и, затем, в обе — по 3-5 см3 0,1 н раствора К2SO4. Записывают в какой пробирке происходит коагуляция.
Сравнивают результаты и записывают наблюдения.
Опыт 9. Коагуляция желатина добавлением дегидратирующего вещества
В пять сухих пробирок приливают по 1 см3 буферных растворов со следующими значениями рН: 6,5; 5,3; 4,7; 4,1; 3,5. В каждую пробирку при перемешивании приливают по 0,3 см3 1%-ного раствора желатина, а затем поочередно добавляют по 1 см3 безводного этилового спирта.
Замечают и записывают очередность помутнения в каждой пробирке. Объясните, почему в пробирке с рН = 4,7 (ИЭТ желатина) помутнение начинается сразу, а при рН = 6,5 и рН = 3,5 помутнения не наблюдается. Сделайте выводы.
Опыт 10. Влияние рН среды на набухание ВМС (желатин).
В пять сухих мерных пробирок помещают по 0,4 г одинаково измельченного желатина. Объем (Vo), занятый желатином, записывают в табл. 6.10.
Таблица 6.10
Данные по определению степени набухания
| № п/п | рН | Vo, см3 | Vн, см3 | α |
| 1 | 3.5 | 0,36 | | |
| 2 | 4.1 | 0,36 | | |
| 3 | 4.7 | 0,36 | | |
| 4 | 5.3 | 0,36 | | |
| 5 | 6.5 | 0,36 | | |
В каждую пробирку приливают до отметки 6 см3 буферного раствора с различными значениями рН (3,5; 4,1; 4,7; 5,3; 6,5). Растворы периодически перемешивают, оставляют в штативе на 40-50 минут. Через указанное время измеряют объем набухшего желатина (Vн).
0,4 г желатина занимает объем ~ 0,70 см3. Рассчитывают степень набухания (α) по ур-нию (6.20) для различных значений рН.
VН –VО
α = ----------- 6.20
VО
Данные заносят в табл.6.10 и строят график зависимости рН = f (α). Делают вывод о влиянии рН (ИЭТ) на набухание.
ПРИЛОЖЕНИЕ
Таблица 1 Универсальная газовая постоянная R
| Единица измерения | Сокращенное обозначение, размерность | Коэффициенты для приведения к единицам СИ |
| Джоуль на киломоль-градус | 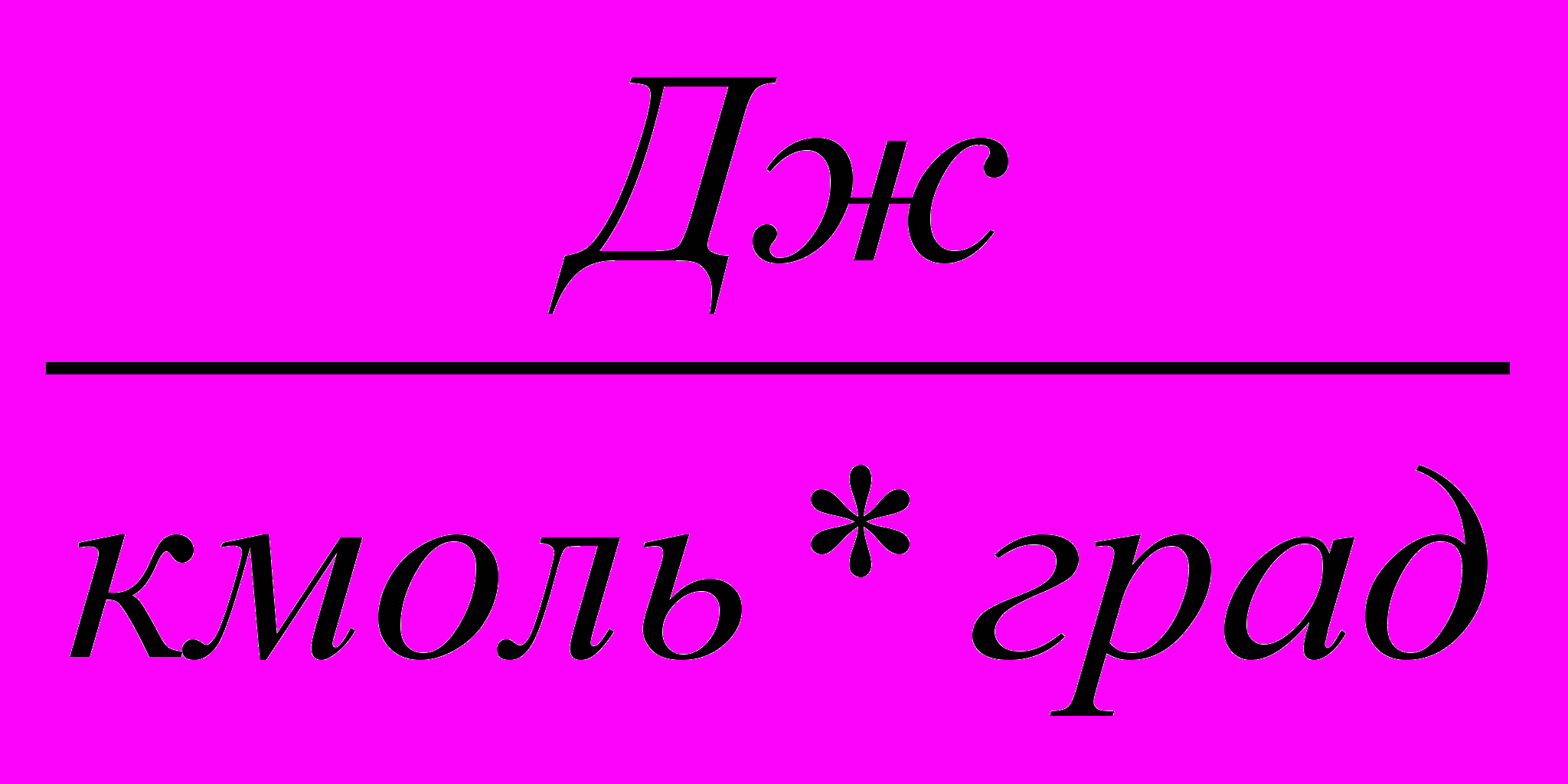 (см2сек2град) | 0,082 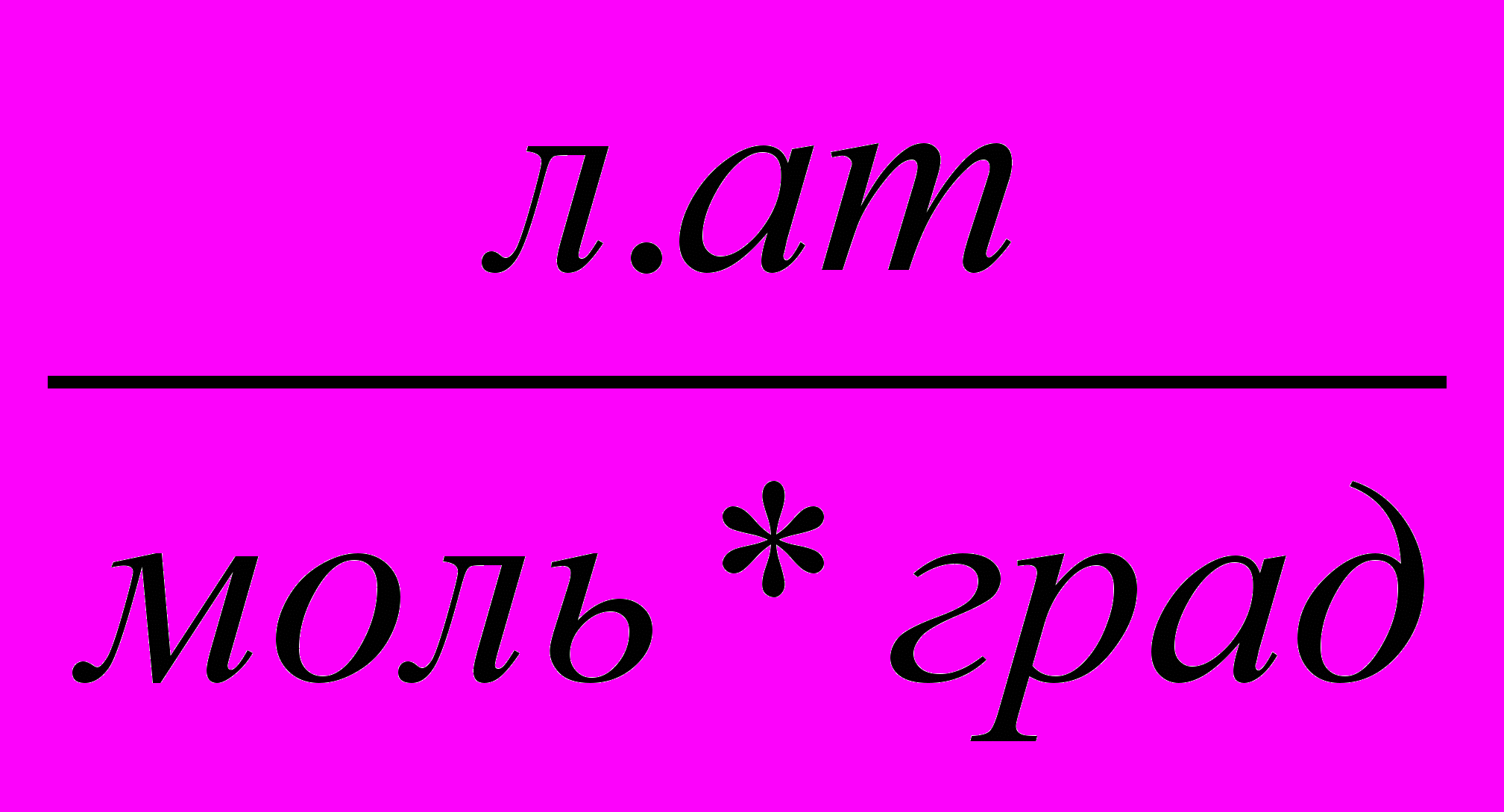 |
| 1,986 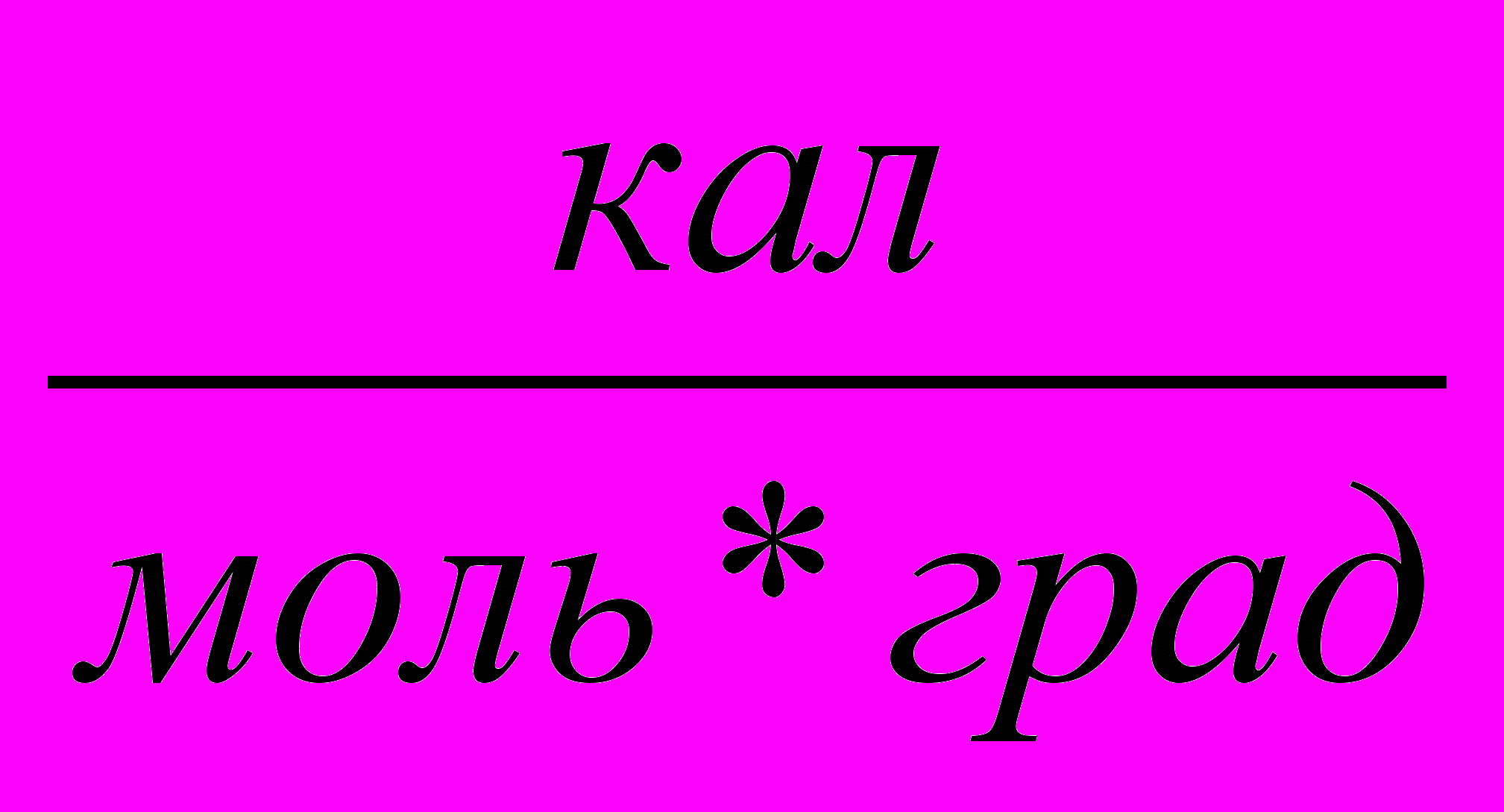 | ||
| 8,32 * 107 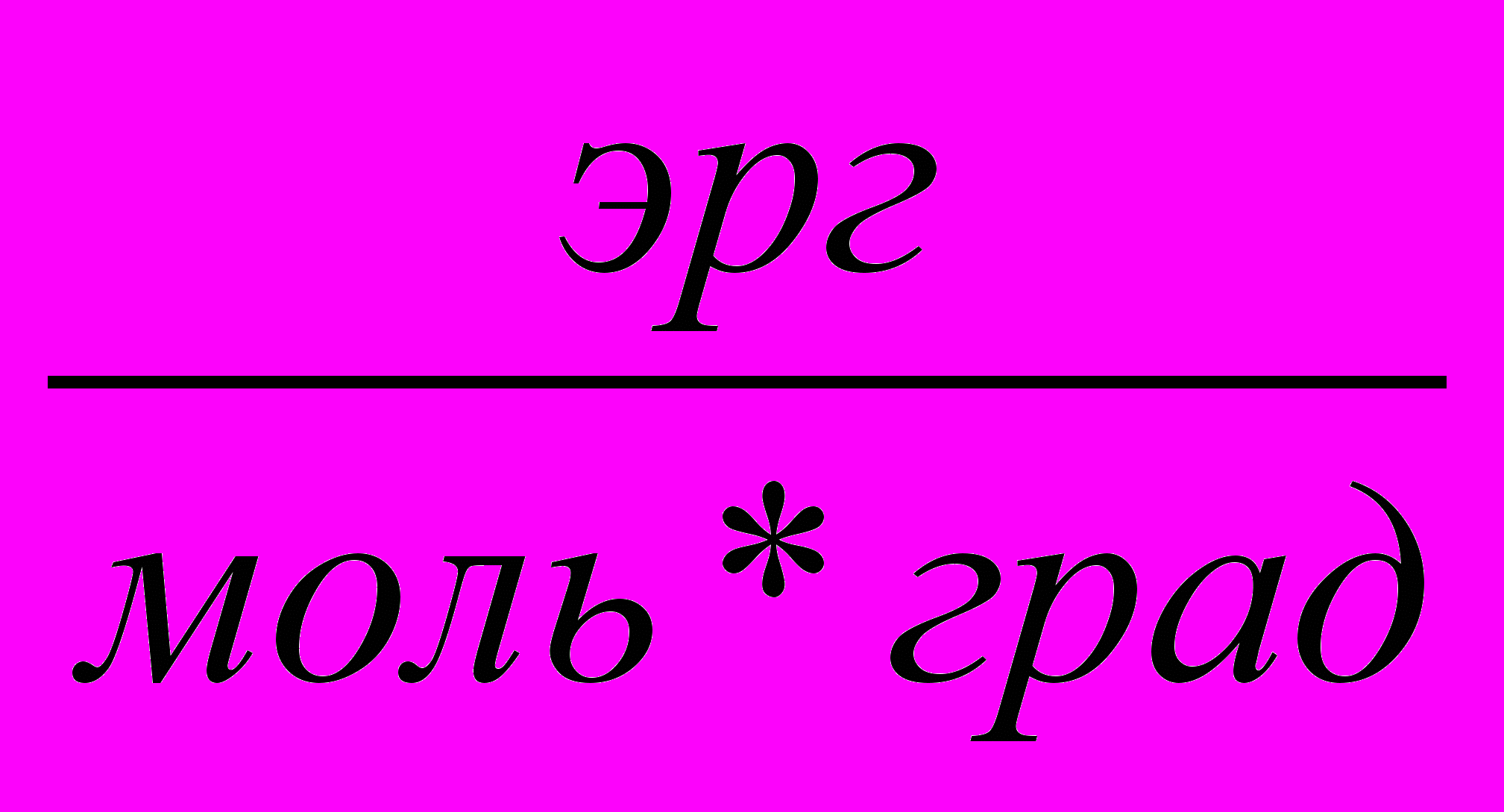 | ||
| 8,32 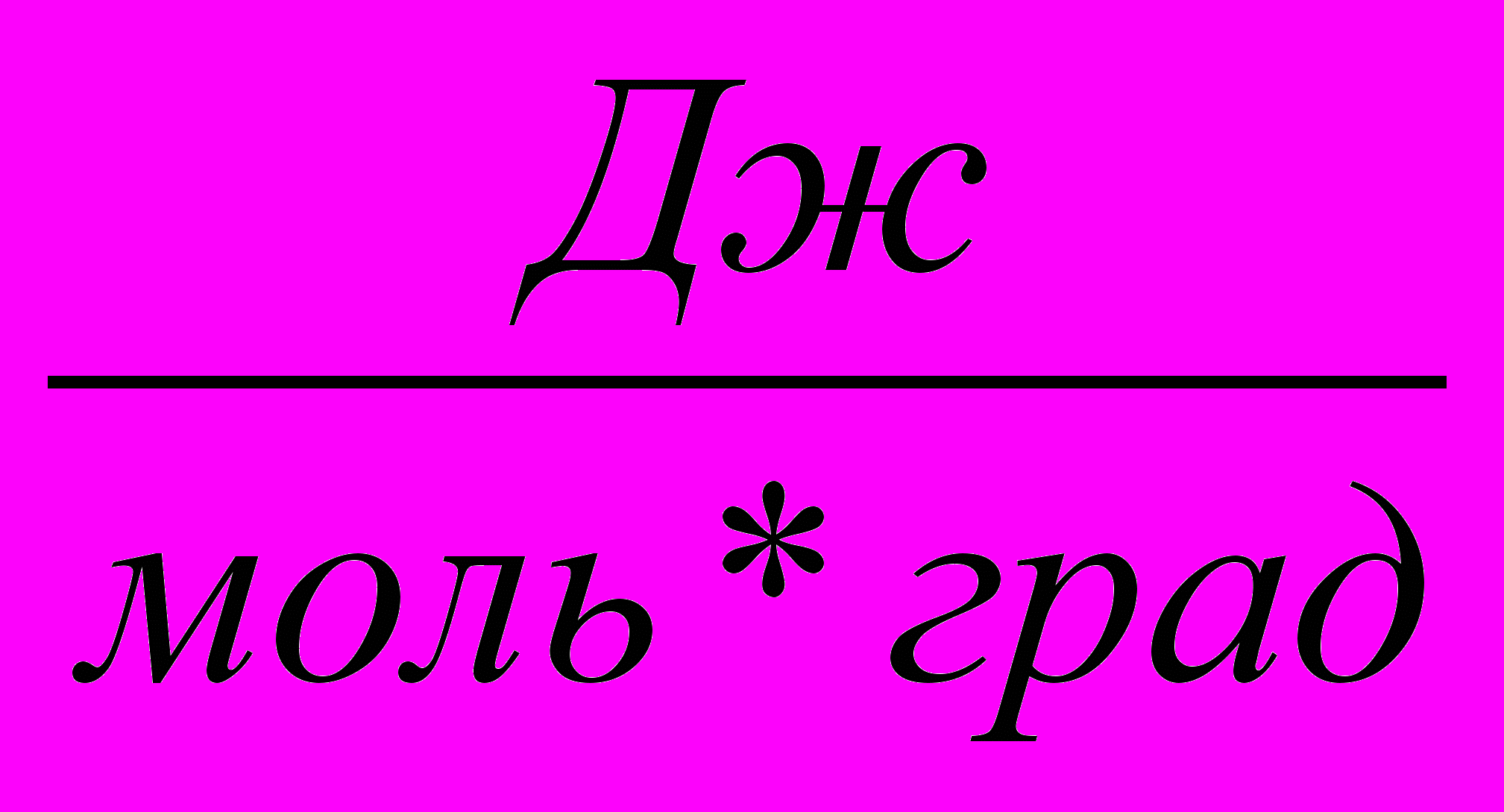 | ||
| 8,32 * 103 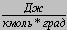 |
Таблица 2. Подвижность ионов при бесконечном разбавлении
раствора, См * м2/кмоль (291К)
| Ион | Подвижность | Температурный Коэффициент |
| Na+ | 43,6 | 0,0244 |
| K+ | 63,7 | 0,0217 |
| Cl+ | 66,3 | 0,0216 |
| OH - | 174,0 | 0,1800 |
| NH4 - | 63,6 | 0,0180 |
| CH3COO - | 35,0 | 0,0238 |
| H+ | 315,0 | 0,154 |
| Ag+ | 53,2 | 0,0229 |
| NO3 - | 62,6 | 0,0205 |
Таблица 3. Криоскопические и эбулиоскопические константы некоторых растворителей
| Растворитель | Формула | К, 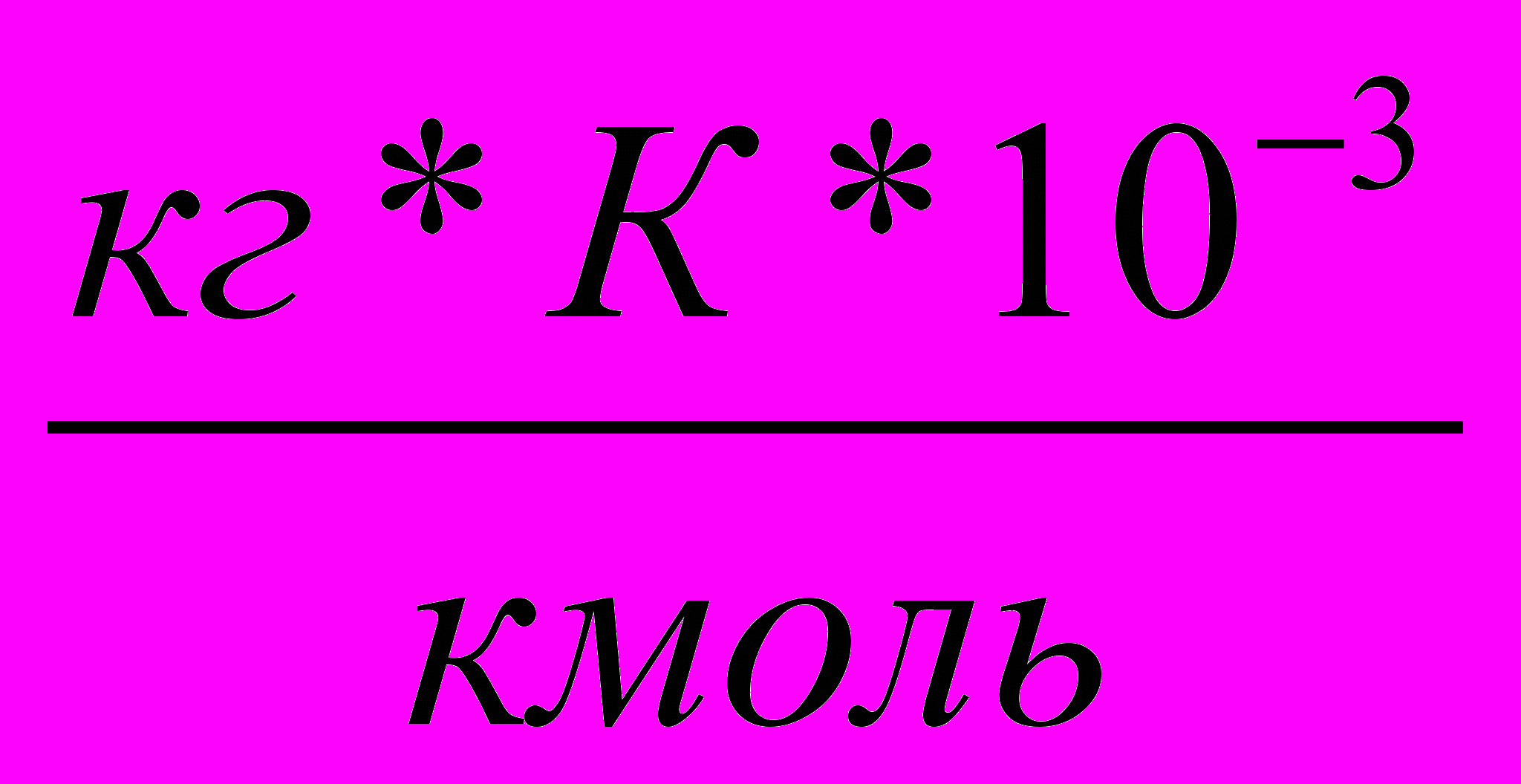 | Е, 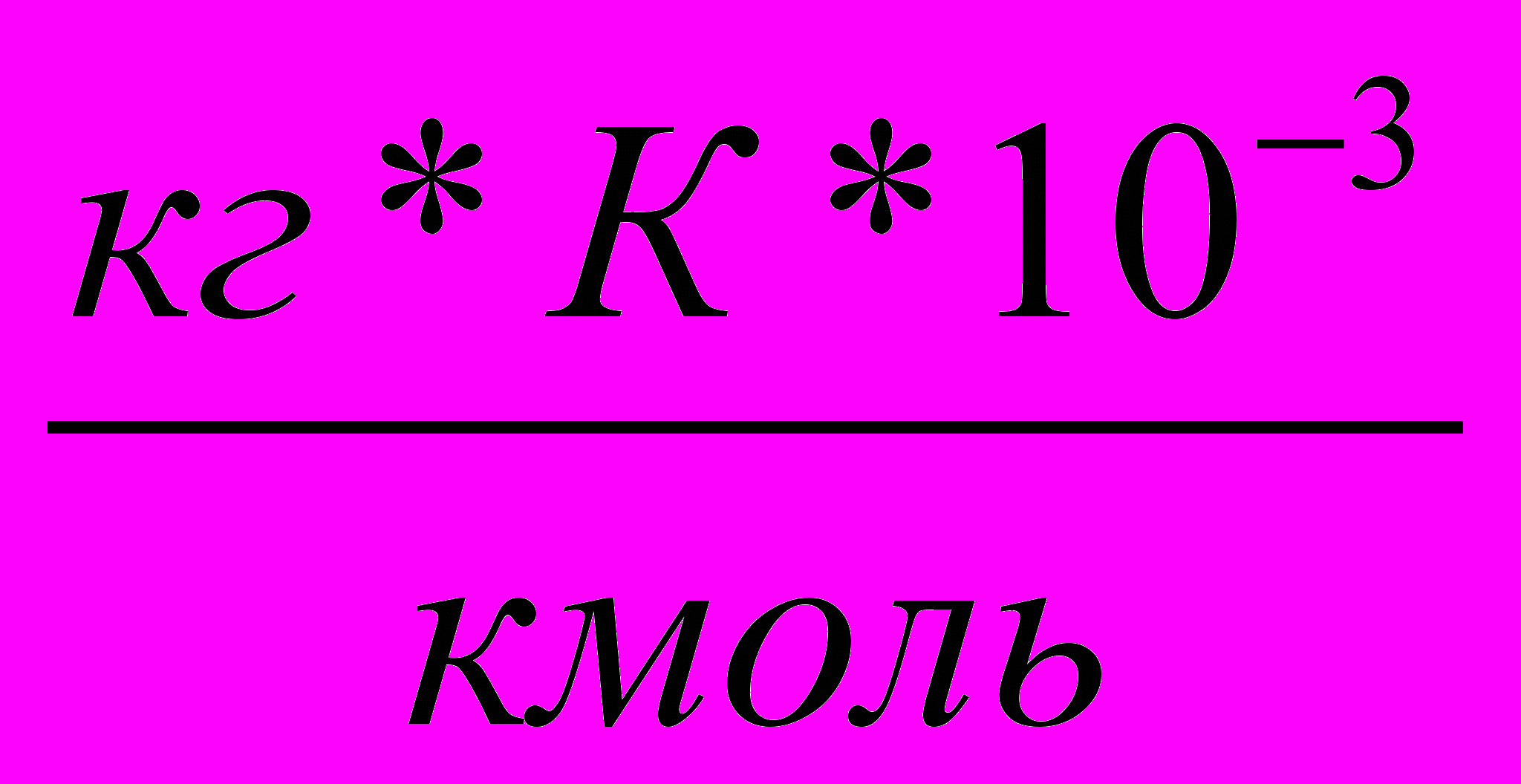 |
| Вода................................. | Н2О | 1,86 | 0,85 |
| Бензол............................. | С6Н6 | 5,12 | 2,57 |
| Уксусная кислота........... | СН3СООН | 3,90 | 3,10 |
Таблица 4 . Поверхностное натяжение воды при различных температурах
| Температура, К | Поверхностное натяжение, 10-3 Н/м | Температура, К | Поверхностное натяжение, 10-3 Н/м |
| 291 | 73,05 | 295 | 72,44 |
| 292 | 73,90 | 296 | 72,28 |
| 293 | 72,75 | 297 | 72,13 |
| 294 | 72,79 | 298 | 71,97 |
Таблица 5 . Константы диссоциации кислот и оснований при 293 К
| Вещество | Формула | Кд | рКд= - lgКд |
| Уксусная | СН3СООН | 1,85*10-6 | 4,75 |
| Фосфорная | Н3РО4 | 1. 7,52*10-3 | 2,12 |
| 2. 6,81*10-8 | 7,20 | ||
| 3. 1,26*10-12 | 11,9 | ||
| Аммоний гидроксид | NH4OH | 1,79*10-5 | 4,74 |
Таблица 6. Интегральная теплота растворения ΔН солей в воде при 298 К
| п, моль соли на 1 кг Н2О | ΔН, кДж/моль | ||||
| NaCl | KCl | KNO3 | CaCl2 | K2SO4 | |
| 1/ | 3,89 | 17,23 | 34,93 | -82,93 | 23,15 |
| 0,1 | 4,25 | 17,55 | 34,77 | -80,88 | 24,18 |
| 1,0 | 3,79 | 17,28 | - | -79,09 | - |
| 5,0 | 1,99 | - | - | - | - |
