На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
СВЕТОЧ
ТАТЬЯНА ЭДУАРДОВНА
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ И ГЕНЕТИЧЕСКАЯ
ХАРАКТРИСТИКА V АНТИГЕНА YERSINIA PESTIS
03.02.03-микробиология
03.01.06-биотехнология (в том числе бионанотехнологии)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Оболенск – 2012
Работа выполнена в Федеральном бюджетном учреждении науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Научные руководители:
доктор медицинских наук, профессор Анисимов Андрей Павлович
кандидат медицинских наук Дентовская Светлана Владимировна
Официальные оппоненты:
доктор медицинских наук Гремякова Татьяна Андреевна
кандидат биологических наук Воложанцев Николай Валентинович
Ведущая организация:
Федеральное казенное учреждение здравоохранения «Ставропольский научно-исследовательский противочумный институт» Роспотребнадзора
Защита состоится «01» марта 2012 года в ______ ч на заседании диссертационного совета Д 350.002.01 при Федеральном бюджетном учреждении науки «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора по адресу: 142279, Московская обл., Серпуховский район, п. Оболенск
С диссертацией можно ознакомиться в библиотеке Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии».
Автореферат разослан «_____» ___________ 2012 г.
Ученый секретарь диссертационного совета,
кандидат биологических наук Фурсова Н.К.
Общая характеристика работы
Актуальность проблемы. V антиген (LcrV) – полифункциональный фактор патогенности и один из основных протективных антигенов иерсиний (Une, Brubaker, 1982). Он представляет собой полипептид с молекулярной массой 37 кДа (Price et al., 1989), кодируемый геном lcrV, расположенным на плазмиде вирулентности (кальцийзависимости) патогенных для человека представителей рода Yersinia: Y. pestis, Y. pseudotuberculosis и Y. enterocolitica. Установлено, что V антиген ингибирует хемотаксис нейтрофилов и запускает механизм супрессии провоспалительных цитокинов (Brubaker et al.,1984, Nakajima et al., 1997). Этот белок регулирует работу многокомпонентной системы секреции белков третьего типа (type 3 secretion system -T3SS) путем прямого влияния на собственно секрецию эффекторных белков Yop (Yersinia outer proteins) и опосредованно – на транскрипцию их генов, а также на перенос белков-эффекторов внутрь эукариотической клетки-мишени (Bergman et al., 1991, Price et al., 1991).
Нуклеотидную последовательность гена lcrV из Y. pestis в 1989 г. опубликовал коллектив авторов из Университета Кентукки, США (Price et al., 1989). Позднее шведские исследователи из Университета Умеа секвенировали аналогичный ген из Y. pseudotuberculosis (Bergman et al., 1991).
По полиморфизму структуры гипервариабельной области на N-конце молекулы в пределах 40-61 а.о. (TLR2 - активный район) V антигены делят на семь классов. Первый из них составляют последовательности белка Y. pestis и Y. pseudotuberculosis, остальные шесть вариантов найдены только у Y. enterocolitica, причем отдельные структурные варианты отличаются по своей иммуносупрессивной активности (Sink et al., 2005).
V антиген является высококонсервативным белком в эпидемически значимых штаммах Y. pestis основного подвида subsp. pestis (Adair et al., 2000, Motin et al., 1992). Вариации в нуклеотидных последовательностях гена lcrV описаны для штаммов неосновного подвида Y. pestis ("полевочьи" штаммы): Pestoides F (Adair et al., 2000) и 91001 (Song et al., 2004, Zhou et al., 2004), циркулирующих в Закавказском высокогорном очаге (Азербайджан, Грузия или Армения) и степях Внутренней Монголии (Китай), соответственно.
Большинство исследований, посвященных оценке протективной активности (Burrows, Bacon, 1958, Une, Brubaker, 1982, Lawton et al., 1963, Motin et al., 1994, 1996), способности образовывать олигомеры (Broz et al., 2007, Caroline et al., 2008, Pouliot et al., 2007, Tito et al., 2001), иммуносупрессивной активности (Pouliot et al., 2007, Motin et al., 1996, Sing et al., 2002, Sodhi et al., 2004), а также определение трехмерной структуры (Derewenda et al., 2004) V антигена проведены с использованием молекул LcrV «классического» (описываемого нами как D) типа.
Анализ генетического и структурно-функционального полиморфизма V антигена Y. pestis с привлечением комплекса методов микробиологии, генной инженерии, биохимии, иммунологии и компьютерного моделирования позволит получить новые сведения о роли различных структурных вариантов V антигена в патогенезе и иммуногенезе чумы, а также о степени его изменчивости в ходе микроэволюции Y. pestis у представителей различных внутривидовых групп. Это создаст основу для разработки методологии получения технологичных штаммов-продуцентов с максимальным уровнем продукции высокопротективных вариантов V антигена, необходимую для конструирования экспериментальных вакцин нового поколения.
Цель исследования - структурно-функциональный и генетический анализ V антигена Y. pestis для рационального конструирования субъединичных противочумных вакцин.
Задачи исследования:
- Изучить полиморфизм нуклеотидных последовательностей lcrV генов и аминокислотных последовательностей соответствующих им полипептидов у представителей различных внутривидовых групп Y. pestis и оценить влияние структуры V антигена на избирательную вирулентность "полевочьих" штаммов возбудителя чумы.
- Провести компьютерное моделирование трехмерной структуры различных вариантов V антигена Y. pestis.
- Осуществить молекулярное клонирование генов различных структурных вариантов V антигена Y. pestis, провести выделение и очистку рекомбинантных белков.
- Изучить иммуногенность различных структурных вариантов V антигена Y. pestis.
Научная новизна.
Приоритет в определении нуклеотидной последовательности, кодирующей иммуногенный полипептид LcrV(G113), вызывающий защитный иммунный ответ против Y. pestis, и в конструировании рекомбинантного штамма бактерий Escherichia coli BL21(DE3)/pETV I3455 – продуцента иммуногенного полипептида LcrV(G113) защищен патентом на изобретение № 2439155 С1 РФ.
Выявлены три новых структурных типа V антигена Y. pestis. Показано, что LcrV типа D, характерный для эпидемически значимых штаммов Y. pestis subsp. pestis, также широко распространен среди наиболее филогенетически древних штаммов различных биоваров subsp. microtus. Только 39 % от изученных «полевочьих» штаммов обладают вариантными структурами LcrV (отличными от типа D).
Установлено, что структурный полиморфизм V антигена Y. pestis не является причиной избирательной вирулентности «полевочьих» штаммов.
Проведено компьютерное моделирование трехмерной структуры V антигена типа А и проведена оценка влияния выявленного структурного полиморфизма V антигена Y. pestis на структуру молекулы.
Показано влияние полиморфизма по отдельным аминокислотным остаткам V антигена на способность белка к олигомеризации и на его протективную активность.
Практическая ценность диссертации.
Депонированы в GenBank последовательности lcrV гена 18 штаммов Y. pestis (номера доступа: EF645809.1, DQ489557.1, EF645806.1, GQ468417.1, DQ489552.1, GQ468423.1, EF645807.1, EF645808.1, DQ489556.1, DQ489555.1, GQ468422.1, GQ468421.1, GQ468420.1, GQ468419.1, DQ489554.1, DQ489553.1, GQ468416.1, GQ468415.1) (международный уровень внедрения).
Депонирован в коллекции "ГКПМ-Оболенск" ГНЦ ПМБ охраноспособный штамм E. coli BL21(DE3)pETV I3455 - продуцент V антигена с повышенной способностью к агломерации и повышенной протективной активностью (федеральный уровень внедрения).
Материалы диссертации используются в лекциях при подготовке магистрантов Пущинского государственного естественнонаучного института и аспирантов ГНЦ ПМБ.
Препараты V антигена, выделенные из сконструированных продуцентов, были использованы для получения моноклональных антител в группе иммунохимии филиала Института биоорганической химии им. ссылка скрыта и ссылка скрыта РАН (Пущино) и в лаборатории молекулярной биологии ГНЦ ПМБ, а также в качестве одного из компонентов экспериментальных чумных вакцин, разрабатываемых в рамках Госконтрактов № 124-Д от 11.06.2009 г. (№ гос. регистрации 01200905859), № 52-Д от 29.06.2010 г. (№ гос. регистрации 01201002280) и № 62-Д от 22.07.2011 г. (№ гос. регистрации 01201174793) с Роспотребнадзором и № Н/3/7/50ф-11-ДГОЗ от 15.04.2011 г. (№ гос. регистрации 01201162945) с Министерством обороны РФ. Кроме того, препараты V антигена применяются в лаборатории биологических испытаний ГНЦ ПМБ для оценки динамики продукции антител у лабораторных животных (мышей, крыс, хомяков и морских свинок), инфицированных Y. pestis.
Положения, выносимые на защиту:
- Избирательная вирулентность "полевочьих" штаммов Y. pestis не обусловлена структурной вариабельностью V антигена.
- Аминокислотный тип D – широко распространенный и наиболее древний из структурных вариантов V антигена Y. pestis.
- Рекомбинантный штамм бактерий E. coli BL21(DE3)/pETV I3455 – продуцент иммуногенного полипептида LcrV(G113), вызывающего защитный иммунный ответ против Y. pestis.
Работа выполнена в лаборатории микробиологии чумы отдела особо опасных инфекций ГНЦ ПМБ по планам НИР в рамках проекта МНТЦ № 2426 (научный руководитель - к.м.н. С.В. Дентовская); проекта РФФИ № 08-04-00405-а (научный руководитель - д.м.н., проф. А.П. Анисимов), договора № 74-Д от 31 декабря 2005 г. (НИР 001-2, № гос. регистрации 01200904237, научный руководитель - д.м.н., проф. И.А. Дятлов) с Роспотребнадзором и Госконтрактов № 124-Д от 11.06.2009 г. (№ гос. регистрации 01200905859), и № 52-Д от 29.06.2010 г. (№ гос. регистрации 01201002280) и № 62-Д от 22.07.2011 г. (№ гос. регистрации 01201174793) с Роспотребнадзором (научный руководитель - д.м.н., проф. А.П. Анисимов).
Личный вклад соискателя. Экспериментальные результаты, представленные в диссертации, получены лично автором в сотрудничестве, главным образом, с П.Х. Копыловым (ГНЦ ПМБ) и В.Л. Мотиным (Медицинское отделение Техасского университета, Галвестон, Техас, США). На защиту вынесены только те положения и результаты экспериментов, в получении которых роль автора была определяющей. В исследованиях также принимали участие сотрудники ГНЦ ПМБ Е.А. Панферцев и М.Е. Платонов. Компьютерное моделирование трехмерной структуры различных вариантов V антигена на основании определенных автором нуклеотидных последовательностей проводили B.W. Segelke и A. Zemla из Ливерморской национальной лаборатории им. ссылка скрыта Министерства энергетики ссылка скрыта (ссылка скрыта, ссылка скрыта, США).
Апробация работы. Материалы диссертации доложены и представлены на: VI-й Межгосударственной научно-практической конференции государств-участников СНГ "Санитарная охрана территорий государств-участников содружества независимых государств: проблемы биологической безопасности и противодействия биотерроризму в современных условиях" (Волгоград, 2005); 2nd FEMS Congress of European Microbiologists (Madrid, Spain, 2006); NIAID Research Conference (Opatija, Croatia, 2006); VII-й Межгосударственной научно-практической конференции государств-участников СНГ "Чрезвычайные ситуации международного значения в общественном здравоохранении в решениях Санкт-Петербургского саммита государств «группы восьми» и санитарная охрана территорий государств-участников содружества независимых государств" (Оболенск, Московская обл., 2006); 9th International Symposium on Yersinia (Lexington, Kentucky, USA, 2006); научно-практической конференции "Современные аспекты эпидемиологического надзора за особо опасными инфекционными заболеваниями на Юге России" (Ставрополь, 2007); 5th International Conference on Emerging Zoonoses (Limassol, Cyprus, 2007); 9th Symposium of Analytical Microbiology (Beijing, People’s Republic of China, 2007); NATO Science for Peace and Security Programme Advanced Research Workshop “Emerging and Endemic Pathogens: Advances in Surveillance, Detection, and Identification” (Тбилиси, Грузия, 2008); IX Межгосударственной научно-практической конференции государств-участников СНГ «Современные технологии в реализации глобальной стратегии борьбы с инфекционными болезнями на территории государств-участников Содружества Независимых Государств» (Волгоград, 2008); научно-практической конференции, посвященной 75-летию Иркутского НИПЧИ (Иркутск, 2009); II-й научно-практической школы-конференции молодых ученых и специалистов научно-исследовательских организаций Роспотребнадзора «Биологическая безопасность в современном мире» (Московская обл., Оболенск, 2009); International Symposium on Bacterial Evolution and Pathogenesis (Zhenjiang, Jiangsu province, China, 2010), III-м съезде военных врачей «Достижения науки и практики в обеспечении санитарно-эпидемиологического благополучия Вооруженных Сил Российской Федерации» (С-Петербург, 2010); III-й научно-практической школы-конференции молодых ученых и специалистов научно-исследовательских организаций Роспотребнадзора «Современные технологии обеспечения биологической безопасности» (Московская обл., Оболенск, 2011).
План и аннотация диссертации обсуждены и одобрены на заседании ученого совета ГНЦ ПМБ 9 апреля 2010 г., протокол № 4. Результаты исследований доложены на заседании межлабораторного семинара ГНЦ ПМБ (протокол № 21 от 27 декабря 2011 г.).
Публикации. Основное содержание работы отражено в 14 научных публикациях, в том числе в двух статьях, опубликованных в междунарнародных рецензируемых журналах, реферируемых ISI, и в одном патенте на изобретение № 2439155 С1 РФ.
Объем и структура диссертации. Диссертация изложена на 105 страницах машинописного текста и включает следующие разделы: введение, обзор литературы, материалы и методы исследований, три главы результатов исследований с их обсуждением, заключение, выводы и указатель литературы, включающий 16 работ отечественных и 228 - зарубежных авторов. Работа иллюстрирована 13 рисунками и 4 таблицами. Приложения состоят из двух статей, опубликованных по теме диссертации, и описания изобретения к патенту № 2439155 С1 РФ.
Содержание работы
Материалы и методы исследования
Для секвенирования гена lcrV использовали 73 штамма чумного микроба, относящихся к различным подвидовым группам (subsp. microtus: (bv. altaica, caucasica, ulegeica, hissarica, talassica) и subsp .pestis (bv. antiqua, medievalis)), выделенные в различных природных очагах чумы России и других стран СНГ, а также на территории Монголии, которые выращивали на агаре Хоттингера с добавлением 1 % гемолизированной крови в течение 48 ч при температуре 28 С. Геномную ДНК выделяли в соответствии с методическими указаниями МУ 1.3.1794 – 03 «Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности» с использованием комплекта реагентов для выделения ДНК из биопроб производства НПФ «Литех».
Используемые для молекулярного клонирования штаммы E. coli DH5α, E. coli BL21(DE3) выращивали на жидкой или плотной питательных средах Луриа-Бертани (LB) при температуре 37 C (Miller, 1972). Отбор трансформантов проводили по фенотипу ApR на плотной питательной среде LB, содержащей ампициллин в концентрации 50 мкг/мл. Для выделения V антигена культуры E. coli BL21(DE3)/pETV I3455 (/pETV I2359, /pETV A1728, /pETV C582, /pETV9) выращивали при температуре 37 C в жидкой аэрируемой среде LB в лабораторном ферментере New Brunsuik Scientific с рабочим объемом 2 л.
Для клонирования и экспрессии в E. coli рекомбинантных белков использовали pET систему (Novagen, США). Данная система содержит плазмидную векторную ДНК pET32b(+) (5899 п.о.) (см. ниже) и подходящие для экспрессии рекомбинантных белков бактериальные штаммы.
В экспериментах с лабораторными животными использовали мышей линии BALB/c (19 2) г, морских свинок (275 25) г из вивария ГНЦ ПМБ в соответствии с требованиями к качеству лабораторных животных и условиям их содержания [Лившиц, 1978].
Генно-инженерные манипуляции с ДНК, а также выделение плазмидной ДНК из E. coli и элекрофорез в агарозном геле проводили согласно руководству (Маниатис и др., 1984) и рекомендациям изготовителя ферментов (MBI Fermentas, Латвия).
Нуклеотидную последовательность гена lcrV различных штаммов Y. pestis определяли методом секвенирования ПЦР-фрагментов, полученных с использованием секвенирующих праймеров (F1 5'-cag cct caa cat ccc tac ga-3'; F2 5'-gca aaa tgg cat caa gcg ag-3' и R 5'-tag ttc ccc ctc ctt tta gg-3'), без предварительного клонирования. Сиквенс гена lcrV проводили с использованием реактивов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом на автоматическом секвенаторе ДНК ABI PRISM 3130 XL (Applied Biosystems, США). Анализ нуклеотидных последовательностей гена lcrV, а также соответствующих аминокислотных последовательностей осуществляли с помощью программного обеспечения Laser gene (Invitrogen Corporation, США) и DNASIS (Hitachi, Япония). Последовательности ДНК сравнивали с представленными в базе данных GenBank с помощью программы BLAST.
Трехмерную модель LcrV для "консенсусного" типа A рассчитали на основе кристаллической структуры LcrV типа D из штамма KIM (код доступа 1R6F в Protein Data Bank) (Derewenda et al., 2004). Применяли структурную классификацию белков (SCOP - Structural classification of proteins; версия 1.71 (lmb.cam.ac.uk/scop/data/scop.b.f.bb.b.b.b.php)) (Murzin et al., 1995) и моделирование с использованием метода LGA (Local global alignment) (Zemla, 2003).
Для аналитической индукции синтеза V антигена клоны E. сoli BL21(DE3), содержащие рекомбинантные плазмиды, выращивали в жидкой питательной среде LB с ампициллином (50 мкг/мл) в течение ночи при температуре 37 С. Ночную культуру разводили в 10 раз LB бульоном, содержащим ампициллин (50 мкг/мл), и культивировали 2 ч при температуре 37 С с аэрацией. Далее в пробирки вносили ИПТГ до конечной концентрации 1 мМ и продолжали культивирование 3,5 ч. По 100 мкл культуры отбирали, клетки осаждали центрифугированием, осадок ресуспендировали в 50 мкл трис-ЭДТА - буфера (pH 7,4) и добавляли 50 мкл лизирующего буфера для белкового электрофореза.
Анализ рекомбинантного V антигена проводили при помощи электрофореза в полиакриламидном геле (Laemmli, 1970) и вестерн-блот-анализа (Towbin et al, 1979).
Выделение и хроматографическую очистку V антигена осуществляли в три этапа. На первом этапе V антиген очищали с помощью гель-эксклюзивной хроматографии, на втором этапе с помощью ионообменной хроматографии, на третьем этапе проводили гидрофобную хроматографию [Копылов и др., 2011].
Для изучения некоторых физико-химических свойств растворы антигенов LcrV(W113) из штамма E. coli BL21(DE3)/pETV C582, LcrV(G113) из штамма E. coli BL21(DE3)/pETV I3455 нормировали по концентрации общего белка до величины 1 мг/мл и инкубировали при температуре 45 C в течение 20 ч (Tito et al., 2001), после чего пробы анализировали при помощи денатурирующего электрофореза в 12 % полиакриламидном геле в нередуцирующих условиях (без добавления 2-меркаптоэтанола), а также в 7 % геле, приготовленном без додецилсульфата натрия. Белки в гелях окрашивали Кумасси G-250.
Титр антител (IgG) к V антигену в сыворотках иммунных мышей определяли методом твердофазного ИФА согласно руководству T. Ngo et al. [1988]. В качестве адсорбированных антигенов были использованы различные структурные варианты V антигена в концентрации 10 мкг/мл. Оптическую плотность в лунках планшета определяли с помощью Multiscan (Labsystem, Финляндия) при длине волны 492 нм. Титр определяли как величину наибольшего разведения сыворотки, оптическая плотность (ОП) которой в 2 раза превышала ОП в соответствующей контрольной лунке.
Вирулентность штаммов Y. pestis с различными структурными вариантами V антигена изучали на мышах и морских свинках. Животных заражали подкожно введением десятикратных разведений культур Y. pestis в физиологическом растворе (0,9 %) в объеме 0,2 мл на животное. Наблюдение за зараженными животными проводили в течение 30 сут. Погибших животных вскрывали и подвергали бактериологическому исследованию для подтверждения причин гибели.
Для изучения иммуногенной и протективной активности препаратов V антигена Y. pestis с различной аминокислотной последовательностью антигены, выделенных из штаммов-продуцентов на основе E.coli BL21 (DE3), сорбировали на стерильной гидроокиси алюминия в фосфатно-солевом буфере при перемешивании в течение 2 ч при комнатной температуре. Белки предварительно стерилизовали, пропуская через мембрану с диаметром пор 0,22 мкм. Концентрацию антигена рассчитывали таким образом, чтобы 200 мкл суспензии содержали 10 мкг белка. Иммунизацию и заражение проводили по следующей схеме: 0-й день иммунизация мышей 10 мкг препаратов антигена, сорбированного на гидроокиси алюминия; 30-й день повторная иммунизация 10 мкг белка; 62-й день отбор крови для определения титров антител иммунизированной и контрольной группы; 64-й день – подкожное заражение мышей вирулентным штаммом Y.pestis 231 в дозе от 1 КОЕ до 107 КОЕ;
Наблюдение за зараженными животными проводили в течение 21 сут. Погибших животных вскрывали и исследовали бактериологическим методом. Вычисление величин LD50 и доверительного интервала (для вероятности 95 ) проводили по методу Kärber в модификации И.П. Ашмарина и А.А. Воробьева (Ашмарин И А.,Воробьев А.А, 1962).
Напряженность противочумного иммунитета (ИИ), т.е. способность вакцинного препарата (экспериментального образца) предохранять животное от заражения массивными дозами вирулентной культуры, определяли по формуле:
| | ИИ= 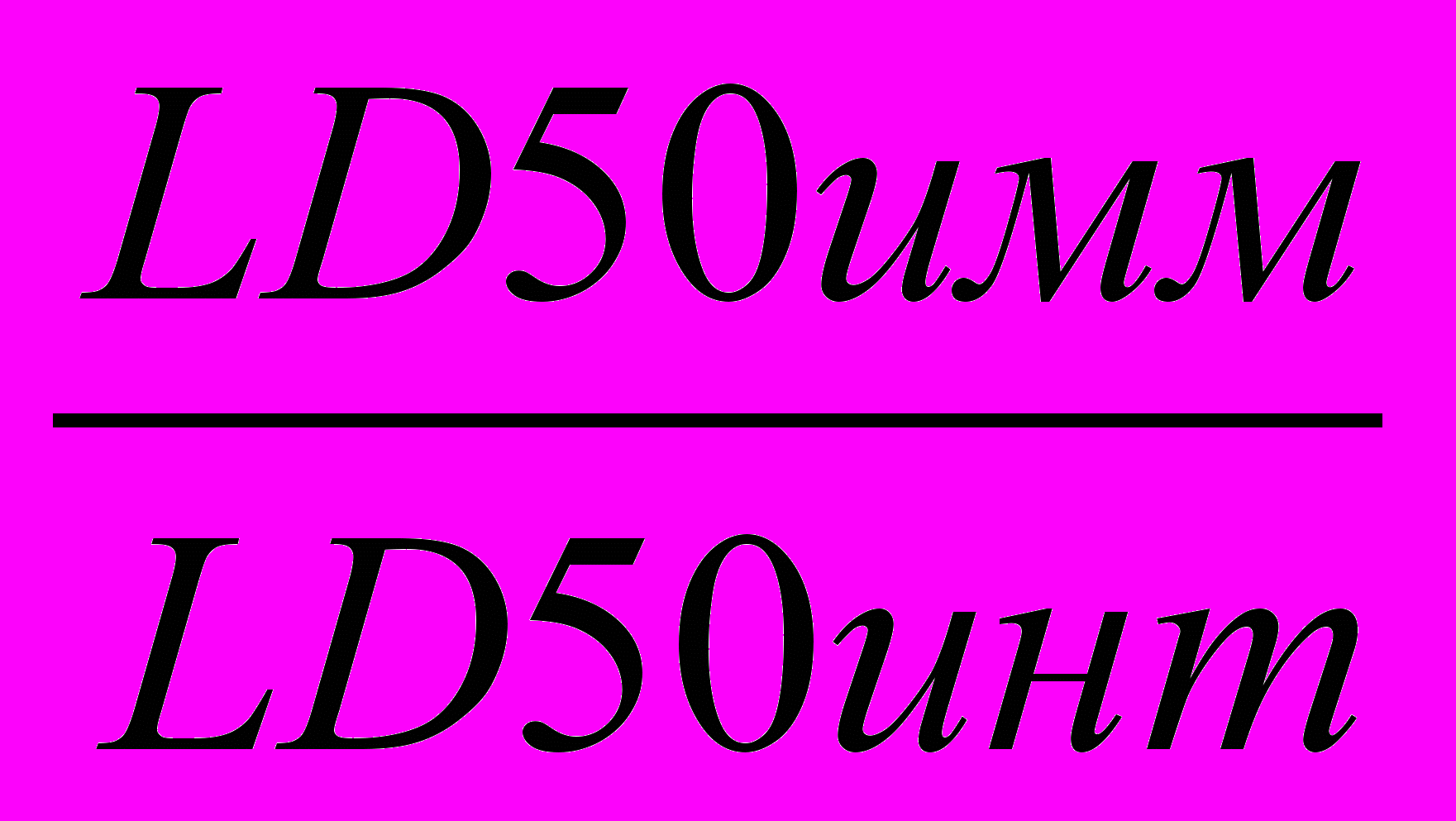 , , | (1) |
где ИИ – индекс иммунитета; LD50имм - LD50 для животных, иммунизированных экспериментальными образцами препаратов, в дозе 10 мкг, КОЕ; LD50инт - LD50 для интактных животных, КОЕ.
