Экспрессия гена и белка марганцевой супероксиддисмутазы в клетках с p53 (+/+) и p53 (-/-) геномом
| Вид материала | Диплом |
| Рис. 5. Зимограммы SOD в клетках MCF-7 Рис 6. Зимограммы SOD в клетках H1299 |
- Курс лекций 1999-2000, 11782.85kb.
- Николай Владимирович Максимович, Игорь Арсениевич Стогов, Андрей Эдуардович Фатеев,, 1978.73kb.
- Чистякова Елена Андреевна Открытый урок, 128.48kb.
- 1. 1 Природа генів, 282.45kb.
- Вопросы к экзамену по курсу «Молекулярная биология» (вечернее отделение), 36.64kb.
- Урок №94 тема. Основные этапы биосинтеза белка, 33.42kb.
- Методическая разработка урока по теме «Биосинтез белка», 59.93kb.
- Молекулярный уровень, 31.47kb.
- Всероссийская олимпиада школьников по обществознанию 2007/2008 гг. Региональный этап., 139.44kb.
- Лекция 2: Принцип Дирихле. Формулировка: Если в n "клетках", 166.11kb.
М
К
2
4
8
Рис.2 Результаты ОТ-ПЦР по генам sod2 и gapdh в клетках MCF-7.
К - экспрессия мРНК генов sod2 и gapdh до нанесения актиномицина ;
2, 4, 8 – экспрессия мРНК генов sod2 и gapdh через 2 ч (2), 4 ч (4) и 8 ч (8) после нанесения ActD соответственно. М – маркер размеров ДНК.
М
2
4
8
К
Рис. 3 Результаты ОТ-ПЦР по генам sod2 и gapdh в клетках H1299.
К - экспрессия мРНК генов sod2 и gapdh до нанесения актиномицина;
2, 4, 8 – экспрессия мРНК генов sod2 и gapdh через 2 ч (2), 4 ч (4) и 8 ч (8) после нанесения ActD соответственно. М – маркер размеров ДНК.
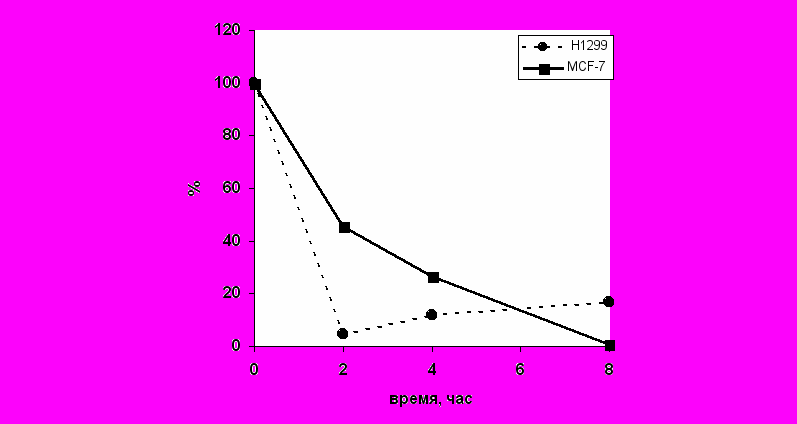
Рис 4. Изменение экспрессии мРНК гена sod2 в клетках MCF-7 и H1299 при действии актиномицина D. Количество мРНК определяли в процентах по содержанию мРНК в контроле (до нанесения ActD). По оси абсцисс отложено время после нанесения актиномицина D.
сдерживающим ингибирование.При более высоких концентрациях белка p53 (8 часов после нанесения ActD, рис. 1) происходит снижение экспрессии гена sod2 до 0%, в то время как в клетках с p53 (-/-) геномом экспрессия гена sod2 через 4 и 8 часов после нанесения ActD постепенно восстанавливается. В данном случае, в условиях высокой концентрации p53 , проявляется его ингибирующая активность на транскрипцию гена sod2.
В дальнейшей работе нами исследовали влияние падение экспрессии мРНК гена sod2 на активность фермента супероксиддисмутаза.
3.3. Активность фермента MnSOD в клетках MCF-7 и H1299 при действии актиномицина D.
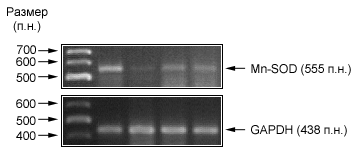
Для определения активности фермента MnSOD из клеток выделяли белки, подвергали их нативному электрофорезу, а затем окрашивали раствором, содержащим источник супероксидного анион-радикала – рибофлавин и NBT – вещество, окрашивающееся при взаимодействии с супероксидным анион-радикалом. В местах локализации ферментов SOD окраска отсутствует, так как супероксидный анион-радикал дисмутировал с образованием перекиси водорода под действием SOD.
Полученны зимограммы MnSOD показаны на рис. 5 и 6. На зимограммах видны изоформы гена sod: верхняя полоса соответствует митохондриальной марганцевой супероксиддисмутазе (MnSOD), а нижние полосы соответствуют двум изоформам медь-цинковой супероксиддисмутазы (Cu,ZnSOD) [Visner A.V., Dougall W.C.,1990].
В предыдущих экспериментах было показано, что экспрессия мРНК при действии актиномицина D в клетках MCF-7 и H1299 снижается. Поэтому ожидалось, что экспрессия и активность фермента MnSOD также будет снижаться. Однако данные, представленные на рис. 5 и 6 показывают, что в условиях падения экспрессии мРНК гена sod2 не надлюдается снижения экспрессии и активности фермента MnSOD. Результаты цифровой обработка зимограмм показаны на рис. 6. Из рисунка видно, что активность фермента MnSOD практически не изменяется в течение всего действия актиномицина D.
Отсутствие изменений в количестве белка и активности MnSOD может быть связано с высокой стабильностью фермента MnSOD. Известно, что каждый белок обладает определённой стабильностью (временем жизни), которая может варьировать от минут (в случае ряда факторов транскрипции, включая p53) до месяцев (в случае гемоглобина). По-видимому, время жизни белка MnSOD сильно превышает 8 часов и снижение количества мРНК (рис. 4) не приводит к снижению активности данного белка (рис. 7)

Рис. 5. Зимограммы SOD в клетках MCF-7 при действии актиномицина D до нанесения (К) и после 2 ч (2), 4 ч (4) и 8 ч (8) после нанесения актиномицина D.

Рис 6. Зимограммы SOD в клетках H1299 при действии актиномицина D до нанесения (К) и после 2 ч (2), 4 ч (4) и 8 ч (8) после нанесения актиномицина D.
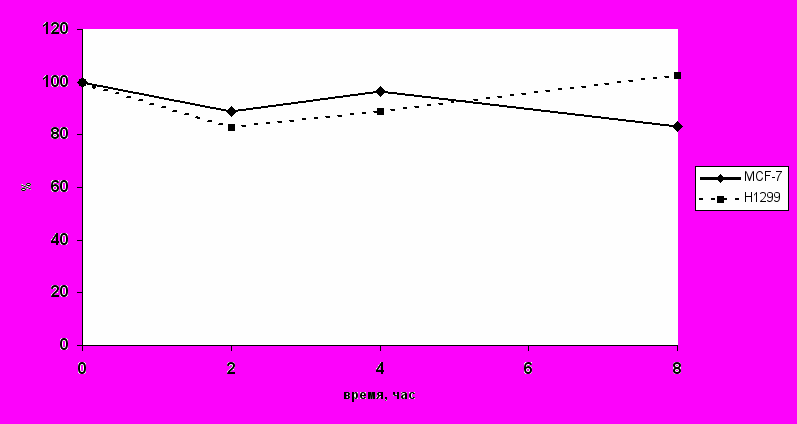
Рис. 7. Экспрессия белка MnSOD и клетках MCF-7 и H1299 при действии актиномицина D.Количество белка определяли в процентах по уровню содержания белка в контроле (до нанесения ActD). По оси абсцисс отложено время после нанесения актиномицина D.
Выводы:
- Актиномицин D вызывает накопление белка p53 в клетках MCF-7. Экспрессия белка p53 при действии актиномицина D достигает максимального значения к 8 часам.
- При действии актиномицина D наблюдается снижение экспрессии гена sod2 в клетках MCF-7 и H1299. В клетках с p53 (+/+) геномом (MCF-7) наблюдается постепенное снижение активности гена sod2 к 8 часам после нанесения актиномицина D. В клетках с p53 (–/–) геномом (H1299) экспрессия гена sod2 резко снижается через 2 часа после нанесения актиномицина D, а затем повышается до уровня 10÷15%.
- Снижение экспрессии гена sod2 при действии актиномицина D не приводит к изменению активности MnSOD в клетках MCF-7 и H1299.
Список использованной литературы.
- Диксон М., Уэбб Э. Ферменты: Пер. с англ. – М.: Мир, 1982. – Т.3. с. 871-872.
- Комарова Е.А., Гудкова А.В. Супрессия p53: новый подход к преодолению побочных эффектов противоопухолевой терапии // Биохимия. 2000. Т. 65. Вып. 1. С. 48-56.
- Drane P., Bravard A., Bouvard V., May E. Reciprocal doun-regulation of p53 and SOD2 gene expression-implication in p53 mediated apoptosis // Oncogene. 2001. V. 20. P. 430-439.
- Hussain S.P., Amstad P., He P., Robles A., Lupold Sh., Kaneko I., Ichimiya M., Sengupta s., Mechanic L., Okamura Sh., Hofseth L.J., Moake M., Nagashima M., Forrester K.S., Harris C.C. P53-induced up-regulatijn of MnSOD and GPx but not catalase increases oxiditive stress and apoptosis // Cancer research. 2004. N64. P. 2350-2356
- Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Биофизика. 1992. Т. 29. С. 3-250.
- Дубинина Е.Е. Биологическая роль супероксидного анион-радикала и супероксиддисмутазы в тканях организма // Успехи современной биологии. 1989. Т. 108, вып. 1, N4. С.3-18.
- Биохимия: Учеб. для вузов / Комов В.П., Шведова В.Н.- М.: Дрофа, 2004. – 640 с.
- Зенков Н.К., Меньщикова Е.Б. Активированные кислородные метаболиты в биологических системах // Успехи современной биологии, 1993. Т. 113. Вып. 3.- С. 286-297
- Турпаев К.Т. АФК и регуляция экспрессии генов // Биохимия, 2002. –Т.67. Вып. 3. С. 339-353.
- Овчинников Ю.А. Биоорганическая химия.- М.: Просвещение, 1987.- 815 с.
- Свободнорадикальное окисление и антиоксидантная терапия / В.И. Казимирко, В.И. Бутылин, Н.И. Горобец.- К.: Морион, 2004.-160 с.
- Кучеренко Н.Е., Васильев А.Н. Липиды.- К, Высшая школа, Киев, 1985.-247 с.
- Богач П.Г., Курский М.Д., Кучеренко Н.Е., Рыбальченко В.К. Структура и функции биологических мембран.- К., Высшая школа, 1981.- 336 с.
- Нонхибел Д., Уолтон Дж. Химия свободных радикалов. М.: Мир, 1977. 606 с.
- Fridovich I. Superoxide anion radical (O2•), superoxide dismutases, and related matters // The Journal of Biological Chemistry. 2001. Vol.272, №30. P.18515-18517.
- Берберова Н.Т. Из жизни свободных радикалов //Соросовский образовательный журнал. Т. 6, №5. 2000. С.39-44
- Поберезкина Н.Б., Осинская Л.Ф. Биологическая роль супероксиддисмутазы // Украинский биохимический журнал. 1989. Т.61. №2. С.14-27.
- Halliwell B., Gutteridge J.M.C. Lipid peroxidation, oxygen radicals, cell damage, and antioxidand therapy // Lancet.1984. P.1396-1398.
- Чумаков П.М. Функция гена p53: выбор между жизнью и смертью // Биохимия. 2000. Т.65. Вып. 1. С.34-37.
- Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: ключ к пониманию базовых механизмов канцерогенеза // Биохимия. 2000. Вып. 65. №1. С.5-33.
- Георгиев Г.П. Гены высших организмов и их экспрессия.- М.: Наука, 1989. С.63-66.
- Roberts S.G.E. Mechanisms of action of transcription activation and repression domains // Cellular and Molecular Life Sciens. 2000. V.57. P. 1149-1160.
- Xu J., Porntadavity S., Clair D.K. Transcriptional regulation of the human manganese superoxide dismutase gene: the role of specificity protein 1 (Sp 1) and activating protein 2 (Ap 2) // Biochemistry Journal. 2002. №362. P.401-412.
- Владимиров Ю.А. Свободнорадикальное окисление липидов и физические свойства липидного слоя биологических мембран // биофизика. 1987. Т.32. №5. С.830-844.
- Kern S.E, Kinzler K.W, Bruskin A, Jarosz D, Friedman P, Prives C, Vogelstein B. Identification of p53 as a sequence-specific DNA-binding protein // Science. 1991. V.252. №5013. P.1708-11.
- Funk WD, Pak DT, Karas RH, Wright WE, Shay JW. A transcriptionally active DNA-binding site for human p53 protein complexes // Molecular and Cellular Biology. 1992. V. 12. №6. P. 2866-2871.
- Ko LJ, Prives C. p53: puzzle and paradigm // Genes and Development. 1996. V.10. №9. P.1054-1072.
- Venot C, Maratrat M, Sierra V, Conseiller E, Debussche L. Definition of a p53 transactivation function-deficient mutant and characterization of two independent p53 transactivation subdomains // Oncogene. 1999. V.18. №14. P. 2405-2410.
- Tan M, Li S, Swaroop M, Guan K, Oberley L.W, Sun Y. Transcriptional activation of the human glutathione peroxidase promoter by p53 //. The Journal of Biological Chemistry. 1999. V.274. №17. P. 12061-12066.
- El-Deiry W.S. p21/p53, cellular growth control and genomic integrity // Current Topics in Microbiolgy and Immunology. 1998. V.227. P. 121-137.
- Waga S, Hannon G.J, Beach D, Stillman B. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA // Nature. 1994. V.369. P.574-578.
- Tarunina M, Jenkins JR. Human p53 binds DNA as a protein homodimer but monomeric variants retain full transcription transactivation activity // Oncogene. 1993. V.8. №11. P.3165-3173.
- Hupp T.R, Meek D.W, Midgley C.A, Lane D.P. Regulation of the specific DNA binding function of p53 // Cell. 1992. V.71. №5. P.875-886.
- Bakalkin G, Selivanova G, Yakovleva T, Kiseleva E, Kashuba E, Magnusson KP, Szekely L, Klein G, Terenius L, Wiman K.G. p53 binds single-stranded DNA ends through the C-terminal domain and internal DNA segments via the middle domain // Nucleic Acids Research. 1995. V.23. №3. P.362-369.
- Ginsberg D, Mechta F, Yaniv M, Oren M.Wild-type p53 can down-modulate the activity of various promoters // Proceeding of the National Academy of Sciences of the U S A. 1991. V.88. №22. P.9979-9983.
- Morgan D.O. Cyclin-dependent kinases: engines, clocks, and microprocessors. // Annual reviews Biochemistry.1997. V.13. P. 261-291.
- Luo Y., Hurwitz J., and Massague J. Cell-cycle inhibition by independent CDK and PCNA binding domains in p21 Cip1 // Nature. 1995. V.15. P. 159-161.
- Chan T.A., Hermeking H., Lengauer C., Kinzler K.W. and Vogelstein B. 14-3-3σ is required to prevent mitotic catastrophe after DNA damage // Nature. 1999. V.401. P.616-620.
- Tayor S.J., Shalloway D. Src and control of cell division // BioAssays. V.18. P.9-11.
- Thompson L.J., Fields A.P. BetaII protein kinase C is required for the G2/M transition of cell cycle // The Journal of Biological Chemistry. 1996. V. 271. P.15045-15053.
- Furuno N., den Elzen N., Pines J. Human ceclin A is required for mitosis until mid prophase // The Journal of Cell Biology. 1999. V.147. №2. P.295-306.
- Gamard C.J., Blobe G.C., Hannun Y.A.,and Obeid L.M. Specific roleffor protein kinase C beta in cell differentiation // Cell Growth Differ. V.5. P.405-409.
- D'Santos C.S., Clarce J.S., Irvin R.F., and Divecha N. Nuclei contain two differentionally regulated pools of diacelglycerol // Current Biology. 1999. V.9. P.437-440.
- Zhang H.S., Gavin M., Dahiya A., postigo A.A., Ma D., Luo R.X., Herbour J.W., Dean D.C. Exit from G1 and S phase of the cell cecle is regulated by repressor complexes containing HDAC-Rb-hSWI/SNF and Rb-hSWI/SNF // Cell. 2000. V.101. №1. P/79-89.
- Oltvai Z.N., Korsmeyer S.J. Checkpoints of dueling dimers foil death wishes // Cell. 1994. V.80. P.293-299.
- Rosse.t., Olivier R., Monney L., Rager M., Conus S., Fellay I., Jansen B., Borner C. Bcl-2 prolongs cell survival after Bax-induced release of cytohrome C // Nature. 1998. V.391. P.496-499.
- Srinivasula S.V., Ahmad M., Fernandes-Alnemri T., Alnemri E.S. Autoactivation of procaspase-9 by Apaf-1 mediated oligomerization // Molecular Cell. 1998. V.1. P.949-957.
- McCurrach M.E.,Connor T.M., Knudson C.M., Korsmeyer S.J., Lowe S.W. Bax-deficiency promotes drug resistance and oncogenic transformationby aftenuating p53-dependent apopnosis // Proceeding of the National Academy of Sciences of the U S A. 1997. V.94. P.2345-2349.
- Venot C., Maratrat M., Sierra V., Conseiller E., Debussche L. The requirement for the p53 proline-rich functional domain for mediation of apoptotic is correlated with specific PIG3 gene transactivation and with transcriptional repression // EMBO Journal. 1998. V.17. P.4668-4679.
- Owen-Schaub L.B., Zhang W., Cusack J.C., Angelo L.S., Santee S.M., Fujiwara T., Roth J.A., Deisseroth A.B., Zhang W.W., Kruzel E. Wild-type human p53 and a temperature-sensitive mutant induce Fas/APO-1 expression // Molecular and Cellular Biology. 1995. V.15. P.3032-3040.
- Bennett M., Macdonald K., Chan S.W., Luzio J.P., Simari R., Weissberg P. Cell surface trafficking of Fas: a rapid mechanism of p53-mediated apoptosis // Science. 1998. V.282. P.290-293.
- Ashkenazi A., Dixit V.M. Deafh receptors: signaling and modulation // Science. 1997. V.281. P.1305-1308.
- Harrington E.A., Fanidi A., Evan G.I. Oncogenes and cell dealth // Current Opinion in Genetics and Development. 1994. V.4. P.120-129.
- Leri A., Liu Y., Claudio P.P., Kajstura J., Wang X., Kang P., Malhotra A., Anversa P. Insulin-like growth factor-1 induced Mdm2 and down-regulates p53, attenuating the myocyte renin-angiotensin system and stretch-mediated apoptosis // The American journal of Pathology. 1999. V.154. P.567-580.
- Prisco M., Hongo A., Rizzo M.G., Sacchi A., Baserga R. The insulin-like growth factjr I receptor as a physiologically relevant target of p53 in apoptosis caused by interleukin-3 withdrawal // Molecular and Cellular Biology. 1997. V.17. P.1084-1092.
- Yin Y., Terauchi Y., Solomon G.G., Aizawa S., Rangarajan P.N., Yazaki Y., Kadawaki T., Barrett J.C. Involvement of p85 in p53-dependent apoptotic response to oxidative stress //Nature. 1998. V.391. P.707-710.
- Okamoto K., Prives C. A role of cyclin c in the process of apoptosis // Oncjgene. 1999. V.18. P.4606-4615.
- Pani G., Bedogni B., Anzevino R., Palazzotti B., Borrello S., Galeotti T. Deregulated manganese dismutase expression to oxidativt injury in p53-deficient cells // Cancer Research. 2000. V.60. P.4654-4660.
- Polyak K., Xia Y., Zweier J.L., Kinzler K.W., Vogelstein B. A model for p53-induced apoptosis // Nature. 1997. V.389. №6648. P.300-305.
- Ewen M.E., Miller S.J. P53 and translational control // Biochim Biophys Acta. 1996. V.1242. №3. P.181-184.
Выражаю огромную благодарность заведующему лабораторией молекулярной биологии ИПХФ РАН А.А. Терентьеву.
Выражаю благодарность сотрудникам лаборатории молекулярной биологии, особенно Н.П.Болтневой, Е.В. Рудаковой и М.А. Лапшиной за помощь в проведении экспериментов и обсуждении полученных результатов.
