Профилактика и лечение госпитальной инфекции мочевых путей при малоинвазивных урологических вмешательствах 14. 00. 40 Урология
| Вид материала | Автореферат |
- Реферат тема: "Урология", 191.4kb.
- Значение эндоскопических методов вдифференциальной диагностике и лечении поверхностных, 283.74kb.
- Эндовидеохирургия в лечении обструкции верхних мочевых путей 14. 00. 40 «Урология», 333.69kb.
- Программа совещания по подведению итогов работы по выполнению приоритетного национального, 171.09kb.
- Рецидивирующая мочевая инфекция (рми) является довольно частым заболеванием. Встречаемость,, 69.04kb.
- В приоритетный национальный проект в сфере здравоохранения входят разделы, обеспечивающие, 88.23kb.
- «О реализации приоритетного национального проекта в сфере здравоохранения по разделу:, 174.05kb.
- Роль фитотопрепарата «Пролит» в лечении больных уролитиазом, 135.63kb.
- Алтайская краевая общественная организация «Анти спид-сибирь» учебный модуль, 526.43kb.
- Методические рекомендации для практического занятия №10, 101.99kb.
Бактериологическому исследованию подвергнуты моча и фекалии 34 больных мочекаменной болезни и 38 пациентов доброкачественной гиперплазией простаты с послеоперационными инфекционно-воспалительными осложнениями. Мужчин было - 46, женщин -26 и здоровых лиц -36. Средний возраст составил 58,0 ±1,4 лет.
Характер и частота дисбиотических изменений у больных мочекаменной болезнью и доброкачественной гиперплазией простаты до операции (при поступлении) и после операции на 6 -7 сутки, на фоне присоединившейся госпитальной инфекции мочевых путей отражены в таблице 4.
Таблица 4
Характер и частота дисбиотических изменений кала у урологических больных
до и после операции на 5-6 сутки
-
Дисбиотические изменения кала
Число больных
до операции,
n-72
после операции на фоне ГИ, n-72
абс.
%
абс.
%
Повышение содержания условно-патогенных бактерий
2
2,8
6
8,4
Снижение содержания нормальной микрофлоры
18
25,0
12
16,7
Одновременное повышение содержания условно-патогенных бактерий и снижение содержания нормальной флоры
8
11,1
52
70,8
ВСЕГО
28
38,9
70
97,2
Как видно из таблицы 4, у 28 (38,9 %) больных отмечались изменения в микрофлоре кишечника в дооперационном периоде, тогда как в послеоперационном периоде на фоне госпитальной инфекции мочевых путей дисбактериоз возник у 97,2%. При этом повышение содержания условно-патогенной флоры (Candida и Enterococcus spp.) без нарушения состава нормальной микрофлоры кишечника обнаружено до операции лишь у 2 (2,8%) больных, после операции на фоне госпитальной инфекции мочевых путей у 6 (8,3%). Снижение содержания нормальной микрофлоры кишечника: лактобактерий, бифидумбактерий, кишечной палочки с нормальной ферментативной активностью отмечено соответственно у 18 (25,0%) и 12 (16,7%) больных. Одновременное повышение содержания условно-патогенной флоры (Proteus vulgaris, Ps. aeruginosa, Enterococcus spp., Staphylococcus saprophyticus, Citrobacter, Candida albicans, Enterobacter agl., Klebsiella spp.) со значительным снижением содержания бифидум- и лактобактерий отмечено у 8 (11,1%) до операции и у подавляющего большинства – 70,8% больных после операции на фоне госпитальной инфекции мочевых путей. Отмечен рост, как отдельных видов, так и ассоциаций условно-патогенной микрофлоры. E. Сoli.
Данные проведенных исследований показывают, что у больных мочекаменной болезнью и доброкачественной гиперплазией простаты, на фоне хронического пиелонефрита и хронической инфекции мочевых путей первичный дисбактериоз до операции выявлен у 28 пациентов (38,9 %). В послеоперационном периоде дисбиотические нарушения обнаружены в 97,2% случаях различной степени выраженности.
В 3 случаях отмечено совпадение бактериологических анализов мочи и кала у больных мочекаменной болезнью и доброкачественной гиперплазией простаты, с инфекционно-воспалительными осложнениями в послеоперационном периоде (таблица 5).
Таблица 5
Микрофлора мочи и кишечника у больных мочекаменной болезнью и
доброкачественной гиперплазией простаты (случаи совпадения)
| Микрофлора кишечника | Микрофлора мочи | ||
| Ps. aeruginosa | Proteus spp. | Ps. aeruginosa + Candida | |
| Ps.aeruginosa | 1 | | |
| Proteus | | 1 | |
| Ps.aeruginosa + Candida | | | 1 |
В моче и кале были выделены Ps. aeruginosa, Proteus spp. и ассоциации Ps. aeruginosa + Candida. Сравнение антибиотикограмм у этих штаммов позволило сделать заключение об их идентичности.
Таким образом, в 4,2% случаев дисбиотические изменения кишечника явились источником эндогенной инфекции мочевых путей.
Эффективность лечения и прогноз основного заболевания во многом зависят от адекватной и своевременной коррекции установленных качественных и количественных изменений состава нормальной микрофлоры кишечника.
Проведено комплексное лечение дисбактериоза 54 больных мочекаменной болезнью и доброкачественной гиперплазией простаты с госпитальной инфекцией мочевых путей в послеоперационном периоде.
В соответствии с результатами бактериологического исследования использовались пробиотик (бифиформ), противогрибковый препарат (микосист), который назначали в связи с повышением содержания в кале Candida >104 (таблица 6).
Таблица 6
Динамика микрофлоры кишечника у больных с госпитальной инфекцией мочевых путей до и после лечения бифиформом
| Микроорганизмы | Частота отклонений от нормы, %, n - 54 | |
| до лечения | после лечения, на 14с | |
| Гемолитическая кишечная палочка | 44,4±0,7 | 3,3±1,0 * |
| Микробы рода Proteus | 13,9±0,1 | - |
| Клебсиеллы | 8,0±1,1 | - |
| Псевдомонады | 22,2±0,4 | 6,7±0,5 * |
| Дрожжевые грибы | 30,5±0,8 | 3,3± 0,3* |
Примечание: * - достоверность различий по сравнению с исходными показателями (р < 0,05).
Комплексное лечение госпитальной инфекции мочевых путей с дисбиотическими нарушениями в послеоперационном периоде с применением бифиформа привело к значительному улучшению клинических и лабораторных показателей в 77,8% и 68,5% случаях соответственно. Однако, полного излечения дисбактериоза в стационаре не наступило у 22,2% больных, их лечение продолжали после выписки из стационара до нормализации клинических и бактериологических симптомов.
Этиологическая структура инфекционно-воспалительных урологических заболеваний
С 1997 по 2007 гг. в микробиологической лаборатории НЦ урологии проводилось бактериологическое исследование 17880 проб мочи урологических больных. Идентифицировано 12600 штаммов микроорганизмов. Среди возбудителей мочевой инфекции преобладали грамотрицательные микроорганизмы - эшерихии, протеи, синегнойная палочка и другие неферментирующие палочки, которые в 1997 г. составляли 81%, а в 2007г. на их долю приходилось 69,0%. Грамположительная флора составляла соответственно 27,5% и 34,0%. Рост микрофлоры был отмечен в 58,9% и 52,6% случаях: в виде монокультуры – 76,7% и 86,2%. Основными возбудителями воспалительных заболеваний верхних мочевыводящих путей являлись грамотрицательные микроорганизмы (64,2%), а в этиологической структуре воспалительных процессов нижних мочевыводящих путей (уретриты) и мужских половых органов (орхоэпидидимиты, простатиты) превалировала грамположительная флора. Наиболее частыми возбудителями пиелонефрита, цистита были E. Сoli, Ps. aeruginosa, Proteus spp. Напротив, простатиты, эпидидимиты чаще обуславливались Staphylococcus spp., Staphylococcus aureus, Streptococcus spp. При этом, обращает внимание, что в этиологии пиелонефрита, возникшего как осложнение после различных оперативных вмешательств у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы преобладали полиантибиотикорезистентные культуры Ps. aeruginosa (21%) и Proteus spp. (6%), что было характерно для госпитальных штаммов микроорганизмов.
Результаты ежегодного микробиологического мониторинга мочи больных с инфекцией органов мочеполовой системы за период с 1997-2007 гг. были использованы при анализе антибиотикорезистентности некоторых наиболее частых возбудителей к антибактериальным препаратам, ее динамики.
П
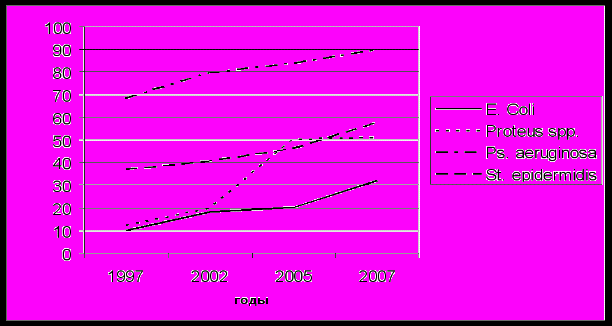 роведенное нами изучение резистентности микроорганизмов к антибиотикам показывает, что активность антибактериальных препаратов существенно изменяется по мере их использования, что связано с ростом резистентных штаммов (рисунки 5-7).
роведенное нами изучение резистентности микроорганизмов к антибиотикам показывает, что активность антибактериальных препаратов существенно изменяется по мере их использования, что связано с ростом резистентных штаммов (рисунки 5-7).Рис. 5. Динамика резистентности к цефотаксиму возбудителей инфекционно-воспалительных осложнений за 1997-2007 гг
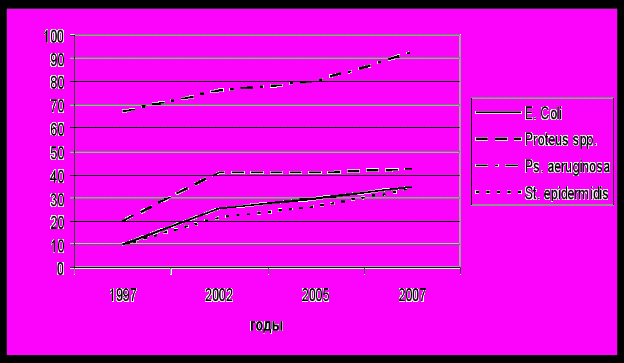
Рис. 6. Динамика резистентности к ципрофлоксацину возбудителей инфекционно-воспалительных осложнений за 1997-2007 гг

Рис. 7. Динамика резистентности к гентамицину возбудителей инфекционно-воспалительных осложнений за 1997-2007 гг
Так, резистентность основных возбудителей послеоперационных инфекционно-воспалительных осложнений к антибиотикам в 2007 году по сравнению с данными 1997 г. увеличилась в 4 раза. Поэтому необходим постоянный бактериологический мониторинг за процессом нарастания их устойчивости для оперативного изменения тактики антибактериальной терапии.
Клинико-экономический анализ закупок и потребления антибактериальных препаратов
В связи с ростом антибиотикорезистентности микрофлоры, арсенал антибактериальных препаратов постоянно расширяется и обновляется. Одновременно, это - одна из наиболее динамичных групп лекарственных средств, которую почти в 50% случаях, по мнению ведущих мировых экспертов, применяют необоснованно.
Учитывая это, актуальным является изучение комплекса вопросов, связанных с антибиотикотерапией и антибиотикопрофилактикой: клинико-экономический анализ закупок и потребления антибактериальных препаратов, составление формулярного перечня, выбор рациональных схем профилактического, лечебного применения антибиотиков.
Клинико-экономический анализ включал АВС, VEN, DDD-методологии и количественный анализ, которые являются наиболее популярными и обладают не только ограничительной функцией, но и способствуют повышению качества фармакотерапии.
АВС-анализ определяет приоритетность финансовых затрат на антибактериальные препараты, по которым в класс «А» вошли цефалоспорины, аминогликозиды, карбапенемы; в класс «В»: пенициллины, фторхинолоны, а остальные группы антибиотиков составили класс «С».
Р
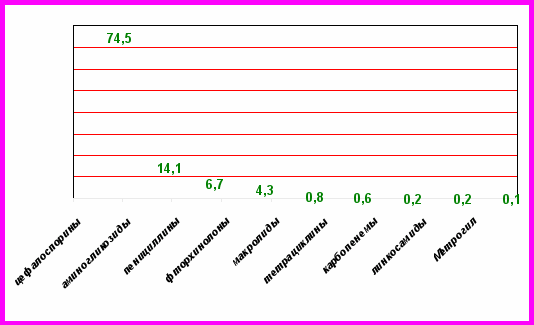 асходы на приобретение антибиотиков в 2005 году составили 34% от всего бюджета. Из них: 74,5% - на закупку цефалоспоринов, 14,1% - аминогликозидов, 6,7% - пенициллинов, 4,3% - фторхинолонов, макролидов -0,8%, 1,1% - на антибиотики разных групп (тетрациклины, линкосамиды и др. Безусловными лидерами среди закупаемых препаратов в клинике являлись цефалоспорины (рисунок 8).
асходы на приобретение антибиотиков в 2005 году составили 34% от всего бюджета. Из них: 74,5% - на закупку цефалоспоринов, 14,1% - аминогликозидов, 6,7% - пенициллинов, 4,3% - фторхинолонов, макролидов -0,8%, 1,1% - на антибиотики разных групп (тетрациклины, линкосамиды и др. Безусловными лидерами среди закупаемых препаратов в клинике являлись цефалоспорины (рисунок 8).Рис.8. Структура финансовых затрат на антибиотики (АВС-анализ, 2005 г)
Нами проведен анализ количества закупленных в течение 2005 г. групп антибактериальных препаратов (АБП) с последующим пересчетом полученного количества внутри группы (рисунки 9,10,11).
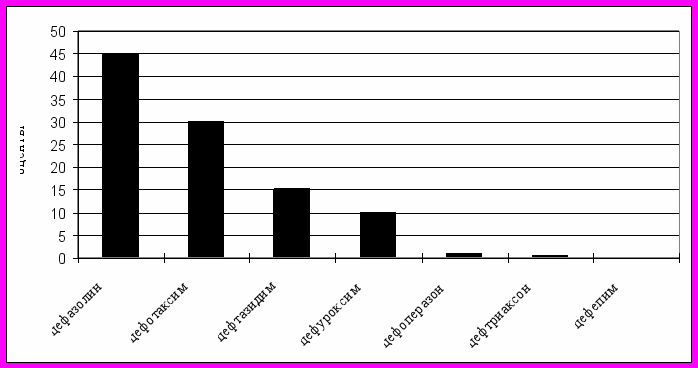
Рис.9. Структура годового потребления препаратов группы цефалоспоринов, 2005 г.
Из группы цефалоспоринов наиболее используемым препаратом был цефазолин (45%), антибиотик 1 поколения цефалоспоринов, спектр действия, в основном, направлен на грамположительную флору и он не эффективен при грамотрицательной флоре. Далее исследовали цефотаксим (30%), цефтазидим (15%), цефуроксим (10%), цефоперазон (0,9%), цефтриаксон (0,5%).
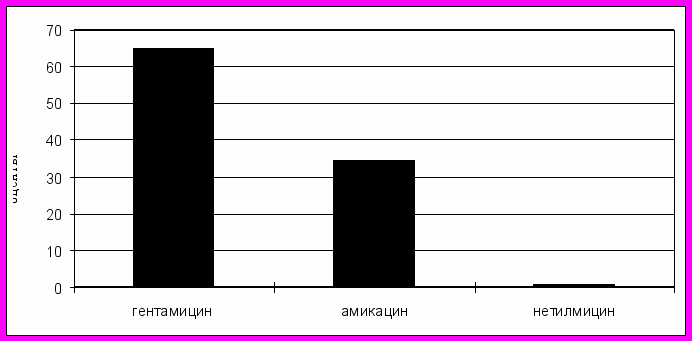
Рис. 10. Структура годового потребления препаратов группы аминогликозидов, 2005 г.
Ведущим препаратом в группе аминогликозидов (рисунок 10) был гентамицин (65%), обладающий высокой нефро- и ототоксичностью в сравнении с амикацином, на долю которого пришлось 34,4%. При этом амикацин является более активным по спектру действия и менее токсичным препаратом, чем гентамицин и относится к аминогликозидам 3-го поколения.
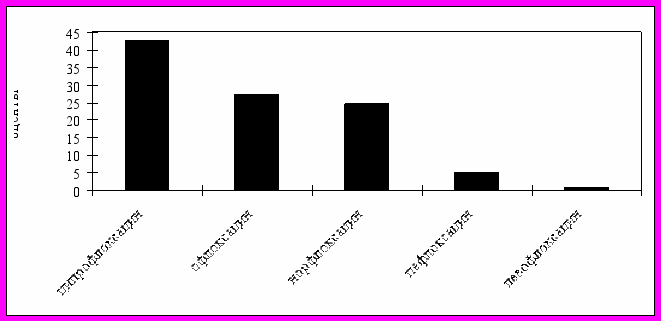
Рис. 11. Структура годового потребления препаратов группы фторхинолонов, 2005 г.
Среди фторхинолонов (рисунок 11) лидирующие позиции занимал ципрофлоксацин (42,8%), далее следовали офлоксацин (27,2%), норфлоксацин (24,4%), пефлоксацин (5,6%), левофлоксацин (0,2%).
На основании данных АВС-анализа мы определили проблемные группы антибиотиков, применение которых небезопасно в плане ухудшения эпидемиологической ситуации в клинике и возможности появления резистентных микроорганизмов. Далее нами был проведен сравнительный АВС-анализ: приоритентность финансовых затрат в структуре закупаемых антибактериальных препаратов на протяжении трех лет (2005-2007 гг.), таблица 7.
Таблица 7
Сравнительный анализ финансовых затрат за 2005-2007 годы (АВС-анализ)
| Название препаратов | Доля финансовых затрат (%) | ||
| 2005 г. | 2006 г. | 2007 г. | |
| Цефалоспорины | 74,5 | 71,6 | 60,5 |
| Аминогликозиды | 14,1 | 11,7 | 7,2 |
| Пенициллины | 6,1 | 5,5 | 1,8 |
| Фторхинолоны | 4,3 | 6,1 | 19,8 |
| Макролиды | 0,4 | 3,4 | 6,6 |
| Тетрациклины | 0,3 | 0,6 | 0,7 |
| Карбапенемы | 0,2 | 1,1 | 2,4 |
| Гликопептиды | - | - | 0,2 |
| Метрогил | 0,1 | - | 0,8 |
Сравнительный анализ финансовых расходов за три года показал, что доля затрат на некоторые группы препаратов изменилась.
Микробиологический мониторинг, а также данные фармакокинетики и фармакодинамики показали, что основными препаратами в лечении инфекций органов мочеполовой системы являются антибиотики группы фторхинолонов. Именно этот результат в 2006 г. позволил определить фторхинолоны, как препараты 1-го ряда и внести нам изменения в реестр закупок антибиотиков.
Соответственно доля затрат на некоторые группы препаратов изменились: уменьшили финансовые расходы на аминогликозиды (14,1%, 11,7%, 7,2%), пенициллины (6,1%, 5,5%, 1,8%), цефалоспорины с 74,5% до 60,5%, в то же время увеличили долю финансовых затрат на фторхинолоны с 4,3% до 19,8%, макролиды с 0,4% до 6,6%.
АВС-анализ позволяет выявить недостатки в вопросах лекарственного обеспечения и проведения лечебного процесса в клинике.
Анализ структуры общего веса антибиотиков (граммы), необходимый для последующего DDD-анализа показал, что цефалоспорины заняли первую позицию и составили 39,8% от общего веса использованных антибактериальных препаратов, далее следовали пенициллины, аминогликозиды.
По наиболее проблемным группам препаратов для системного применения и ряду других препаратов на основании данных количественного анализа рассчитаны показатели DDD, который соответствует средней суточной дозе (граммах) лекарственного препарата.
Нами проведен мониторинг DDD показателей с 2005 по 2007 гг., таблица 8.
Таблица 8
Динамика DDD показателей антибактериальных препаратов
за период с 2005 по 2007 годы
| Название препарата | Показатели DDD | ||
| 2005 г. | 2006 г. | 2007 г. | |
| Цефазолин | 2,05 | 1,90 | 1,4 |
| Ампициллин | 3,81 | 3,91 | 2,4 |
| Цефтриаксон | 1,8 | 1,8 | 2,3 |
| Цефоперазон | 1,1 | 1,0 | 0,8 |
| Гентамицин | 1,14 | 0,89 | 0,35 |
| Амоксиклав | 1,0 | 1,21 | 0,61 |
| Карбенициллин | 0,02 | 0,02 | 0,01 |
| Спирамицин | 0,01 | 0,34 | 0,26 |
| Цефтазидим | 1,41 | 1,82 | 2,48 |
| Цефотаксим | 0,92 | 1,25 | 2,82 |
| Ципрофлоксацин | 0,21 | 0,36 | 0,41 |
| Цефуроксим | 0,31 | 0,28 | 0,39 |
| Норфлоксацин | 0,36 | 0,41 | 0,46 |
| Доксициклин | 0,19 | 0,21 | 0,19 |
| Азитромицин | 0 | - | 0,16 |
| Офлоксацин | 0,21 | 0,37 | 0,40 |
| Цефепим | - | - | 0,01 |
| Пефлоксацин | - | - | 0,39 |
| Левофлоксацин | - | - | 0,09 |
| Амикацин | 0,87 | 2,29 | 3,91 |
| Рокситромицин | - | - | 0,26 |
| Кларитромицин | - | - | 0,21 |
| Нетилмицин | - | 0,03 | 0,65 |
В группу нежелательных для активного применения антибактериальных средств вошли пенициллины (ампициллин), цефалоспорины (цефазолин), аминогликозиды (гентамицин).
Мониторинг DDD показателей в течение последующих двух лет позволил определить достоверное снижение уровня потребления ампициллина с 3,8 до 2,4 г, цефазолина с 2,05 до 1,4 г., гентамицина с 1,14 до 0,35 г., цефоперазона с 1,1 до 0,8 г.
Проведен анализ DDD показателей внутри групп антибактериальных препаратов (рисунок 12).
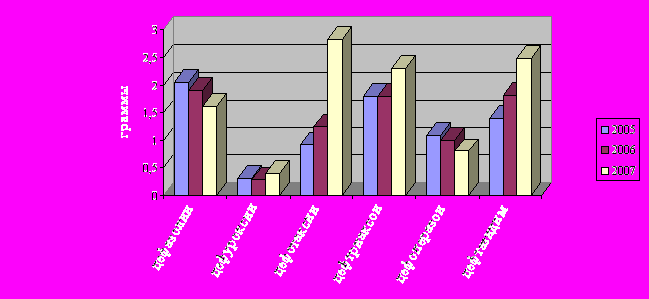
Рис.12. Динамика изменений DDD в группе цефалоспоринов за 2005-2007 гг.
Как видно из рисунка, снижение уровня потребления цефазолина, цефоперазона сопровождалось повышением уровня других цефалоспоринов: цефотаксима с 0,9 до 2,82 г, цефтриаксона с 1,8 до 2,3 г с хорошим спектром действия, эффективных при инфекциях мочевыводящих путей и цефтазидима с 1,41 до 2,8 г.
В группе аминогликозидов при сравнительном DDD-анализе отмечено изменение соотношения антибактериальных средств в пользу амикацина. Отмечается снижение уровня потребления гентамицина с 1,14 до 0,35 г., увеличение потребления амикацина с 0,87 до 3,9 г. и в 2007 г. стали применять нетилмицин (рисунок 13).
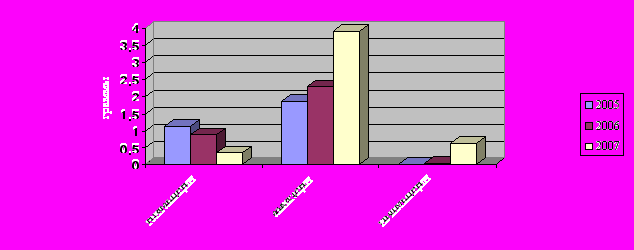
Рис.13. Динамика изменений DDD в группе аминогликозидов за 2005-2007 гг.
Несмотря на то, что в целом на группу аминогликозидов финансовые расходы снизились, по количеству суммарной DDD гентамицина, амикацина, нетилмицина не превышает первоначальный показатель за первый год анализа.
За анализируемый период времени (2005-2007 гг.) значительно изменился количественный и качественный состав группы фторхинолонов (рисунок 14).
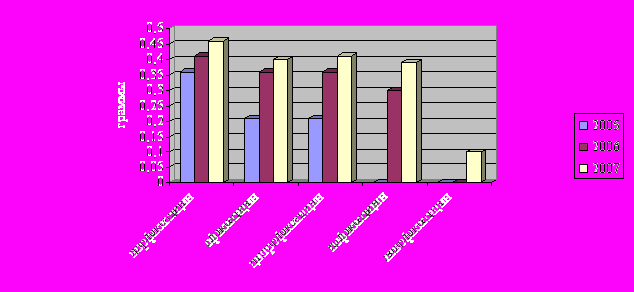
Рис.14 Динамика изменений DDD в группе фторхинолонов за 2005-2007 гг.
Достоверно увеличилось потребление всех фторхинолонов: норфлоксацина, ципрофлоксацина, пефлоксацина, которые продолжают оставаться актуальными в лечении ИВО у урологических больных. Также увеличилось потребление офлоксацина с 0,21 до 0,4 г. К числу рекомендованных в современных стандартах лечения урологических инфекций относится левофлоксацин, уровень потребления которого в 2006 г составил 0,09г. Критерием выбора данного препарата, кроме клинического состояния больного, были аллергия на бета-лактамные препараты, предполагаемая вероятность неэффективности при тяжелых внебольничных и госпитальных инфекциях.
Мониторинг DDD показателей позволяет контролировать и регулировать объемы применяемых антибактериальных препаратов.
Таким образом, результаты клинико-экономического анализа, включающего АВС-анализ, количественный и DDD анализы используемых антибиотиков с учетом результатов микробиологического мониторинга, позволили выявить недостатки в вопросах лекарственного обеспечения и применения антибактериальных препаратов. Уровень потребления антибактериальных препаратов оказался необоснованно высоким, особенно-проблемных групп препаратов. Это сделало возможным перераспределить финансовые средства в группе антибактериальных препаратов с улучшением их ассортимента и качества, обеспечить постоянное наличие безопасных и эффективных лекарственных средств. Все вышеперечисленные факторы позволяют формировать политику более рационального использования антибактериальных препаратов с повышением уровня оказания лечебной помощи.
Формуляр антибактериальных средств для урологического отделения
Результаты комплексного клинико-экономического анализа потребления антибактериальных препаратов в клинике за 2005 г. позволили внедрить ряд организационных мероприятий по оптимизации их применения в последующие годы (2006-2007). Так, в 2006 г. введена должность клинического фармаколога. Вопросами составления заявок на закупки антибактериальных препаратов начала заниматься созданная формулярная комиссия в составе: клинического фармаколога, эпидемиолога, микробиолога.
В 2005 году в нашей клинике закуплено практическое руководство по антибактериальной терапии (под ред. Страчунского Л.С., Белоусова Ю.Б. , Козлова С.Н.), создана школа «Рациональная антибактериальная терапия», в рамках которой проводились семинары, конференции с приглашением специалистов для проведения тематических лекций.
Знание структуры инфекционно-воспалительных осложнений в урологическом стационаре и микробиологический мониторинг за микрофлорой мочи и ее чувствительностью к антибиотикам позволили разработать и внедрить формулярный перечень (формуляр) антибактериальных препаратов, назначаемых урологическим больным с воспалительными заболеваниями органов мочеполовой системы.
Для стартовой терапии инфекций (таблица 9), вызванных вышеуказанными микроорганизмами могут применяться: фторхинолоны - ципрофлоксацин, пефлоксацин, левофлоксацин (парентеральные формы), цефалоспорины 2-3 поколений, аминогликозиды (нетилмицин, амикацин). К ранее хорошо применявшимся антибиотикам, как ампициллин, карбенициллин, гентамицин в настоящее время выявляется большая частота резистентных штаммов возбудителей мочевой инфекции. Препаратами для эмпирического лечения впервые возникших пиелонефритов являются ингибиторзащищенные пенициллины, фторхинолоны, цефалоспорины.
В качестве препаратов второго ряда, предусмотренных для этиотропного лечения инфекционно-воспалительных осложнений органов мочеполовой системы могут быть использованы антисинегнойные цефалоспорины (2-4 поколений), фторхинолоны, аминогликозиды последнего поколения, монобактамы, макролиды, тетрациклины (доксициклин), рифампицин, меронидазол, противогрибковые препараты в зависимости от клинической ситуации или по результатом бактериологического исследования. Но в ряде случаев аминогликозиды (амикацин), могут быть и препаратами первого ряда или обязательным препаратом в комбинированной терапии, например в отношении Ps. аeruginosa.
Антибактериальными препаратами резерва, предназначенные для лечения тяжелых, жизнеопасных инфекций, в том числе госпитальных, отнесены цефалоспорины 4 поколения (цефепим, цефпиром), карбопенемы, гликопептиды (ванкомицин), оксазолидиноны (линезолид-зивокс).
Таблица 9
Формулярный перечень антибактериальных препаратов для больных
урологического стационара
| Препараты выбора | Препараты 2 ряда | Препараты резерва |
| Амоксициллин/клавуланат Цефотаксим Цефоперазон/сульбактам Ципрофлоксацин в/в Левофлоксацин Амикацин Противогрибковые | Фторхинолоны 2-3 п. Цефалоспорины 2-4п. Аминопенициллины/ ингибиторзащищенные Аминогликозиды 3п. Макролиды Доксициклин Рифампицин Азтреонам Метронидазол Противогрибковые (флуконазол, натамицин, амфотерицин В) | Цефепим Имипенем/циластин Карбапенемы Ванкомицин Линезолид |
Для предоперационной профилактики предусмотренными препаратами являются: цефуроксим, цефтриаксон, амоксициллин/клавуланат, левофлоксацин.
Внедрение данного формуляра привело к оптимизации проведения антибактериальной терапии и дало возможность проводить целенаправленную профилактику антибиотикорезистентности, а именно: возможность выбора оптимального препарата и проведения их ротации при неблагоприятных эпидемиологических ситуациях.
Показатели иммунной системы организма больных с госпитальной инфекцией мочевых путей
Как известно инфекционно-воспалительный процесс возможен только при взаимодействии микро и макроорганизма. Сложность профилактики и лечения госпитальной инфекции мочевых путей у больных мочекаменной болезнью и доброкачественной гиперплазией простаты с хроническими инфекциями мочевых путей, хроническим пиелонефритом побудила нас к изучению иммунологических аспектов этой проблемы.
При исследовании показателей иммунной системы организма больных с госпитальной инфекцией мочевых путей были выявлены изменения, которые свидетельствовали о развитии вторичного иммунодефицитного состояния со снижением функциональной активности основных её компонентов.
Анализ субпопуляций лимфоцитов свидетельствовал об угнетении реакции клеточного звена иммунитета у больных с госпитальной инфекцией мочевых путей, проявляющееся наиболее наглядно на 5-6 сутки послеоперационного периода.
У больных мочекаменной болезнью и доброкачественной гиперплазией простаты с осложненным послеоперационным течением, вследствие госпитальной инфекции мочевых путей подавляется система неспецифического звена иммунитета: снизились фагоцитарная активность нейтрофилов на 26% по сравнению с контрольной группой, фагоцитарное число - в 1,6 и индекс активации фагоцитов в 3,3 раза. Окислительно- восстановительные процессы в нейтрофилах (НСТ -с и НСТ-и) отражали снижение их резервных способностей.
Концентрация сывороточных иммуноглобулинов оставалась практически на одном уровне, за небольшим снижением уровня IgM.
Учитывая, что исследования цитокинов, участвующих в активации клеток воспаления приобретают особую ценность при определении сдвигов иммунного статуса, нами были исследованы цитокины: интерлейкин-10, фактор некроза опухолей, которые в основном стимулируют пролиферацию стволовых клеток - предшественников Т и В-лимфоцитов, а также индуцируемый ответ. Кроме того, были определены уровни интерлейкин-4 и интерлейкин-6, которые участвуют в активации синтеза антител совместно с интерлейкином-10. Наряду с этим, интерлейкин-6 является одновременно противовоспалительным цитокином.
При этом, уровни всех исследуемых цитокинов на 5-6 сутки послеоперационного периода достоверно повысились, что свидетельствует о мобилизации защитных сил организма больных, направленных на ограничение воспалительного процесса.
С целью раннего выявления вторичного иммунодефицита и проведения своевременной и адекватной иммунокоррекции у урологических больных с госпитальной инфекцией мочевых путей нами проведено исследование состояния рецепторного аппарата клеток иммунной системы: В-лимфоцитов, имеющих рецепторы к иммуноглобулину - IgG и С3 (третьему компоненту комплемента). Они претерпевали изменения на 2 сутки послеоперационного периода у 96% пациентов, тогда как унифицированные показатели клеточного и гуморального звеньев иммунитета в эти сроки оставались в пределах нормы или подвергались незначительным изменениям (28%).
Выявленные изменения состояния иммунной реактивности больных с госпитальной инфекцией мочевых путей требовали комплексного подхода к лечению, а именно: включение в базисную терапию иммунокорригирующих препаратов.
Исходя из патогенеза антиинфекционной защиты, мы применили иммуномодулятор – полиоксидоний (таблица 10), который оказывает прямое воздействие на фагоцитирующие клетки и естественные киллеры и стимулирует всю совокупность специфических и неспецифических факторов защиты организма от инфекции. Полиоксидоний - это производное N-окиси поли-1,4-этиленпиперазин. Молекулярная масса от 60 000 до 10 000 дальтон. Биодоступность 89%. Максимальная концентрация в крови достигается через 40 мин. Период полувыведения 25,4 часа. Выводится преимущественно почками. Препарат хорошо переносится, он обладает детоксикационной, мембранопротекторной, антиоксидантной и противовоспалительной активностью. Не обладает антигенными свойствами, не оказывает аллергизирующего действия.
Таблица 10
Динамика показателей иммунограммы до и после иммунокоррекции
у больных с инфекционно-воспалительными осложнениями мочевых путей
| Показатели иммунограммы | До лечения, n-52 | 1 группа, n - 28 | 2 группа, n - 30 |
| после лечения антибиотиками | после лечения полиоксидонием и антибиотиками | ||
| CD3, % | 22,1 ± 0,6 | 38,0 ± 0,6* | 51,8 ± 0,8* |
| CD4, % | 19,6 ± 1.4 | 28,0 ± 1,1* | 42,0 ± 0,7* |
| CD8, % | 44,3 ± 0,6 | 18,0 ± 0,8* | 22,0 ± 0,2* |
| Фагоцитоз, % | 38,6 ± 1,3 | 55,0 ± 0,8* | 65,0 ± 1,2* |
| ФЧ | 2,8 ± 0,2 | 4,3 ± 0,3* | 6,0 ± 0,2* |
| НСТ- спонтанный, % | 12,9 ± 0,1 | 14,9 ± 0,6* | 16,0 ± 0,9* |
| ФНОa, пкг/мл | 510,0 ± 7,5 | 201,7 ± 4,1* | 90,0 ± 4,6* |
| ИЛ-1b, пкг/мл | 118,8 ± 5,7 | 93,2 ± 3,1* | 46,1 ± 1,2* |
| ИЛ- 6, пкг/мл | 65, 9 ± 1,6 | 56,0 ± 1,1* | 43,6 ± 0,9* |
| ИЛ- 4, пкг/мл | 198,6 ± 3,7 | 127,6 ± 1,4* | 63,5 ± 0,7* |
