Профилактика и лечение госпитальной инфекции мочевых путей при малоинвазивных урологических вмешательствах 14. 00. 40 Урология
| Вид материала | Автореферат |
- Реферат тема: "Урология", 191.4kb.
- Значение эндоскопических методов вдифференциальной диагностике и лечении поверхностных, 283.74kb.
- Эндовидеохирургия в лечении обструкции верхних мочевых путей 14. 00. 40 «Урология», 333.69kb.
- Программа совещания по подведению итогов работы по выполнению приоритетного национального, 171.09kb.
- Рецидивирующая мочевая инфекция (рми) является довольно частым заболеванием. Встречаемость,, 69.04kb.
- В приоритетный национальный проект в сфере здравоохранения входят разделы, обеспечивающие, 88.23kb.
- «О реализации приоритетного национального проекта в сфере здравоохранения по разделу:, 174.05kb.
- Роль фитотопрепарата «Пролит» в лечении больных уролитиазом, 135.63kb.
- Алтайская краевая общественная организация «Анти спид-сибирь» учебный модуль, 526.43kb.
- Методические рекомендации для практического занятия №10, 101.99kb.
На правах рукописи
САРКУЛОВА МАРЬЯШ НУКИНОВНА
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ГОСПИТАЛЬНОЙ ИНФЕКЦИИ МОЧЕВЫХ ПУТЕЙ ПРИ МАЛОИНВАЗИВНЫХ УРОЛОГИЧЕСКИХ ВМЕШАТЕЛЬСТВАХ
14.00.40 - Урология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2009
Работа выполнена в Национальном научном медицинском центре г. Астаны Республики Казахстан
Научный консультант:
Доктор медицинских наук Перепанова Тамара Сергеевна
Официальные оппоненты:
Доктор медицинских наук, профессор Мартов Алексей Георгиевич
Доктор медицинских наук, профессор Раппопорт Леонид Михайлович
Доктор медицинских наук, профессор Анкирская Алла Семеновна
Ведущая организация:
Московский областной научно-исследовательский клинический институт имени
М.Ф. Владимирского
Защита состоится « 10 » ноября 2009 года в 14 часов на заседании диссертационного совета Д. 208.056.01. при Федеральном Государственном Учреждении «Научно-исследовательский институт урологии» Министерства здравоохранения и социального развития Российской Федерации по адресу: 105425, Москва, ул. 3-я Парковая, д. 51.
С диссертацией можно ознакомиться в библиотеке ФГУ «НИИ Урологии Министерства здравоохранения и социального развития Российской Федерации» (105425, г. Москва, ул. 3-я Парковая, д. 51).
Автореферат разослан «____» ______________ 2009 года
Ученый секретарь
диссертационного совета
доктор медицинских наук Перепанова Т.С.
Актуальность темы
Госпитальные инфекции представляют одну из актуальных проблем современного здравоохранения во всем мире.
Среди всех их видов госпитальная инфекция мочевых путей (40%) является одной из ведущих инфекций, влияющих на эффективность лечения, прогноз заболевания и большие экономические затраты. Основными причинами госпитальной инфекции мочевых путей являются восходящий путь инфекции через уретральные катетеры и дренажи; несоблюдение санитарно-гигиенических требований; резистентность возбудителей к антимикробным препаратам (K.G. Naber , M.C. Bishop et al.,2008).
Большинство публикаций с госпитальной инфекцией мочевых путей относятся к отделениям интенсивной терапии и реанимации.
В урологической же практике частота госпитальной инфекции мочевых путей по данным паневропейского и пан-евроазитского исследований (PEP и PEAP) составляет 11%, однако трудности лечения обусловлены осложняющими факторами: обструкцией мочевых путей, наличием камней, снижением функции почек и полирезистентными штаммами возбудителей мочевой инфекции (Truls E. Bjerklund Johansen, 2006).
Широкое внедрение в урологическую практику малоинвазивных оперативных вмешательств, доля которых в объеме оперативного лечения достигает 75-90%, открывает новые «входные ворота» инфекции.
Специфика проведения этих методов увеличивает риск возникновения инфекционно-воспалительных осложнений мочевыводящих путей:
- повышение внутрилоханочного давления из-за постоянной ирригации жидкости;
- многократное введение инструментов в мочевые пути;
- необходимость дополнительного дренирования мочевых путей;
- сложность конструкции малоинвазивной аппаратуры, затрудняющей её стерилизацию;
- неоднократное применение в силу их малой инвазивности;
а также, увеличение числа пожилых пациентов с множеством интеркуррентных заболеваний, со сниженным иммунитетом.
Изучение структуры и спектра резистентности возбудителей, проведение клинико-экономического анализа потребления антибиотиков является одной из важных задач при лечении госпитальной инфекции мочевыводящих путей и предполагает не только коррекцию антибактериальной терапии, но и выработку стратегии и тактики их рационального применения в клинике.
Известно, что риск возникновения госпитальной инфекции мочевыводящих путей у больных в послеоперационном периоде и эффективность ее лечения в значительной степени зависят от иммунной реактивности организма [Петров Р.В., 1994; Игнатов П.Е., 2002]. Низкий исходный уровень иммунитета у больных мочекаменной болезнью (МКБ) и доброкачественной гиперплазией предстательной железы (ДГПЖ), обусловленный хроническим воспалительным процессом, длительной антибактериальной терапией, оперативным стрессом предполагает развитие инфекционно-воспалительных осложнений (ИВО), которые в свою очередь, приводят у таких больных к вторичному иммунодефициту (Хаитов Р.М., Пинегин Б.В.,1999). Необходимо совершенствование методов диагностики и лечения вторичного иммунодефицитного состояния, усугубляющего течение основного заболевания у больных с госпитальной инфекцией мочевых путей.
Широкое и длительное применение антибиотиков у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы, особенно у лиц пожилого возраста с ослабленным иммунитетом, послеоперационный период, которых осложняется госпитальной инфекцией мочевых путей, может привести к развитию дисбактериоза кишечника. Последний в свою очередь, усугубляет иммунную недостаточность организма и создает условия для эндогенного инфицирования мочевых путей, являясь потенциальным резервуаром патогенных возбудителей (Бердичевский Б.А., Цветцих В.Е.,1993; Бондаренко В.М., Учайкин В.Ф., 1995; Перепанова Т.С., 1996). В связи с этим, у больных с госпитальной инфекцией мочевых путей возникает необходимость изучения состава микрофлоры кишечника с целью диагностики дисбактериоза и его коррекции.
Большое значение имеют и вопросы, связанные с расходами на диагностику и лечение госпитальной инфекции. Экономический ущерб, ежегодно причиняемый внутрибольничными инфекциями в Соединенных Штатах Америки составляет 1,4 - 4,0 млрд. долларов (Huskins W.S., 1996). В России ежегодно регистрируют от 50 до 60 тыс. случаев внутрибольничного инфицирования, однако по расчетным данным эта цифра в 40-50 раз выше. Присоединение внутрибольничных инфекций к основному заболеванию увеличивают в среднем на 6-8 дней продолжительность пребывания пациента в стационаре (Бурганская Е.А., 1997). Годовые затраты на госпитальную инфекцию мочевыводящих путей превышают 1 млрд. евро в Европе (Truls E. Bjerklund Johansen, 2006).
До настоящего времени исследований, изучающих вопросы экономических затрат, связанных с госпитальной инфекцией недостаточно, а в клинической урологии такие работы вообще не проводились.
Хотя в последние годы проблеме госпитальной инфекции мочевыводящих путей уделяется должное внимание, но в большинстве стран СНГ, в том числе в Казахстане комплексные исследования, посвященные её изучению единичные, а работ, посвященных вопросам профилактики и лечения госпитальной инфекции мочевых путей в урологических стационарах при малоинвазивных технологиях вообще нет.
Таким образом, все вышеизложенное отражает актуальность выбранной темы диссертации.
Цель исследования
Снижение частоты инфекционно-воспалительных осложнений после малоинвазивных урологических вмешательствах у больных мочекаменной болезнью и доброкачественной гиперплазией простаты, путем разработки организационных, диагностических и лечебных мероприятий.
Задачи исследования
1. Анализ частоты, характера, источников и путей распространения госпитальной инфекции мочевых путей, оценка различных факторов, влияющих на ее развитие у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы в условиях применения малоинвазивной технологии.
2. Изучение этиологической структуры, особенностей и динамики антибиотикорезистентности возбудителей инфекционно-воспалительных осложнений мочевыводящих путей при малоинвазивных урологических вмешательствах.
3. Разработка системы рациональной и оптимальной антибактериальной политики в урологическом стационаре на основе бактериологического мониторинга, с использованием клинико-экономического анализа закупа и потребления антибиотиков.
4. Изучение состояния иммунного статуса, разработка критериев ранней диагностики вторичного иммунодефицита и оценка эффективности иммунокорригирующей терапии у больных мочекаменной болезнью и доброкачественной гиперплазией простаты с инфекционно-воспалительными осложнениями мочевыводящих путей после применения малоинвазивных методов лечения.
5. Изучение и возможности коррекции дисбиотических изменений кишечника на фоне госпитальной инфекции мочевых путей у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы.
6. Определение экономической эффективности профилактики госпитальной инфекции мочевых путей у урологических больных в условиях применения малоинвазивной технологии.
Научная новизна
На основании изучения этиологической структуры, характера, частоты госпитальной инфекции мочевых путей у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы в условиях применения малоинвазивных методов лечения разработаны способы и меры профилактики инфекционно-воспалительных осложнений при уретероскопии с литотрипсией и при оперативном лечении доброкачественной гиперплазии предстательной железы
На основании комплексного изучения: бактериологического мониторинга, клинико-экономического анализа потребления антибактериальных препаратов в урологическом стационаре в условиях применения малоинвазивной технологии разработаны принципы рациональной антибактериальной политики.
Предложено комплексное лечение госпитальной инфекции мочевых путей с включением иммунокорректора - полиоксидония у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы с госпитальной инфекции мочевых путей.
Изучена и определена роль дисбиотических изменений кишечника у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы с госпитальной инфекции мочевых путей в условиях применения малоинвазивных технологий и рекомендовано применение пробиотика - бифиформа.
На основании изучения финансовых затрат на содержание, лечение и реабилитацию урологических больных с госпитальной инфекции мочевых путей определена экономическая эффективность профилактики её в условиях применения малоинвазивной технологии.
Практическая значимость
1. Выявление и установление факторов, предрасполагающих к развитию инфекционно-воспалительных осложнений мочевых путей при малоинвазивных вмешательствах позволяют научно обосновать подходы к их профилактике. Определение микрофлоры и антибиотикограмм в тканях простаты в дооперационном и в камне в послеоперационном периодах, являются определяющим в выборе этиотропной антибактериальной профилактики и терапии.
2. Способ профилактики инфекционно - воспалительных осложнений при контактной уретеролитотрипсии с использованием баллонного катетера у больных с камнем мочеточника позволяет сократить частоту инфекционно-воспалительных осложнений в послеоперационном периоде в 6 раз.
3. На основании данных комплексного клинико-экономического анализа потребления антибиотиков разработана рациональная политика антибактериальной терапии в урологическом стационаре, создан формуляр антибактериальных препаратов.
4. Предложен способ ранней диагностики вторичного иммунодефицита - определение рецепторов иммунных клеток, позволяющий своевременно и адекватно проводить иммунокоррекцию у урологических больных с инфекционно-воспалительными осложнениями в послеоперационном периоде.
5. Выявление дисбиотических нарушений у больных с госпитальной инфекцией мочевых путей в послеоперационном периоде, позволяет проводить целенаправленную их коррекцию, способствовать улучшению состояния больных и препятствовать формированию потенциальных источников возбудителей инфекционно-воспалительных осложнений.
Основные положения, выносимые на защиту
1. На основании изучения этиологической структуры, источников и путей развития инфекционно-воспалительных осложнений при применении малоинвазивных оперативных вмешательств в урологии определены факторы их риска. Определена роль эндогенных и экзогенных источников инфекционно-воспалительных осложнений мочевых путей при малоинвазивных вмешательствах у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы.
2. Эффективными методами профилактики инфекционно-воспалительных осложнений у больных с камнями мочеточника при трансуретральной уретеролитотрипсии и литоэкстракции являются антибактериальное лечение в соответствии с микрофлорой камня и применение баллонного мочеточникового катетера.
3. Эффективными методами профилактики инфекционно-воспалительных осложнений у больных доброкачественной гиперплазией предстательной железы является антибактериальная профилактика в соответствии с выявленной микрофлорой ткани простаты при ее биопсии до операции.
4. Комплексный клинико-экономический анализ потребления антибактериальных препаратов урологическими больными с инфекционно-воспалительными осложнениями мочевых путей определяет тактику закупа и рационального использования антибактериальных препаратов в урологической клинике.
5. Дисбиотические изменения кишечника в редких случаях могут быть источником эндогенного инфицирования мочевых путей.
6. Профилактика госпитальной инфекции мочевых путей является экономически выгодной, клинически оправданной и может сократить финансовые расходы стационара.
Связь с планом НИР
Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ республиканского государственного предприятия «Национальный научный медицинский центр» Министерства здравоохранения Республики Казахстан
Внедрение в практику
Полученные результаты исследования внедрены в практику Научного центра урологии г. Алматы, отделения урологии Национального научного медицинского центра министерства здравоохранения Республики Казахстан г. Астаны, 1-й городской больницы г.Астаны, отделения урологии Республиканского Научного центра неотложной медицинской помощи г. Астаны, урологического отделения больницы скорой медицинской помощи г. Актобе.
Апробация работы
Основные положения диссертации доложены на ежегодных научно-практических конференциях Научного центра урологии г. Алматы и Казахской государственной медицинской академии г. Астаны (2000-2007гг), заседаниях научного общества урологов г. Астаны (2000-2007гг), Международных и Республиканских научно-практических конгрессах и конференциях в городах Барнаул (2004г), Москва (2004, 2005,2006гг), Актобе (2003, 2004, 2005, 2006гг), Астана (2003, 2004, 2005, 2006гг), Алматы (2000-2006гг), X сьезде урологов России в Москве (2003г), на заседании Научно-координационного совета научно-исследовательского института урологии МЗ СР РФ, г. Москва, 09.06.2009г.
Публикации
По теме диссертации опубликовано 23 научные работы, в том числе 2 методические рекомендации, получены четыре предварительных патента на изобретение Республики Казахстан. В рецензируемых журналах в России опубликовано – 8 работ.
Объем и структура диссертации
Диссертация изложена на 198 страницах компьютерного текста, состоит из введения, 7 глав, заключения, выводов, практических рекомендаций и указателя литературы, включающего 237 отечественных и 115 зарубежных источников литературы. Работа иллюстрирована 20 рисунками и 65 таблицами.
Материал и методы исследования
В основу работы положены результаты комплексных клинических исследований, проведенных у 306 больных с госпитальной инфекцией мочевых путей. Всего было обследовано 2022 оперированных пациентов, из них: 1392 - мочекаменной болезнью и 630 - доброкачественной гиперплазией предстательной железы, пролеченные в клиниках Национального научного медицинского центра, 1-й городской больницы (г. Астана) и Научного центра урологии (г. Алма-Ата) за период с 1997 по 2007 гг.
Для выполнения поставленных задач были использованы общеклинические, рентгенологические, ультразвуковые, иммунологические (клеточно-опосредованный и общий иммунитет), микробиологические (посевы с камня, посевы мочи, посев ткани простаты, секрета простаты, уретрального катетера, кал на дисбиоз) методы исследования, а также клинико-экономический анализ (АВС, VEN, DDD методологии, количественный расчет) и фармако-экономические расчеты. Общеклинические методы исследования включали: анализы крови, мочи, биохимические исследования крови (мочевина, креатинин, клиренс креатинина, билирубин, трансаминазы, общий белок и белковые фракции, электролиты, глюкоза), показатели свёртывающей системы крови (свертываемость и длительность кровотечения, тромбоциты, протромбиновое время и индекс, фибриноген).
Инструментальные и эндоскопические методы исследования: уретроскопия, цистоскопия, уретеропиелоскопию проводили с применением аппаратуры фирмы «Karl Storz». Для ирригации жидкости использовали аппарат «UROMAT» той же фирмы.
Ультразвуковые исследования (эхография) почек, мочевого пузыря, трансректальное ультразвуковое исследование предстательной железы и мочевого пузыря выполняли на аппарате «ALOKA SSD-630», Япония.
Рентгенологические методы исследования: обзорная и экскреторная урография, пиелография, цистография, уретрография, ангиография с использованием высокоатомных йодсодержащих контрастных веществ (ультравист, омнипак); компьютерная томография, ядерная магнитно-резонансная томография органов мочеполовой системы проводились по показаниям на аппаратах «Diagnost» фирмы «Philips» (Германия).
Микробиологическим анализатором “МикроТакс” (фирма “SYLAB”, Австрия), осуществляли автоматизированный скрининг мочи на наличие бактериурии.
Проведены бактериологические исследования биоматериалов с очагов инфекции: 60 смывов с уретрального катетера и уретры, 130 мазков из ткани предстательной железы (по 65 из пунктата и срезов), 114 проб секрета простаты, 54 смыва с поверхности и ядра конкрементов почек, мочеточников и мочевого пузыря.
При исследовании пунктата из предстательной железы производили посев на чашки Петри с 5% кровяным агаром. Забор материала проводился по разработанной нами методике «Способ определения микрофлоры ткани предстательной железы» (предпатент №16121 на изобретение Республики Казахстан).
Способ осуществлялся следующим образом: с помощью трансректального датчика фиксируется участок простаты, из которого необходимо взять пунктат, затем по адаптеру, укрепленному на датчике по направлению к намеченному участку предстательной железы продвигается игла с мандреном на нужную глубину. Место нахождения иглы контролируется по изображению на экране монитора. После появления кончика иглы в нужном участке простаты мандрен извлекается, надевается шприц, оттягиванием его поршня удается получить аспират или пунктат, который погружается в пробирку со средой для бактериологического исследования. Больному накануне за сутки ставится очистительная клизма и предварительно перед пункцией простаты проводится орошение раствором антисептика слизистой прямой кишки для профилактики контаминации.
Бактериологическое исследование ткани аденоматозно измененной предстательной железы производили взятием мазков из толщи ткани или срезов стерильным ватным тампоном в стерильные пробирки после аденомэктомии или трансуретральной резекции простаты в операционной.
Микробиологическое исследование камней проводили взятием мазков стерильным ватным тампоном в стерильные пробирки с их поверхности и ядра (конкремент раскалывали зажимом Микулича на операционном столе). Посев и идентификацию возбудителя проводили по общепринятой методике.
В качестве дополнительных методов изучения госпитальных штаммов проводили серотипирование выделенных штаммов P.аeruginosa (22 пробы), с использованием набора диагностических О-сывороток Центрального НИИ вакцин и сывороток им. И.И. Мечникова (г. Москва).
Исследование иммунной системы: определяли абсолютное и относительное количество Т- и В-лимфоцитов. Для характеристики клеточного звена иммунитета определяли субпопуляции лимфоцитов с фенотипами CD3 (Т-лимфоциты), CD4 (Т-хелперы), CD8 (Т-супрессоры), CD16 (клетки - киллеры) методом непрямой иммунофлоуресцентной реакции моноклональными антителами с помощью реактивов «Колоноспектр» (Россия). Учет результатов осуществлялся на люминесцентном микроскопе «Люмам» (ЛОМО, С-Петербург).
Изучали фагоцитарную активность лейкоцитов, фагоцитарное число, фагоцитарный индекс.
Иммуноглобулины трёх основных классов: А, G и М определяли методом иммуноферментного анализа, используя тест-систему «Вектор» (Россия).
Исследование рецепторного аппарата клеток иммунной системы к иммуноглобулинам человека IgG проводили реакцией розеткообразования с инертными эритроцитами (Е-РОК) барана, а также эритроцитами, нагруженными кроличьей антисывороткой (ЕА). Для выявления рецепторов к СД3 компоненту комплемента на В-лимфоцитах использовали эритроциты, сенсибилизированные антителами и нагруженные комплементом (ЕАС-РОК).
При определении дисбактериоза кишечника руководствовались методическими указаниями МЗ РК №10.05.044.03 от 2004 года: «Бактериологическая диагностика дисбактериоза кишечника.
Статистическая обработка результатов исследования
Полученные в исследовании результаты были обработаны с помощью прикладных компьютерных программ Microsoft Excel. При статистической обработке полученных данных использовался критерий Стьюдента с использованием метода вычисления средней арифметической и стандартной ошибки (М±м). Достоверность различий средних величин оценивали с применением таблицы значений доверительного коэффициента t.
Результаты собственных исследований
При сравнительной оценке методов оперативного лечения больных с мочекаменной болезнью и доброкачественной гиперплазией простаты установлено превалирование удельного веса малоинвазивных вмешательств над традиционными, что составило соответственно 79,1% и 20,9% (рисунок 1).

Рис. 1. Методы оперативного лечения больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы
При лечении мочекаменной болезни из малоинвазивных методов лечения чаще применялась дистанционная ударно-волновая литотрипсия (46,9%), при лечении доброкачественной гиперплазии предстательной железы - трансуретральная резекция в 41,7%, что отражено в таблице 1.
Таблица 1
Удельный вес различных видов оперативного лечения больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы
| Виды операций | Количество больных | |||
| МКБ | ДГПЖ | |||
| абс. | % | абс. | % | |
1.Малоинвазивные операции | | | | |
| Дистанционная литотрипсия камней почек | 551 | 39,6 | | |
| Дистанционная литотрипсия камней мочеточника | 134 | 9,6 | | |
| Перкутанная нефролитотомия | 28 | 2,0 | | |
| Уретероскопия с литоэкстракцией без установки стента | 284 | 20,4 | | |
| Уретероскопия, контактная литотрипсия с литоэкстракцией с стентированием почки | 176 | 12,6 | | |
| Контактная цистолитотрипсия с литоэкстракцией | 46 | 3,3 | | |
| Трансуретральная резекция ДГПЖ | | | 264 | 41,9 |
| Трансуретральная резекция склероза шейки мочевого пузыря и стриктуры уретры после аденомэктомии | | | 30 | 4,8 |
| Трансуретральная резекция ДГПЖ с контактной цистолитотрипсией с литоэкстрацией | | | 20 | 3,2 |
| Трансуретральная термотерапия ДГПЖ | | | 72 | 11,4 |
2. Открытые операции | | | | |
| Нефрэктомия | 10 | 0,7 | | |
| Пиелолитотомия | 64 | 4,6 | | |
| Нефролитотомия, пиелолитотомия с нефростомией | 42 | 3,0 | | |
| Уретеролитотомия | 44 | 3,2 | | |
| Цистолитомия | 14 | 1,0 | | |
| Аденомэктомия | | | 212 | 33,6 |
| Эпицистостомия / цистолитотомия | | | 32 | 5,1 |
| Всего | 1392 | 100,0 | 630 | 100,0 |
При анализе частоты и характера инфекционно - воспалительных осложнений госпитальная инфекция мочевых путей в послеоперационном периоде выявлена у 306 больных из 2022 обследованных пациентов, что составило 15,1%. При этом, после эндоскопических вмешательств - 11,8%, открытых - 27,9%. Но, несмотря на малую инвазивность эндоскопических методов, удельный вес госпитальной инфекции после контактной уретеро- и цистолитотрипсии с литоэкстракцией у больных мочекаменной болезнью и доброкачественной гиперплазией простаты оставался на достаточно высоком уровне, более 22 %.
Инфекционно-воспалительные осложнения были представлены: острым пиелонефритом (32,4%), острым уретритом (20,6%), острым циститом (16,7%), острым орхоэпидидимитом (16,7%), острым простатитом (8,8%), нагноением послеоперационной раны (4,9%), отражены на рисунке 2.

Рис.2. Нозологические формы госпитальной инфекции мочевых путей у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы
Спектр возбудителей инфекционно-воспалительных осложнений мочевых путей у больных мочекаменной болезнью после дистанционной литотрипсии и доброкачественной гиперплазией предстательной железы после трансуретральной резекции простаты представлен в основном, грамотрицательной флорой: E.сoli - 29,7 и 23,19% соответственно, Рs. аeruginosa - 15,9 и 29,3%, Proteus spp. - 4,9 и 5,6% и др., составляющие при мочекаменной болезни – 56,6%, при доброкачественной гиперплазии предстательной железы - 71,7%.
Из грамположительных возбудителей превалировал Staphylococcus spp. При этом воспалительные процессы верхних мочевых путей были обусловлены грамотрицательной флорой, а нижних мочевых путей - грамотрицательными микроорганизмами.
Возбудители мочевой инфекции, выделенные в послеоперационном периоде в моче у больных мочекаменной болезнью и доброкачественной гиперплазией предстательной железы расценены как госпитальные штаммы, спектр которых был представлен: Ps. aeruginosa в 60,1% случаях, E.сoli - 13,7%, Proteus spp. - 11,4%, Enterobacter cloacae - 8,2%, Klebsiella spp.- 0,7%, грамположительная флора составила 3,8%, ассоциации микроорганизмов - 1,7%.
Экзогенные и эндогенные источники инфицирования мочевых путей
Для выявления экзогенных источников и путей распространения госпитальной инфекции мочевыводящих путей нами регулярно с 1997 года 2 раза в месяц проводилось бактериологическое исследование смывов с аппаратуры, инструментов, дезинфицирующих средств, рук и одежды медицинского персонала, объектов в перевязочной, цистоскопической, процедурных кабинетах, операционных, палатах. В случаях, когда высевался госпитальный штамм, проводили контрольные посевы в динамике после проведенных санитарно-гигиенических, эпидемиологических мероприятий.
Найдены экзогенные очаги инфицирования в 39% случаев (120 наблюдений) у исследуемых пациентов. Источниками инфекции являлись: пациенты - 5%, медицинский персонал - 45,9%, объекты окружающей среды (мебель, кушетка, кресло и др.) - 12,9%.
Передача инфекции чаще всего осуществлялась через руки медицинского персонала, путями передачи инфекции также служили цистоскопы, катетеры, стенты, дренажи, дезинфицирующий раствор (фурациллин), перевязочный материал и др. Местами передачи инфекции были в 18 (25,0%) случаях - перевязочный и в 4 (5,6%) – цистоскопический кабинеты, ещё в 4 (5,6%) – палата.
Экзогенные очаги инфекции в наших наблюдениях были выявлены в 87,5% случаев инфекционно-воспалительных послеоперационных осложнений, а в 12,5% случаях найдены эндогенные источники инфекции - ткань простаты, конкременты.
Для анализа эндогенных очагов инфекции нами проведены комплексные бактериологические исследования смывов с поверхности и ядра мочевых камней, пузырной и лоханочной мочи у 54 больных с камнями почек и мочеточника (таблица 2 ).
При бактериологическом анализе мочи и смывов с конкрементов выделена микрофлора в 55,6% случаях.
Таблица 2
Характер микрофлоры мочи и смывов с конкрементов (поверхности и ядра)
у больных мочекаменной болезнью
| Микроорганизмы | Количество микроорганизмов (%) | |||
| Моча самостоятельно | Моча из лоханки | Поверхность конкремента | Ядро конкремента | |
| E. Сoli | 22,2 | 25,6 | 28,6 | 28,7 |
| Enterobacter spp. | 11,1 | 11,1 | 4,1 | 4,0 |
| Ps. aeruginosa | 26,8 | 22,2 | 14,2 | 12,2 |
| Proteus spp. | 5,6 | 5,6 | 7,1 | 6,9 |
| Staphylococcus spp. | 26,1 | 26,7 | 28,6 | 28,7 |
| Staph. spp. + E. сoli | - | - | 14,3 | 12,7 |
| E. coli + Ps. aeruginosa | 2,6 | 2,1 | 2,1 | - |
| Staph. spp.+ Strept. spp. | 5,6 | 6,7 | 1 | 6,8 |
| Всего | 100,0 | 100,0 | 100,0 | 100 |
При бактериологическом исследовании мочи и смывов с конкрементов у больных с госпитальной инфекцией мочевых путей грамотрицательная флора была выявлена соответственно в 65,7% и 54% случаях; грамположительная – 26,1% и 28,6% и смешанная флора – 8,2% и 6,8 %.
В 83,3% результаты бактериологических анализов пузырной и лоханочной мочи совпадали.
При исследовании смывов с поверхности камня - флора выделена в 51,9% случаях, с ядра камня - в 55,6%. При этом в 12,6% микрофлора из конкрементов выделена при стерильной моче.
Очевидно, что выделение разных возбудителей из мочи и камня может свидетельствовать о формировании биопленок в камнях у этих пациентов (Rodney M. Donlan, J.W. Costerton, 2002). В 12,6% случаях инфицированные конкременты могут быть источником эндогенной инфекции в условиях применения малоинвазивной технологии (контактной литотрипсии).
Предложенный нами способ профилактики инфекционно-воспалительных осложнений при контактной уретеролитотрипсии и литоэкстракции с введением баллонного катетера выше конкремента, препятствующего рефлюксу ирригационной жидкости (предварительный патент на изобретение №17179 РК) позволил снизить частоту таких осложнений с 15,7% до 2,6%. Способ осуществляется следующим образом: после введения уретеропиелоскопа в мочеточник и обнаружения конкремента, через уретеропиелоскоп вводят баллоный катетер, который устанавливают выше уровня конкремента, баллон с помощью шприца заполняют антисептической жидкостью в количестве 2,0-3,0. Проводят дробление и извлечение камня мочеточника при постоянном введении и отведении промывной жидкости под давлением 75-80 мм рт.ст., со скоростью 400 мл/мин. При выполнении основного этапа операции баллон прекращает активный ретроградный ток жидкости в почку, тем самым предотвращает возможный пиеловенозный рефлюкс, бактериемию, диссеминацию микрофлоры, выделяющуюся из ядра разрушаемого конкремента. Кроме того, баллон препятствует миграции фрагментов конкремента в почку. После удаления конкремента, баллон катетера опорожняют, катетер вместе с уретеропиелоскопом удаляют (рисунок 3).

Рис.3. Применение баллонного катетера у больных с камнями мочеточника при трансуретральной резекции уретеролитотрипсии и литоэкстракции
По предложенному нами способу удалось снизить послеоперационные инфекционно-воспалительные осложнения мочевых путей с 15,7% до 2,6%.
Для выявления инфицированности ткани простаты с целью проведения адекватной предоперационной подготовки и профилактики инфекционно-воспалительных осложнений в послеоперационном периоде у больных доброкачественной гиперплазией простаты проведены бактериологические исследования ткани предстательной железы в 65 случаев взятой при пункционной биопсии простаты и в 65 случаях – во время трансуретральной резекции, всего -130 исследований. Анализ и забор пунктата проводился, по разработанной нами методике (предпатент на изобретение № 16121 РК), забор и исследование срезов ткани простаты проводились в операционной, далее в бактериологической лаборатории.
Результатами бактериологических исследований установлено, что в моче, пунктате и ткани простаты, взятой в ходе операции отмечался рост микрофлоры в 58,5%, 36,9% и 43,1% анализов. При сравнении микрофлоры мочи, ткани и пунктата простаты совпадение результатов отмечено в 44,7% случаях. При стерильной моче в ткани простаты обнаружена микрофлора в 11,8% случаях.
Следует отметить, что в моче Рs. aeruginosa выделена у 3 пациентов, тогда как в ткани простаты у – 9, при этом у 7 пациентов инфицирование было выявлено до операции, причем всем этим 7 пациентам проводились эндовезикальные манипуляции (катетеризации, цистоскопия и др.) накануне или в анамнезе. Эти данные также могут свидетельствовать о существовании биопленок – специфически организованных, прикрепленных к субстрату скоплений микроорганизмов, которые не выявляются обычными бактериологическими исследованиями. В таких случаях целесообразно проводить посев пунктата простаты и ткани простаты для проведения адекватной предоперационной подготовки и профилактики послеоперационных осложнений. А в некоторых случаях (наличие в анамнезе данных об эндовезикальных вмешательствах, простатите, хронической инфекции мочевых путей и т.д.) желательно проведение бактериологического исследования пунктата простаты до операции.
Для борьбы с экзогенными факторами госпитальной инфекции мочевыводящих путей внедрение нами одноразовых емкостей со стерильными растворами для ирригации жидкости во время операции, мочеприемников, дезинфицирующих салфеток для рук медицинского персонала вместо полотенец, закрытых дренажных систем, центрального автоклавирования, стерилизации парами формалина (гибкого инструментария), строгое соблюдение санитарно-гигиенического (мытье рук при контакте с катетером и мочеприемником) и эпидемиологического режимов, изъятие из клинической практики фурацилина снизило выявляемость синегнойной палочки с 30,3% в 1997г. до 14,2% в 2007 году. Также в последующие годы ликвидировали контаминацию лекарственных форм, аппаратуры. Так, при бактериологическом исследовании материалов (смыв с емкости для промывания мочевого пузыря), лекарственных форм (дезинфицирующие растворы) и эндоскопической аппаратуры положительные результаты в 1997 г. были получены соответственно – в 2%, в 50% и в 3,1%; в 2002 г. соответственно в 1,1%, 9,8% и 2,9%; а в 2007 г. посевы были стерильными (таблица 3, рисунок 4).
Таблица 3
Результаты исследований на стерильность различных материалов и объектов
-
Виды объектов
исследований на
стерильность
Количество положительных смывов по годам
1997
2002
2007
абс
%
абс
%
абс
%
Материалы
306/6
2.0
374/4
1,1
138/0
-
Лекарственные формы
112/56
50,0
417/41
9,8
249/0
-
Аппаратура, инструментарий
902/28
3,1
793/23
2,9
789/0
-
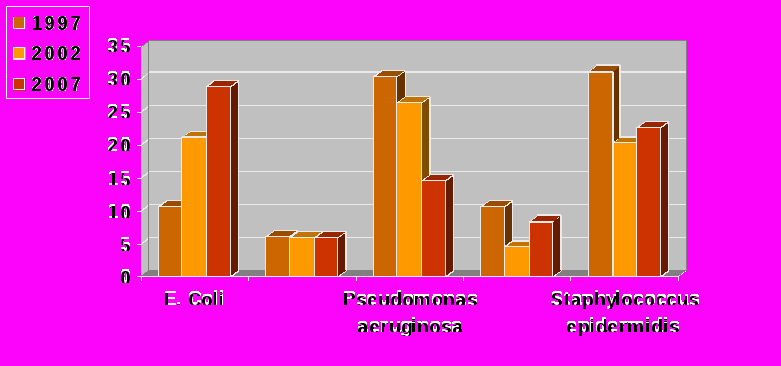
Рис. 4. Микрофлора мочи у урологических больных за период 1997 - 2007 гг, (%)
Изучение особенностей развития госпитальной инфекции мочевыводящих путей при применении малоинвазивной технологии выявило зависимость их частоты с её объективными факторами.
Полученные данные свидетельствовали, что современные эндоскопические технологии, несмотря на малую инвазивность опасны в возникновении инфекционно-воспалительных осложнений.
При исследовании двух групп больных мочекаменной болезнью, послеоперационный период которых в 1-й группе (50 пациентов) протекал без осложнений, во 2-й группе (46 пациентов) отмечались инфекционно-воспалительные осложнения было выявлено, что операции у пациентов во 2 группе были в 1,6 раза длительнее, чем в 1-й, длительность ирригации жидкости, соответственно - 35,0 и 1,3; 58,0 и 3,3 минут (р<0,05). Кратность введения резектоскопа во 2 группе в 1,8 раза была чаще, чем в первой группе (р<0,05). Длительность дренирования мочевыводящих путей во 2 группе достоверно в 2,1 раза превышала аналогичные показатели 1 группы. Аналогичные результаты исследования зависимости частоты возникновения инфекционно-воспалительных осложнений в послеоперационном периоде от клинико-технических особенностей эндоскопических оперативных вмешательств получены в 2-х группах больных доброкачественной гиперплазией простаты.
Таким образом, риск возникновения госпитальной инфекции мочевых путей у больных мочекаменной болезнью и доброкачественной гиперплазией простаты в послеоперационном периоде нарастает по мере увеличения длительности операции и ирригации жидкости более 1 часа, кратности введения цистоскопов в нижние и верхние мочевые пути более 9 раз.
Нами проведено изучение зависимости частоты послеоперационных инфекционно-воспалительных осложнений в группах больных с различными размерами камней мочеточника и объёмом простаты. При мочекаменной болезни в 1-ю группу вошли пациенты, у которых размеры камня составили от 0,5 до 1,5 см и 2-ю – более 1,5 см. При доброкачественной гиперплазии предстательной железы – 1-ю группу составили пациенты с объемом простаты до 90 см3 и 2-ю – более 90 см3.
Результаты исследований свидетельствуют, что в первых группах при обеих нозологиях частота осложнений была меньше, чем во вторых, и составляла соответственно, при мочекаменной болезни: 2,6 % -13,3 %, при доброкачественной гиперплазии предстательной железы: 3,7 % - 25,0 %.
Вышеприведенные данные свидетельствуют о зависимости частоты госпитальной инфекции мочевых путей от размеров камней мочеточника и объёма простаты.
Роль дисбактериоза кишечника как эндогенного фактора инфицирования
С целью исключения первичных дисбактериозов и уточнения возможности эндогенного инфицирования мочевых путей, а также для адекватной их коррекции нами проведены исследования характера сдвигов в составе кишечной микрофлоры у урологических больных, послеоперационный период которых осложнился госпитальной инфекцией мочевых путей.
