На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Как известно основным непосредственным показателем качества и адекватности выполненного хирургического вмешательства у онкологических больных является радикальность, т.е. возможность тотального удаления опухоли в пределах здоровых тканей. В группе оперированных больных в 86,4%(n=291) случаев использование указанных доступов позволило выполнить радикальное удаление опухолей. Аналогичный показатель изолированно среди злокачественных опухолей составил - 81%(n=128), при этом оценивалось удаление с соблюдением принципа блочности, т.е. резекции в пределах здоровых тканей (рис.5). В остальных случаях (19%, n=30) удаление опухоли носило условно радикальный характер.
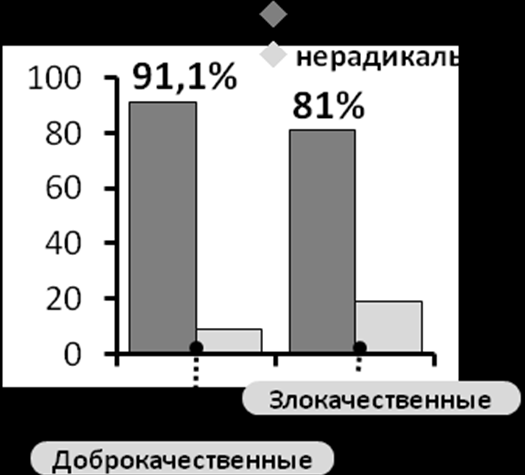
Рисунок 5. Частота радикальных хирургических вмешательств выполненных в группах доброкачественных и злокачественных опухолей основания черепа.
Следует отметить, что при анализе отдаленных результатов частота развития местных рецидивов статистически достоверно снижалась в группе пациентов, которым хирургические вмешательства выполнялись в радикальном объеме (удаление опухоли в пределах здоровых тканей) по сравнению с группой нерадикальных вмешательств, с 73,3% (нерадикальные) до 51,2% (р=0,02) (рис.6). Снижение частоты развития местных рецидивов в свою очередь привело к увеличению 5-летней безрецидивной выживаемости в группе радикально оперированных больных до 35,3%±4,8% (медиана 13,7 мес.) против 21%±8,4% (медиана 8 мес.) в группе нерадикальных операций (р=0,098).
Чаще нерадикальные вмешательства выполнялись при поражении основания черепа саркомами – 28,6%(n=16), значительно реже при раке придаточных пазух полости носа – 6,7%(n=7). В большинстве случаев (66,7%) подобная ситуация возникла при распространении поражения в область среднего отдела основания черепа, когда интраоперационно констатировалась невозможность выполнения блоковой резекции в связи с массивной инфильтрацией окружающих тканей. Частота выполнения радикальных вмешательств (резекции в пределах здоровых тканей) при использовании передних доступов среди злокачественных опухолей составила - 83,9%(n=99), передне-боковых - 67,6% (n=25), задне-боковых - 66,7%(n=2). Последний показатель не является репрезентативным, т.к. представлен небольшим числом наблюдений.
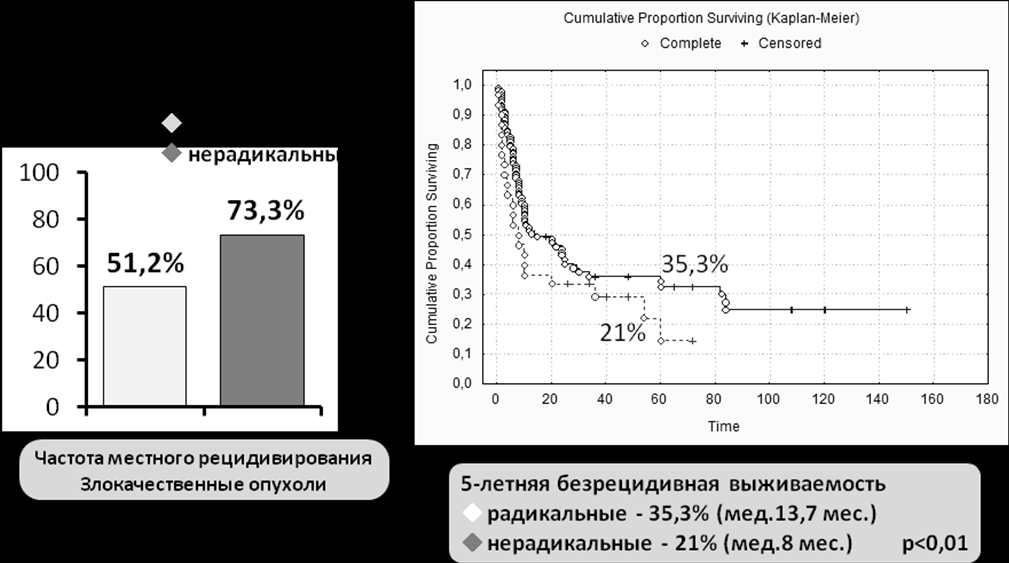
Рисунок 6. Отдаленные результаты в зависимости от радикальности удаления опухоли в области основания черепа.
Среди других причин неоперабельности опухолей основания черепа в исследуемой группе встречались такие, как: двустороннее поражение тканей орбиты, поражение кавернозного синуса, массивное периневральное распространение опухоли, поражение магистральных сосудов.
Вовлечение в опухолевый процесс магистральных сосудов (внутренней сонной и позвоночной артерий, больших венозных коллекторов головного мозга) в области основания черепа является одним из сильнейших факторов, ограничивающих возможность выполнения радикального удаления опухоли из-за опасности ранения сосуда и возникновения смертельно опасных осложнений. В связи с этим необходимо четкое дооперационное планирование резекционного этапа и определение возможности сохранения целостности магистрального сосуда. Существующие методики визуализации опухолевого поражения основания черепа позволяют определять степень вовлечения магистрального сосуда в опухолевый процесс - от сдавления стенки до инфильтрации с полным охватом диаметра сосуда. В нашем исследовании вовлечение в опухолевый процесс внутренней сонной артерии наблюдалось в 13,1%(n=59) случаев. Чаще всего подобное вовлечение происходило при локализации опухолевого процесса в области подвисочной ямки 24%(n=43). Наибольшей потенциальной способностью к инфильтрации стенки внутренней сонной артерии обладали вагальные параганглиомы - 63,6%(n=21) и экстракраниальные менингиомы - 60%(n=6). Интересно, что поражение внутренней сонной артерии клинически (головные боли, головокружение) проявлялось лишь в 18,6%(n=11) случаев, т.е. у остальных пациентов уменьшение кровоснабжения в гомолатеральной половине головного мозга вызванное постепенным нарастанием компрессии сосуда компенсировалось возможностями коллатеральной сети. 27 больным выполнялись хирургические вмешательства, во время которых производилось выделение внутренней сонной артерии (денудация), при этом в 5(18,5%) случаях сохранить сосуд не удалось в связи, с чем выполнена резекция пораженной стенки с перевязкой дистального конца артерии. В 3 случаях после подобных вмешательств отмечено развитие острого нарушения мозгового кровообращения в раннем послеоперационном периоде, в двух случаях с регрессией неврологической симптоматики и в одном с летальным исходом.
Вовлечение кавернозного синуса в опухолевый процесс в нашем исследовании имелось в 19(4,2%) случаях. Чаще всего подобное поражение наблюдалось у пациентов с костными саркомами (ПНЭО, остеосаркома) переднего и среднего отделов основания черепа (13,9%, n=5), а также при раке слизистой оболочки полости носа и придаточных пазух (5,3%, n=8). Во всех указанных случаях опухолевый процесс был признан неоперабельным и хирургические вмешательства не выполнялись.
Выполнение хирургических вмешательств в области основания черепа сопряжено с необходимостью восстановления обширных дефектов, образующихся после расширенных резекций в этой области. Основным специфическим осложнением после подобных хирургических вмешательств является ликворея, которая несет потенциальную опасность развития более тяжелых инфекционных осложнений – менингита, энцефалита, абсцесса. Частота инфекционных осложнений значительно возрастает при наличии сообщения полости черепа с изначально инфицированными полостью носа и полостью рта. Как правило, объем резецированных тканей при операциях в области переднего отдела основания черепа включает: содержимое орбиты, верхнюю челюсть, костные ткани основания черепа и твердую мозговую оболочку. Операции в области среднего отдела основания черепа сопровождаются возникновением дополнительных дефектов тканей в околоушной области, височной кости, верхней и нижней челюсти.
Выбор пластического материала для замещения дефектов основания черепа в нашем исследовании зависел от нескольких факторов, среди которых: размер дефекта, его локализация, наличие предшествующей лучевой терапии в зоне операции, доступность пластического материала, наличие дополнительного дефекта эпителиальных поверхностей (кожи, слизистой оболочки полости рта и ротоглотки). Для замещения дефектов основания черепа мы использовали различные регионарные и перемещенные лоскуты, среди них встречались простые и сложные составные, например кожно-мышечные лоскуты. При этом мы придерживались определенного алгоритма выбора варианта реконструкции дефектов тканей в области основания черепа, который представлен в табл.4.
Таблица 4. Алгоритм выбора варианта реконструкции комбинированных дефектов краниофациальной зоны.
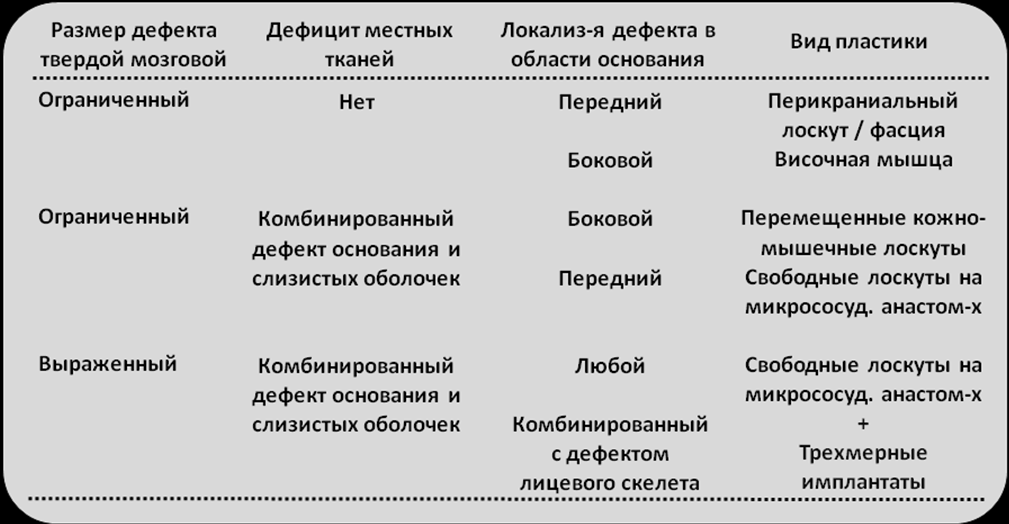
Всего в нашем исследовании пластические и реконструктивные вмешательства после удаления опухолей в области основания черепа потребовались 32 пациентам. При этом в 19 случаях имелись дефекты твердой мозговой оболочки различного размера. В качестве пластического материала для восстановления дефектов тканей в области основания черепа в 17(53,1%) случаях использовался перикраниальный надкостничный лоскут, в 4(12,5%) случаях - височная мышца, 5(15,6%) - большая грудная мышца, 5(15,6%) - широчайшая мышца спины, 2(6,3%) - кожно-фасциальный лоскут с предплечья, 1(3,1%) - лоскут с включением трапециевидной мышцы. Свободные реваскуляризированные лоскуты использованы в 6(18,8%) случаях.
Для замещения комбинированных дефектов краниофациальной зоны, требующих восстановления значительного объема утраченных тканей лицевого скелета, нами использовались трехмерные титановые сетчатые трансплантаты. Неоспоримыми преимуществами этой методики являются: прецизионная точность и симметричность воспроизведения костных структур лицевого скелета противоположной стороны, которые достигаются предварительным моделированием с помощью стереолитографической модели. Благодаря этому приобретается абсолютная конгруэнтность устанавливаемого имплантата окружающим тканям в зоне дефекта в комбинации с простотой его установки и фиксации. Всего подобные имплантаты использованы у 4 пациентов.
Общая частота осложнений после выполнения расширенно-комбинированных операций в области основания черепа составила 20,8%(n=70). Среди них ликворея 3%(n=10), менингит 0,9%(n=3), выпадение функции черепных нервов каудальной группы 16%(n=54), инсульт 0,9%(n=3), выраженная пневмоцефалия 0,3%(n=1), эпидуральный абсцесс 0,3%(n=1).
Многие опухоли поражающие основание черепа являются высокочувствительными к химио- и лучевой терапии, что позволяет использовать указанные методы в комплексном лечении злокачественных процессов этой локализации. При этом сообщений по поводу использования химиотерапии в комбинированном лечении злокачественных опухолей основания черепа к настоящему времени накопилось крайне мало. Как уже было отмечено ранее, в нашем исследовании лучевая терапия была проведена 173(67,6%) пациентам, при этом в 25 случаях она проводилась после удаления первичного очага (в послеоперационном периоде), в связи с чем мы оценивали непосредственный эффект только у 148 пациентов основной группы. Химиотерапия проведена 99(38,7%) пациентам (рис.7).
Общая эффективность лучевой/химиолучевой терапии (частота полной+частичной регрессии) оказалась высокой в группах таких опухолей как: аденокарцинома (71,4%), эстзионейробластома (65%), ангиосаркома (100%), хондросаркома (100%), ПНЭО/саркома Юинга (60%), эмбриональная рабдомиосаркома (80%) (рис.7). Интересно, что в этой группе оказались опухоли, традиционно считающиеся относительно чувствительными к проведению лучевой терапии – ангиосаркома и хондросаркома. Крайне низкой эффективность лечения была в группах злокачественной фиброзной гистиоцитомы, злокачественной шванномы и синоназальной меланомы.
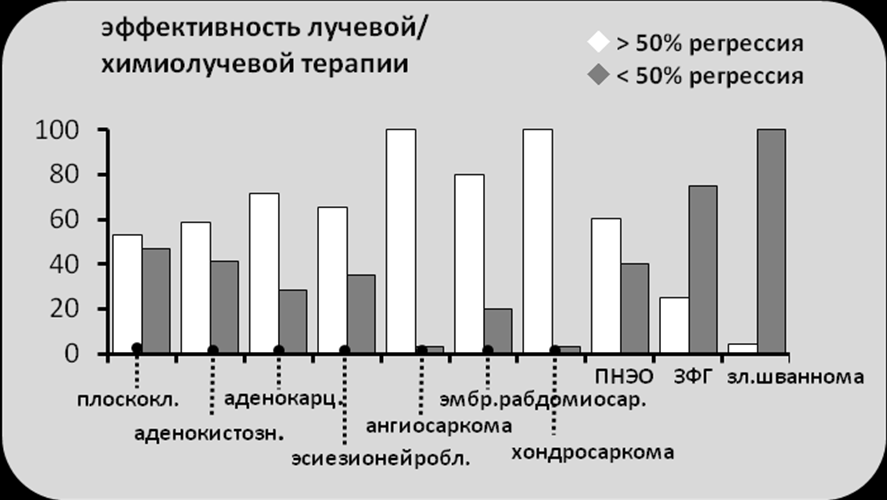
Рисунок 7. Непосредственная эффективность лучевой/химиолучевой терапии в группе злокачественных опухолей, поражающих основание черепа.
Наиболее чувствительными к проводимой лучевой/химиолучевой терапии, по показателю частоты полной клинической регрессии, оказались эмбриональная рабдомиосаркома (100%) и эстезионейробластома (50%). При этом в группе плоскоклеточного рака имелась прямая зависимость непосредственного эффекта от увеличения дозы подводимой лучевой терапии и подключения химиотерапии в сторону повышения ее эффективности. Так частота местного рецидивирования в группе пациентов с самостоятельной лучевой терапией достоверно превосходил аналогичный показатель для пациентов с химиолучевой терапией – 92,9% против 60%, соответственно (р=0,03) (рис.8). Полученное различие было также достоверным при подсчете общей выживаемости, так общая 5-летняя выживаемость в группе пациентов получивших самостоятельную лучевую терапию оказалась значительно ниже аналогичного показателя в группе химиолучевой терапии - 11±9,2% (медиана 13,6 мес.) против 37,8±13,5% (медиана 29,7 мес.) (р=0,03).
Определяющим фактором в оценке влияния воздействия лучевой/химиолучевой терапии на отдаленные результаты лечения опухолей поражающих основание черепа является чувствительность опухоли к проводимому лечению, выражающаяся в степени клинической регрессии. Подобная оценка проводилась нами в группах с выраженным объективным эффектом в виде полной или частичной регрессий первичного очага (регрессия более 50%) и с негативным эффектом в виде стабилизации или прогрессирования опухолевого процесса (регрессия менее 50%).
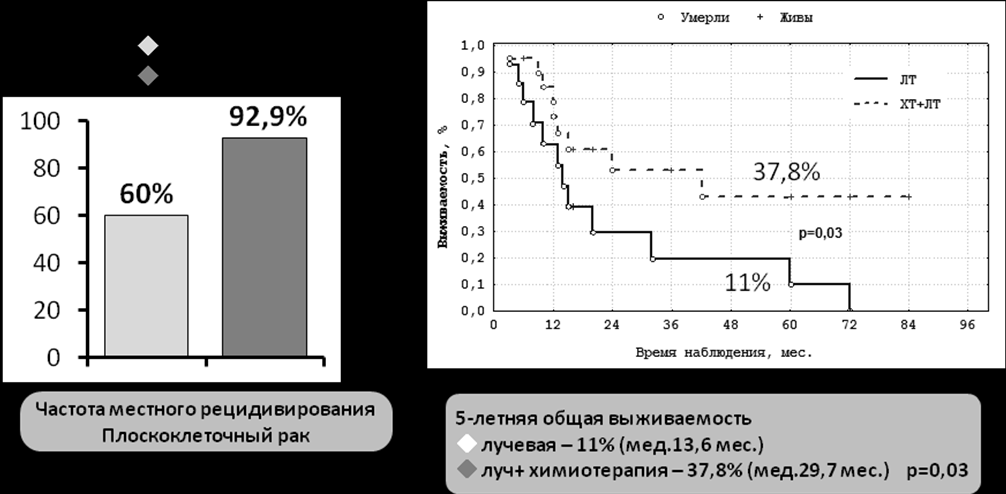
Рисунок 8. Отдаленные результаты лечения плоскоклеточного рака, поражающего основание черепа в группах лучевого и химиолучевого воздействия.
Основным проявлением влияния указанных факторов явилось статистически достоверное уменьшение общей частоты местного рецидивирования в группе пациентов с с выраженным противоопухолевым эффектом после проведения лучевого/химиолучевого лечен ия в сравнении с пациентами с негативным клиническим эффектом – 50,6% (регрессия опухоли более 50%) против 69,2% (менее 50%) (р=0,01) (рис.9). При этом выраженность противоопухолевого воздействия четко коррелировала с показателями общей и безрецидивной выживаемости пациентов. Так общая 5-летняя выживаемость в группе пациентов с выраженной регрессией опухоли составила - 46,6±6,1% (медиана 43 мес.) и значительно превосходила аналогичный показатель в группе пациентов с отсутствием регрессии – 27,2±6% (медиана 15 мес.), различие статистически достоверно (р=0,042) (рис.9).
Влияние указанного фактора на отдаленные результаты лечения увеличивалось с увеличением степени регрессии первичной опухоли. Так общая 5-летняя выживаемость в группе пациентов с полной регрессией опухоли составила – 50% и оказалась значительно выше аналогичных показателей в группах пациентов с частичной регрессией - 42%, стабилизацией – 27% и прогрессированием опухолевого процесса – 6,6%, различия статистически достоверны (р=0,049, 0,004 и 0,02).
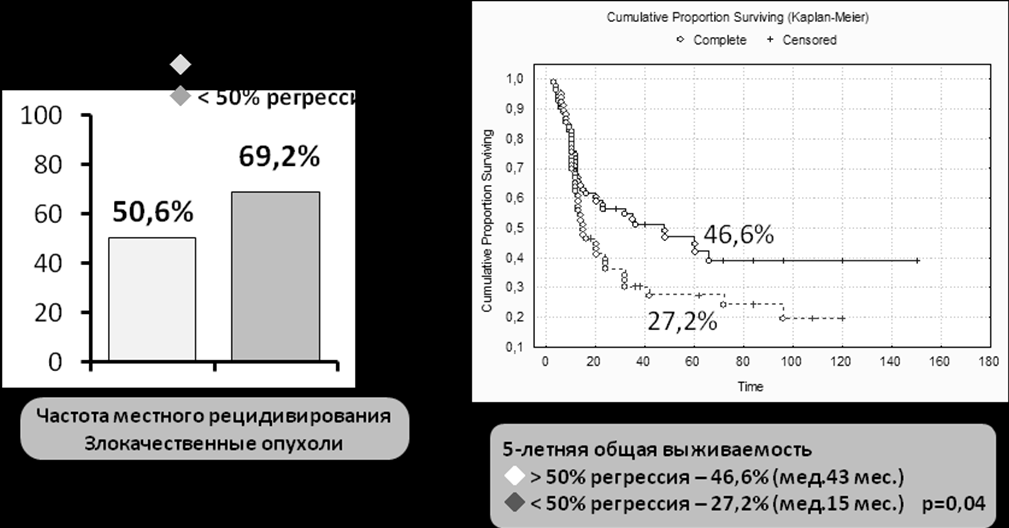
Рисунок 9. Отдаленные результаты лечения в группе злокачественных опухолей основания черепа в зависимости от выраженности клинической регрессии после окончания лучевой/химиолучевой терапии.
Различия в биологическом поведении и многообразие опухолей поражающих основание черепа затрудняют оценку отдаленных результатов лечения и определение прогностических факторов. Наиболее авторитетные работы указывают, что основными признаками, влияющими на снижение показателей выживаемости у пациентов с поражением основания черепа, являются агрессивность опухоли, распространение процесса на ткани головного мозга, поражение тканей глазницы, нерадикальное хирургическое вмешательство (Lund V.J. 1998, Clayman G.L. 1995). В нашем исследовании отдаленные результаты прослежены в группе, включающей 237 пациентов с различными злокачественными процессами в области основания черепа. Общая 5-летняя выживаемость в группе злокачественных опухолей поражающих основание черепа вне зависимости от вида лечения составила - 37,7±3,7% (медиана 23,3 мес.), 5-летняя безрецидивная выживаемость - 30±3,3% (медиана 10 мес.) (рис.10).
Местные рецидивы реализовались в 59,9% (n=142) случаев, период реализации рецидивов в среднем составил 13,4±12,4 месяцев от начала лечения. Общая частота регионарного метастазирования составила 4,2% (n=10), в средние сроки 5,0±3,6 месяцев, общая частота отдаленного метастазирования – 8,9% (n=21), в среднем через 8,7±8,2 месяцев. Таким образом, в подавляющем большинстве случаев (88%) прогрессирование было вызвано местным рецидивированием опухолевого процесса в основном в течение первого года после окончания лечения.
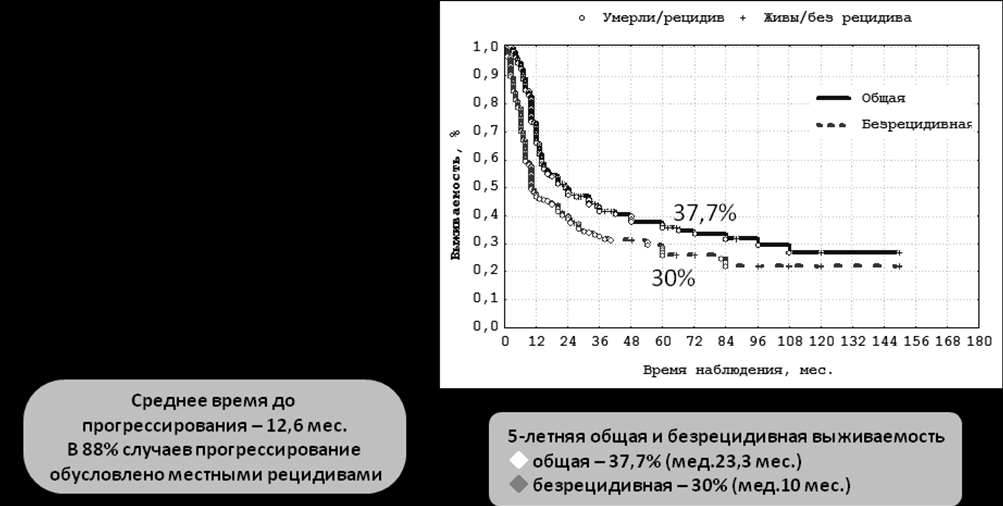
Рисунок 10. Отдаленные результаты в группе злокачественных опухолей, поражающих основание черепа.
Анализ отдаленных результатов лечения в зависимости от морфологии опухоли демонстрирует следующие проявления. Местные рецидивы чаще всего возникали у пациентов в группе сарком Юинга/ПНЭО – 100%, злокачественной шванномы – 83,3% и хондросаркомы – 77,8%. Регионарные метастазы чаще регистрировались в группах эстезионейробластомы – 8,3%, злокачественной шванномы – 8,3% и цилиндромы 4,2%, отдаленные метастазы в группе эстезионейробластом – 25%, цилиндромы – 16,7% остеосаркомы – 12,5% и злокачественной шванномы – 8,3% (Рис.11).
Самые высокие показатели общей 5-летней выживаемости были отмечены в группе эпителиальных опухолей, среди них на первом месте группа прочих эпителиальных злокачественных опухолей (кроме плоскоклеточного рака и цилиндромы), большинство из которых составили аденокарцинома и базальноклеточный рак – 46,0±12,7% (медиана 46,6 мес.), затем аденокистозный - 45,2±15,9% (медиана не достигнута) и плоскоклеточный рак - 36,1±6,4% (медиана 24 мес.). Среди опухолей производных нейроэктодермального зачатка лучшие показатели общей 5-летней выживаемости отмечались в группе эстезионейробластомы - 34,7±12,3% (медиана 15,9 мес.). Среди сарком самые высокие показатели зарегистрированы в группе мягкотканых сарком - 33,2±7,8% (медиана 13,1 мес.) против 16,5±8,3% (медиана 14 мес.) в группе костных сарком, различие не достоверно.
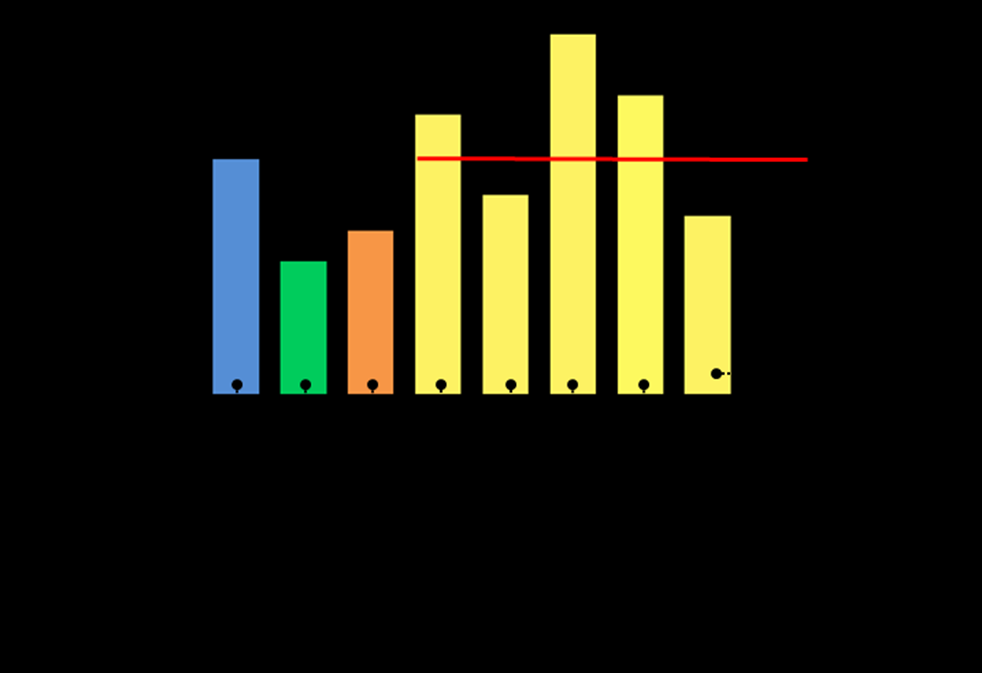
Рисунок 11. Частота местного рецидивирования в разных морфологических группах опухолей, поражающих основание черепа.
Таким образом, при анализе общих показателей выживаемости и безрецидивного течения вне зависимости от вида лечения лучшим прогнозом обладали следующие виды опухолей: среди эпителиальных (раков) – цилиндрома, среди производных нейроэктодермы – эстезионейробластома, среди мягкотканых сарком - эмбриональная рабдомиосаркома, среди костных сарком - хондросаркома.
При анализе отдаленных результатов лечения в группах самостоятельного хирургического (n=57), консервативного (лучевая/химиолучевая) (n=80) и комплексного (лучевая/химиолучевая+операция) (n=100) лечения не было отмечено достоверных различий по показателям безрецидивного течения и выживаемости пациентов. Однако следует учесть, что исследуемые группы состояли из разнородных морфологических вариантов опухолей, которые нивелировали различия в эффективности разных методов лечения. Поэтому детальная оценка влияния вида терапевтического воздействия на отдаленные результаты лечения проводилась в наиболее численных и значимых группах, таких как – эпителиальные и неэпителиальные злокачественные опухоли, плоскоклеточный рак, цилиндрома, эстезионейробластома, костные и мягкотканые саркомы.
Проведение хирургического вмешательства статистически достоверно снижало частоту развития местных рецидивов с 68,7% (у неоперированных) до 55,4% (р=0,03) (табл.5). Наиболее выраженное влияние хирургическое вмешательство оказывало в группе эпителиальных злокачественных опухолей. Так 5-летняя безрецидивная выживаемость у больных с эпителиальными злокачественными опухолями в группе оперированных пациентов оказалась значительно выше, чем в группе консервативного лечения (без операции) - 37,9±6,4% (медиана 24,6 мес.) и 15,9±6,3% (медиана 10 мес.) соответственно, различие имеет тенденцию к достоверности (р=0,08) (табл.5). Следует отметить, что улучшение показателей безрецидивного течения и выживаемости в группе эпителиальных злокачественных опухолей происходило именно при комбинированном применении хирургического вмешательства и лучевой терапии (Рис.12).
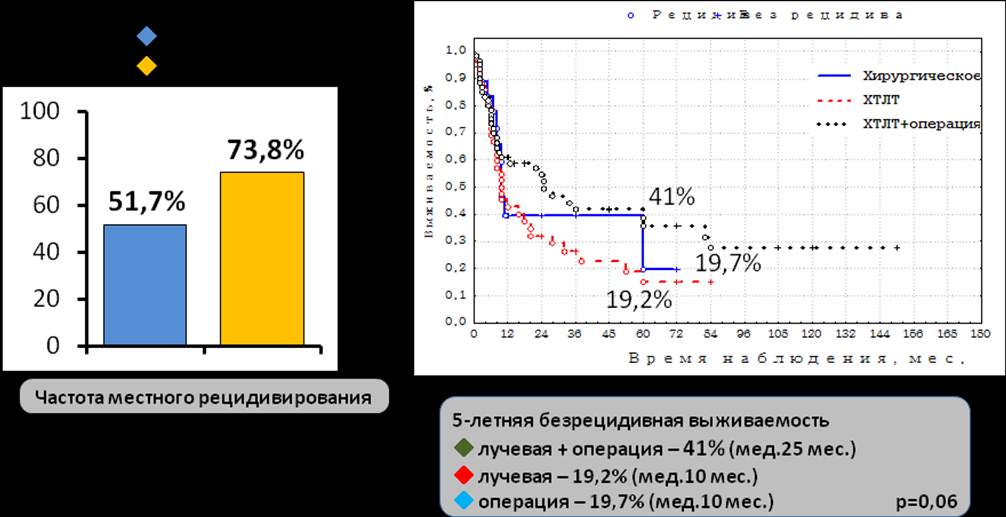
Рисунок 12. Отдаленные результаты лечения в группе эпителиальных злокачественных опухолей в зависимости от вида терапевтического воздействия.
Так 5-летняя безрецидивная выживаемость среди пациентов, подвергшихся хирургическим вмешательствам в группе комплексного лечения значительно превосходила аналогичные показатели в группах консервативного (самостоятельное химиолучевое) и самостоятельного хирургического лечения - 41,0±7,1% (медиана 25 мес.) против 19,2±6,7% (медиана 10 мес.) и 19,7±12,5% (медиана 10 мес.) соответственно, различие имеет тенденцию к достоверности (р=0,06).
Аналогичная тенденция наблюдалась и при статистическом анализе влияния указанного фактора для всех пациентов. Так частота реализации местных рецидивов в группе самостоятельной лучевой терапии оказалась значительно выше в сравнении с комбинированным лечением - 78,1% и 51,5% соответственно (р=0,01). При этом самое сильное влияние проведение комбинированного лечения оказывало в группе аденокистозного рака, где частота местного рецидивирования после проведения операции снижалась с 80% до 30,8% (р=0,08).
В группе костных сарком также наблюдалось значительное снижение частоты местного рецидивирования у оперированных пациентов с 87,5% до 67,9%, однако в связи с немногочисленностью выборки это различие оказалось недостоверным (табл.5). При этом группа костных сарком отличалась тем, что подключение лучевой/химиолучевой терапии к операции не приводило к улучшению отдаленных результатов лечения. Так общая 5-летняя выживаемость у больных с костными саркомами в группе самостоятельного хирургического лечения значительно превосходила аналогичные показатели в группах консервативного (химиолучевая) и комплексного (химиолучевая + операция) лечения - 23±15,6% (медиана 16,5 мес.) (операция) против 6,3±8,6% (медиана 16 мес.) (химиолучевая) и 0% (медиана 12 мес.) (химиолучевая+операция), при этом различие достигает тенденции к достоверности между группами самостоятельного хирургического и комплексного (химиолучевая + операция) лечения (р=0,1).
Наличие операции в общем лечебном плане не приводило к улучшению показателей безрецидивного течения и выживаемости в группах таких опухолей как: эстезионейробластома, мягкотканые саркомы, другие неэпителиальные злокачественные опухоли (злокач.гемангиоперицитома, злокач.параганглиома, меланома). Однако необходимо понимать, что хирургическое вмешательство является неотъемлемой частью лечения опухолей резистентных к проведению химиолучевой терапии.
Т
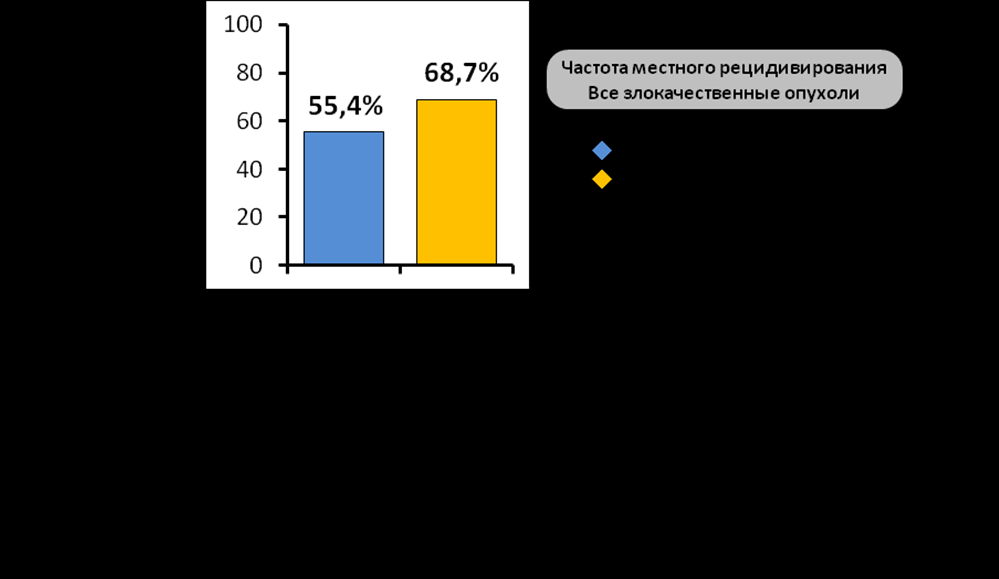 аблица 5. Отдаленные результаты лечения в зависимости от включения в терапевтических план хирургического вмешательства.
аблица 5. Отдаленные результаты лечения в зависимости от включения в терапевтических план хирургического вмешательства.Подключение химиотерапии к лучевой терапии также имело преимущество в сравнении с самостоятельной лучевой терапией, при этом наиболее значимое влияние указанный фактор имел также в группе эпителиальных злокачественных опухолей. Частота местного рецидивирования в группе самостоятельной лучевой терапии значительно превосходила аналогичный показатель в группе химиолучевой терапии – 90% против 59,1% соответственно (р=0,02) (табл.6). Различие оказалось достоверным и при подсчете общей выживаемости, так общая 5-летняя выживаемость в группе пациентов получивших самостоятельную лучевую терапию оказалась значительно ниже аналогичного показателя в группе химиолучевой терапии - 12,2±9,1% (медиана 14,6 мес.) против 37,4±13,1% (медиана 28,3 мес.) соответственно (р=0,03). Самое сильное влияние химиолучевая терапия оказывала в группе плоскоклеточного рака, где указанная тенденция проявлялась практически с одинаковыми показателями.
Подключение химиотерапии дополнительно к лучевой в группах эстезионейробластом и цилиндром не приводило к значимому улучшению отдаленных результатов лечения, несмотря на высокую общую эффективность проводимого лечения. Вероятной причиной подобной тенденции является небольшое количество пациентов в этих выборках, которое не позволяет проследить влияние этого фактора.
Т
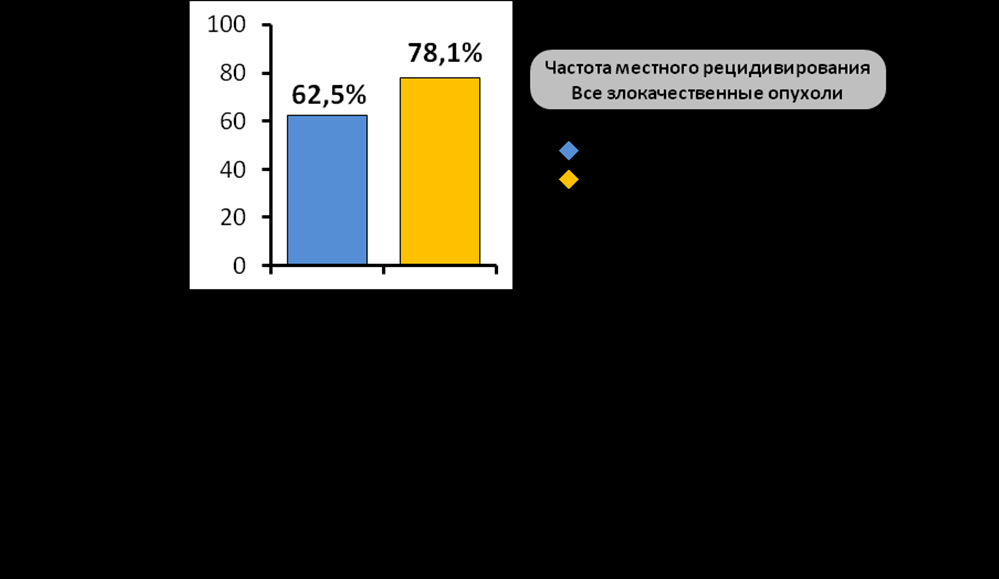 аблица 6. Отдаленные результаты лечения в зависимости от включения в терапевтических план химиолучевой терапии.
аблица 6. Отдаленные результаты лечения в зависимости от включения в терапевтических план химиолучевой терапии.Среди неэпителиальных опухолей химиолучевая терапия приводила к незначительному улучшению отдаленных результатов в группе мягкотканых сарком. Исключением стали пациенты со злокачественной шванномой, общая летальность для которой составила 83,3%, при отсутствии даже незначительных улучшений результатов лечения при подключении к операции химиолучевой терапии.
Интересно, что включение в лечебный план химиолучевой терапии достоверно не влияло на показатели частоты регионарного и отдаленного метастазирования во всех исследуемых группах.
Также интересным представлялось проследить влияние эскалации дозы лучевой терапии на отдаленные результаты лечения злокачественных опухолей поражающих основание черепа. Анализ показателей безрецидивного течения в зависимости от дозы лучевой терапии проводился в двух группах: а) доза лучевой терапии не превышала 60Гр (нерадикальная) и б) доза лучевой терапии превышала 60Гр (радикальная для опухолей поражающих основание черепа). При этом в большинстве исследуемых групп не было отмечено достоверных различий в показателях безрецидивного течения и выживаемости в зависимости от дозы полученной лучевой терапии (ниже или выше 60Гр), что может быть обусловлено преобладанием радиорезистентных опухолей.
Тем не менее, влияние указанного фактора сильнее прослеживалось в группе эпителиальных злокачественных опухолей. Так летальность в группе консервативного лечения у пациентов получавших лучевую терапию в дозах ниже 60Гр составила 90% и оказалась значительно выше аналогичного показателя в группе пациентов получавших лучевую терапию в дозах свыше 60Гр – 53,1%, различие статистически достоверно (р=0,03). Определенное влияние высоких доз лучевой терапии проявлялось и в группе мягкотканых сарком, однако оно не достигало статистически значимого уровня. Следует отметить, что в группе хондросаркомы, являющейся радиорезистентной опухолью, встречались случаи высокой эффективности лучевой терапии в радикальных дозах. Вероятно, этот вид опухоли все-таки обладает определенной чувствительностью к лучевому воздействию, которая проявляется на более высоких дозах.
При дальнейшем анализе наиболее значимыми прогностическими факторами, ухудшающими результаты лечения у больных с опухолевым поражением основания черепа, оказались следующие: наличие рецидивной опухоли, поражение регионарных лимфоколлекторов до начала основного лечения, поражение кавернозного синуса, локализация поражения в области заднего отдела основания черепа, комбинированное поражение сразу нескольких отделов основания черепа (табл.7).
Т
 аблица 7. Влияние различных прогностических факторов на отдаленные результаты лечения злокачественных опухолей поражающих основание черепа.
аблица 7. Влияние различных прогностических факторов на отдаленные результаты лечения злокачественных опухолей поражающих основание черепа.Так 5-летняя безрецидивная выживаемость в группе рецидивных опухолей подвергшихся лечению оказалась значительно ниже в сравнении с группой первичных опухолевых процессов – 7,9±5,7% (медиана 8 мес.) в сравнении с первичными опухолевыми процессами – 33,2±3,6% (медиана 12 мес.) соответственно, различие статистически достоверно (р=0,006). Подобное ухудшение было вызвано дальнейшим прогрессированием опухолевого процесса за счет увеличения частоты реализации местных рецидивов с 55,7% до 83,3% (р=0,001).
Поражение регионарных лимфоколлекторов до начала лечения вызывало значительное ухудшение общей 5-летней выживаемости в сравнении с группой пациентов без подобного поражения - 11,5±8% (медиана 12 мес.) и 40±3,9% (медиана 24 мес.) соответственно (р=0,042). Интересно, что основной причиной такого различия являлось увеличение частоты отдаленного метастазирования до 19,1% против 7,9% в группе без первичного поражения лимфоколлекторов, различие имеет тенденцию к достоверности (р=0,09).
Поражение кавернозного синуса было достоверно ассоциировано с высоким риском развития местных рецидивов. Так частота местного рецидивирования у пациентов с вовлечением в опухолевый процесс кавернозного синуса составила – 85,7% и оказалась значительно выше аналогичного показателя в группе пациентов без подобного вовлечения – 58,3%, различие статистически достоверно (р=0,04). При этом общая 5-летняя выживаемость у пациентов без поражения кавернозного синуса составила – 44,9±6,2% (медиана 11 мес.), а у пациентов с поражением кавернозного синуса – 38,8±3,8% (медиана 24 мес.), различие имеет тенденцию к достоверности (р=0,063).
Локализация опухолевого поражения изолированно в области переднего или среднего отдела основания черепа не имела прогностического влияния на отдаленные результаты лечения (по показателям летальности и местного рецидивирования). В то же время поражение заднего отдела было достоверно ассоциировано с высокой частотой местного рецидивирования по сравнению с опухолями других локализаций. Так 5-летняя безрецидивная выживаемость в группе пациентов с поражением переднего и среднего отделов основания черепа вне зависимости от общей распространенности опухолевого процесса составила 31%±3,4% (медиана 11 мес.), в то время как при поражении заднего отдела безрецидивная выживаемость достигла нулевого показателя, различие статистически достоверно (р=0,029).
Распространенность опухолевого поражения в области основания черепа также оказывала влияние на отдаленные результаты лечения. Наиболее выраженные различия наблюдались между группами больных с изолированным поражением переднего отдела и комбинированным поражением переднего и среднего отделов основания черепа. Частота прогрессирования опухолевого процесса также объективно повышалась с увеличением распространенности опухолевого процесса – 62,2% (изолированное поражение) против 79,6% (комбинированное поражение), различие статистически достоверно (р=0,02). Указанная тенденция оказывала достоверное влияние и на показатели выживаемости. Так безрецидивная 5-летняя выживаемость в группе пациентов с изолированным поражением переднего отдела основания черепа достоверно превосходила аналогичный показатель в группе с комбинированным поражением переднего и среднего отделов основания черепа – 37,6±4,7% (медиана 20 мес.) против 11,2±5,5% (медиана 10 мес.), различие статистически достоверно (р=0,028).
Интересно, что самые высокие показатели общей 5-летней выживаемости наблюдались в группе с изолированным поражением переднего отдела основания черепа – 43,3±5,1% (медиана 32 мес.), затем среднего – 39,2±7,9% (медиана 24,2 мес.), значительно ниже при комбинированном поражении переднего и среднего отделов – 16,1±7,1% (медиана 13 мес.), а при поражении заднего отдела и тотальном поражении сразу всего основания черепа вообще не достигали 5-летнего периода, различие имеет тенденцию к достоверности (р=0,063).
Интракраниальное распространение опухоли и поражение тканей орбиты не оказывали влияние на отдаленные результаты лечения. В то же время сохранение глазного яблока у пациентов с деструкцией костных стенок орбиты без признаков инфильтрации ее тканей не ухудшало показатели безрецидивного течения в группе оперированных больных. Так частота местного рецидивирования в группе пациентов, которым при поражении стенок орбиты без инфильтрации параорбитальных тканей выполнялись краниофациальные резекции с сохранением глазного яблока, составила - 52,2%, а в группе больных, которым выполнена экзентерация орбиты при аналогичном поражении стенок – 51,3%, различие не достоверно.
