Клинико-функциональная характеристикА и оптимизациЯ диагностики внебольничныХ пневмониЙ 14. 00. 05 внутренние болезни
| Вид материала | Автореферат диссертации |
- Клинико-функциональная характеристика и возможности восстановительного лечения больных, 382.92kb.
- Клинико-генетическое прогнозирование риска развития ишемической болезни сердца 14., 572.45kb.
- Клинико-диагностические критерии супрапищеводных синдромов гастроэзофагеальной рефлюксной, 329.02kb.
- Клиническая и морфофункциональная характеристика гастроэзофагеальной рефлюксной болезни, 290.17kb.
- Клинико-эпидемиологические особенности метаболического синдрома у больных профессиональными, 337.94kb.
- Расписание лекций по дисциплине «внутренние болезни», 62.03kb.
- Стратегия диагностики и лечения ишемической болезни сердца в торако-абдоминальной онкохирургии, 788.25kb.
- Эпидемиология, оптимизация диагностики и профилактики меланоцитарных дерматозов в республике, 282.66kb.
- Автореферат диссертации на соискание учёной степени, 320.76kb.
- Оптимизация системного подхода в реабилитации больных сахарным диабетом с высокой коморбидностью, 922.15kb.
Защита состоится « » _________ 2009 г. в ____00 часов на заседании диссертационного совета Д 208.096.02 при ГОУ ВПО Сибирский государственный медицинский университет Росздрава по адресу: 634050, г. Томск, Московский тракт, 2.
С диссертацией можно ознакомиться в научно-медицинской библиотеке ГОУ ВПО Сибирский государственный медицинский университет Росздрава
Автореферат разослан « » ___________ 2009 г.
Ученый секретарь
диссертационного совета Тюкалова Л.И.
ВВЕДЕНИЕ
Актуальность работы
Внебольничные пневмонии (ВП) относятся к числу наиболее распространенных заболеваний: в России заболеваемость, согласно расчетным данным, составляет 14-15‰, при этом общее число пациентов ВП ежегодно превышает 1,5 млн человек (А.Г. Чучалин, 2003). Высокая частота ВП отмечается и в других странах: в США диагностируется более 4 млн случаев в год, в странах Евросоюза – более 3 млн (M.А. Woodhead et al., 2005; L.A Mandell. et al., 2007).
Несмотря на достаточный арсенал современных эффективных антимикробных препаратов, а также определенную эффективность вакцин, ВП по-прежнему остается не только широко распространенным, но и потенциально жизнеугрожающим заболеванием (А.И. Синопальников, Р.С. Козлов, 2008; R. G. Wunderink, G.М. Mutlu, 2006; С. Feldman, et al., 2006; R. Fujiki et al., 2007; Z.U. Khan et al., 2007). Поэтому в настоящее время ВП рассматривается как общеврачебная проблема (А.Г. Чучалин, 2005; А.С. Димов, О.А. Волкова, 2008).
Главными условиями повышения качества медицинской помощи при ВП являются их своевременная диагностика и раннее начало антимикробной терапии (Дж Бартлетт, 2000; А.Г. Чучалин и соавт., 2006; J.M. Querol-Ribelles et al., 2008). Однако, объективные причины ошибок в распознавании ВП до сих пор достигают 73,5%, а уровни как гипо-, так и гипердиагностики превышают 30% (Л.И. Дворецкий, 2002; А.Л. Черняев, 2005). Поэтому проблема своевременной диагностики ВП остается весьма актуальной.
Известно, что ведущие клинические симптомы и синдромы в дебюте ВП могут значительно отличаться, а осложнения и полиорганная патология могут маскировать первые симптомы самой пневмонии. Следовательно, представляется обоснованным дифференцированное рассмотрение первоначальных клинических признаков ВП, и, прежде всего, доминирующей в структуре ВП – нетяжелой ВП, на долю которой приходится около 90% всех случаев заболевания (А.Г. Чучалин и соавт., 2002, 2006).
В литературных источниках последних десятилетий основное внимание уделяется проблемам этиологии и антимикробной терапии ВП, тогда как описанию клинических симптомов в плане предсказания их диагностической ценности посвящены немногочисленные работы (J.P. Metlay, M.J. Fine, 2003 и другие). И, кроме того, нами не обнаружено исследований, в которых клинические признаки ВП рассматривались бы дифференцированно в зависимости от степени тяжести, типа и распространенности легочного инфильтрата.
Поиск дополнительных методов, верифицирующих диагноз ВП, представляется чрезвычайно важным не только для диагностики ВП, но и для исключения синдромосходной очагово-инфильтративной патологии, в частности, немассивной ТЭЛА. В этом плане может быть перспективным использование радионуклидных методов исследования легких, но работы, посвященные этому вопросу, малочисленны и малосопоставимы (Р.И. Габуния, Г.А. Зубовский, 1985; А.В. Капишников, И.П. Королюк, 1999; М.П. Рубин и соавт., 2002; M.J. O' Doherty et al., 1989).
Исследование функции аппарата внешнего дыхания у пациентов ВП на протяжении последних десятилетий остается редко изучаемым разделом респираторной медицины. Однако, решение вопроса о том, какие показатели важны для характеристики респираторных нарушений при ВП, имеет практическое значение для формирования функционального компонента диагноза ВП, позволяющего, наряду с клиническим, наиболее полно оценить состояние пациента и проводимую терапию (Д. Комро и соавт., 1961; З.Р. Айсанов, 2002; Ф.Ф. Тетенев, 2005). Остается недостаточно изученной структура неэластического сопротивления легких при ВП, оценка которой затруднена в связи с недостаточной изученностью проблемы (Ф.Ф. Тетенев, 2001).
Острая воспалительная реакция при ВП обычно изучается по традиционным клинико-лабораторным показателям. Высокая оксигенация легочной паренхимы способствует активному развитию окислительных повреждений, и образующиеся при свободнорадикальном окислении активные формы кислорода и продукты липопероксидации, помимо прямого деструктивного действия на клетку, оказывают влияние на синтез провоспалительных цитокинов (Н.К. Зенков и соавт., 2001; С.К. Соодаева, И.А. Климанов, 2009). Однако ранее не проводилось изучение состояния системы прооксиданты-антиоксиданты при разных типах легочного инфильтрата и разной распространенности инфильтративного поражения легкого при ВП.
Поэтому, наряду с дальнейшим изучением этиологии, этиологической диагностики и антимикробной (этиотропной и эмпирической) терапии ВП, несомненно, адекватного внимания заслуживают проблемы оптимизации диагностики и верификации диагноза ВП, включая сюда дифференцирование с синдромосходной очагово-инфильтративной патологией, используя для реализации указанного возможности современных диагностических технологий.
Цель исследования
Установить клинико-функциональные и клинико-патофизиологические проявления внебольничных пневмоний, используя для этого возможности современных диагностических технологий, с целью совершенствования диагностики и определения клинического значения обнаруженных изменений при выборе тактики лечения.
Задачи исследования
- Систематизировать клинические проявления внебольничных пневмоний в зависимости от этиологии, типа легочного инфильтрата – альвеолярного и интерстициального и распространенности легочного инфильтрата – сегментарной и полисегментарной.
- Исследовать проявления окислительного дисбаланса на фоне острой воспалительной реакции у пациентов внебольничной пневмонией в зависимости от типа и распространенности легочного инфильтрата.
- Исследовать вентиляционную функцию легких и бронхиальное сопротивление у пациентов внебольничной пневмонией для оценки состояния бронхиальной проходимости, оптимизации дифференциальной диагностики в условиях сочетания с обструктивными заболеваниями легких и определения тактики лечения.
- Определить характер вентиляционно-перфузионных нарушений и состояние альвеолярно-капиллярной проницаемости у пациентов внебольничной пневмонией.
- Выявить особенности интегральной и регионарной механики дыхания при внебольничных пневмониях, сопоставить обнаруженные изменения с состоянием альвеолярно-капиллярной проницаемости легких.
- Оценить вовлеченность в патологический процесс, развивающийся у пациентов внебольничной пневмонией, интактного легкого.
- Оптимизировать дифференциально-диагностические критерии внебольничной пневмонии и тромбоэмболии дистальных ветвей легочной артерии для своевременного выбора тактики лечения.
Научная новизна
Впервые клинические проявления внебольничной пневмонии были проанализированы в зависимости от типа и распространенности легочного инфильтрата. Установлено, что более выраженные общевоспалительные и локальные клинические симптомы/синдромы заболевания отмечаются при альвеолярном типе легочного инфильтрата и полисегментарном инфильтративном поражении легкого по сравнению с интерстициальным типом и сегментарной распространенностью инфильтрата. Показано, что общепринятые критерии диагностики заболевания необходимо дополнить следующими: температура тела 37°-38°С, усиление голосового дрожания, ослабленное везикулярное дыхание, нейтрофилез в общем анализе периферической крови при альвеолярном типе легочного инфильтрата. Для диагностики пневмонии с интерстициальным типом легочного инфильтрата диагностическое значение имеют наличие приступообразного и малопродуктивного кашля и локально определяемых при физическом исследовании пациента жесткого везикулярного дыхания и сухих хрипов, которые свидетельствуют в пользу регионарного поражения бронхов в зоне легочной инфильтрации – локального бронхообструктивного синдрома, сопровождающего этот вариант пневмонии.
Впервые установлено, что интенсивность перекисного окисления липидов и компонентов антиоксидантной защиты у пациентов внебольничной пневмонией не зависит от выраженности клинической картины пневмонии при альвеолярном и интерстициальном типах легочного инфильтрата, а также сегментарной и полисегментарной его распространенности. Полученные результаты свидетельствуют, что в случае формирования острого воспаления легочной ткани решающим моментом становится вовлечение в патологический процесс хотя бы одного легочного сегмента.
Впервые проведено сопоставление регионарных значений общего неэластического сопротивления легких и регионарных величин альвеолярно-капиллярной проницаемости в дебюте внебольничной пневмонии. Установлено, что на фоне неравномерности регионарных значений общего неэластического сопротивления легких регистрируется однонаправленное повышение регионарных величин альвеолярно-капиллярной проницаемости. Это служит подтверждением наличия собственной механической активности легких, благодаря действию которой преодолевается значительная часть общего неэластического сопротивления легких.
Впервые при внебольничных пневмониях установлено, что интактное легкое так же, как и пораженное, вовлечено в патологический процесс. Доказательством служат следующие изменения, зарегистрированные в интактном легком: повышение проницаемости структур альвеолярно-капиллярной мембраны, повышение регионарных значений общего неэластического сопротивления на вдохе и выдохе, снижение интегрального градиента плотности после ингаляции бронхолитика.
Впервые показано, что интегральный градиент плотности по интактному легкому у пациентов внебольничной пневмонией характеризует состояние бронхиальной проходимости. Доказано, что между бронхиальным сопротивлением и градиентом плотности у пациентов внебольничной пневмонией существует достоверная обратная корреляционная связь.
Впервые разработаны диагностические критерии ХОБЛ, скрыто протекающей у пациентов внебольничной пневмонией и не установленной у них на предыдущих этапах доклинического обследования.
Получены приоритетные данные, свидетельствующие о генерализованном поражении структур альвеолярно-капиллярной мембраны у пациентов внебольничной пневмонией. Эти данные впервые позволили объяснить механизм повышения тканевого трения при внебольничных пневмониях, который заключается в инспираторно-экспираторном изменении кровенаполнения легких, включая дыхательные колебания степени выраженности альвеолярного и интерстициального воспалительного отека.
Впервые установлены дифференциально-диагностические сцинтиграфические критерии для внебольничной пневмонии и тромбоэмболии дистальных ветвей легочной артерии и показано, что основным отличительным сцинтиграфическим признаком заболеваний является состояние альвеолярно-капиллярной проницаемости, которая при внебольничной пневмонии значительно повышена, а при тромбоэмболии дистальных ветвей легочной артерии – замедлена по сравнению с аналогичными значениями у лиц контрольной группы.
Новизна исследований подтверждается получением 5 патентов на изобретения.
Практическая значимость работы
Полученные результаты проведенного клинического исследования у пациентов внебольничной пневмонией позволяют оптимизировать диагностику внебольничной пневмонии за счет дополнительного использования в качестве критериев диагноза пневмонии ряда локальных симптомов, свидетельствующих в пользу синдрома уплотнения легкого – отдельно или в комплексе признаков.
Для предварительного распознавания вероятности наличия у пациента внебольничной пневмонии пневмококковой или микоплазменной этиологии разработана клиническая математическая модель пациента пневмококковой и микоплазменной внебольничной пневмонией.
Полученные данные расширяют возможности своевременного выявления у пациентов внебольничной пневмонией ранее скрыто протекающей ХОБЛ.
На основе проведенных исследований разработан способ оценки бронхиальной проходимости у пациентов внебольничной пневмонией по величине интегрального градиента плотности по интактному легкому при проведении инспираторно-экспираторной компьютерной томографии высокого разрешения.
Полученные данные расширяют возможности диагностики внебольничной пневмонии и тромбоэмболии дистальных ветвей легочной артерии, а также их дифференциальной диагностики с помощью радионуклидных методов исследования. Выявленные нарушения вентиляции и перфузии, а также альвеолярно-капиллярной проницаемости, характерные для этих заболеваний, позволяют верифицировать диагноз на ранних этапах дифференциально-диагностического процесса, и, тем самым, способствовать своевременной коррекции этиотропной и патогенетической терапии заболеваний.
Предложен способ определения регионарной механической активности легких по наличию феномена извращения регионарной петли гистерезиса легких.
Основные положения, выносимые на защиту
- Клинические проявления общевоспалительной реакции и локальные признаки внебольничной пневмонии более выражены при альвеолярном типе легочного инфильтрата и полисегментарной его распространенности в отличие от одинаковой степени выраженности окислительного дисбаланса.
- Поражение структур альвеолярно-капиллярной мембраны при внебольничной пневмонии состоит в генерализованном двустороннем повышении ее проницаемости, сохраняющемся после полного клинико-рентгенологического выздоровления, и степень выраженности этого дефекта не зависит от типа и распространенности легочного инфильтрата.
- Бронхиальное сопротивление у пациентов внебольничной пневмонией не повышено, преимущественно остается в пределах низких значений нормы. Повышение общего неэластического сопротивления легких происходит за счет увеличения тканевого трения, которое связано с инспираторным повышением и экспираторным снижением содержания тканевой жидкости в легких, что, в свою очередь, обусловлено генерализованным повышением альвеолярно-капиллярной проницаемости.
- Собственная регионарная механическая активность легких у пациентов внебольничной пневмонией подтверждается, во-первых, наличием отрицательного регионарного гистерезиса легких, который поддерживает механический гомеостазис легких. Во-вторых, отсутствием повышения тканевого трения в зонах легких, где оно должно быть повышенным в соответствии с генерализованным повышением альвеолярно-капиллярной проницаемости, что объясняется повышенной механической активностью легких в этих зонах, благодаря действию которой преодолевается значительная часть общего неэластического сопротивления и, следовательно, тканевое трение.
- Интактное легкое, наряду с пораженным легким, вовлекается в патологический процесс при внебольничной пневмонии, поскольку в нем развиваются нарушения вентиляции и перфузии, диффузное повышение проницаемости альвеолярно-капиллярной мембраны, повышение регионарных значений общего неэластического сопротивления легких, парадоксальное снижение интегрального градиента плотности при проведении теста с бронхолитиком.
- Разнонаправленные изменения интегральных и регионарных значений альвеолярно-капиллярной проницаемости являются дополнительными критериями дифференциальной диагностики внебольничной пневмонии и тромбоэмболии дистальных ветвей легочной артерии, использование которых позволяет обеспечить раннее начало дифференцированной этиотропной и патогенетической терапии указанных заболеваний.
Внедрение результатов исследования
Результаты работы внедрены в лечебно-диагностическую практику клиники пропедевтики внутренних болезней ГОУ ВПО Сибирский государственный медицинский университет Росздрава, отделения радионуклидных методов исследования НИИ кардиологии CО РАМН, клиник ФГОУ ВПО «Томский военно-медицинский институт» МО РФ, ММЛПУ «Городская больница №1 г. Томска».
Результаты, выводы и практические рекомендации используются в педагогическом процессе на кафедре терапии усовершенствования врачей ФГОУ ВПО «Томский военно-медицинский институт» МО РФ, на кафедре пропедевтики внутренних болезней и кафедре лучевой диагностики и лучевой терапии ГОУ ВПО Сибирский государственный медицинский университет Росздрава.
Апробация работы
Основные материалы исследования доложены на I съезде терапевтов Сибири и Дальнего Востока (Новосибирск, 2005), Итоговых научно-практических конференциях ФГОУ ВПО «Томский военно-медицинский институт» МО РФ (2006, 2007, 2008, 2009), II Съезде кардиологов Сибирского Федерального округа (Томск, 2007), представлены на 16, 17 и 18 Европейских респираторных конгрессах (Мюнхен, 2006; Стокгольм, 2007; Берлин, 2008), XVI Национальном конгрессе по болезням органов дыхания и II Конгрессе евроазиатского респираторного общества (Санкт-Петербург, 2006), III Конгрессе Евроазиатского респираторного общества (Астана, 2007), XVII и XVIII Национальных конгрессах по болезням органов дыхания (Казань, 2007 и Екатеринбург, 2008), II и III Национальных конгрессах терапевтов (Москва, 2007 и 2008).
Публикации
Основные материалы исследования опубликованы в 96 печатных работах, из них 12 – полнотекстовые статьи в журналах из «Перечня…» ВАК РФ, в которых рекомендуется публикация основных результатов диссертаций на соискание ученой степени доктора наук, 13 – опубликованы в материалах зарубежных конгрессов и конференций. Получены 5 патентов РФ на изобретения.
Объем и структура диссертации
Работа изложена на 313 страницах машинописного текста, содержит 74 таблицы, иллюстрирована 34 рисунками и состоит из введения, 7 глав, обсуждения результатов, выводов, практических рекомендаций, списка литературы, который содержит 337 источников: 172 отечественных и 165 иностранных.
Материал и методы исследования
Исследование выполнено на базе кафедры и клиники пропедевтики внутренних болезней (зав. каф. – д-р мед. наук, профессор Ф.Ф. Тетенев), кафедры лучевой диагностики и лучевой терапии (зав. каф. – д-р мед. наук, профессор В.Д. Завадовская), кафедры биохимии (зав. каф. – д-р мед. наук, профессор В.Ю. Серебров), кафедры фундаментальных основ медицины (зав. каф. – д-р мед. наук, профессор Н.В. Рязанцева) ГОУ ВПО СибГМУ Росздрава; лаборатории радионуклидных методов исследования НИИ кардиологии СО РАМН (рук. – д-р мед. наук, профессор, член–корр. РАМН Ю.Б. Лишманов), клиник ФГОУ ВПО «Томский военно-медицинский институт» МО РФ, ММЛПУ «Городская больница №1» г. Томска.
Согласно цели и задачам работы было исследовано 303 человека: 200 пациентов внебольничной пневмонией (средний возраст – 36,8±0,9 года), 37 – тромбоэмболией дистальных ветвей легочной артерии (средний возраст – 44,3±13,8 года) и 66 – здоровых добровольцев, составивших контрольные группы. Все пациенты ВП и тромбоэмболией дистальных ветвей легочной артерии были госпитализированы в стационар в порядке экстренной помощи и обследованы согласно современным стандартам диагностики. Диагноз ВП, включая определение степени тяжести заболевания, устанавливался на основании общепринятых критериев диагностики заболевания (Клинические рекомендации. Пульмонология, 2005). Формулировка диагнозов соответствовала Международной статистической классификации болезней, травм и причин смерти Х пересмотра (МКБ-10, 1992 г.).
По результатам рентгенологического и КТ-исследования у 129 пациентов ВП был зарегистрирован альвеолярный тип легочного инфильтрата, у 64 – интерстициальный, у 7 – смешанный (И.Е. Тюрин, 2006). Распространенность легочного инфильтрата у 122 пациентов была сегментарная, у 78 – полисегментарная (от 2-х до 4-х сегментов включительно).
Пациентам ВП было проведено: 77 – спирография (из них: 60 – бодиплетизмография и 57 – компьютерная томография легких высокого разрешения), 31 – исследование биомеханики дыхания, 40 – определение газового состава артериальной крови, 35 – вентиляционно-перфузионная пульмоносцинтиграфия (из них: 24 с альвеолярным типом легочного инфильтрата, 11 – с интерстициальным), 30 – исследование окислительного статуса крови; 43 – спирометрия, бодиплетизмография и функциональная компьютерная томография легких высокого разрешения были выполнены дважды: до и после использования ингаляционного бронхолитика; 10 пациентам через 3 месяца после перенесенной ВП на фоне полного клинико-рентгенологического выздоровления повторно были выполнены спирография и бодиплетизмография, компьютерная томография легких высокого разрешения, вентиляционно-перфузионная пульмоносцинтиграфия (ВПП). ВПП была также выполнена 11 пациентам тромбоэмболией дистальных ветвей легочной артерии с односторонним характером поражения.
Критериями включения в исследование пациентов ВП являлись:
- Пациенты нетяжелой внебольничной пневмонией (А.Г. Чучалин и соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике, 2003).
- Возраст от 16 до 60 лет.
- Первые дни от дебюта заболевания (первые дни госпитализации).
- Согласие пациента на исследование (информированное согласие).
- Для проведения ВПП – некурящие пациенты с односторонним характером поражения и локализацией инфильтрации в нижней доле легкого.
Критериями включения в исследование пациентов тромбоэмболией дистальных ветвей легочной артерии являлись:
- Пациенты только тромбоэмболией дистальных ветвей легочной артерии.
- Возраст от 16 до 60 лет.
- Первые дни от дебюта заболевания (первые дни госпитализации).
- Согласие пациента на исследование (информированное согласие).
- Для проведения ВПП – некурящие пациенты с односторонней тромбоэмболией дистальных ветвей легочной артерии.
Контрольные группы составили здоровые добровольцы, из них: у 30 были выполнены спирография, бодиплетизмография, биомеханика дыхания; у 16 – ВПП; у 20 – исследование окислительного статуса крови.
Исследование выполнено на базе протокола, одобренного локальным комитетом по этике ГОУ ВПО СибГМУ Росздрава (заключение № 552 от 26. 12. 2006).
Вид исследования: проспективное когортное. Когорта формировалась во время исследования, прослеживалась до его окончания.
Методы исследования
Всем пациентам ВП было проведено клиническое обследование и наблюдение: проводился подробный сбор анамнеза, обращали внимание на начало развития заболевания, преобладающие симптомы/синдромы, и тщательное физическое обследование. Параклинические методы обследования соответствовали медико-экономическим стандартам для ВП.
Состояние окислительных процессов в организме оценивалось по показателям эритроцитов и плазмы крови. В плазме крови и мембранах эритроцитов определялось содержание конъюгированных диеновых структур гидроперекисей липидов (В.Б. Гаврилов, М.И. Мишкорудная, 1983) и концентрация ТБК-активных продуктов (Ю.А. Владимиров, А.К. Арчаков, 1972). В мембранах эритроцитов определялась активность Na+/K+-АТФазы (К.Ф.3.6.3.9) (D.J. Hanahan et al., 1973), в гемолизате эритроцитов – содержание восстановленного глутатиона (А.И. Карпищенко, 1999), белка биуретовым методом, а также оценивалась активность антиоксидантных ферментов (А.И. Карпищенко, 1999): каталазы, учитывая скорость утилизации Н2О2; супероксиддисмутазы (СОД), определяя торможение автоокисления эпинефрина (МР Biomedicals, США) при рН 10,2 (разведение гемолизата 1:100) и глутатионпероксидазы, оценивая катализ реакции взаимодействия глутатиона (МР Biomedicals, США) с гидроперекисью трет-бутила (МР Biomedicals, США) (разведение гемолизата 1:200).
Для определения газового состава крови пациентам ВП в первые сутки поступления в стационар проводилось определение раСО2, раО2, pH крови с помощью газоанализатора «Bayer Diagnostics 348» (Германия).
Исследование показателей вентиляции легких и бронхиального сопротивления (Raw) проводилось с помощью прибора «Masterlab pro» фирмы «Erich Jaeger» (Германия).
Показатели механики дыхания изучались в лаборатории кафедры пропедевтики внутренних болезней ГОУ ВПО СибГМУ Росздрава. Исследование показателей механики дыхания проводилось путем одновременной регистрации спирограммы, пневмотахограммы и транспульмонального давления (разница между давлением во рту и в нижней трети пищевода). Давление в пищеводе определялось с помощью специального зонда, введенного в нижнюю треть пищевода через нижний носовой ход (Ф.Ф. Тетенев, 1981). Разница внутрипищеводного давления и давления в ротовой полости определялась с помощью дифференцированного датчика давления ПДП 1000 МД. Пневмотахограмма регистрировалась с помощью пневмотахографа с интегратором.
Кроме интегральных показателей механики дыхания было выполнено исследование показателей регионарной механики дыхания посредством одновременной регистрации зональных реограмм вентиляции методом Е.А. Фринермана и транспульмонального давления. Регистрацию реограмм вентиляции осуществляли с помощью реографа РПГ4-01.
Вентиляционно-перфузионная пульмоносцинтиграфия проводилась на гамма-камере «Омега-500» фирмы «Technicare» (США-Германия). Регистрация и обработка изображений осуществлялась с помощью компьютерной системы «Сцинти» (НПО «Гелмос», Россия). Первоначально проводилась вентиляционная пульмоносцинтиграфия с 99мТс-Пентатех («Диамед», Россия) в статическом режиме в 4-х стандартных проекциях, затем – перфузионная по общепринятой методике с 99мТс-Макротех («Диамед», Россия). Рассчитывались вентиляционно-перфузионное соотношение (V/Q), верхушечно-основной градиент перфузии (U/L-Q) и вентиляции (U/L-V) легких, альвеолярно-капиллярная проницаемость (АКП).
Компьютерная томография органов грудной полости с применением методик высокого разрешения (КТВР) и использованием функциональных проб (инспираторно-экспираторная КТВР) была выполнена на спиральном компьютерном томографе «Xpress GX» фирмы Toshiba Medikal Systems (Япония) в режиме шагового сканирования с толщиной выделяемого слоя 1,5 мм в положении пациента лежа на спине. Сканирование выполнялось в фазу максимального задержанного вдоха и максимального задержанного выдоха на 3-х легочных уровнях: 2 см выше дуги аорты, на уровне бифуркации трахеи и на 2 см выше куполов диафрагмы, составляющих три изучаемые плоскости срезов. В зонах интереса на указанных уровнях от прикорневых до субплевральных отделов, исключая зоны корней легких, в интактном легком определялся градиент плотности (ГП) в качестве разницы показателей плотности легочной ткани в различные фазы дыхания.
Статистическую обработку полученных данных проводили при помощи программных пакетов STATISTICA 6.0. FOR WINDOWS, а также с применением программы статистического анализа SPSS 11.5 for WINDOWS. Проверку на нормальность распределения признака определяли с помощью W-теста Шапиро-Уилка. Проводился описательный и сравнительный анализ. Описательный анализ включал определение среднего арифметического значения (
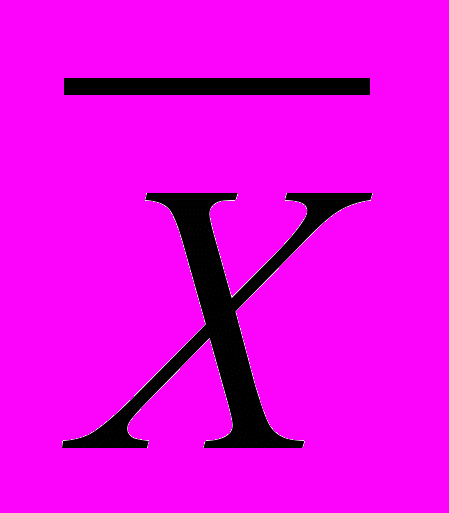 ), ошибки среднего значения (m), а также расчет квартилей (Me, Q1-Q3) для не нормально и не симметрично распределенных параметров. Сравнительный анализ основывался на определении достоверности разницы показателей по t-критерию Стьюдента для параметрических и по Z – критерию Манна-Уитни для непараметрических показателей. При количестве выборок более 2, во избежание эффекта множественных сравнений, применяли непараметрический аналог дисперсионного анализа – Н-критерий Крускала-Уоллиса, уровень статистической значимости попарных различий определяли по U-критерию Манна-Уитни. Для определения взаимосвязи между качественными переменными в связи с небольшим объемом выборок использовали точный критерий Фишера. Критический уровень значимости (р) при проверке статистических гипотез в исследовании принимался равным 0,05. Степень взаимосвязи между признаками оценивали, вычисляя коэффициент ранговой корреляции Спирмена (R). Построение математической модели проводилось на основе линейного дескриминантного анализа – логистической регрессии (метода многомерной статистики) (С. Гланц, 1999; В. Боровиков, 2001).
), ошибки среднего значения (m), а также расчет квартилей (Me, Q1-Q3) для не нормально и не симметрично распределенных параметров. Сравнительный анализ основывался на определении достоверности разницы показателей по t-критерию Стьюдента для параметрических и по Z – критерию Манна-Уитни для непараметрических показателей. При количестве выборок более 2, во избежание эффекта множественных сравнений, применяли непараметрический аналог дисперсионного анализа – Н-критерий Крускала-Уоллиса, уровень статистической значимости попарных различий определяли по U-критерию Манна-Уитни. Для определения взаимосвязи между качественными переменными в связи с небольшим объемом выборок использовали точный критерий Фишера. Критический уровень значимости (р) при проверке статистических гипотез в исследовании принимался равным 0,05. Степень взаимосвязи между признаками оценивали, вычисляя коэффициент ранговой корреляции Спирмена (R). Построение математической модели проводилось на основе линейного дескриминантного анализа – логистической регрессии (метода многомерной статистики) (С. Гланц, 1999; В. Боровиков, 2001). ОСНОВНЫЕ результаты исследования и их обсуждение
Клинико-функциональная характеристика внебольничных пневмоний
Частота регистрации основных клинических симптомов и синдромов в дебюте ВП у 200 пациентов свидетельствовала, что острое развитие клинической симптоматики было у 68,5%, причем, у всех пациентов заболевание начиналось с повышения температуры тела (в 56,5% случаев температура тела была выше 38˚С) и в 32% случаев с озноба, появления кашля (у 57,5% – продуктивного) с отделением мокроты (в основном слизистой и слизисто-гнойной – в 76,5% случаев), у 56% заболевших отмечалась одышка, у 42% – плевральные боли, у 85,5% – тахикардия, у 62,5% – тахипноэ. При этом перечисленные симптомы ВП у 81,5% пациентов возникали на фоне ОРВИ.
Локальные объективные проявления легочного инфильтрата заключались в усилении голосового дрожания (61,0%), притуплении перкуторного звука (69,0%), выявлении ослабленного и жесткого везикулярного дыхания и бронхиального дыхания (87,0%), влажных звучных мелкопузырчатых хрипов (60,5%) и крепитации (3,5%). Синдром уплотнения легкого был обнаружен только у 17,5% пациентов ВП и реже, чем отдельные субъективные и объективные признаки заболевания, что может оказывать влияние на затруднения, возникающие во время диагностического процесса.
В анализах периферической крови наблюдались лейкоцитоз (46,0%), реже – нейтрофилез (27,5%) и увеличение количества палочкоядерных нейтрофилов (19,0%). Также были варианты как одновременного повышения показателей (нейтрофильный лейкоцитоз и палочкоядерный сдвиг (3,5%), лейкоцитоз и изолированное увеличение сегментоядерных нейтрофилов (24,5%) или палочкоядерных нейтрофилов (4,5%)), так и изолированного увеличения сегментоядерных или палочкоядерных нейтрофилов на фоне нормального количества лейкоцитов или лейкопении (10,0% и 9,5% соответственно).
Несмотря на достаточно редкое обнаружение классических объективных признаков пневмонии, характеризующих синдром уплотнения легкого, у остальных пациентов ВП при физическом исследовании были найдены те или иные изменения, которые, в сущности, также свидетельствовали в пользу уплотнения легкого. Так, усиление голосового дрожания было обнаружено также часто, как притупление перкуторного звука (61,0% и 69,0%; р=0,349). Ослабленное везикулярное дыхание было зарегистрировано также часто, как и жесткое и бронхиальное дыхание вместе (46,0% и 41,0%; р=0,364), причем, определение его тем более важно, поскольку известно, что его появление может опережать на несколько часов другие аускультативные феномены над зоной воспалительного процесса (А.Г. Чучалин и соавт., 2002).
Изолированное увеличение количества сегментоядерных нейтрофилов встречалось чаще, чем палочкоядерный сдвиг (27,5% и 19,0% соответственно; р=0,048), и оба варианта – одинаково часто как на фоне нормального количества лейкоцитов, так и на фоне лейкопении.
Сопоставление полученных нами данных в аспекте их значения для диагностики ВП, согласно критериям определенного диагноза ВП (Клинические рекомендации. Пульмонология, 2005), позволяет считать обоснованным дополнительно использовать в качестве критериев диагноза следующие симптомы: температура тела 37-38°С, локально определяемые усиление голосового дрожания, ослабленное везикулярное дыхание, нейтрофилез за счет сегментоядерных нейтрофилов (рисунок 1).
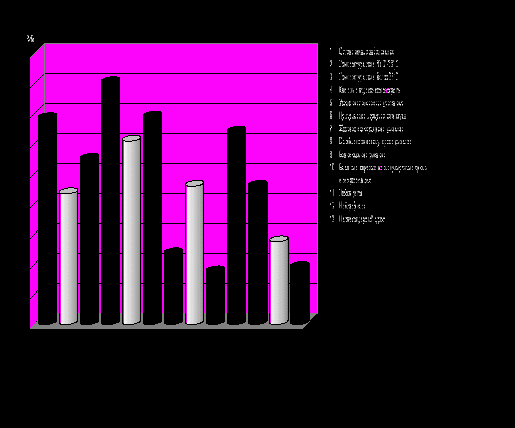
Рис. 1. Симптомы ВП, имеющие значение как критерии диагноза: 1 – острое начало заболевания; 2 – температура тела 37-38 °С; 3 – температура тела более 38 °С; 4 – кашель с отделением мокроты; 5 – усиление голосового дрожания; 6 – притупление перкуторного звука; 7 – жесткое везикулярное дыхание; 8 – ослабленное везикулярное дыхание; 9 – бронхиальное дыхание; 10 – влажные звучные мелкопузырчатые хрипы или крепитация; 11 – лейкоцитоз; 12 – нейтрофилез за счет сегментоядерных нейтрофилов; 13 – палочкоядерный сдвиг.
 – симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВП
– симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВПИсследование клиники ВП в зависимости от типа легочного инфильтрата – альвеолярного и интерстициального (ВПаи и ВПии) показало, что в дебюте заболевания более выраженные клинические проявления были характерны для ВПаи: заболевание чаще начиналось с озноба (32,6% и 12,5%, р=0,003), продуктивного кашля (68,2% и 34,4%, р<0,001), тахикардии; чаще регистрировались локальные проявления воспалительного инфильтрата в легких: усиление голосового дрожания (73,6% и 32,8%, р<0,001), изменения перкуторного звука (77,5% и 45,3%, р<0,001).
Если для ВПаи в дебюте заболевания более характерным было бронхиальное дыхание и влажные звучные мелкопузырчатые хрипы (р<0,001 и р=0,003), то для ВПии – жесткое везикулярное дыхание и удлиненный выдох, сухие хрипы (р=0,004 и р<0,001), приступообразный кашель (р<0,001). У пациентов ВПаи в 8 раз чаще определялся синдром уплотнения легких (р=0,001), а при ВПии – локальный бронхообструктивный клинический синдром (только над проекцией зоны инфильтрации легочной ткани), (р=0,04). Выраженное ускорение СОЭ и сдвиг лейкоцитарной формулы влево были характерны для ВПаи (р=0,003 и р=0,02).
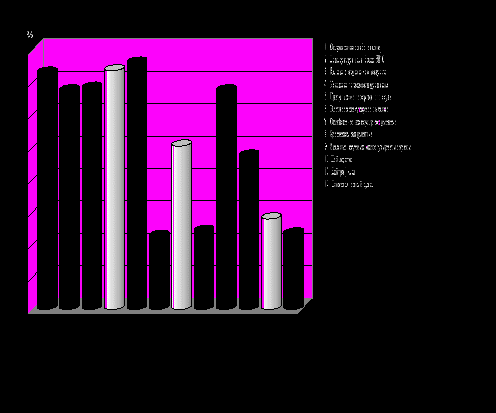
Рис. 2. Симптомы ВПаи, имеющие значение как критерии диагноза: 1 – острое начало заболевания; 2 – температура тела более 38 °С; 3 – кашель с отделением мокроты; 4 – усиление голосового дрожания; 5 – притупление перкуторного звука; 6 – жесткое везикулярное дыхание; 7 – ослабленное везикулярное дыхание; 8 – бронхиальное дыхание; 9 – влажные звучные мелкопузырчатые хрипы; 10 – лейкоцитоз; 11 – нейтрофилез за счет сегментоядерных нейтрофилов; 12 – палочкоядерный сдвиг.
 – симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВПаи
– симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВПаиТем не менее, если анализировать значение первоначальных симптомов ВПаи в соответствии с критериями определенного диагноза ВП (Клинические рекомендации. Пульмонология, 2005), то они весьма схожи с аналогичными признаками, характерными для ВП вообще (рисунок 2), включая симптомы, рекомендуемые нами дополнительно в качестве критериев диагноза заболевания.
Тогда как для ВПии дополнительное диагностическое значение имеют наличие приступообразного и малопродуктивного кашля (65,6%), и локально определяемых при физическом исследовании пациента жесткого везикулярного дыхания и удлиненного выдоха (45,3%), сухих хрипов (34,4%), которые свидетельствуют в пользу регионарного поражения бронхов в зоне легочной инфильтрации – локального бронхообструктивного клинического синдрома, сопровождающего этот вариант пневмонии (рисунок 3).
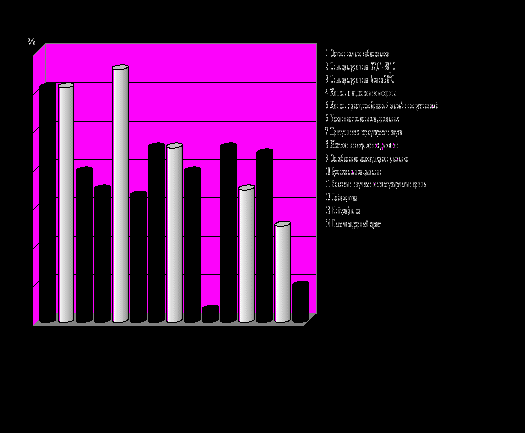
Рис. 3. Симптомы ВПии, имеющие значение как критерии диагноза: 1 – острое начало заболевания; 2 – температура тела 37-38 °С; 3 – температура тела более 38 °С; 4 – кашель с отделением мокроты; 5 – кашель приступообразный мало- и непродуктивный; 6 – усиление голосового дрожания; 7 – притупление перкуторного звука; 8 – жесткое везикулярное дыхание и удлиненный выдох; 9 – ослабленное везикулярное дыхание; 10 – бронхиальное дыхание; 11 – влажные звучные мелкопузырчатые хрипы; 12 – сухие хрипы; 13 – лейкоцитоз; 14 – нейтрофилез за счет сегментоядерных нейтрофилов; 15 – палочкоядерный сдвиг.
 – симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВПии
– симптомы, рекомендуемые дополнительно в качестве критериев диагноза ВПииКлиника ВП у пациентов с разной распространенностью легочного инфильтрата была более яркой у пациентов ВП при полисегментарном инфильтративном поражении легкого: чаще зарегистрированы острое начало заболевания, ознобы, одышка, тахипноэ, синдром уплотнения легких, повышение СОЭ более 40 мм/час. Причем, частота обнаружения симптомов нарастала при увеличении распространенности инфильтративного поражения легкого от 1 до 2 и более сегментов. Если при сегментарном поражении синдром уплотнения легкого определялся у 12,3% пациентов, то при поражении 2 сегментов – у 21,3%, а при поражении 3 и более сегментов – у 41,1%.
В дебюте ВП у 53 (26,5%) пациентов при физическом исследовании легких обнаружены аускультативные признаки умеренно выраженного бронхообструктивного синдрома (БОС): у 20 – генерализованного (включая зону инфильтративных изменений в легких) и у 33 – локального (только над проекцией зоны инфильтрации легочной ткани). Причем, в 60,4% случаев эти симптомы определялись только в клиностатическом положении тела и на форсированном выдохе.
Частота обнаружения клинического БОС зависела от типа инфильтративного поражения легкого: как генерализованный, так и локальный его варианты чаще встречались у пациентов ВПии (р=0,002 и р=0,040). При микоплазменной пневмонии, по сравнению с пневмококковой, он был зарегистрирован чаще и только локальный (28,1% и 12,9% соответственно; р=0,036). Здесь он сопровождался выраженным приступообразным кашлем и обнаруживался только при проведении аускультации легких в клиностатическом положении тела и на форсированном выдохе.
При генерализованном клиническом БОС 11 пациентов в анамнезе имели ХОБЛ, у остальных 9 было зарегистрировано снижение показателей скорости воздушного потока (ОФВ1 – 61,8 (53,5-88,8)% от должной величины) и повышение Raw (176,8 (138,8-233,5)% от должной величины). Причем, если у 2-х пациентов отмечалось небольшое повышение Raw (в дальнейшем впервые была диагностирована бронхиальная астма), то у остальных 7 пациентов Raw почти в 2 раза превышало значения должных величин, и у них впервые была диагностирована ХОБЛ. У всех пациентов ХОБЛ клинические признаки генерализованного БОС сохранялись вплоть до окончания лечения по поводу ВП. Обнаружение ранее скрыто протекающих хронических обструктивных заболеваний легких не зависело от типа легочного инфильтрата (р=0,067), его распространенности (р0,99), этиологии (пневмококковой или микоплазменной) пневмоний (р=0,147).
Что касается локального клинического БОС, то клиническое наблюдение в период лечения пациентов по поводу ВП показало прогрессивное снижение и полное исчезновение его клинических признаков, в связи с чем, дополнительного обследования им не потребовалось.
Возбудители внебольничной пневмонии были установлены у 161 (80,5%) из 200 пациентов: Str. рneumoniae – у 124 (62%) пациентов; M. рneumoniae – у 32 (16%), H.influenzae – у 5 (2,5%).
Не преувеличивая значение клинико-рентгенологических особенностей ВП в расшифровке их этиологической принадлежности, тем не менее, было обращено внимание, что учет условий возникновения и клинических признаков заболевания может предоставить определенные этиологические ориентиры (А.Г. Чучалин и соавт., 2006). Указанное будет способствовать рациональному выбору стартовой эмпирической антибактериальной терапии, так как среди пациентов нетяжелой ВП основной анализ в большинстве случаев проводится между первыми двумя возбудителями, преобладающими в этиологической структуре ВП (Дж. Бартлетт, 2000; Л.И. Дворецкий, 2002), в силу чего выбор осуществляется между аминопенициллинами и макролидами (А.И Синопальников, Р.С. Козлов, 2007; E. Robenshtok et al., 2008). Кроме того, в последние годы широко дискутируется вопрос о повышении устойчивости пневмококка к макролидам и необходимости ограничения необоснованного их применения (В.Е. Ноников, 2008). Поэтому представляется оправданным, что у данной категории пациентов для реализации указанных целей можно ориентироваться на вероятную этиологию ВП (K. Stralin, 2007).
Исследование показало, что при пневмококковой ВП чаще, чем при микоплазменной, были зарегистрированы озноб в начале заболевания (33,1% и 9,4%; р=0,008), продуктивный кашель (70,9% и 6,3%; р<0,001), плевральные боли (47,6% и 15,6%; р=0,001), локальные физические признаки пневмонии: усиление голосового дрожания (69,4% и 37,5%; р=0,001), притупление перкуторного звука (74,2% и 37,5%; р<0,001), бронхиальное дыхание (21% и 6,2%; р=0,04), влажные звучные мелкопузырчатые хрипы (63,7% и 43,8%; р=0,040) и синдром уплотнения легкого (в 3,4 раза). Все это достаточно закономерно, так как при пневмококковой ВП почти в 2,5 раза чаще был обнаружен альвеолярный тип легочного инфильтрата, тогда как при микоплазменной – преобладал интерстициальный. Однако, и при микоплазменной ВП имелись характерные признаки: приступообразный мало- или непродуктивный кашель (93,7% и 29,0%; р<0,001), локально определяемое жесткое везикулярное дыхание и удлиненный выдох (50,0% и 25,0%; р=0,038), сухие высокие хрипы (40,6% и 14,5%; р=0,001), свидетельствующие в пользу локального клинического БОС.
Учитывая полученные данные, для принятия решения о наличии пневмококковой, либо микоплазменной ВП было выполнено построение клинической математической модели – решающего правила для определения вероятности наличия пневмококковой и микоплазменной ВП, были определены значения весовых коэффициентов при наличии/отсутствии клинического признака заболевания.
Исследование вентиляционной функции легких выявило у 48,1% пациентов ВП нарушения вентиляции по обструктивному, рестириктивному и смешанному типам. Причем, в 30% случаев нарушения вентиляционной функции были обструктивного типа, что, однако, не сопровождалось повышением Raw за исключением случаев, когда у пациентов ВП при проведении физического обследования обнаруживался генерализованный клинический БОС. Как было показано нами ранее, в дебюте ВП на снижение вентиляционных показателей оказывают влияние внелегочные факторы, обусловленные воспалительной интоксикацией (Т.Н. Бодрова, Ф.Ф. Тетенев, Т.С. Агеева и соавт., 2006). В связи с чем, у пациентов ВП не следует связывать обструктивные нарушения вентиляции с бронхоспазмом. Встречающаяся в литературе интерполяция понятий: обструктивный тип нарушения вентиляции и истинная обструкция при ВП, как и при других заболеваниях – неправомерна, поскольку тип нарушения вентиляционной функции легких не свидетельствует о наличии бронхиальной обструкции. Поэтому для диагностики нарушения бронхиальной проходимости у пациентов ВП нельзя опираться на скоростные показатели вентиляционной функции легких, а использовать с этой целью измерение Raw.
Изменения газового состава артериальной крови были зарегистрированы у 35% (14 из 40) пациентов ВП в остром периоде заболевания: у 3 была обнаружена гипоксемия (раО2 – ниже 80 мм рт.ст.), у 1– сочетание гипоксемии и гипокапнии, у 10 – гипокапния (уровень раСО2 был ниже 35,5 мм рт.ст.). В 4 первых случаях ВП была отнесена к тяжелой степени, что позволило своевременно внести необходимые коррекции в проводимую терапию. Случаи, когда ВП сопровождалась гипокапнией, свидетельствовали об избыточной вентиляции альвеол и диффузионном виде недостаточности внешнего дыхания (М.А. Гриппи, 2001).
В заключение необходимо отметить, что практическое значение использования представленных данных состоит в возможности оптимизации, во-первых, клинической диагностики ВП, во-вторых, стартовой эмпирической антибактериальной терапии ВП пневмококковой и микоплазменной этиологии. Первое в большей степени касается ВПии и ВП с сегментарной распространенностью инфильтрата. Причем, обнаружение локального клинического БОС требует коррекции дальнейшего диагностического поиска в плане выявления ВПии, а предположение о вероятной этиологии ВП позволяет определить вариант стартовой антибактериальной терапии. Для формирования функционального компонента клинического диагноза у пациентов ВП имеет значение исследование газового состава артериальной крови и Raw.
Окислительный дисбаланс на фоне острой воспалительной реакции при внебольничных пневмониях
В дебюте ВП у всех пациентов в крови отмечались признаки активации свободно-радикальных процессов, выражающиеся в увеличении концентрации продуктов перекисного окисления липидов (ПОЛ). При этом количество конъюгированных диеновых структур гидроперекисей липидов составило в плазме крови – 0,37 (0,33-0,39) мкмоль/л, в мембранах эритроцитов – 2,58 (2,39-2,89) у.е./мг, а содержание ТБК-активных продуктов, соответственно 0,564 (0,523-0,609) мкмоль/л и 10,99 (6,44-21,31) нмоль/мг (p<0,001 – для всех). Стимуляция окисления липидов в мембранах эритроцитов отрицательно сказывалась на функциональной активности маркерного липид-зависимого фермента плазматической мембраны клетки Na+/K+-АТФазы: отмечено ингибирование его каталитической активности – 0,021 (0,009-0,038) мкМ Рi/ч·мг, что, вероятно, являлось следствием окисления SH-групп активного центра фермента активными формами кислорода (АФК) и продуктами ПОЛ (Н.К. Зенков и соавт., 2001).
Активация процессов ПОЛ в клеточных мембранах у пациентов ВП регистрировалась при сочетанном угнетении системы антиоксидантов в эритроцитах, о чем свидетельствовало снижение концентрации восстановленного глутатиона – 0,089 (0,059-0,091) мкМ/г (p<0,001) и активности ключевых антиоксидантных ферментов: СОД – 0,13 (0,10-0,15) ЕД/г (p<0,001), каталазы – 5,41 (4,68-5,89) мМ/мин·г (p<0,001) и глутатион-пероксидазы – 0,701 (0,628-0,742) нмоль/(мин·мг) (p<0,001). Снижение содержания SH-формы глутатиона в эритроцитах при ВП отмечалось, вероятно, вследствие расхода его восстановительного потенциала глутатион-зависимыми ферментами, а также использования в реакциях защиты от АФК в качестве донора SH-групп. При этом было показано, что выраженность накопления продуктов окисления липидов в эритроцитах и плазме крови и степень угнетения активности антиоксидантной защиты в эритроцитах при ВП была одинаковой при ВПаи и ВПии, а также при разной распространенности легочного инфильтрата.
Известно, что активация процессов окисления липидных и белковых молекул в клетке и ее мембранах, а также в плазме крови при сочетанном угнетении системы антиоксидантов, указывает на развитие окислительного стресса во всем организме (В. Halliwell, J.M.C. Gutteridge, 1999; Ю.А. Владимиров и соавт., 2003; Е.Б. Меньщикова и соавт., 2008). Принимая во внимание результаты исследования, можно заключить, что в дебюте ВП, независимо от типа легочного инфильтрата и его распространенности, имелись одинаковые молекулярные основы, определяющие изменения структурно-функционального состояния и проницаемости мембран клеток.
Нарушения вентиляции и перфузии легких, проницаемость альвеолярно-капиллярной мембраны при внебольничных пневмониях
При ВП с односторонней и нижнедолевой локализацией легочного инфильтрата нарушения соотношения вентиляции и перфузии отмечались в пораженном легком (по сравнению с группой контроля). Эти изменения при ВПаи, независимо от распространенности поражения легочной ткани, были однонаправленные – в сторону повышения V/Q, U/L-V, U/L-Q. В интактном легком всегда отмечалось небольшое снижение V/Q, а U/L-V во всех случаях оставался в пределах нормальных значений. Только при ВПии были зарегистрированы иные изменения: нормальные значения U/L-V в пораженном легком при повышении U/L-Q в интактном легком.
О состоянии структур альвеолярно-капиллярной мембраны можно судить по исследованию альвеолярно-капиллярной проницаемости (АКП). При пневмониях АКП оценивалась в единичных публикациях посредством метода динамической сцинтиграфии легких, и были получены противоречивые данные (P.N. Lankin, et al., 1980; M.J. O' Doherty et al., 1997). Не выполнялись такие исследования при разных типах и распространенности легочного инфильтрата.
При ВП были выявлены следующие изменения интегральных значений АКП (таблица 1): в пораженном и в интактном легких, на 10-й и на 30-й мин исследования, было обнаружено повышение АКП.
Таблица 1
Интегральные значения АКП у пациентов ВП (Me, (Q1-Q2), p)
| Значения АКП для пораженного легкого (ПЛ) и интактного легкого (ИЛ) | Пациенты ВП(n=35) | Контрольнаягруппа (n=20) | p1-2 | |
| АКП, % (10 мин) | ПЛ | 20,90 (17,60-24,85) | 9,80 (8,90-11,80) | <0,001 |
| ИЛ | 17,90 (16,00-21,85) | 9,80 (8,90-11,80) | <0,001 | |
| АКП, % (30 мин) | ПЛ | 33,70 (30,33-41,70) | 16,50 (13,73-16,70) | <0,001 |
| ИЛ | 29,55 (24,48-36,63) | 16,50 (13,73-16,70) | <0,001 | |
