Наибольший вред приносит электрохимическая коррозия
| Вид материала | Документы |
- 18 Коррозия электрохимическая и химическая, 45.45kb.
- Данная статья посвящена вопросу преподаванию литературы и искусства в соотвествии, 58.24kb.
- Xii всероссийская конференция молодых исследователей «шаг в будущее» муниципальное, 206.03kb.
- Лекция коррозия металлов. Способы борьбы с нею, 54.35kb.
- Тема: «Рейтинг вредных продуктов», 132.08kb.
- Коррозия металлов, 40.27kb.
- Реферат На тему: Коррозия металлов, 45.45kb.
- Аннотация дисциплины «коррозия и защита металлов», 13.74kb.
- Законом обязанность возмещения вреда может быть возложена на лицо, не являющееся причинителем, 232.66kb.
- Конкурс школьных работ «Питайся правильно будешь здоров!», 65.33kb.
Наибольший вред приносит электрохимическая коррозия. Электрохимической коррозией называют разрушение металла в среде электролита с возникновением внутри системы электрического тока. В этом случае наряду с химическими протекают и электрические процессы (перенос электронов от одного участка к другому)
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный – окисление металла:
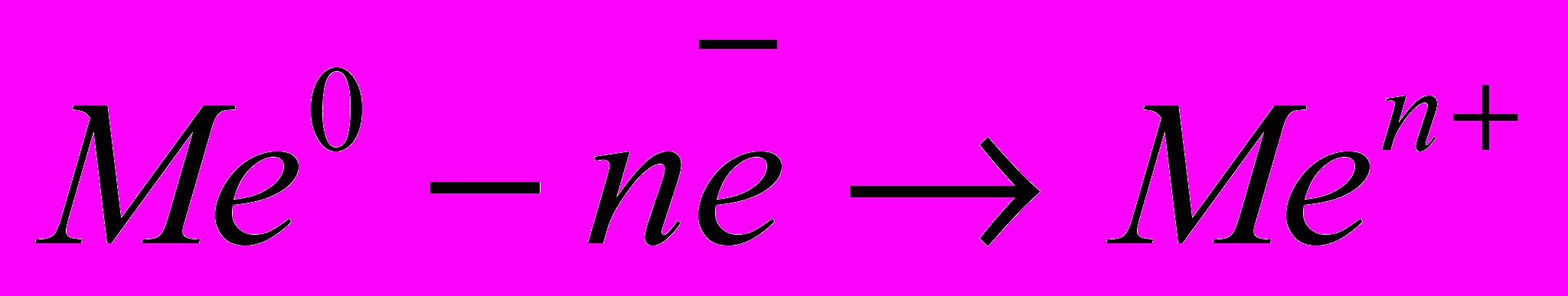
и катодный – восстановление ионов водорода:
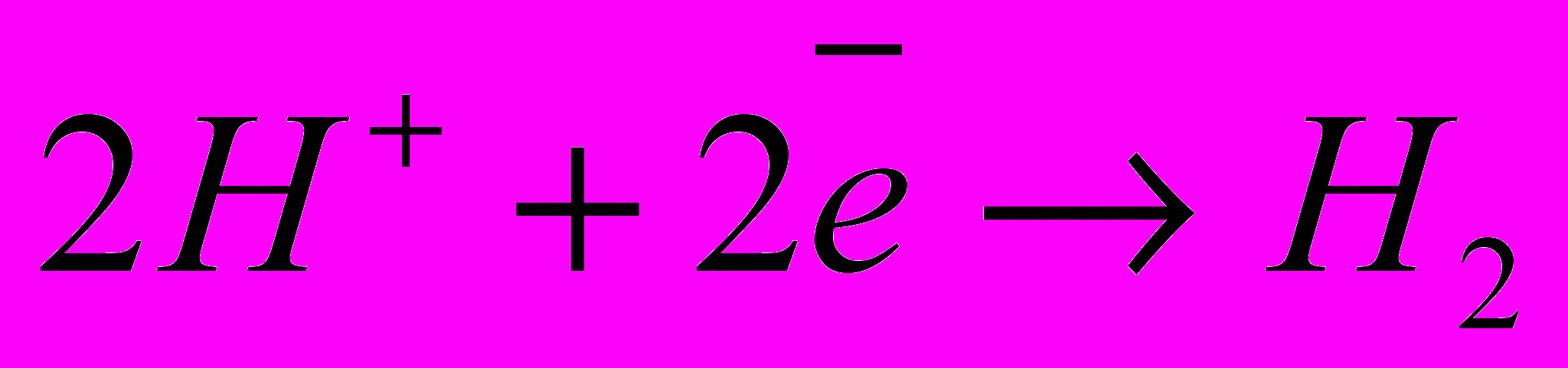
или молекул кислорода, растворенного в воде:
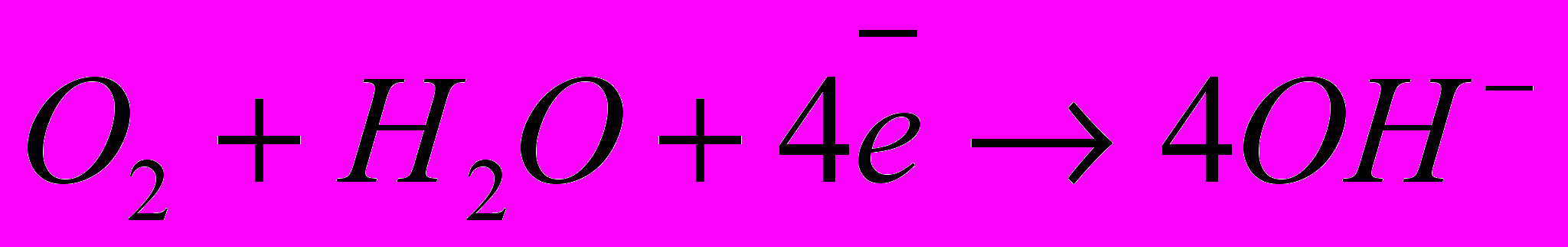
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. Коррозия, протекающая с выделением водорода, называется коррозией с водородной деполяризацией. В кислой среде деполяризатом является водород. Коррозия, протекающая с поглощением кислорода называется коррозией с кислородной деполяризацией. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Коррозия металлов причиняет огромный ущерб. Радикальным методом борьбы с коррозией является изыскание коррозионностойких металлов, устойчивых в данной агрессивной среде. А также замена их коррозионностойкими неметаллическими материалами. Однако полностью заменить металлы неметаллическими материалами невозможно, поэтому насущная задача заключается в резком уменьшении или сведении к минимуму коррозии посредством применения методов защиты металлов.
К основным видам защиты металлов от коррозии относятся следующие:
- Изменение свойств коррозионной среды.
- Изоляция металла от коррозионной среды. Защитные покрытия.
- Электрохимические методы защиты.
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение
Цинк имеет более отрицательный потенциал (–0,763 В), чем кадмий ( 0,403 В), поэтому он является анодом, а кадмий – катодом.
Анодный процесс:
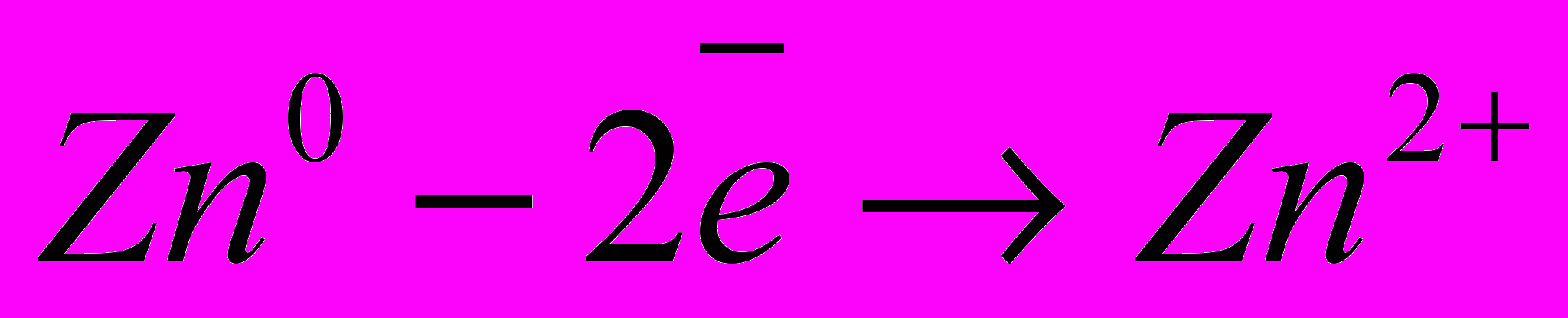
катодный процесс:
в кислой среде
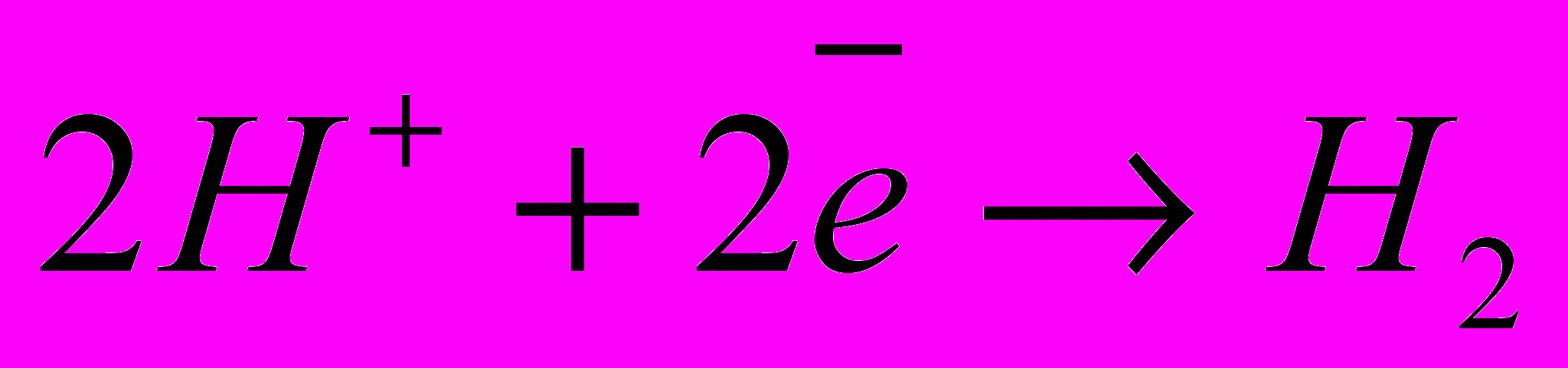
в нейтральной среде
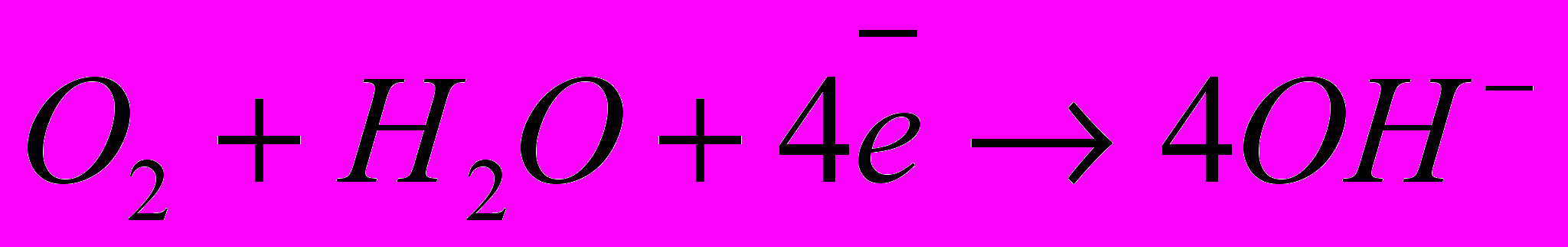
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2.
Контрольные ВОПРОСЫ
- Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
- Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составьте электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
- Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
- Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
- В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
- Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
- В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
- Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
- Какое покрытие металла называется анодным, а какое – катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
- Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
- Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
- Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
- Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
- Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
- Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
- Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
- В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
- Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
- Серебряную и цинковую пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на этих пластинках. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
- Приведите примеры защиты металлов от коррозии.
- Одно железное изделие покрыли никелем, другое – оловом. Какие это покрытия? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия в кислой среде. В каком случае коррозия будет происходить активнее?
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары олово-медь. Какие продукты коррозии образуются в первом и во втором случаях?
- Свинцовую и цинковую пластинки опустили в раствор нитрата серебра. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на этих пластинках. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
- Ряд судовых конструкций содержат пары материалов, разнородных в электрохимическом отношении. Почему подобная практика не рекомендуется? Ответ проиллюстрируйте конкретными примерами.
- Почему в конструкциях, омываемых водой, не следует одновременно применять детали из железа и алюминиевых сплавов? Приведите схему коррозии в случае небрежной эксплуатации таких деталей. Составьте электронные уравнения анодного и катодного процессов.
- В каком случае будет быстрее разрушаться цинковое покрытие: а) железного изделия; б) кобальтового изделия? Почему? Напишите электронные уравнения анодного и катодного процессов, происходящих при коррозии в кислой среде.
- Трущиеся поверхности гребных валов защищают от коррозии, применяя облицовки из бронзы (сплава меди с оловом). Составьте схему коррозии стального вала в морской воде при появлении в облицовке трещин.
- Приведите примеры катодного и анодного покрытия для кобальта. Составьте электронные уравнения анодных и катодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
Комплексные соединения
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные.
Понятие «комплексные соединения» трактуется по-разному. Чаще дается следующее определение: комплексные соединения это вещества, содержащие «центральный атом» – комплексообразователь, с которым в неионогенной связи находится определенное количество атомов или молекул, составляющих внутреннюю сферу.
При написании формул таких соединений комплексные ион или молекулы заключают в квадратные скобки, а справа вверх (для ионов) указывают их заряд (например, [Ag(NH3)2]+). Часть комплексного соединения, заключенная в квадратные скобки, называется внутренней сферой. Ионы, находящиеся снаружи, образую его внешнюю сферу.
Центральный ион внутренней сферы, удерживающий около себя определенное число других ионов или молекул, называется комплексообразователем. С комплексообразователем связаны (координированы) полярные молекулы или ионы, которые называются лигандами (или аддендами).
Способность к образованию комплексных соединений связана с электронным строением атомов. Особенно легко образуют комплексные ионы элементы d-семейства, например:
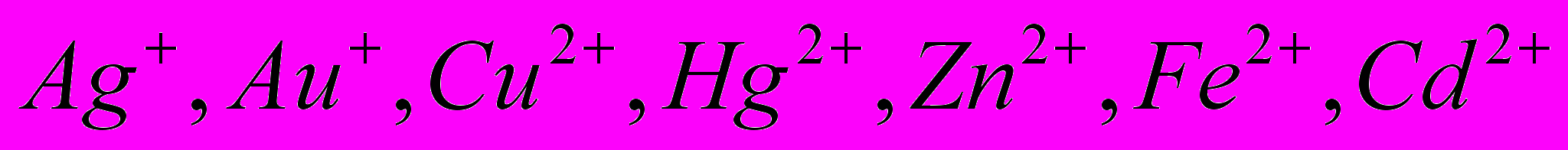 и др. Однако роль комплексообразователей могут играть А1, В и некоторые неметаллы например, кремний в комплексной соли K2[SiF6].
и др. Однако роль комплексообразователей могут играть А1, В и некоторые неметаллы например, кремний в комплексной соли K2[SiF6].В качестве лигандов (аддендов) выступает целый ряд отрицательно заряженных ионов, например:
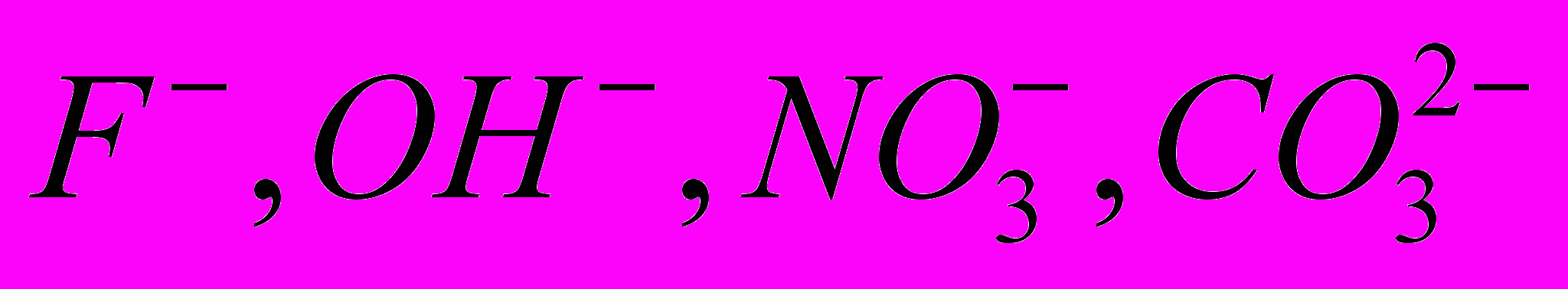 и др. Лигандами могу служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.
и др. Лигандами могу служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.Количество химических связей между комплексообразователем и лигандами определяет координационное число комплексообразователя. Если один лиганд образует с комплексообразователем одну связь, то координационное число совпадает с количеством лигандов. Такие лиганды называются монодентантными. Например, лиганды Н2О и С1– – монодентантные, координационное число центрального иона Сг3+ в соединении [Сг(Н2О)5С1]С13 равно 6.
Лиганд, образующий с комплексообразователем две связи, называется бидентантным. Например, оксалат-ион
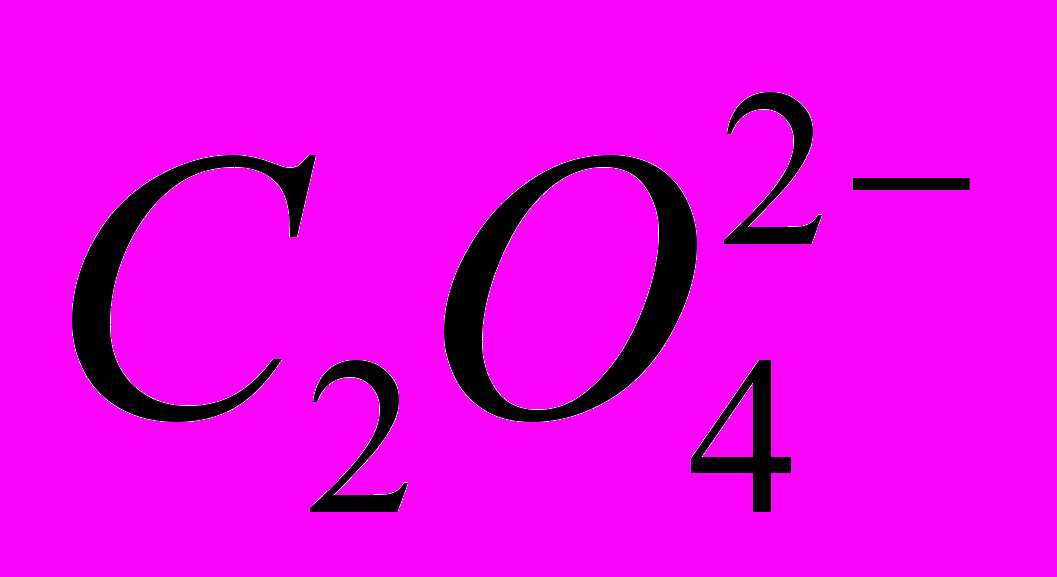 – бидентантный и образует с катионом Сu2+, координационное число которого равно 4, соединение K4[Cu(C2O4)2]. В таблице приведены характерные координационные числа для некоторых комплексообразователей:
– бидентантный и образует с катионом Сu2+, координационное число которого равно 4, соединение K4[Cu(C2O4)2]. В таблице приведены характерные координационные числа для некоторых комплексообразователей:| Комплексообразователи | Характерное координационное число |
| Cu+, Ag+, Au+ | 2 |
| Cu2+, Hg2+, Pb2+, Pt2+, Pd2+ | 4 |
| Ni2+, Ni3+, Co3+ | 4 и 6 |
| Fe2+, Fe3+, Pt4+, Pd4+, Si4+ | 6 |
Координационное число зависит в основном от природы комплексообразователя и лигандов, а также от условий образования комплексного соединения. Большую роль играют объемы (ионные и/или молекулярные) комплексообразователя и лигандов, их заряды и поляризационные взаимодействия.
При составлении названия комплексного соединения используются следующие правила:
1) если соединение состоит из комплексного иона и ионов внешней сферы, т. е. является комплексной солью, то первым называется анион в именительном падеже, а затем катион в родительном падеже;
2) при названии комплексного иона сначала указываются лиганды, затем комплексообразователь;
3) молекулярные лиганды соответствуют названиям молекул (кроме воды и аммиака), для их обозначения применяются термины «аква» и «аммин».
К анионным лигандам добавляют окончание "о", например:
F- – фторо.
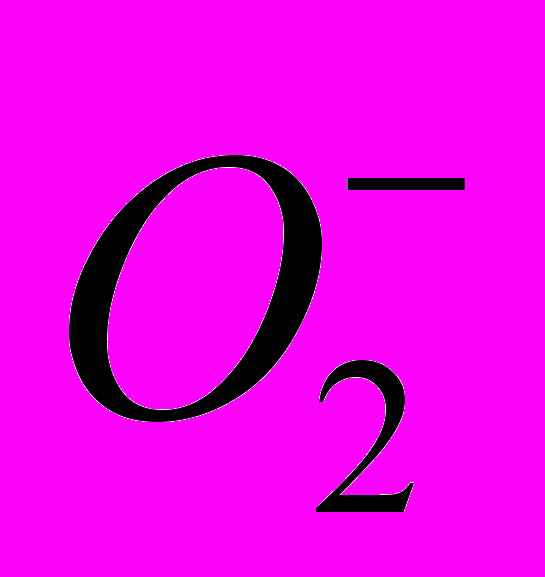 – оксо, CNS- – родано, Cl- – хлоро,
– оксо, CNS- – родано, Cl- – хлоро, 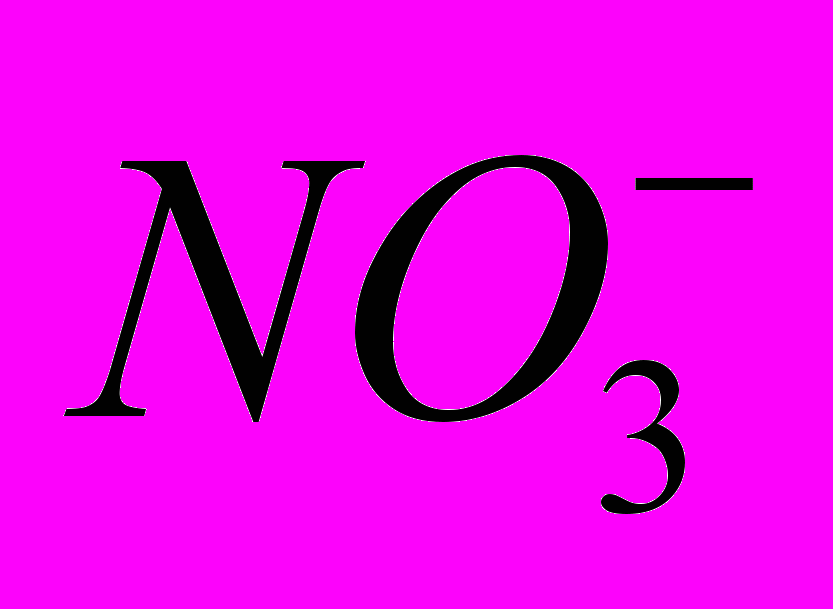 – нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано,
– нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано, 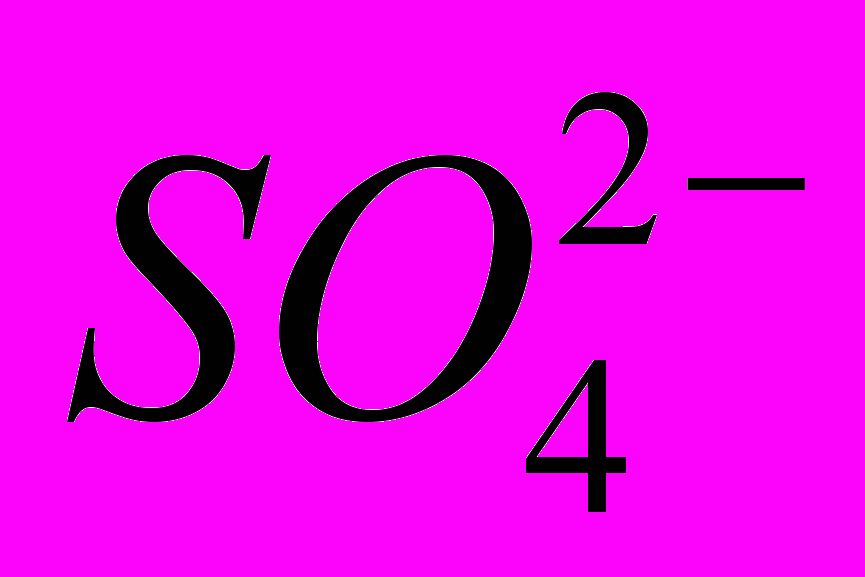 – сульфато,
– сульфато, 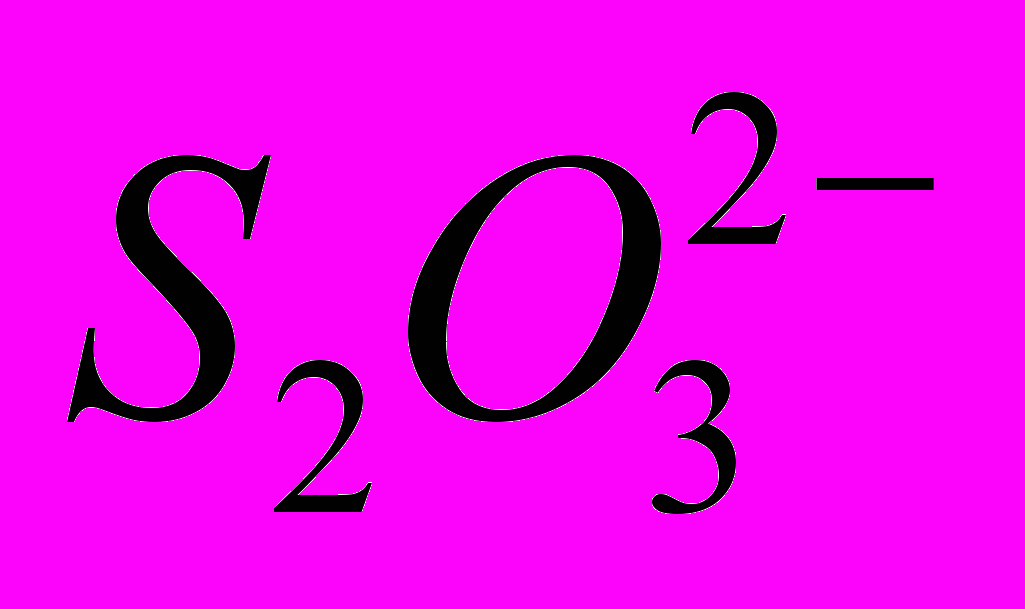 – тиосульфато,
– тиосульфато, 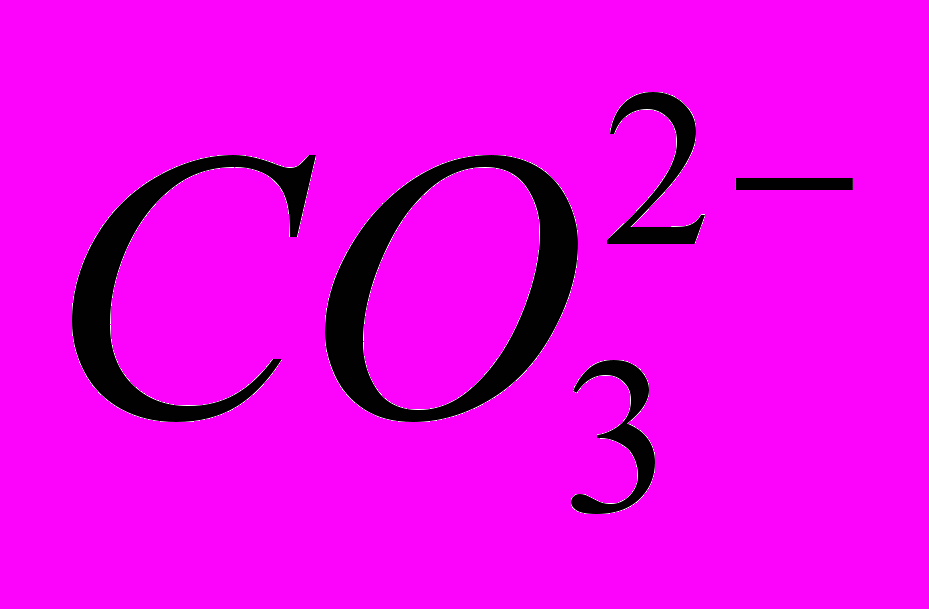 – карбонато,
– карбонато, 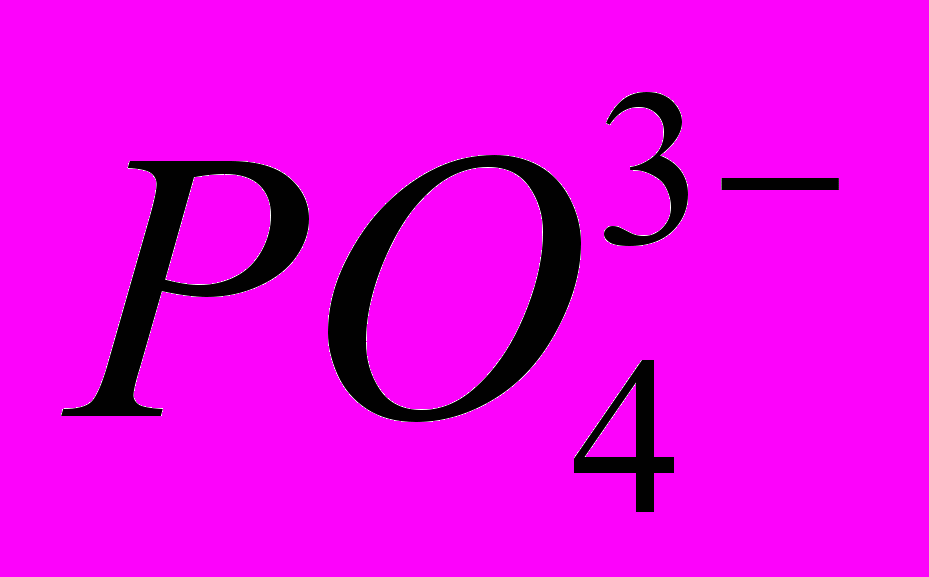 – фосфато,
– фосфато, 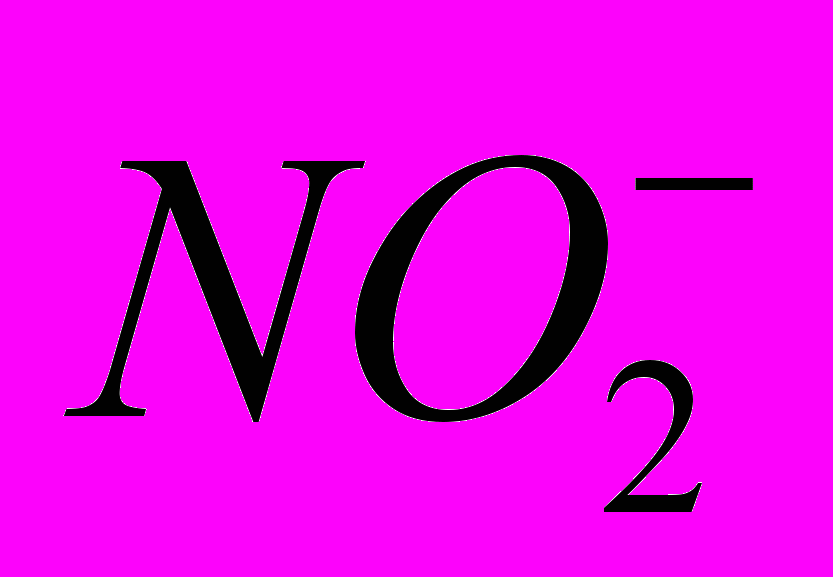 – нитро.
– нитро.Для обозначения количества лигандов используются греческие числительные: 2 – ди-, 3 – три-, 4 – тетра-, 5 – пента-, 6 — гекса-.
4)если комплексный ион – катион, то для названия комплексообразователя используют русское наименование элемента, если анион, то латинское. После названия комплексообразователя римской цифрой в круглых скобках указывают его степень окисления. У нейтральных комплексов название центрального атома дается в именительном падеже, а его степень окисления не указывается.
Например: [Ag(NH3)2]Cl – хлорид диамминсеребра;
K2[PtCl6] – гексахлороплатинат (IV) калия;
[Ni(NH3)6][Co(NO2)6] – гексанитрокобальтат (III) гексаамминникеля (III).
Необходимо обратить внимание, что формула комплексного соединения читается в обратной последовательности ее записи.
В водном растворе комплексные соединения диссоциируют по типу диссоциации сильного электролита – на комплексный ион и ионы, составляющие внешнюю сферу, например: Na3[Co(NO2)6]
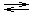 3Na+ + [Co(NO2)6]3–
3Na+ + [Co(NO2)6]3–Внутренняя сфера типичных комплексных соединений в растворах может диссоциировать на ионы или на ионы и молекулы (по типу диссоциации слабого электролита). Например, ион [Co(NO2)6]3-
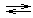 Co3+ 6
Co3+ 6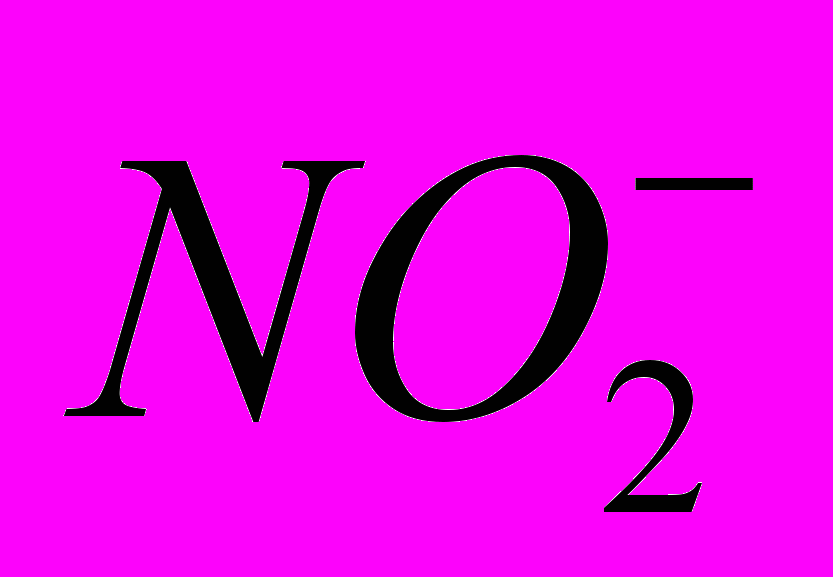
Электролитическая диссоциация комплексных ионов подчиняется закону действующих масс и количественно характеризуется константой диссоциации, которая носит название константы нестойкости Кн:
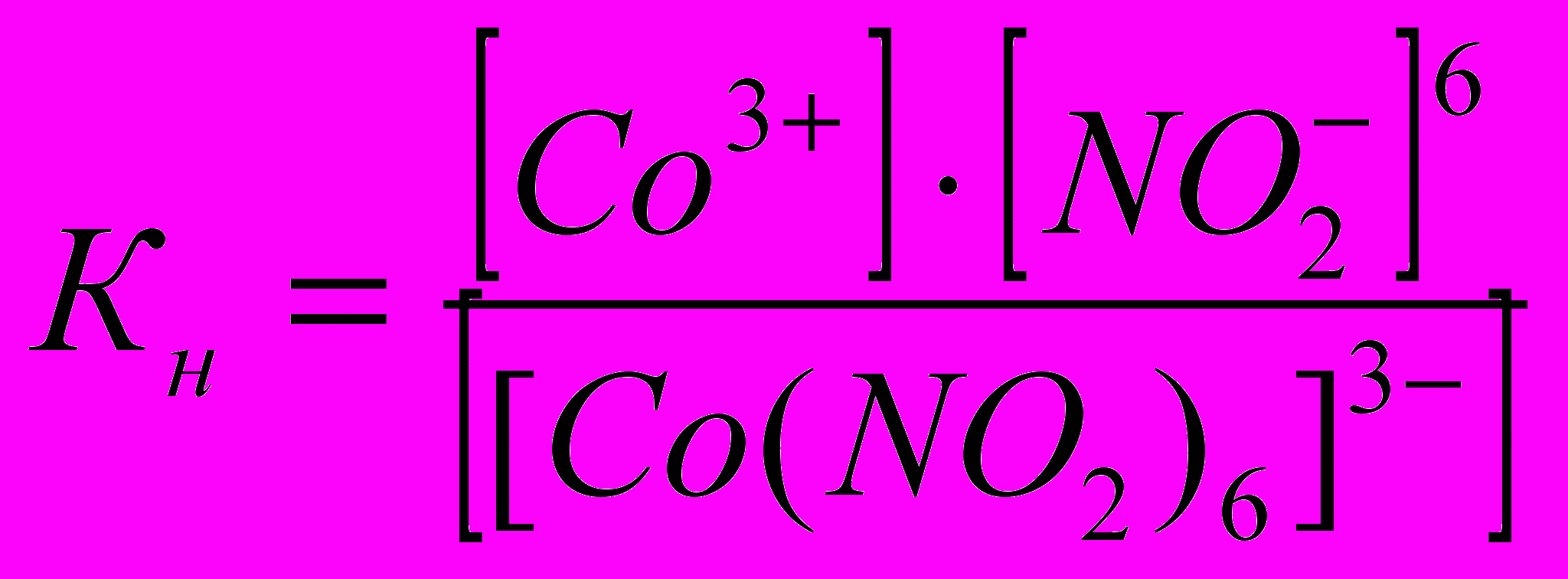
У типичных комплексных ионов Кн очень мала и является мерой его устойчивости.
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: а) К4[Fe(CN)6]; б) Nа[Ag(NO2)2]; в) К2[МoF8]; г) [Cr(H2O)2(NH3)3Cl]Cl2.
