Наибольший вред приносит электрохимическая коррозия
| Вид материала | Документы |
| Контрольные вопросы Контрольные вопросы Жесткость воды и методы ее устранения |
- 18 Коррозия электрохимическая и химическая, 45.45kb.
- Данная статья посвящена вопросу преподаванию литературы и искусства в соотвествии, 58.24kb.
- Xii всероссийская конференция молодых исследователей «шаг в будущее» муниципальное, 206.03kb.
- Лекция коррозия металлов. Способы борьбы с нею, 54.35kb.
- Тема: «Рейтинг вредных продуктов», 132.08kb.
- Коррозия металлов, 40.27kb.
- Реферат На тему: Коррозия металлов, 45.45kb.
- Аннотация дисциплины «коррозия и защита металлов», 13.74kb.
- Законом обязанность возмещения вреда может быть возложена на лицо, не являющееся причинителем, 232.66kb.
- Конкурс школьных работ «Питайся правильно будешь здоров!», 65.33kb.
Решение
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| | Заряд иона | К. ч | Степень окисления |
| а | –4 | 6 | +2 |
| б | –1 | 2 | +1 |
| в | –2 | 8 | +6 |
| г | +2 | 6 | +3 |
Пример 2. Напишите выражение для константы нестойкости комплекса [Fe(CN)6]4-.
Решение
Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер: K4[Fe(CN)6]
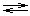 4K+ + [Fe(CN)6]4-, то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы: [Fe(CN)6]4-
4K+ + [Fe(CN)6]4-, то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы: [Fe(CN)6]4- 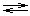 Fe2+ + 6CN- обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн.) комплекса:
Fe2+ + 6CN- обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн.) комплекса: 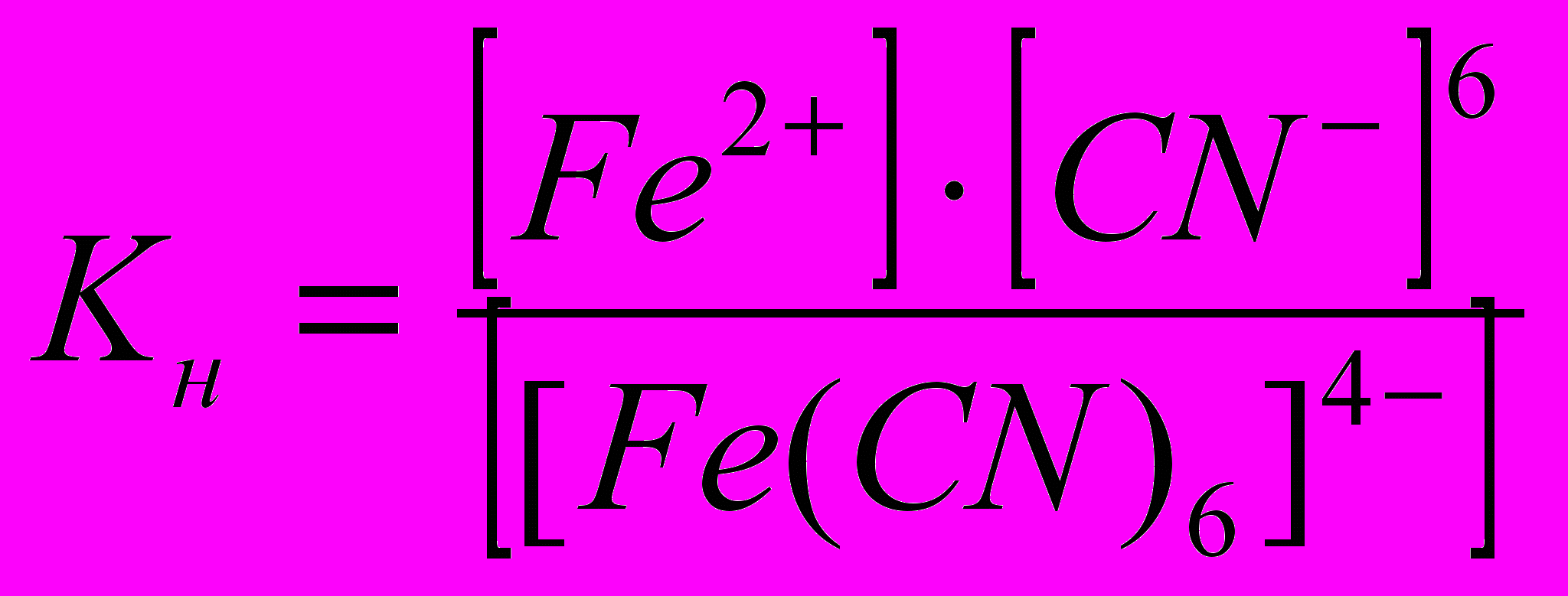 , чем меньше значение Кн, тем более прочен данный комплекс.
, чем меньше значение Кн, тем более прочен данный комплекс.Контрольные вопросы
- Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах.
- Составьте координационные формулы следующих комплексных соединений платины: PtCl4 6NH3; PtCl4 4NH3; PtCl4 2NH3. Координационное число платины (IV) равно 6. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?
- Составьте координационные формулы следующих комплексных соединений кобальта: CoCl3 6NH3, CoCl3 5NH3, CoCl3 4NH3. Координационное число кобальта (III) равно 6. Напишите уравнения диссоциации этих соединений в водных растворах.
- Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbCl6], Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах?
- Составьте координационные формулы следующих комплексных соединений серебра: AgCl 2NH3, AgCN KCN, AgNO2 NaNO2. Координационное число серебра равно двум. Напишите уравнения диссоциации этих соединений в водных растворах.
- Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgI4]. Как диссоциируют эти соединения в водных растворах?
- Из сочетания частиц Co3+, NH3, K+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
- Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4Cl2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите формулы соединений, содержащих эти комплексные ионы.
- Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO3], [Pd(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni2+. Напишите формулы комплексных соединений, содержащих эти ионы.
- Из сочетания частиц Cr3+, H2O, Cl-, K+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
- Составьте координационные формулы следующих комплексных соединений кобальта: 3NaNO2 Co(NO2)3, CoCl3 3NH3 2H2O, 2KNO2 NH3 Co(NO2)3. Координационное число кобальта (III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах.
- Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]2+, [Fe(CN)6]4-, [PtCl6]2-. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
- Константы нестойкости комплексных ионов [Co(CN)4]2-, [Hg(CN)4]2-, [Cd(CN4)]2- соответственно равны 8 10-20, 4 10-41, 1,4 10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CN- больше? Напишите выражения для констант нестойкости указанных комплексных ионов.
- Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]-, [Ag(NH3)2]+, [Ag(SCN)2]-. Зная, что они соответственно равны 1,0 10-21, 6,8 10-8, 2,0 10-11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации больше ионов Ag+.
- При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнение реакции. Константа нестойкости какого иона [Zn(NH3)4]2+ или [Zn(CN)4]2- больше? Почему?
- Напишите уравнение диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадет осадок гидроксида железа (III)? Напишите молекулярное и ионно-молекулярное уравнение реакции. Какие комплексные соедиения называются двойными солями?
- Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2 3NH3, PtCl2 NH3 KCl, PtCl2 2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из этих соединений является комплексным неэлектролитом?
- Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций.
- Какие комплексные соедиения называются двойными солями? Напишите уравнения диссоциации солей: K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадет осадок гидроксида железа (III), если к каждой из них прилить щелочи? Напишите молекулярное и ионно-молекулярное уравнение реакции.
- Константы нестойкости комплексных соединений ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2 10-36, 1,0 10-37, 1,0 10-44 Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
- Найдите заряды комплексных частиц и укажите среди них катионы, анионы и неэлектролиты: [Co(NH3)5Cl], [Cr(NH3)4PO4], [Ag(NH3)2], [Cr(OH)6], [Co(NH3)3(NO2)3], [Cu(H2O)4].
- Определите степень окисления комплексообразователя в следующих комплексных ионах:[Fe(CN)6]4-, [Ni(NH3)5Cl]+, [Co(NH3)2(NO2)4]-, [Cr(H2O)4Br2]+, [AuCl4]-, [Hg(CN)4]2-, [Cd(CN)4]2-.
- Кирпично-красные кристаллы розеосоли имеют состав, выражаемый формулой [Co(NH3)5(H2O)]Cl3, пурпуреосоль – малиново-красные кристаллы состава [Co(NH3)5Cl]Cl2. Привести химические названия этих солей. Напишите уравнения диссоциации этих соединений в водных растворах.
- Какие ионы являются комплексообразователями в следующих комплексных соединениях: K[Pt(NH3)Cl5], [Cr(H2O)5Cl]Cl2, K2[Cu(CN)4]? Определите степень окисления комплексообразователя и координационное число.
- Определите, чему равен заряд комплексного иона, степень окисления и координационное число комплексообразователя в следующих соединениях: K3[Fe(CN)6], [Zn(NH3)4]SO4, Na2[Cu(CN)4], K2[HgI4]. Напишите уравнения диссоциации этих соединений в водных растворах.
- Назовите комплексные соли: [Pd(H2O)(NH3)2Cl]Cl, [Cu(NO3)4](NO3)2, K2[Cu(CN)4]. Напишите уравнения диссоциации этих соединений в водных растворах.
- Напишите координационные формулы следующих комплексных соединений: а) дицианоаргентат калия; б) гексанитрокобальтат (3) калия; в) хлорид гексаамминникеля (2); г) бромид гексаамминкобальта (3). Напишите уравнения диссоциации этих соединений в водных растворах.
- Пользуясь номенклатурой ИЮПАК, дайте названия следующим комплексным соединениям: Ba[Pt(NO2)4Cl2]; [Cr(NH3)6]Cl3; [Ti(H2O)6]Br3; K4[CoF6]. Напишите уравнения диссоциации этих соединений в водных растворах.
- При добавлении азотной кислоты к раствору хлорида диаминсеребра (1) [Ag(NH3)2]Cl образуется осадок хлорида серебра. Напишите молекулярное и ионно-молекулярное уравнения реакций, объясните причину разрушения комплексного иона.
- Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между: а) K4[Fe(CN)6] и CuSO4; б) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
s-Элементы (…ns1-2)
К блоку s – элементов относятся 14 элементов, общим для которых является застраивание в их атомах s – подуровня внешнего энергетического уровня. Электронная формула внешней оболочки элементов IА – группы и водорода ns1 (
 ), а элементов IIА – группы и гелия ns2 (
), а элементов IIА – группы и гелия ns2 (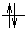 ). Водород и гелий относятся к s – элементам, однако их свойства значительно отличаются от свойств других элементов IА и IIА групп и рассматриваются отдельно.
). Водород и гелий относятся к s – элементам, однако их свойства значительно отличаются от свойств других элементов IА и IIА групп и рассматриваются отдельно. К элементам IА – группы относятся Li, Na, K, Cs, Fr, называемые щелочными металлами. К элементам IIА – группы относятся Be, Mg, Ca, Sr, Ba, Ra. Кальций, стронций, барий и радий называют щелочно-земельными металлами. . Простые вещества – это типичные металлы, обладающие блеском, высокой электрической проводимостью и теплопроводностью Химические свойства элементов IА и IIА групп сходны, они обладают высокой химической активностью. s – Элементы имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Они легко отдают валентные электроны, т.е. представляют собой сильные восстановители. Как правило, данные элементы образуют соединения с ионным типом связи, частично ковалентный характер связи в соединениях в известной мере имеет место у лития, бериллия и магния. Исключение составляет водорода, для которого в соединениях даже с самыми электроотрицательными элементами характерна преимущественно ковалентная связь. Элементы IА и IIА групп проявляют только положительные степени окисления +1 и +2 (соответственно), водород кроме положительно степени окисления (+1) в соединениях с металлами (гидридах) имеет отрицательную степень окисления 1.
С ростом радиуса атома в группе ослабевает связь валентных электронов с ядром, вследствие чего уменьшается энергия ионизации и закономерно увеличивается химическая активность. Щелочные металлы очень сходны по свойствам, что объясняется однотипным строением валентной электронной оболочки. Однако, свойства натрия и лития имеют некоторые отличия, что обусловлено строением их предвнешних электронных уровней. Несмотря на то что число валентных электронов у атомов s – элементов IIА группы одинаково, свойства магния и в особенности бериллия существенно отличаются от свойств щелочно-земельных металлов. Данное явление объясняется значительным различием радиусов атомов и ионов бериллия и магния, строением внутренних электронных слоев, а также наличием у кальция, стронция, бария и радия d – орбиталей, близких по энергии к ns – орбиталям.
Общим, присущим исключительно металлам, химическим свойством является способность только отдавать электроны, превращаясь в свободные положительно заряженные ионы:
Ме ne Ме n+.
Восстановительными свойствами металлов обусловлены их способностью вступать в реакции с различными окислителями: неметаллами, кислотами, водой, солями менее активных металлов.
1. Взаимодействие металлов s – элементов с неметаллами.
- С кислородом: 2 Mg + O2 = 2 MgO (оксид магния)
2 Na + O2 = Na2O2 (пероксид натрия)
К + O2 = KO2 (надпероксид калия)
- С галогенами: 2 Na + Cl2 = 2 NaCl (хлорид натрия)
- С азотом: 3 Ba + N2 = Ba3N2 (нитрид бария)
- С серой: 2 К + S = K2S (сульфид калия)
- С углеродом: Са + С = Са С2 (карбид кальция)
- С фосфором: 3 Li + P = Li3P (фосфид лития)
- С водородом: Са + Н2 + СаН2 (гидрид кальция)
- С кремнием: 2 Mg + Si = Mg2Si (силицид магния)
2. Взаимодействие с водой. Щелочные и щелочно-земельные металлы в ряду стандартных электродных потенциалов располагаются до водорода, поэтому они легко окисляются водой, образуя гидроксиды, при этом металл вытесняет из воды водород. Бериллий и магний взаимодействуют с водой только при нагревании.
2 Na + H2O = H2 + 2 NaOH
2 Be + 3 H2O = 2 H2 + ВеО + Ве(OH)2
Mg + 2 H2O = H2 + Mg(OH)2
3. Взаимодействие с кислотами. Металлы вытесняют водород из кислот – неокислителей (HCl, H2SO4).
2 Cs + 2 HCl = 2 CsCl + H2
2 K + H2SO4 = K2SO4 + H2
Ca + 2 HCl = CaCl2 + H2
Mg + H2SO4 = MgSO4 + H2
При взаимодействии с кислотами-окислителями (H2SO4(конц), HNO3) водород не выделяется, образуются различные продукты восстановления серы (+6) и азота (+5). Магний пассивирует в концентрированной серной кислоте, бериллий пассивирует в концентрированных серной и азотной кислотах.
8 K + 5 H2SO4(конц) = 4 K2SO4 + H2S + 4 H2O
8 Na + 10 HNO3(конц) = 8 NaNO3 + N2O + 5 H2O
8 Li + 10 HNO3(разб) = 8 LiNO3 + NH4NO3 + 3 H2O
3 Be + 8 HNO3(разб) = 3 Be(NO3)2 + 2 NO + 4 H2O
4 Mg + 10 HNO3(разб) = 4 Mg(NO3)2 + N2O + 5 H2O
Бериллий по химическим свойствам сходен с алюминием (диагональное сходство). Подобно алюминию он растворяется не только в кислотах, но и в щелочах:
Be + 2 KOH + 2 H2O = K2[Be(OH)4] + H2
Гидроксиды щелочных металлов проявляют основные свойства, они гигроскопичные вещества, легко поглощают СО2 из воздуха, разъедают стекло:
NaOH + HCl = NaCl + H2О
NaOH + СО2 = NaHCO3
2 NaOH + SiO2 = Na2SiO3 + H2O
В водных растворах гидроксиды щелочных металлов почти полностью диссоциируют:
NaOH
 Na+ + OH
Na+ + OHПо химическим свойствам гидроксиды металлов IIА группы менее активны, чем гидроксиды щелочных металлов. Их основной характер усиливается в группе сверху вниз: гидроксид бериллия – амфотерное соединение, гидроксид магния – слабое основание, гидроксиды кальция, стронция, бария, радия – сильные основания:
Ве(ОН)2 + 2 HCl = ВеCl2 + H2O
Ве(ОН)2 + 2 КОН = К2 [Be(OH)4]
Ва(ОН)2
 Ва2+ + 2 OH
Ва2+ + 2 OHКонтрольные вопросы
- Какие соли образуются при взаимодействии гидроксида калия: а) с оксидом углерода (IV); б) с оксидом серы (VI); в) с хлороводородом; г) с хлором? Рассчитайте массу КОН, которая потребуется для взаимодействия с хлором объемом 1,2 л (н.у.) при высокой температуре.
- Вычислите массу гидроксида натрия и карбоната натрия в смеси массой 2,92 г, если на образование хлорида натрия из этой смеси затрачено 0,06 М раствора соляной кислоты объемом 1 л.
- Через раствор, содержащий гидроксид натрия массой 60 г, пропустили оксид углерода (IV), полученный при разложении карбоната кальция массой 200 г. Определите массу образовавшейся соли и назовите ее.
- Кристаллогидрат соды массой 2,5 г после удаления кристаллизационной воды имеет массу 0,926 г. Вычислите массовую долю воды в кристаллогидрате и выведите его формулу.
- Прокалили смесь карбонатов кальция и стронция массой 1,73 г. при температуре выше 1000оС образовалась смесь новых твердых продуктов массой 1,07 г. Вычислите массы карбоната кальция и стронция в исходной смеси.
- Сколько граммов гидроксида кальция следует прибавить к раствору гидрокарбоната кальция с массовой долей Са(НСО3)2 5% массой 162 г для образования средней соли.
- Смесь оксидов бериллия и магния массой 0,3 г растворили в 1 М растворе соляной кислоты объемом 17 мл. Избыток кислоты нейтрализовали 0,5 М раствором гидроксида натрия объемом 8 мл. Вычислите массовые доли оксидов в смеси.
- Какой объем водорода (27 0С и 99,7 кПа) получиться при разложении водой 21 л гидрида кальция? Какой объем 1 М раствора соляной кислоты необходим для нейтрализации полученного продукта?
- Почему при реакции между MgCl2 и NH4OH образование малорастворимого гидроксида магния происходит не полностью? Что следует добавить к этой системе, чтобы полностью предотвратить образование Mg(ОН)2?
- Чем объясняется различный характер продуктов взаимодействия соды с солями Be2+ и Mg2+ и с солями Ca2+ , Sr2+ , Ba2+? Напишите уравнения соответствующих химических реакций.
- Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя и в которых – восстановителя.
- Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
- Напишите уравнения реакций с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N.
- Как получают металлический натрий? Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
- Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2О; б) с КI.
- Почему пероксид водорода способен диспропорционировать (самоокисляться – самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
- Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
- Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
- Гидроксид, какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой, б) со щелочью.
- При пропускании диоксида углерода через известковую воду (раствор Са(ОН)2) образуется осадок, который при дальнейшем пропускании СO2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
- Составьте электронные и молекулярные уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
- При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
- Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства?
- Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций.
- Как можно получить гидроксиды щелочных металлов? Почему едкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, происходящих при насыщении гидроксида натрия: а) хлором; б) оксидом серы SO3; в) сероводородом.
- Чем можно объяснить большую восстановительную способность щелочных металлов. При сплавлении гидроксида натрия с металлическим натрием последний восстанавливает водород щелочи в гидрид-ион. Составьте электронные и молекулярные уравнения этой реакции.
- Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнений реакций кальция: а) с V2О5; б) с CaSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
- Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
- Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
- Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Ca CaH2 Ca(OH)2 CaCO3 Ca(HCO3)2
Жесткость воды и методы ее устранения
Жесткость воды отражает содержание в ней ионов кальция и магния.
Жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния, называется временной, или карбонатной (Жвр). Жесткость, обусловленная хлоридами и сульфатами этих металлов, называется постоянной (Жп). Суммарная жесткость воды носит название общей жесткости. Жесткость воды (степень жесткости принято выражать в миллимолях ионов Са2+ или Mg2+ (или обоих ионов) в 1 дм3 или 1 кг воды – ммоль/дм3 или ммоль/кг. В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм3 или мг-экв/кг. Зная, что молярные массы эквивалентов ионов Са2+ и Mg2+ соответственно равны 20,04 и 12,16 мг/дм3, можно рассчитать обжую жесткость воды (в ммоль/дм3):
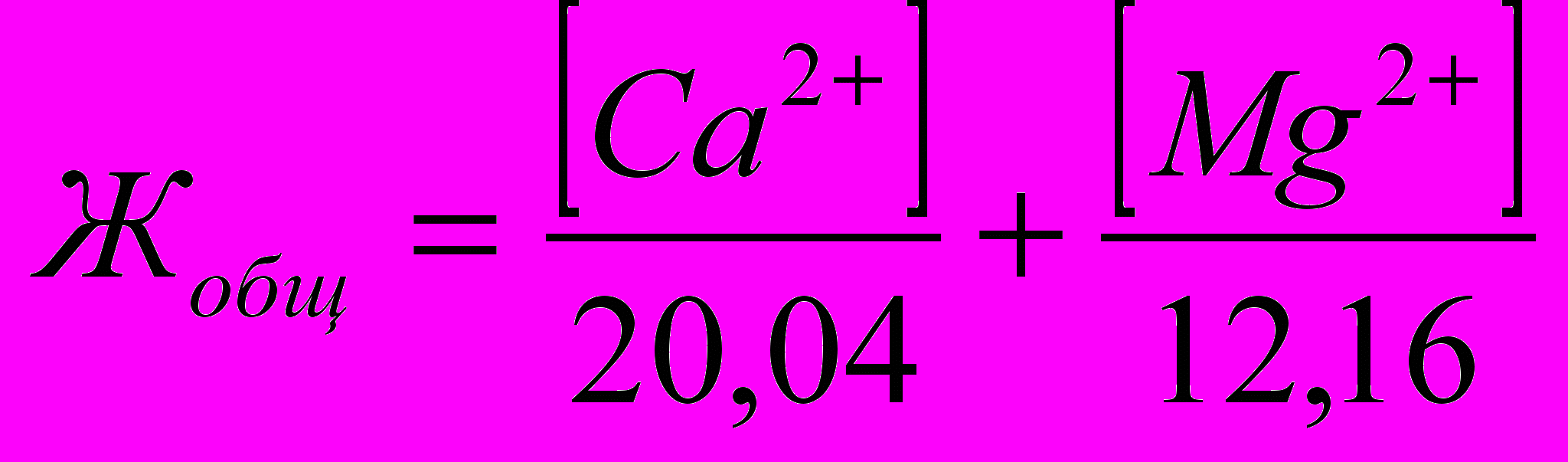 . Часто в расчетах жесткости используют формулу:
. Часто в расчетах жесткости используют формулу: 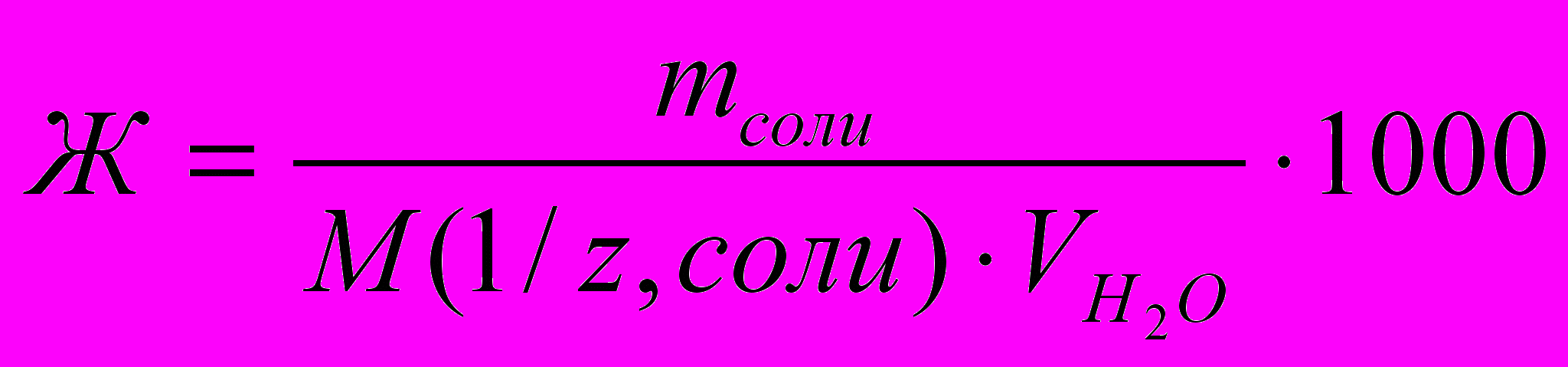 (19)
(19)Пример 1. Вычислите временную жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2.
