Наибольший вред приносит электрохимическая коррозия
| Вид материала | Документы |
СодержаниеКонтрольные вопросы Органические соединения. Полимеры |
- 18 Коррозия электрохимическая и химическая, 45.45kb.
- Данная статья посвящена вопросу преподаванию литературы и искусства в соотвествии, 58.24kb.
- Xii всероссийская конференция молодых исследователей «шаг в будущее» муниципальное, 206.03kb.
- Лекция коррозия металлов. Способы борьбы с нею, 54.35kb.
- Тема: «Рейтинг вредных продуктов», 132.08kb.
- Коррозия металлов, 40.27kb.
- Реферат На тему: Коррозия металлов, 45.45kb.
- Аннотация дисциплины «коррозия и защита металлов», 13.74kb.
- Законом обязанность возмещения вреда может быть возложена на лицо, не являющееся причинителем, 232.66kb.
- Конкурс школьных работ «Питайся правильно будешь здоров!», 65.33kb.
Контрольные вопросы
- Каплю раствора соли неизвестного металла поместили на медную пластинку. Через некоторое время на том месте, где была капля раствора, осталось блестящее пятно, которое исчезает после нагревания. Объясните наблюдаемое явление. Какой металл входит в состав соли? Напишите уравнение реакций, происходящих при образовании пятна.
- На смесь железа и меди массой 1,76 г подействовали горячей серной кислотой объемом 7 мл с массовой долей H2SO4 70% ( = 1,6 г/см3). Определите состав смеси, сколько и какой газ выделился в результате реакции.
- Какой металл следует взять для вытеснения хрома из CrCl3: Mg, Sn, Cu, Hg? Какие из следующих веществ реагируют между собой: Cr(OH)3 и KOH; Cr2O3 и SiO2; Cr(NO3)3 и MgCl2; K2CrO4 и H2SO4 ; Na2Cr2O7 и NaOH; Cr2O3 и H2O.
- Сколько оксида хрома () и азота (в объемных единицах) образуется при разложении дихромата аммония массой 27 г, содержащей массовую долю примесей 7,41%?
- Для получения металлического марганца применяются три способа: силикотермический, алюмотермический и электролитический. Выразите эти процессы химическими уравнениями.
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Mn MnSO4 H2MnO4 MnO2 MnCl2
Mn Mn(OH)2 Mn(NO3)2 HMnO4 MnO2
- Смесь железа и цинка, масса железа в которой составляет 5,6 г, обработана соляной кислотой ( = 1,1 г/см3) с массовой долей НCl. 20%. Какова масса этой смеси, если выделился газ объемом 13,44 л (н.у.)? Какой объем кислоты был при этом израсходован?
- При производстве стали оксид железа () смешиваясь с расплавом, окисляет примеси: кремний, фосфор, углерод. Сколько килограммов продуктов окисления получилось, если в расплаве содержалось кремния – 2,8 кг, фосфора – 3,01 кг, углерода – 1,2 кг.
- Смесь железа с медью обработали раствором соляной кислоты с массовой долей НCl. 20% ( = 1,1 г/см3). Массовая доля железа в смеси составляет 35%. Вычислите массу исходной смеси, если при реакции выделился газ объемом 244 мл (н.у.), и объем кислоты, вступившей в реакцию.
- Вычислите массу сульфата меди () и сульфата цинка в смеси массой 1,202 г, если при прибавлении к смеси избытка хлорида бария выпал осадок массой 1,089 г.
- Сколько мл 30% -ной азотной кислоты ( = 1,184 г/см3) потребуется для растворения 1 г меди?
- Составьте уравнения окислительно-восстановительных реакций: а) цинка с концентрированной серной кислотой; б) кадмия с разбавленной азотной кислотой. В чем можно растворить Zn(OH)2? Составьте молекулярные и ионные уравнения соответствующих химических реакций.
- Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
- Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Cu Cu(NO3)2 Cu(OH)2 CuCl2 [Cu(NH3)4]Cl2.
- Составьте электронные и молекулярные уравнения реакций цинка: а) с раствором гидроксида натрия; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
- Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Ag AgNO3 AgCl [Ag(NH3)2]Cl AgCl.
- При постепенном прибавлении раствора КI к раствору Hg(NO3)2 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
- Составьте уравнения реакций, которые надо провести для осуществления
следующих превращений: Cd Cd(NO3)2 Cd(OH)2 [Cd(NH3)6](OH)2 CdSO4.
- При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке КCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
- К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnС12, СdС12, НgСl2? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
- При действии на титан концентрированной хлороводородной (соляной) кислоты образуется трихлорид титана, а при действии азотной – осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
- При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с высшей степенью окисления. Составьте электронные и молекулярные уравнения реакций.
- Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия КI с сульфатом меди.
- Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между: а) ТiO2 и ВаО; б) ZrО2 и NаОН. В первой реакции образуется метатитанат, а во второй – ортоцирконат соответствующих металлов.
- На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. Какие соединения цинка и кадмия образуются в каждой из этих реакций? Составьте молекулярные и ионно-молекулярные уравнения реакций?
- Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
- В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
- Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой – избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
- Ванадий получают алюминотермически или кальцийтермически восстановлением оксида ванадия (V) V2О5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
- Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения реакции.
- Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления? Составьте уравнения реакций: а) V2O3 с Н2SО4; б) V2О5 с NaОН.
- При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (II). Составьте электронные и молекулярное уравнения реакции.
- Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярное уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
- Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) растворения вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
- При сплавлении хромита железа Fе(СrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают соответственно степени окисления +6 и +3. Составьте электронные и молекулярное уравнения реакции.
- К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора перешла в зеленую. Составьте электронные и молекулярное уравнения реакции.
- Хром получают методом алюминотермии из его оксида (III), а вольфрам – восстановлением оксида вольфрама (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
- Составьте уравнения реакций, которые надо провести для осуществления превращений: Na2Cr2O7 Na2CrO4 Na2Cr2O7 CrCl3 Cr(OH)3. Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
- Марганец азотной кислотой окисляется до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
- Хлор окисляет манганат калия К2МnО4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
- Как меняется степень окисления марганца при восстановлении КМnО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакции между KMnO4 и KNO2 в нейтральной среде.
- На основании электронных уравнений составьте уравнение реакции получения манганата калия К2МnО4 сплавлением оксида марганца (IV) с хлоратом калия КСlO3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
- Почему оксид марганца (IV) может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений, составьте уравнения реакций: а) MnO2 + KI + H2SO4 …;
б) MnO2 + KNO3 + KOH …
- Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
- Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Fe FeSO4 Fe(OH)2 Fe(OH)3 FeCl3.
- Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fе2+ и Fе3+ в растворе? Составьте молекулярные и ионно-молекулярные уравнения реакций.
- Чем отличается взаимодействие гидроксидов кобальта (III) и никеля (III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения этих реакций.
- Могут ли в растворе существовать совместно следующие вещества: а) FеС13 и SnС12; б) FеSО4 и NaОН; в) FеС13 и К3[Fе(СN)6]? Для взаимодействующих веществ составьте уравнения реакций.
- Составьте уравнения реакций, которые надо провести для осуществления превращений: Ni Ni(NO3)2 Ni(OH)2 Ni(OH)3 NiCl2. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
- Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий – до +8.
- Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления следующих превращений:
- Fе FеС12 Fе(СN)2 К4[Fе(СN)6] К3[Fе(СN)6]. К окислительно-восстановительным реакциям составьте электронные уравнения.
- Феррат калия К2FеО4 образуется при сплавлении Fе2О3 с калийной селитрой КNО3 в присутствии КОН. Составьте электронные и молекулярное уравнения реакции.
Органические соединения. Полимеры
Полимер – вещество, состоящее из молекул, характеризующихся многократным повторением одного или более типов атомов или групп атомов (cструктурных звеньев), соединенных между собой ковалентными химическими связями в количестве, достаточном для проявления комплекса свойств, которые остаются практически неизменными и при добавлении или удалении одного или нескольких структурных звеньев.
Большую часть полимеров составляют органические полимеры. Если цепь макромолекулы полимера состоит только из атомов углерода, то его называют карбоцепным, например полиэтилен:
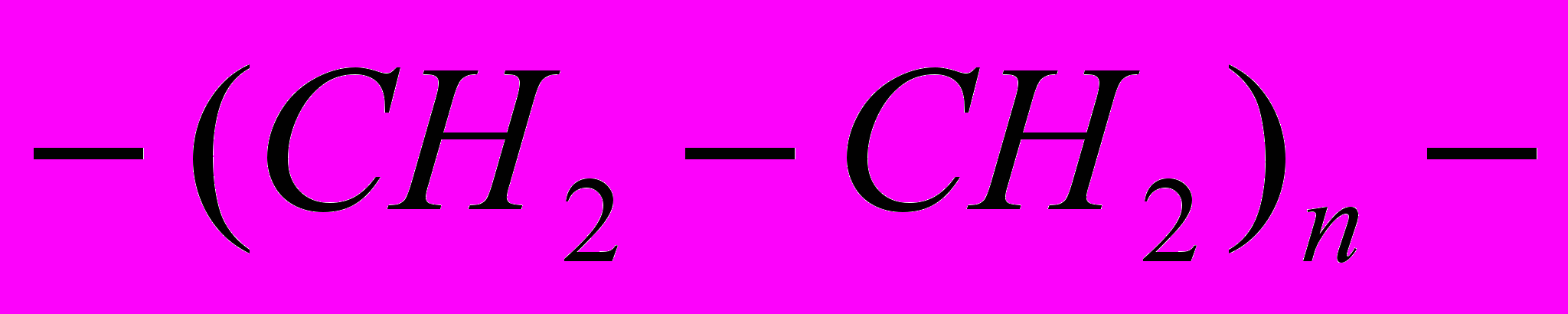
где n – степень полимеризации, т. е. число повторяющихся структурных звеньев цепи полимера. При этом в составе боковых групп этих соединений могут находиться атомы водорода, кислорода, азота и серы.
Е
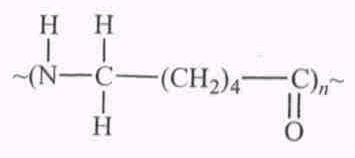 сли основная цепь полимера состоит из атомов углерода и кислорода, углерода и азота, углерода и серы, то такой полимер называют гетерогенным, например полиамиды:
сли основная цепь полимера состоит из атомов углерода и кислорода, углерода и азота, углерода и серы, то такой полимер называют гетерогенным, например полиамиды: Ц
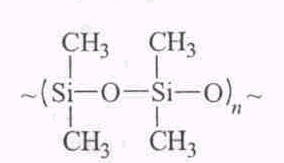 епь элеменгпорганических полимеров состоит из атомов кремния. фосфора и др., к которым присоединены углеродные атомы или группы, например силоксан:
епь элеменгпорганических полимеров состоит из атомов кремния. фосфора и др., к которым присоединены углеродные атомы или группы, например силоксан: В
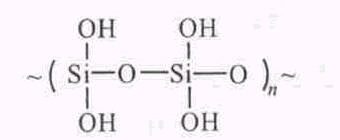 отличие от органических полимеров в цепях и боковых группах неорганических полимеров атомы углерода отсутствуют. Примером таких полимеров может служить кремниевая кислота:
отличие от органических полимеров в цепях и боковых группах неорганических полимеров атомы углерода отсутствуют. Примером таких полимеров может служить кремниевая кислота: Цепная молекула полимера называется макромолекулой. Составляющие ее низкомолекулярные повторяющиеся структурные единицы (или звенья) образованы низкомолекулярными веществами, способными к многократному соединению друг с другом в результате химических реакций синтеза. Эти вещества называются мономерами.
Е
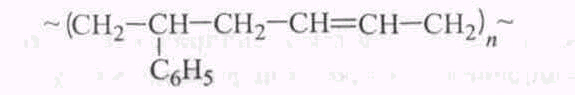 сли полимер содержит в основной цепи молекулы двух или более мономеров, то он является сополимером, например бутадиен-стирольный сополимер
сли полимер содержит в основной цепи молекулы двух или более мономеров, то он является сополимером, например бутадиен-стирольный сополимерВ зависимости от строения основной цепи макромолекулы подразделяются на линейные, разветвленные и сшитые (сетчатые) ( рис. 3).

Рис. 3. Схематичное изображение различных видов макромолекул:
1 – линейные; 2 – разветвленные; 3 – сшитые (сетчатые)
Полимеры получают синтезом из низкомолекулярных соединений – мономеров методом полимеризации или методом поликонденсации.
Полимеризацией называют цепную реакцию в ходе которой молекулы мономера последовательно присоединяются к активному центру, находящемуся на конце растущей цепи.
Поликонденсацией называют процесс образования полимеров из би- или полифункциональных мономеров, сопровождающийся выделением побочных низкомолекулярных соединений.
Важнейшие представители полимеров в качестве примера приведены в табл. 11.
Контрольные вопросы
- Напишите схему строения синтетического каучука, полученного из 2,3-диметилбутадиена, считая, что он представляет собой продукт 1,4-полимеризации.
- Какой путь получения синтетического каучука разработал С.В. Лебедев? Приведите уравнения реакций.
- Напишите схему строения бутадиен-стирольного каучука, считая для простоты, что он представляет собой регулярный полимер, в котором на одно стирольное звено приходится три бутадиеновых, и что бутадиен реагирует только в положения 1,4.
- Что такое хлоропреновый каучук? Как синтезировать необходимый для его получения мономер?
- Рассчитайте содержание хлора (%) в хлоропреновом каучуке.
- Напишите схему строения бутадиен-нитрильного каучука, считая, что он представляет собой регулярный полимер, в котором на один остаток акрилонитрила приходятся три остатка бутадиена, и что бутадиен реагирует только в положения 1,4.
- Приведите примеры высокомолекулярных соединений, относящихся к полиолефинам. Напишите их структурные формулы.
- Напишите схему образования димера и тримера изобутилена под действием серной кислоты с учетом механизма этой реакции.
- Из изобутилена, подобно этилену и пропилену, можно получить полимер. Как построен этот полимер? Возможна ли в этом случае стереоспецифическая полимеризация?
- Напишите схему строения сополимера стирола с акрилонитрилом, считая, что образуется полимер с регулярным чередованием мономерных (структурных) звеньев (соотношение мономеров 1:1).
- Сколько структурных звеньев входит в макромолекулу поливинилхлорида с молекулярной массой 350000?
- Из каких мономеров можно получить прозрачный материал – “органическое стекло”. Напишите схему строения соответствующего полимера.
- Как получают волокно нитрон? Напишите схемы соответствующих реакций.
- Исходные вещества для синтеза найлона 66 можно получить из бутадиена, используя реакцию 1,4-присоединения хлора. Напишите все стадии этого синтеза.
- Напишите реакцию полимеризации винилацетата.
- Напишите схему образования продуктов поликонденсации фенола с уксусным альдегидом.
- Напишите уравнения реакции полимеризации изомеров бутилена, структура которых выражается формулами СН2=СН-СН2-СН3 и СН3-СН=СН-СН3.
- Составьте уравнение реакции получения изопренового каучука полимеризацией изопрена.
- Напишите уравнение реакции полимеризации формальдегида и определите степень полимеризации в реакции получения полиформальдегида со средней молекулярной массой 45000.
- Составьте уравнения реакций получения полихлорвинила, если в качестве исходного вещества взять ацетилен.
- Напишите структурную формулу акриловой (простейшей непредельной одноосновной карбоновой) кислоты и уравнение реакции взаимодействия этой кислоты с метиловым спиртом. Составьте схему полимеризации образовавшегося продукта.
- Как из карбида кальция и воды, применив реакцию Кучерова, получить уксусный альдегид, а затем винилуксусную кислоту (винилацетат) . Напишите уравнения соответствующих реакций. Составьте схему полимеризации винилацетата.
- Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер.
- Как можно получить винилхлорид, имея карбид кальция, хлорид натрия, серную кислоту и воду? Напишите уравнения соответствующих реакций. Составьте схему полимеризации винилхлорида.
- Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина?
- Напишите уравнения реакций получения ацетилена и превращения его в ароматический углеводород. При взаимодействии какого вещества с ацетиленом образуется акрилонитрил? Составьте схему полимеризации акрилонитрила.
- Напишите структурную формулу метакриловой кислоты. Какое соединение получается при взаимодействии ее с метиловым спиртом? Напишите уравнение реакции. Составьте схему полимеризации образующегося продукта.
- Какие углеводороды называют диеновыми (диолефины или алкадиены)? Приведите пример. Какая общая формула выражает состав этих углеводородов? Составьте схему полимеризации бутадиена (дивинила).
- Какие углеводороды называют олефинами (алкенами)? Приведите пример. Какая общая формула выражает состав этих углеводородов? Составьте схему получения полиэтилена.
- Какая общая формула выражает состав этиленовых углеводородов (олефинов или алкенов)? Какие химические реакции наиболее характерны для них? Что такое полимеризация, поликонденсация? Чем отличаются друг от друга эти реакции?
- Каковы различия в составах предельных и непредельных углеводородов? Составьте схему образования каучука из дивинила и стирола. Что такое вулканизация?
- Какие соединения называют аминокислотами? Напишите формулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют образующийся при этом полимер?
- Какие соединения называют альдегидами? Что такое формалин? Какое свойство альдегидов лежит в основе реакции серебряного зеркала? Составьте схему получения фенолоформальдегидной смолы.
- Как называют углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена.
- Какие соединения называют элементорганическими, кремнийорганическими? Укажите важнейшие свойства кремнийорганических полимеров. Как влияет на свойства кремнийорганических полимеров увеличение числа органических радикалов, связанных с атомами кремния?
- Какая общая формула выражает состав ацетиленовых углеводородов (алкинов)? Как из метана получить ацетилен, затем винилацетилен, а из последнего хлоропрен?
- Напишите уравнение реакции дегидратации пропилового спирта. Составьте схему полимеризации полученного углеводорода.
- Какие полимеры называют стереорегулярными? Чем объясняется более высокая температура плавления и большая механическая прочность стереорегулярных полимеров по сравнению с нерегулярными полимерами?
- Как получают в промышленности стирол? Приведите схему его полимеризации. Изобразите с помощью схем линейную и трехмерную структуры полимеров.
- Какие полимеры называются термопластичными, термореактивными? Укажите три состояния полимеров. Чем характеризуется переход из одного состояния в другое?
