Рабочая программа по «Эмиссионному спектральному анализу» для специальности 010201 "Химия"
| Вид материала | Рабочая программа |
- Рабочая программа по дисциплине специализации "Хемометрика" для специальности 020101, 126.88kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- Рабочая программа спецкурса "Процессы образования и превращения органических молекул, 252.89kb.
- Рабочая программа спецкурса «Методы органического синтеза» для специальности 020101, 103.25kb.
- Рабочая программа по дисциплине специализации «Электрохимические методы анализа» для, 142.82kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Рабочая программа по дисциплине: Неорганическая химия. Аналитическая химия. Специальность:, 240.03kb.
Министерство образования Российской Федерации
Кемеровский государственный университет
Кафедра общей физики
"Утверждаю"
Декан физического факультета
________________________
"___" ___________ 2009г.
РАБОЧАЯ ПРОГРАММА
по «Эмиссионному спектральному анализу»
для специальности 010201 "Химия"
Факультет химический
курс - IV
семестр - 7
лекции - 4 часа
практические занятия - 39 часа
зачет - 5 часов
Всего часов – 48 часов
Составители: д.ф.-м.н., профессор Полыгалов Ю.И.
к.ф.-м.н., доцент Титов Ф.В.
Кемерово 2009г.
Рабочая программа курса «Атомная спектроскопия» составлена на основании требований Государственного образовательного стандарта высшего профессионального образования по специальности 010400 «Физика».
Программа содержит основной теоретический материал курса, методику проведения качественного и количественного спектрального анализа пробы без ее разделения.
Рабочая программа обсуждена на заседании кафедры общей физики.
Протокол № ____ от "__"_________ 2003г.
Зав. кафедрой ____________ д.ф.-м.н., профессор Полыгалов Ю. И.
Одобрено методической комиссией
Протокол № ____ от "__"_________ 2003г.
Председатель _____________ к.ф.-м.н., доцент Золотарев М. Л.
Учебный план по курсу «Атомная спектроскопия».
Содержание программы
- Требования государственного образовательного стандарта по курсу
- Цели и задачи курса
- Лекции (4)
- Практические занятия (39)
- Контрольные вопросы для зачета
- Рекомендуемая литература
Цели и задачи курса
Современная наука и техника немыслима без знания химического состава веществ, которые являются объектами деятельности человека. Бурное развитие техники предъявляет все новые требования к методам анализа вещества. Еще сравнительно недавно можно было ограничиться определением примесей, присутствующих в концентрации до 10-2 -10-3 %. Но в связи с развитием промышленности полупроводниковых материалов к чистоте веществ, а, следовательно, и к чувствительности аналитических методов предъявлены высокие требования - необходимо определять примеси до 10-7 -10-9 %. Среди этих методов одно из главных мест по праву занимает эмиссионный спектральный анализ. В основе спектрального анализа лежит изучение строение света, испускаемого атомами и молекулами анализируемого вещества при переходе из возбужденного в обычное состояние.
Излагаемый курс делится на две части:
1. Эмиссионный спектральный анализ.
2. Атомная спектроскопия.
Основная задача курса – изложение основных законов излучения атомных систем.
В соответствии с положениями Государственного Образовательного Стандарта Высшего профессионального образования по специальности «Физика» данный курс направлен на формирование умений и практических навыков использования будущими специалистами в практической деятельности.
Часть I. Эмиссионный спектральный анализ
Возбуждение вещества и интенсивность спектральных линий.
Соударения частиц. Тепловое равновесие интенсивность спектральных линий. Зависимость интенсивности линии от концентрации. Ширина и форма спектральной линии. Сплошной фон. Чувствительность спектральных линий.
Источники света.
Газовый разряд. Дуговой разряд. Искровой разряд. Газовый разряд при низком давлении. Электрические схемы питания газового разряда. Схема питания дуги постоянного тока. Схема дуги переменного тока. Схема высоковольтной конденсированной искры. Плазма.
Введение анализируемого вещества.
Процессы, протекающие при введении анализируемого вещества в источники света. Плавление, испарение, диссоциация, возбуждение. Влияние состава и структуры пробы на интенсивность спектральных линий. Методы устранения и учета влияния состава и структуры пробы на интенсивность спектральных линий. Методы введения металлических монолитных проб. Методы введения порошков. Методы введения растворов и расплавов.
Спектральные аппараты.
Призма и дифракционная решетка. Оптическая схема спектрального аппарата. Основные характеристики и параметры спектральных аппаратов. Способы освещения щели. Стилоскопы и стилометры. Спектрографы. Техника работы со спектрографами. Монохроматоры. Визуальная фотометрия. Фотографическая регистрация и фотометрия. Характеристическая кривая. Чувствительность фотографических материалов. Спектральная чувствительность. Обработка фотографических материалов. Микрофотометры. Техника фотометрирования. Методы построения характеристической кривой. Методы фотографической фотометрии. Приборы для рассматривания спектрограмм и измерения расстояния между линиями.
Качественный анализ.
Ориентировка в спектрах и определение длины волны спектральных линий. Идентификация спектральных линий и молекулярных полос. Эмиссионный качественный анализ, чувствительность анализа. Задачи и методика качественного анализа. Поведение полукачественных оценок концентрации открытых концентрации открытых элементов в анализируемой пробе.
Количественный анализ.
Точность анализа. Случайные ошибки, постоянные ошибки. Эмиссионный количественный анализ. Эталоны. Отбор пробы для анализа. Подготовка пробы к анализу. Источники света и введение пробы. Аналитические линии и выбор спектрального аппарата. Регистрация и фотометрия спектров. Градуировочные графики. Влияние сплошного фона на ход градуировочного графика. Определение неизвестной концентрации методом добавок. Влияние наклона градуировочного графика на точность анализа.
Часть II. Атомная спектроскопия.
Спектр атома водорода и водородоподобных ионов.
Квантовые числа одноэлектронного атома и степень вырождения его уровней. Характеристика стационарных состояний одноэлектронного атома. Правила отбора и вероятности перехода для одноэлектронного атома. Тонкая структура уровней энергии и спектральных линий.
Одноэлектронные спектры атомов с одним внешним s-электроном.
Основной уровень атомов щелочных металлов. Возбужденные уровни и спектральные серии атомов щелочных металлов. Дублетная структура уровней атомов щелочных металлов. Интенсивности в спектрах атомов щелочных металлов.
Основы общей систематики сложных спектров.
Сложение орбитальных и спиновых моментов и типы связи. Общая характеристика нормальной связи. Термы конфигураций, состоящих из эквивалентных электронов. Термы смешанных конфигураций содержащих эквивалентные электроны. Мультиплетное расщепление. Мультиплеты в спектрах. Случай связи
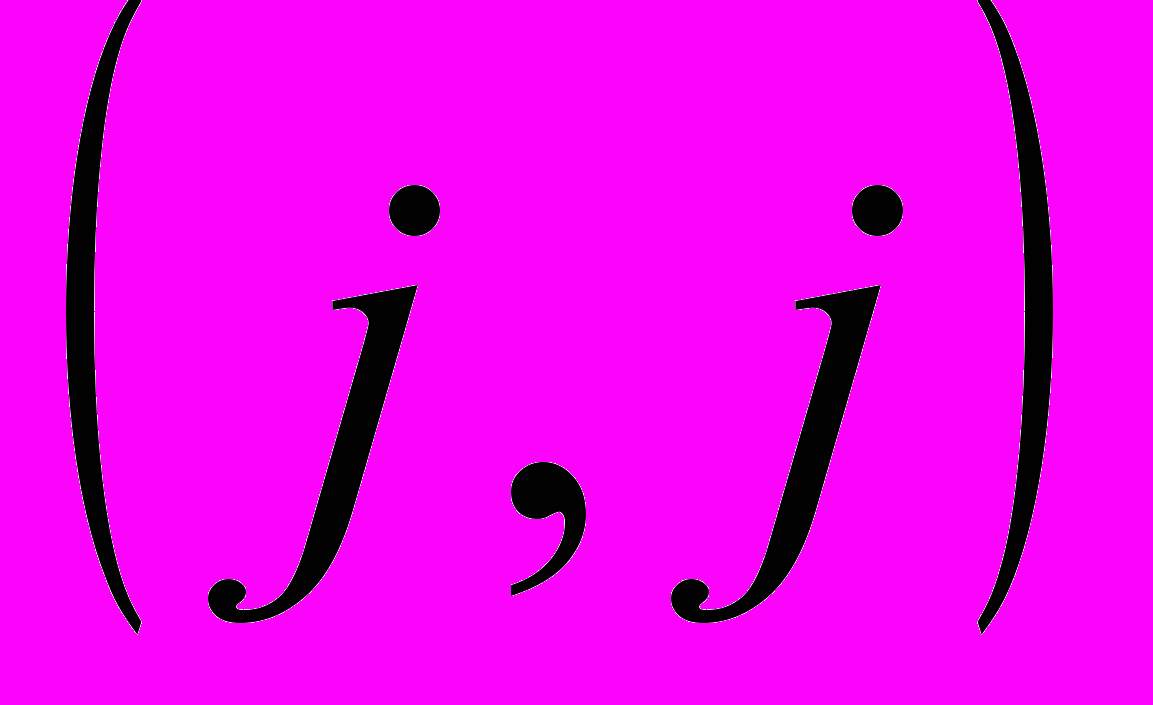 .
.Спектры атомов с двумя внешними s-электронами.
Общая характеристика спектров атомов с двумя внешними электронами. Спектр атома гелия. Спектры атомов щелочноземельных металлов. Спектры атомов цинка, кадмия, ртути. Смещенные термы.
Спектры атомов с заполняющимися и заполненными p-оболочками.
Общая характеристика спектров атомов с заполняющимися p-оболочками. Спектры атомов с одним p-электроном. Спектры атомов с оболочками p2, p3 и p4. Спектры атомов галоидов. Спектры атомов инертных газов. Запрещенные линии в спектрах Туманностей и солнечной короны.
Спектры атомов с достраивающимися d- и f-оболочками.
Особенности спектров атомов с достраивающимися оболочками. Общая характеристика спектров атомов с достраивающимися d-оболочками. Спектры атомов с d-оболочками, заполненными менее чем наполовину. Спектры атомов с d-оболочками, заполненными наполовину. Спектры атомов с d-оболочками, заполненными более чем наполовину. Спектры атомов с внешними s-электронами, помимо заполненной d-оболочки. Общая характеристика спектров атомов с достраивающимися f-оболочками. Спектры атомов с f-оболочками, заполненными менее наполовину. Спектры атомов с f-оболочками, заполненными наполовину и более.
Контрольные вопросы по курсу «Атомная спектроскопия»
1. Во сколько раз возрастает интенсивность линий Cu(I) 3247,5
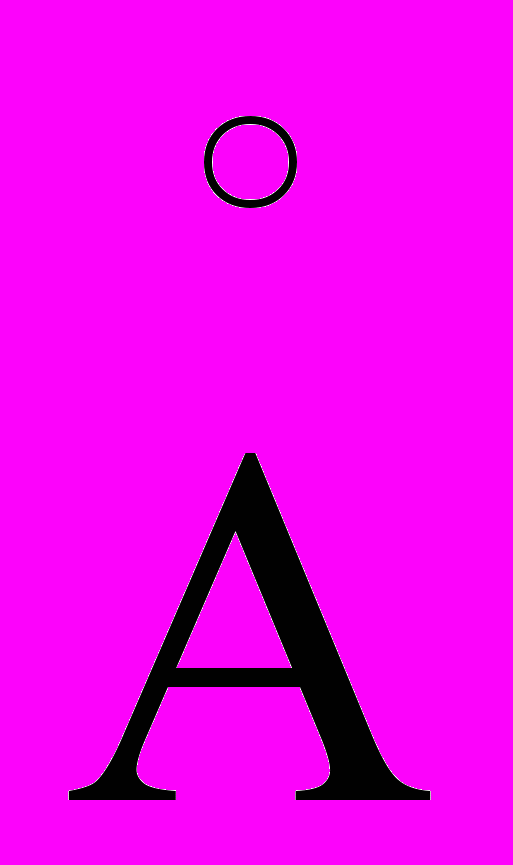 и Cu(II) 2824,4
и Cu(II) 2824,4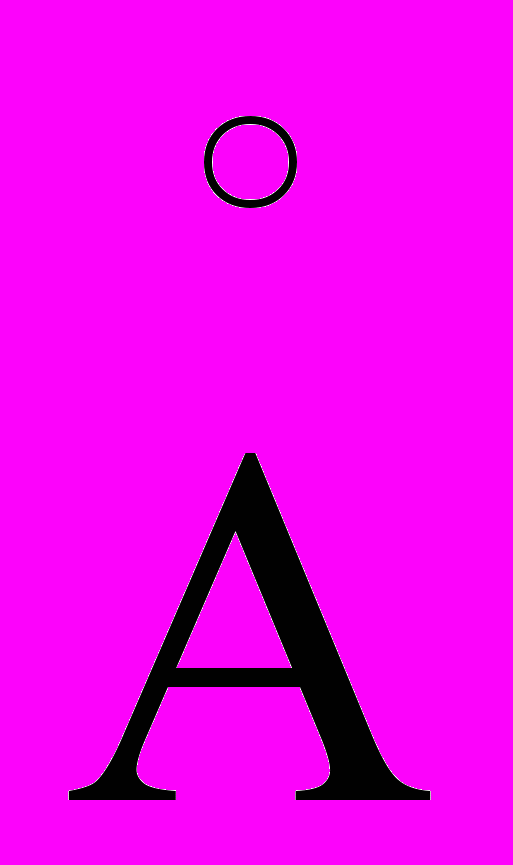 при увеличении температуры источника света от 3000° до 5000°? Ионизация меди при этих температурах мала и может не учитываться. Потенциалы возбуждения линии имеются в таблицах.
при увеличении температуры источника света от 3000° до 5000°? Ионизация меди при этих температурах мала и может не учитываться. Потенциалы возбуждения линии имеются в таблицах.2. Часто при сильном самообращении спектральной линии интенсивность излучения в ее центре меньше интенсивности сплошного фона источника. Объясните, как возникает это явление.
3. Две спектральные линии имеют одинаковую максимальную интенсивность, одна при температуре 4000°, другая – при 7000°. Какая из линий обеспечивает наибольшую чувствительность открытия элемента при одинаково благополучных других условиях анализа?
4. В луче искрового разряда 12 колебаний. Какая продолжительность цуга, если емкость конденсатора 0,01 мкФ, а индуктивность катушки 0,55 мГн.
5. Каким образом может проявиться влияние третьих элементов на относительную интенсивность полностью гомологической аналитической пары?
6. Как практически определить время, необходимое для предварительного обыскривания образцов при анализе?
7. При фотографировании спектра почернение аналитической линии оказалось слишком большим s=1,9, оно лежит на границе с областью передержек. Как нужно изменить выдержку, чтобы получить для этой линии s=0,8, если контрастность пластинок 1,26?
8. Определите длину волны линии в спектре анализируемой пробы, если в спектре нормали выбраны линии
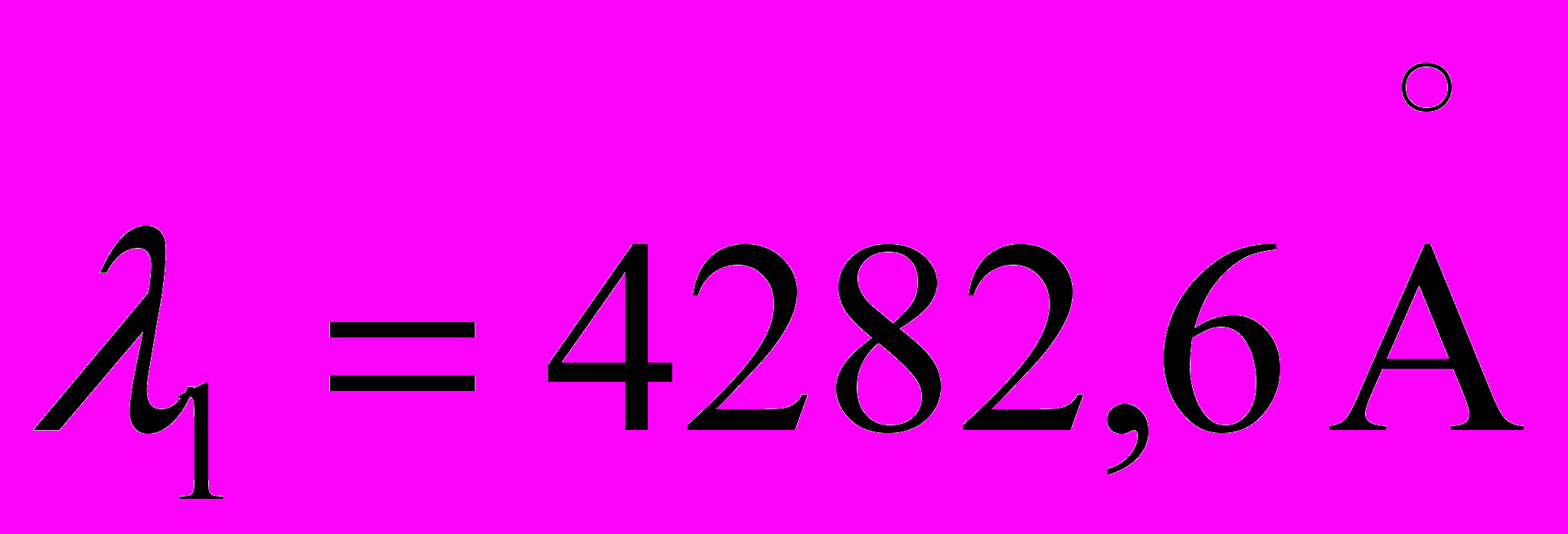 ,
, 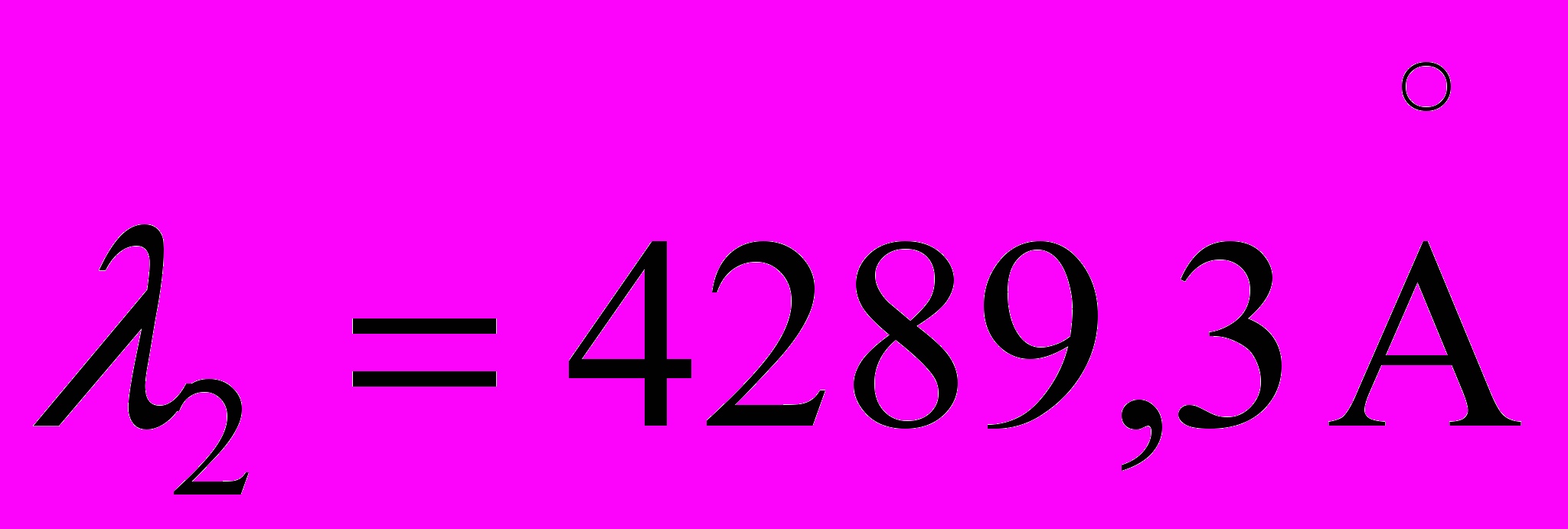 и при измерении получены следующие отсчеты по шкале измерительного микроскопа: а1=1,37мм, а7=2,04мм, а2=2,12мм.
и при измерении получены следующие отсчеты по шкале измерительного микроскопа: а1=1,37мм, а7=2,04мм, а2=2,12мм.9. Продумайте все условия полного качественного анализа при расшифровке состава совершенно неизвестного цветного сплава.
10. Сопоставьте для кальция и цинка их химические свойства и оптический спектр со строением атома. Чем объясняется общие черты и различия в химических свойствах и спектрах этих дух элементов?
11. Определите, какие линии в спектре кадмия измеряются при переходе электрона на нулевой уровень. Длину волны линий и их потенциал возбуждения найдите в таблицах спектральных линий.
12. Постройте в масштабе систему термов для атома лития (уровень 2s-нулевой). Нужные данные найдите в таблицах спектральных линий.
13. В каких областях спектрах лежат самые интенсивные линии ионов Na+, Ca+, Ca++?
14. Определите величину расщепления нулевого уровня нейтрального атома алюминия?
15. Покажите, как распределены по уровням энергии электроны в невозбужденных атомах гелия, бора, кислорода, калия, молибдена, серебра и ртути. Для каждого электрона внешней оболочки приведите значения всех квантовых чисел.
16. Для элементов, указанных в предыдущем упражнении нарисуйте систему незаполненных термов и покажите, как происходит возбуждение атомов. Опишите химические свойства и спектральные характеристики этих элементов: потенциал возбуждения последних линий и область спектра, в которой они расположены, сложность спектра, потенциала ионизации.
17. Почему у редкоземельных элементов химические свойства очень близки, а различие в спектре достаточно велико?
18. Сопоставьте список последних линий для элементов третьего периода, если для их анализа ограничиться только видимой областью спектра.
19. Интенсивные линии в спектре водорода
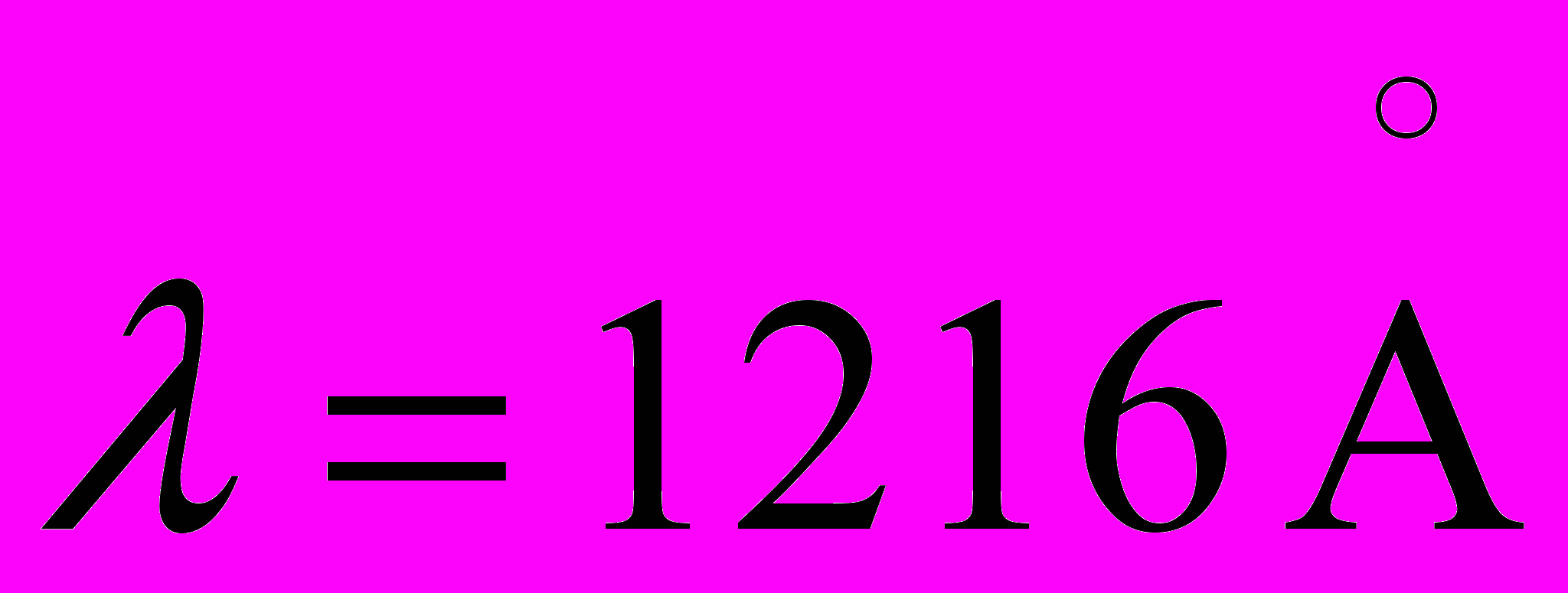 и
и 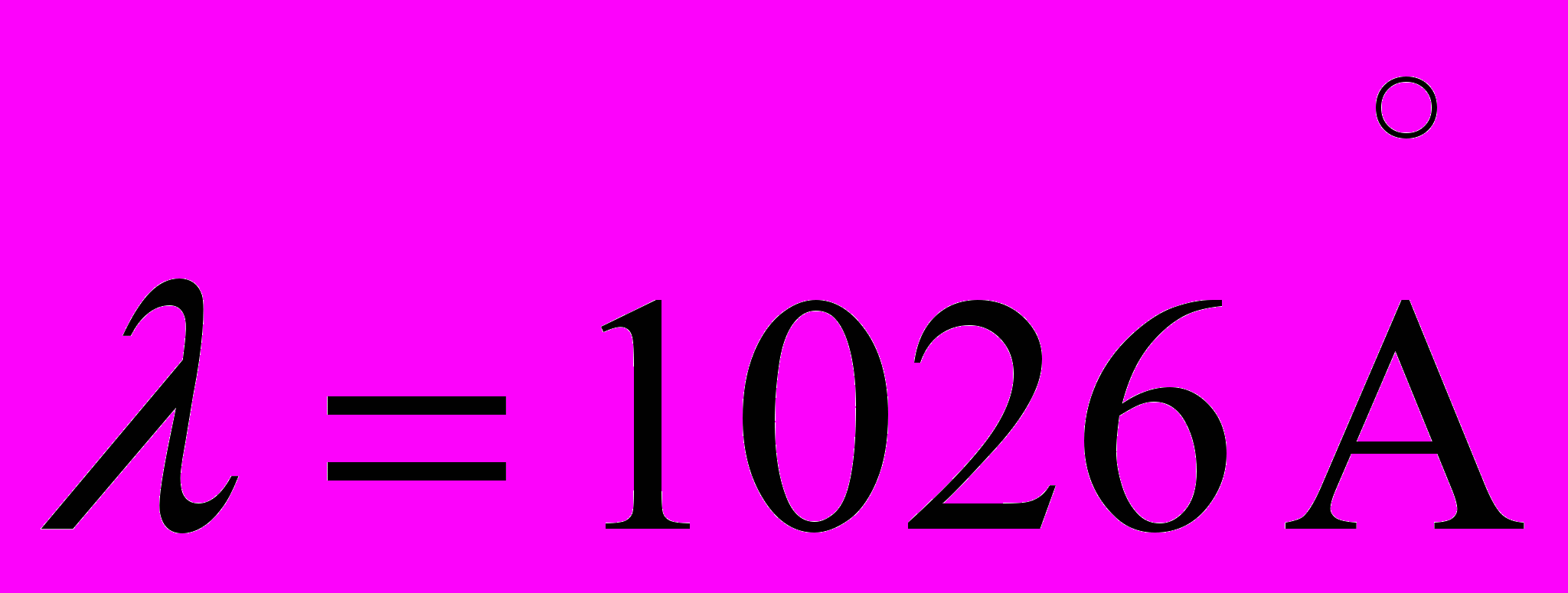 соответствуют переходу с уровней n=2 и n=3 на нижний уровень. Определите длину волны интенсивной линии водорода в видимой области, которой возникает при переходе с уровня n=3 на уровень n=2. Полученные результаты сравните с табличными данными.
соответствуют переходу с уровней n=2 и n=3 на нижний уровень. Определите длину волны интенсивной линии водорода в видимой области, которой возникает при переходе с уровня n=3 на уровень n=2. Полученные результаты сравните с табличными данными.20. Газообразный литий, содержащий N=31016 атомов, находится при T=1500К. При этом мощность испускания резонансной линии
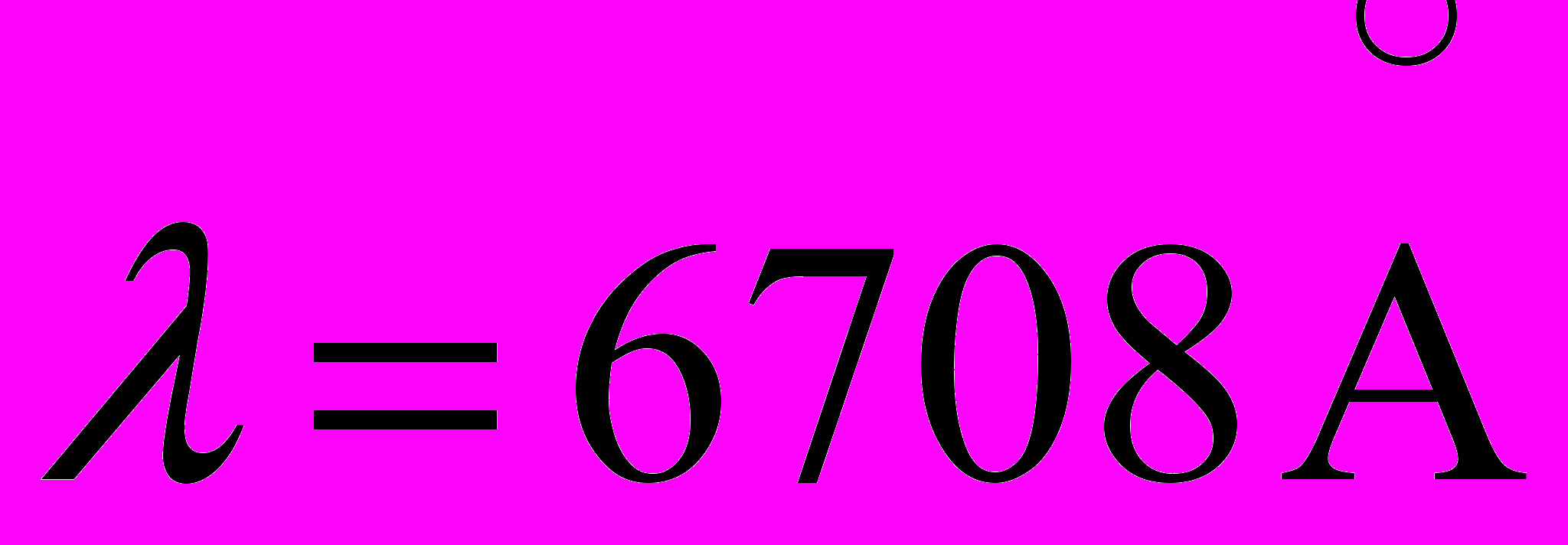 (2p-2s) с
(2p-2s) с  равна Р=0,25 Вт. Найти среднее время жизни атома лития в состоянии резонансного возбуждения.
равна Р=0,25 Вт. Найти среднее время жизни атома лития в состоянии резонансного возбуждения.21. Определить потенциал ионизации и первый потенциал возбуждения атома Na, у которого квантовые дефекты основного терма 3s и терма 3p равны соответственно 1,37 и 0,88.
22. Вычислить квантовые дефекты s-p-термов Li, если известно, что энергия связи валентного электрона в основном состоянии равна 5,39 эВ, а первый потенциал возбуждения 1,85 эВ и длина волны головной линии диффузной серии
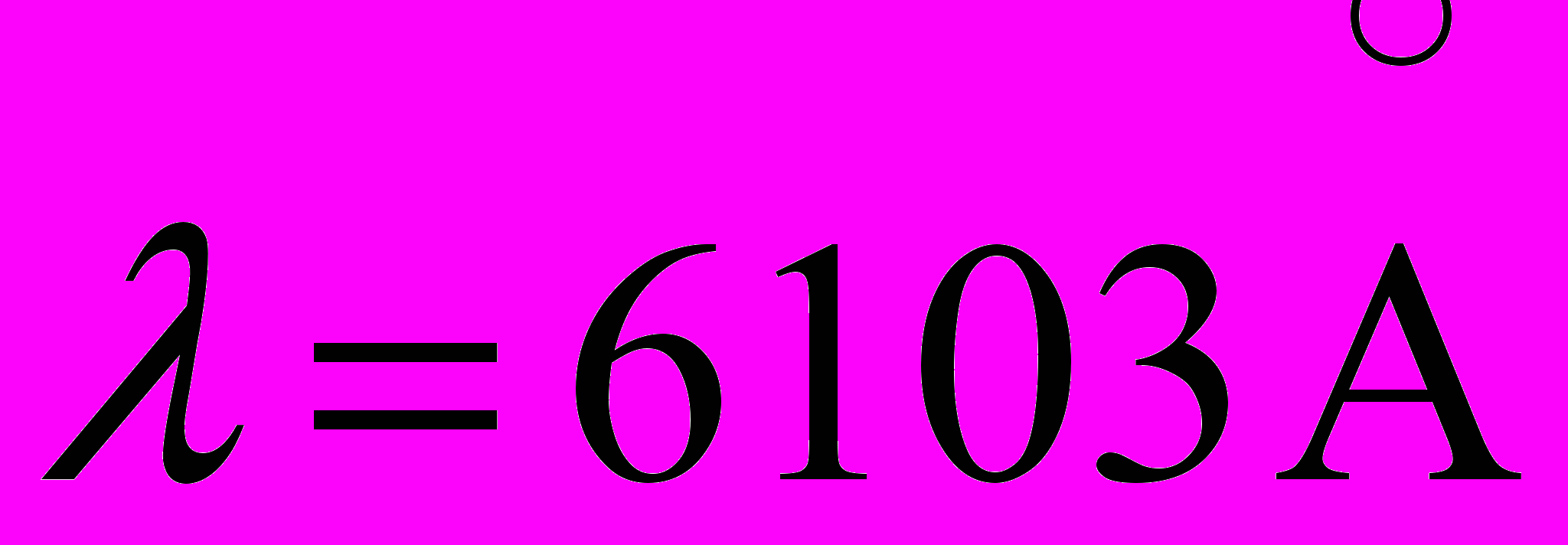 .
.23. Найти величину расщепления (эВ) уровня 4p атома K, если известно, что длины волн компонент дуплета резонансной линии равны
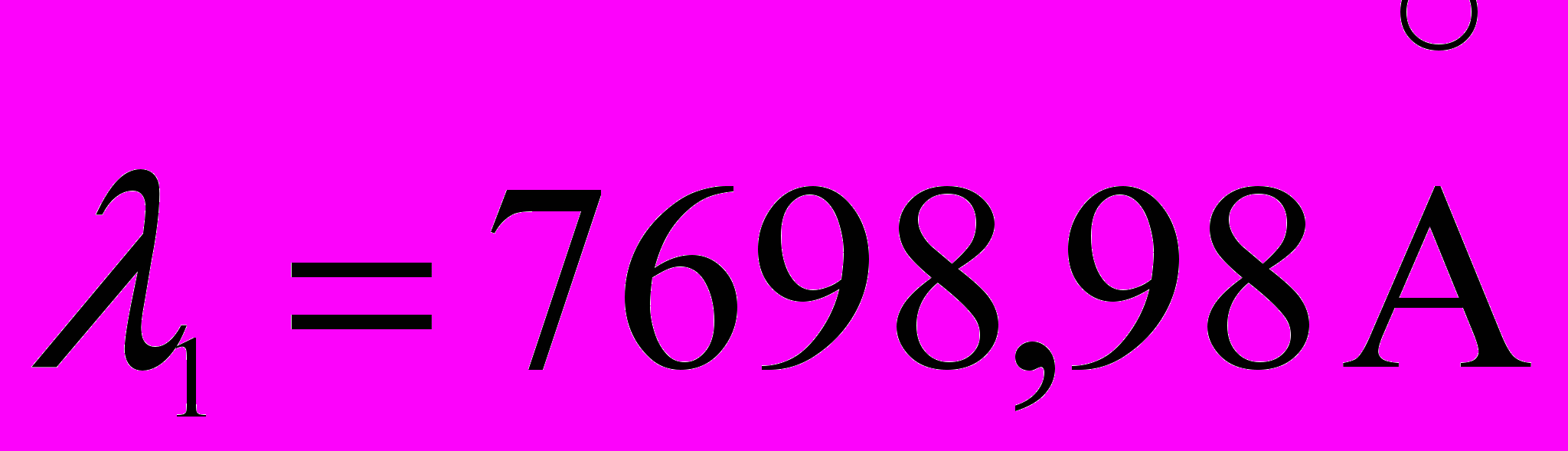 и
и 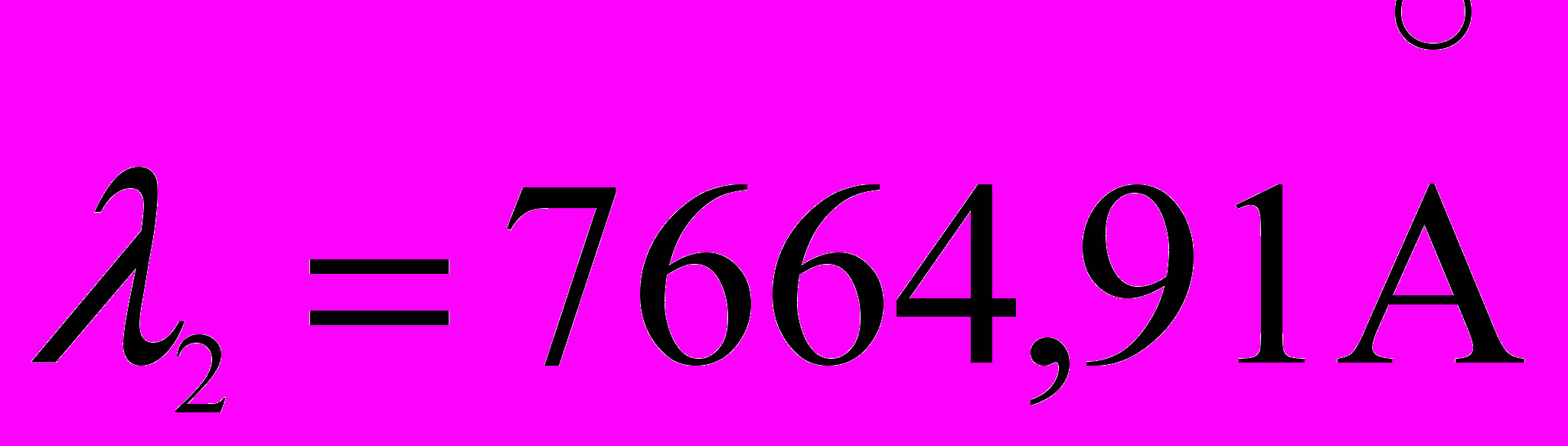 .
.24. Вычислить электронные конфигурации типа np5u1l1 возникающие при возбуждении одного из p-электронов атома Ne.
25. Найти энергию связи валентного электрона в основном состоянии атома Li (литий), если известно, что длины волн головной линии резкой серии и ее коротковолновой границы равны соответственно
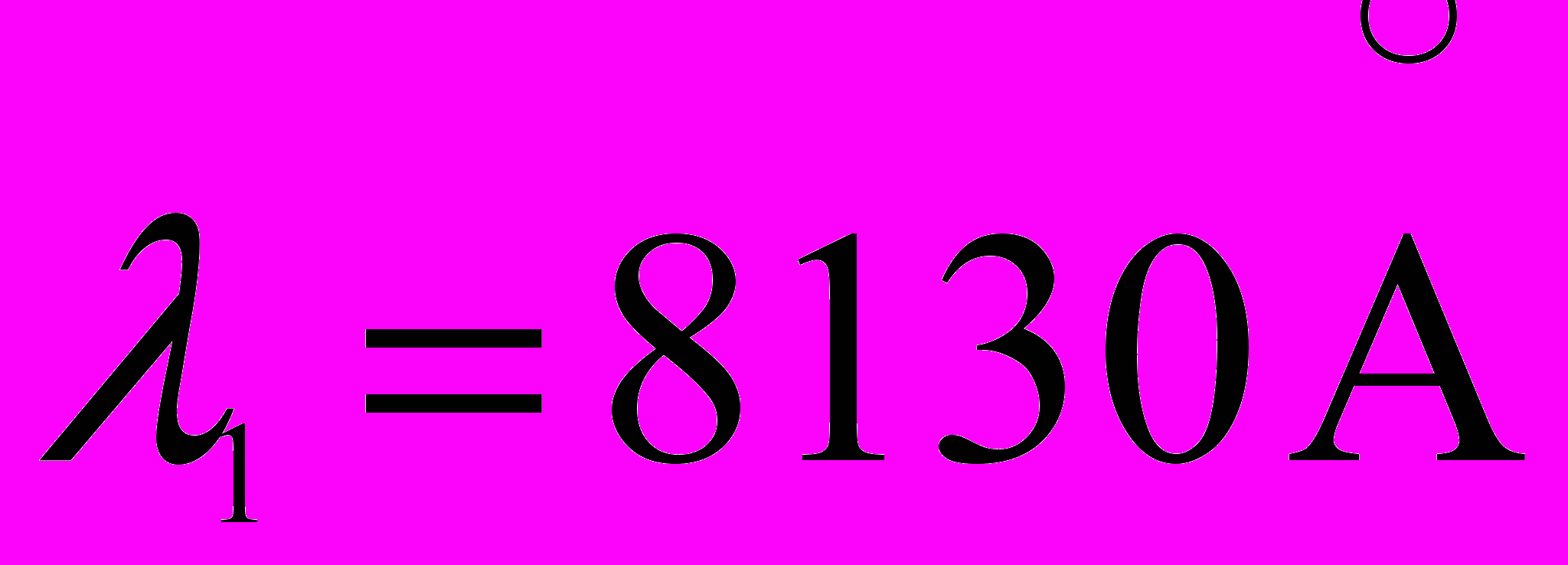 и
и 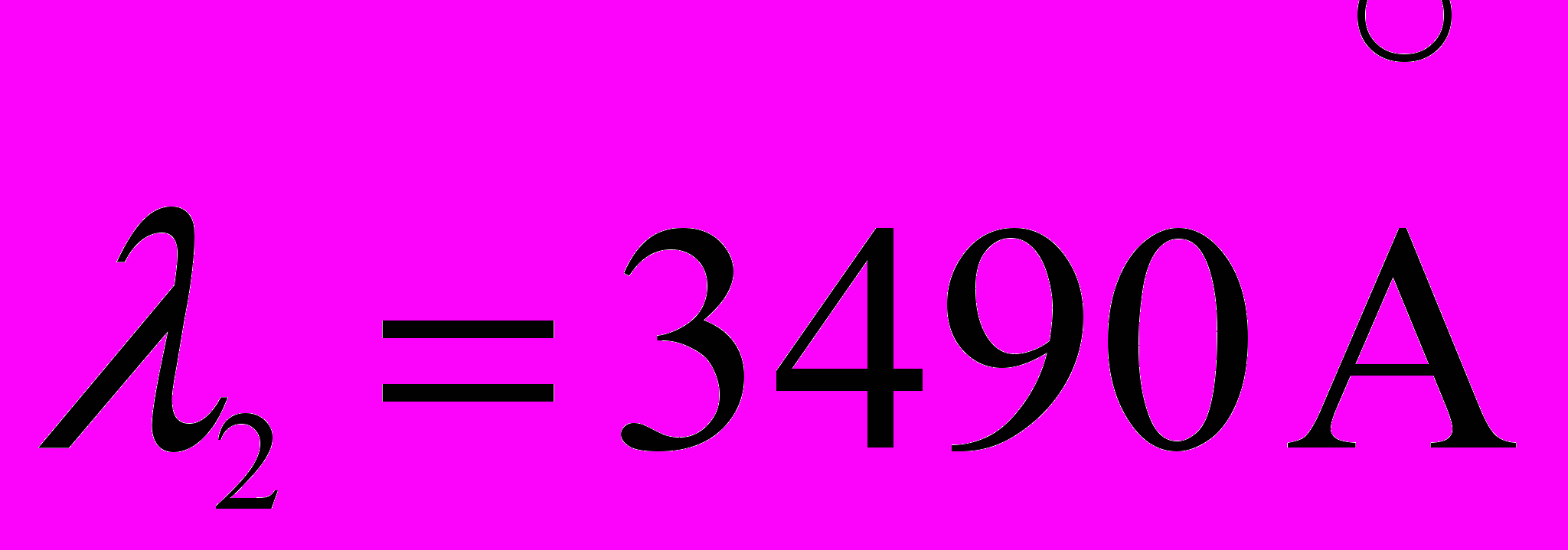 .
.26. Определить отношение числа атомов газообразного натрия в состоянии 3p к числу атомов в основном состоянии при T=4000K. Длина волны резонансной линии (3p-3s)
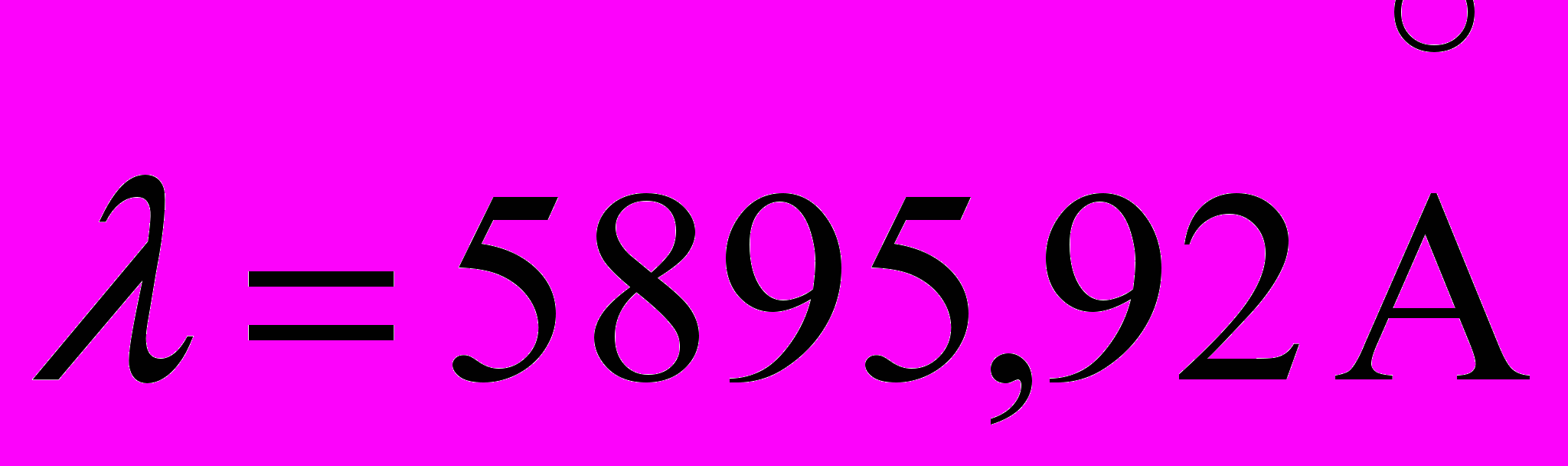 c энергией возбуждения
c энергией возбуждения 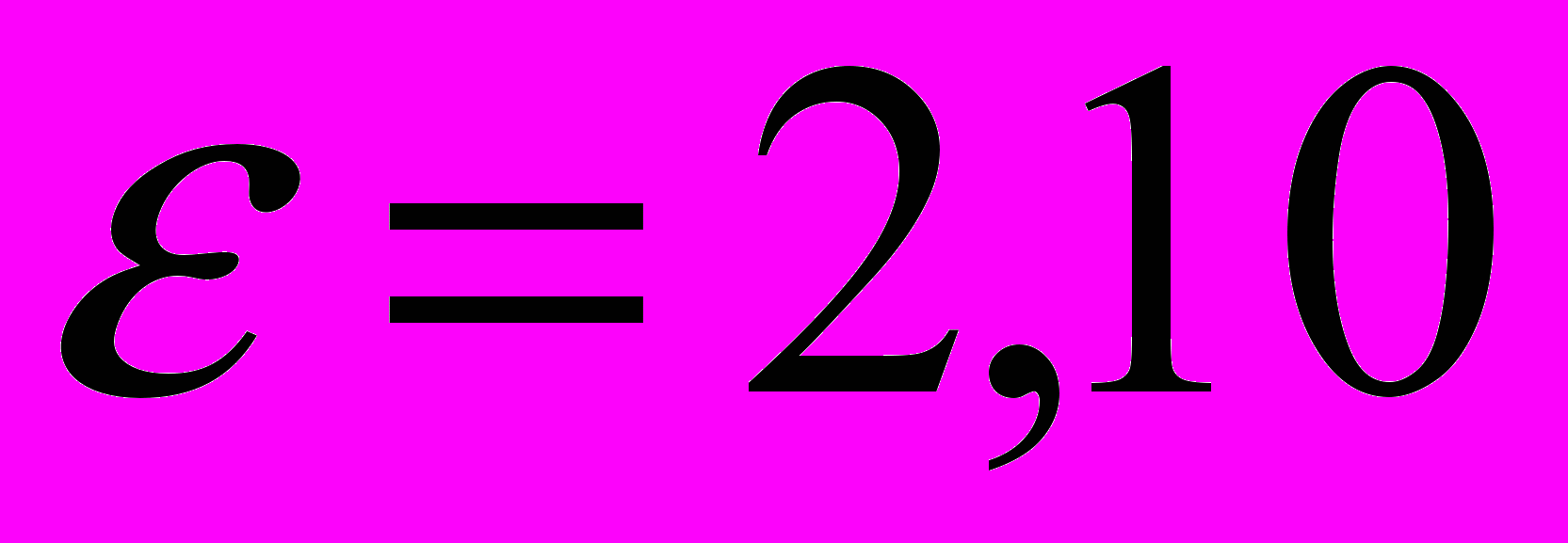 эВ.
эВ.27. Во сколько раз возрастает интенсивность линии Cu II
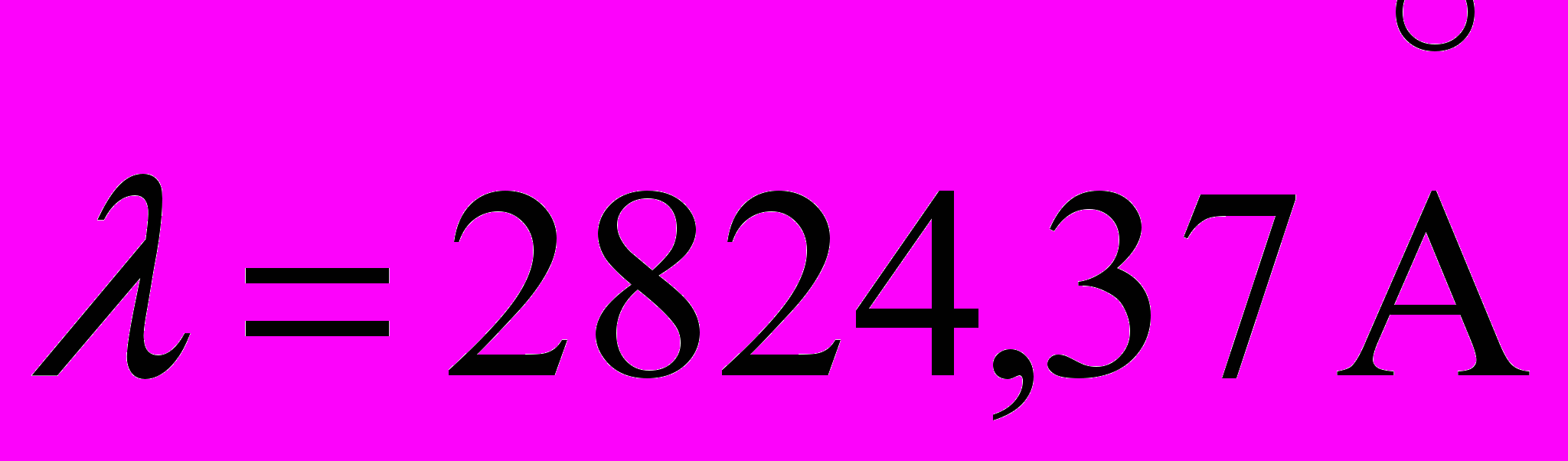
c
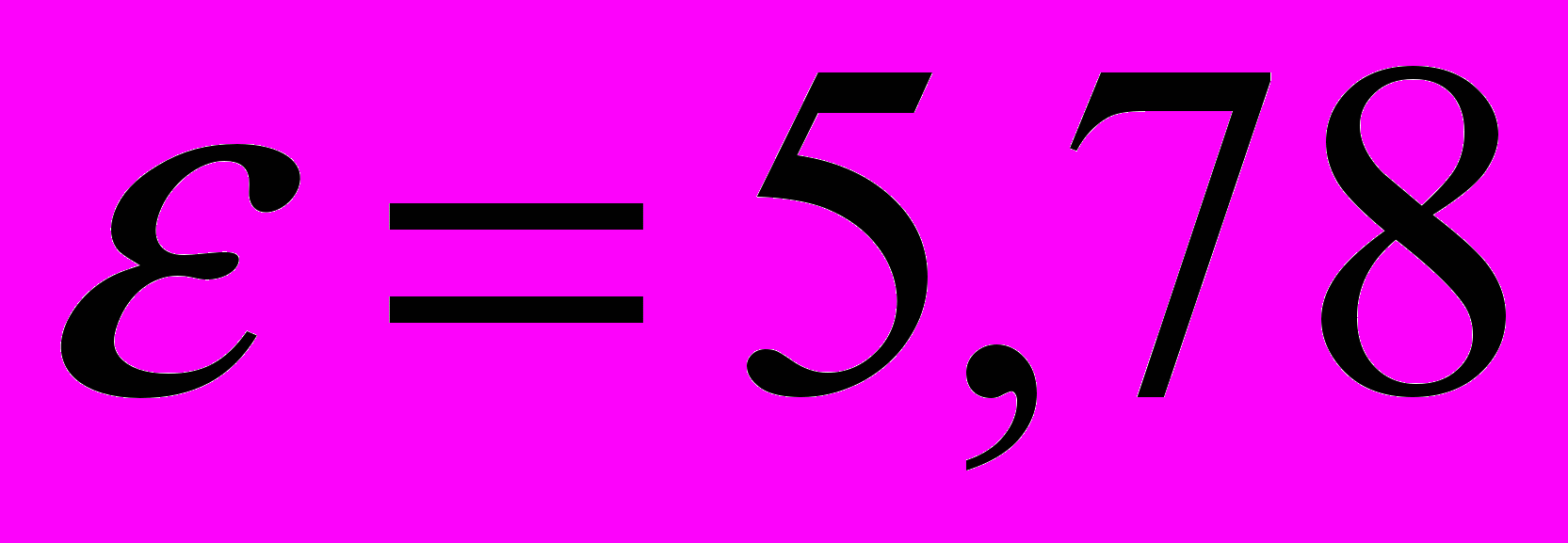 эВ при увеличении температуры источника света от 3000К до 5000К. Ионизация меди при этих температурах мала и может не учитываться.
эВ при увеличении температуры источника света от 3000К до 5000К. Ионизация меди при этих температурах мала и может не учитываться.28. Объясните связь между интенсивностью спектральной линии и почернением ее изображения на фотопластинке.
29. Выписать электронную конфигурацию и с помощью правила Гунда найти основной терм атома кислорода.
30. Выписать электронную конфигурацию и с помощью правила Гунда найти основной терм атома, незамкнутая оболочка которого заполнена равно на половину пятью электронами.
31. Во сколько раз возрастает интенсивность линии Cu I
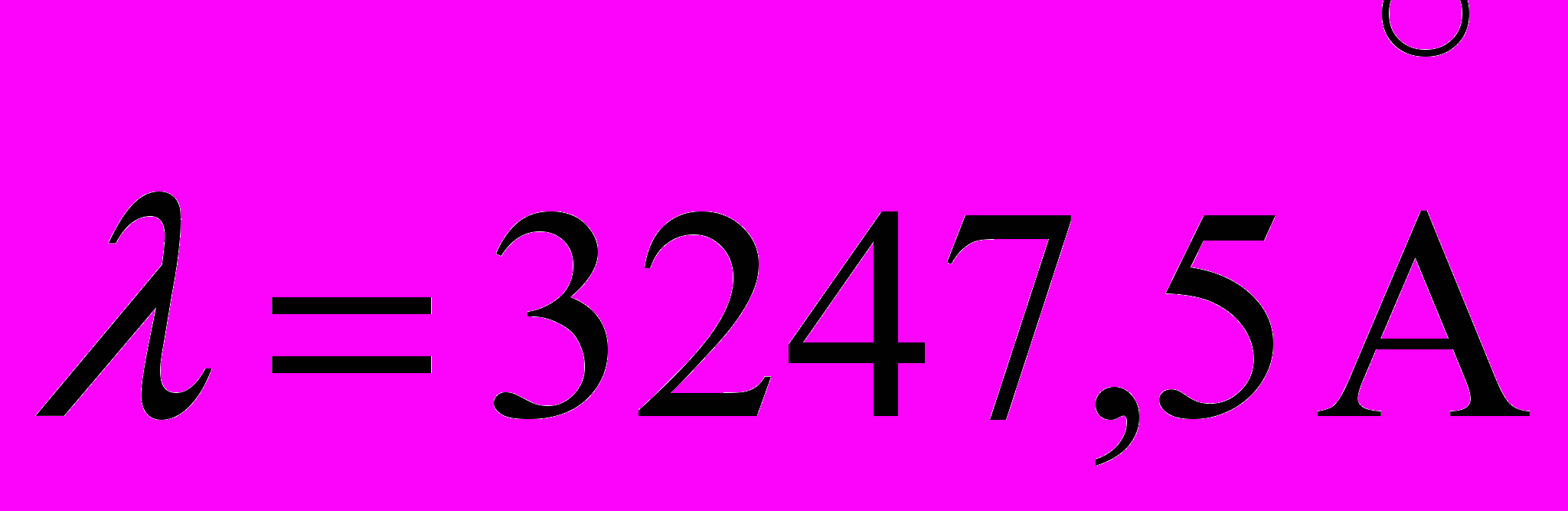
c
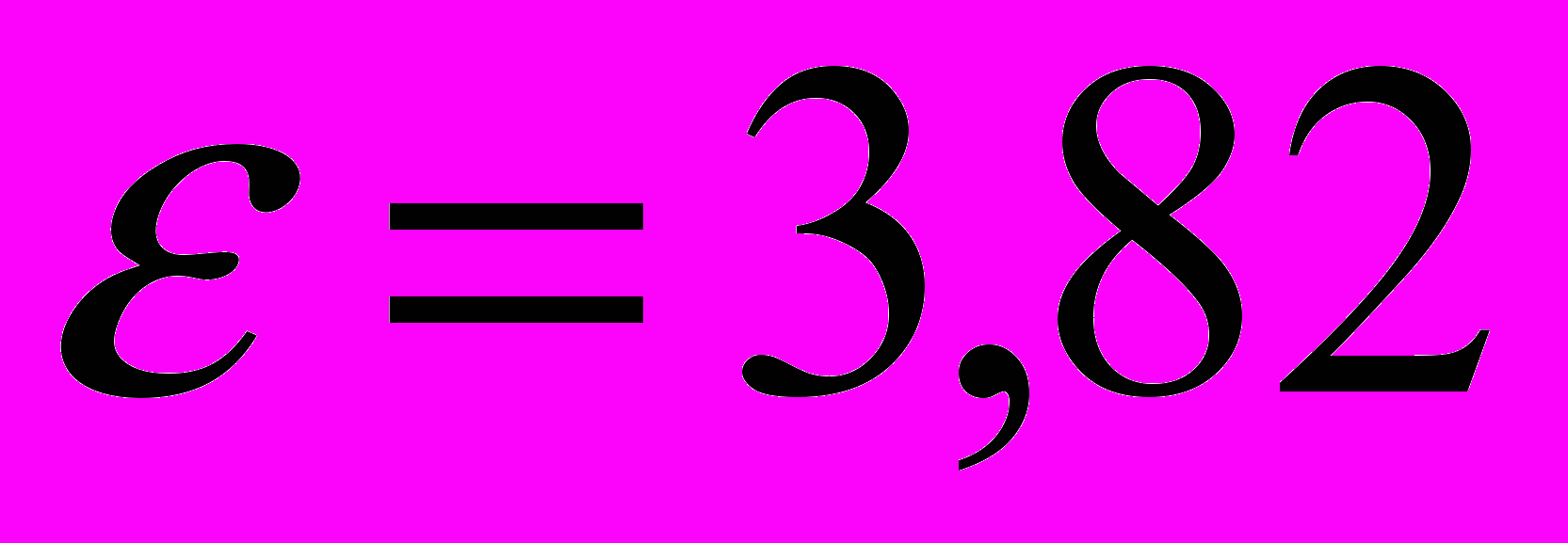 эВ при увеличении температуры источника света от 3000К до 5000К. Ионизация меди при этих температурах мала и может не учитываться.
эВ при увеличении температуры источника света от 3000К до 5000К. Ионизация меди при этих температурах мала и может не учитываться.32. Определите возможную мультиплетность терма D3/2.
33. Определите возможную мультиплетность термов атома C (углерод), если возбуждаются электроны только внешних незамкнутых оболочек.
34. Определить число возможных состояний двухэлектронной системы из p- и d-электронов.
35. Выписать электронную конфигурацию и с помощью правила Гунда найти терм атома N. Электронные конфигурации этого атома соответствует застройке электронных оболочек в нормальном порядке.
36. Выписать электронную конфигурацию и рассчитать величину дуплетного расщепления (эВ) основного терма 2pо для атома Al в нормальном состоянии.
37. Найти основной терм атома и электронную конфигурацию незаполненной подоболочки nd; nd2; nd3.
38. В спектре калия есть линии
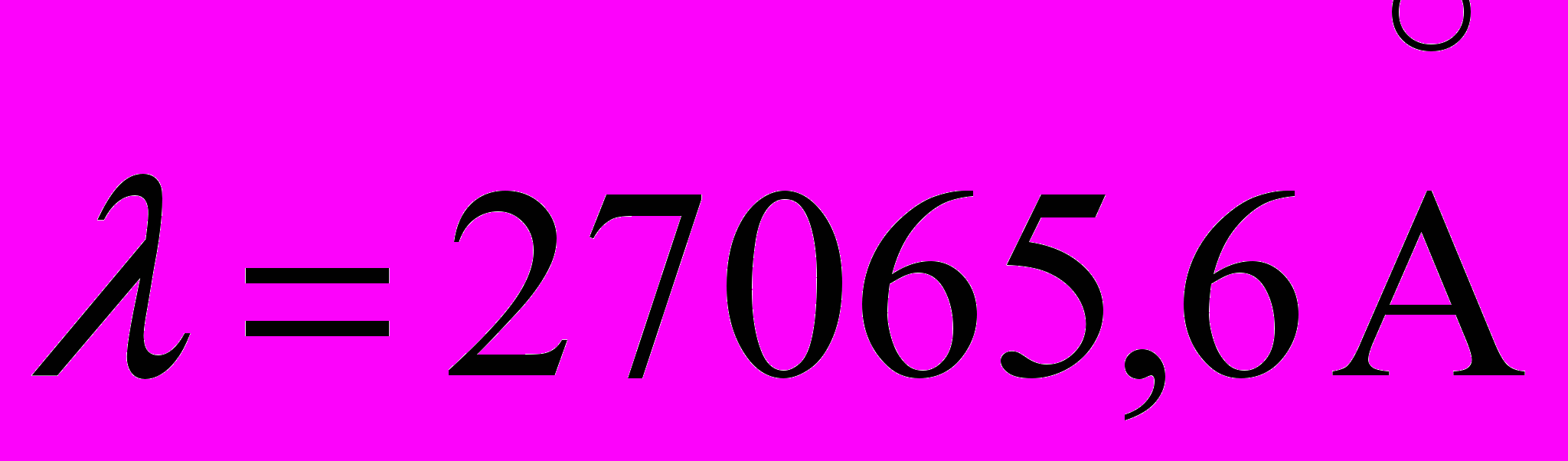 (переход 5p5s),
(переход 5p5s), 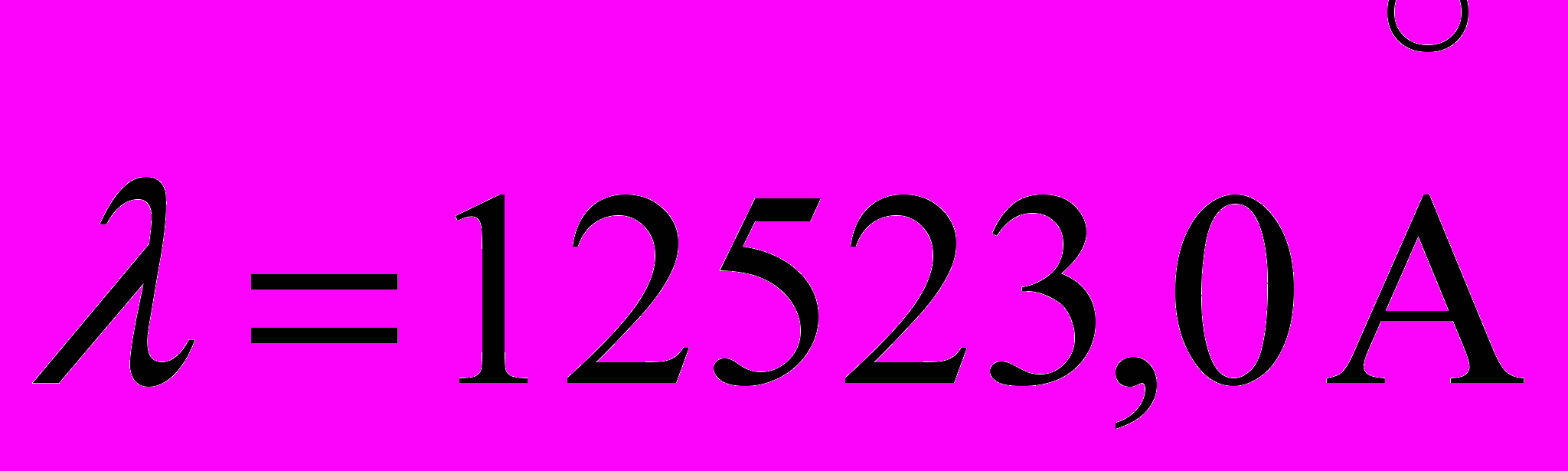 (переход 5s4p) и
(переход 5s4p) и 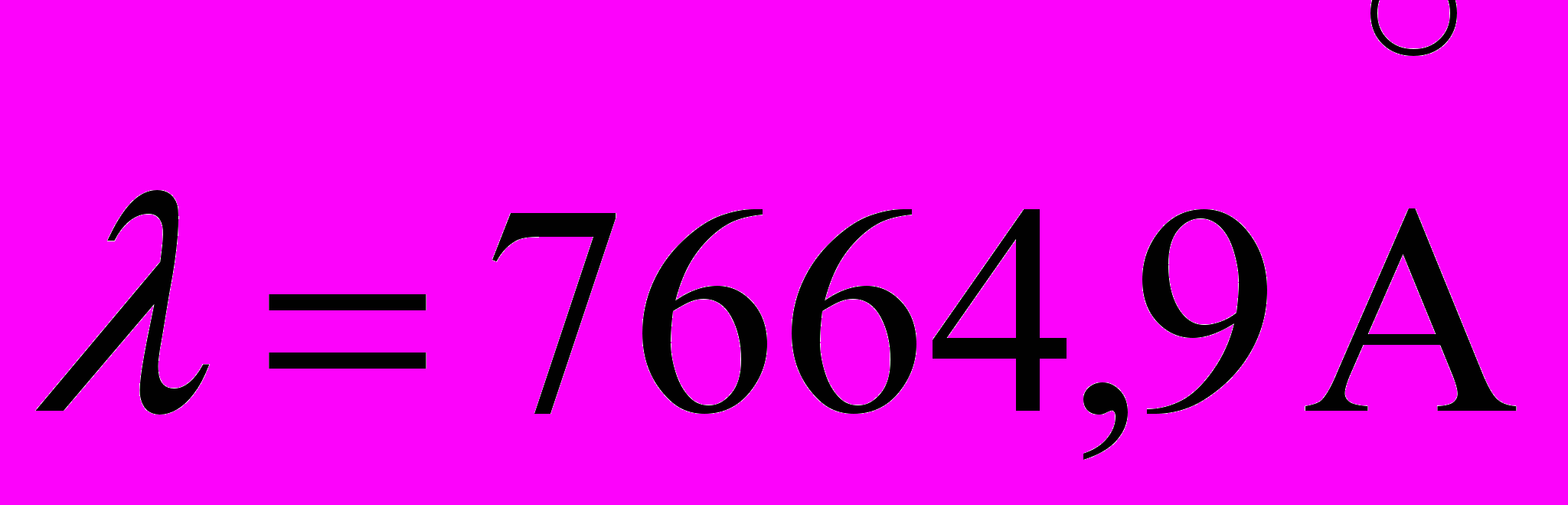 (4p4s). Найдите длину волны спектральной линии, соответствующей переходу электрона между уровнями (5p-4s).
(4p4s). Найдите длину волны спектральной линии, соответствующей переходу электрона между уровнями (5p-4s).39. Сколько спектральных линий, разрешенных правилами отбора, возникает при переходе атомов Li (литий) в основное состояние из состояния 4s?
40. Выпишите четные термы конфигурации 3d64s2 для нейтрального атома железа.
41. Выписать возможные типы термов атомов, содеоржащих кроме заполненных оболочек: а) два электрона s и p; б) два электрона p и d.
42. Мультиплетное расщепление. Причины, вызывающие мультиплетное расщепление.
43. Выписать электронную конфигурацию и с помощью правила Гунда найти основной терм атома азота (N).
44. Выпишите четные термы конфигураций 3d64s и 3d7 для Fe II.
Рекомендуемая литература.
1. Ельяшевич М.А. Атомная спектроскопия. М., 1962.
2. Зайдель А.Н., Прокопьев В.К., Райский С.М. Таблицы спектральных линий. Гостехиздат, М., 1952.
3. Зайдель А.Н., Калитеевский Н.И. и др. Эмиссионный спектральный анализ атомных материалов. Гостехиздат, М., 1960.
4. Кустанович И.М. Спектральный анализ. Гостехиздат, М., 1962.
