Рабочая программа учебной дисциплины ф тпу 1 -21/01 утверждаю
| Вид материала | Рабочая программа |
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 360.66kb.
- Рабочая программа учебной дисциплины ф тпу 1 -21/01, 102.93kb.
- Рабочая программа учебной ф тпу 1 21 / 01 дисциплины утверждаю: Директор иип, 107.44kb.
- Рабочая программа учебной дисциплины ф тпу 1- /01 утверждаю, 624.2kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 613.5kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 358.31kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 214.59kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 370.96kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 409.82kb.
- Рабочая программа учебной дисциплины ф тпу 1-21/01 утверждаю, 389.67kb.
| 9Рабочая программа учебной дисциплины |  | Ф ТПУ 7.1 –21/01 | ||||||||||||||||||||||||||||||
| | | УТВЕРЖДАЮ Декан факультета _________ В.М. Погребенков (подпись) ( И.О. фамилия) ___________ (дата) | ||||||||||||||||||||||||||||||
| Аналитическая химия и физико-химические методы анализа Рабочая программа для направления 550800 – «Химическая технология и биотехнология» Факультет___–_____Химико-технологический (ХТФ)__________________ (полное название и сокращенное обозначение) Обеспечивающая кафедра_– Физической и аналитической химии (ФАХ) Курс__– ___второй (2), третий (3)____ Семестр_– __третий (3), шестой (6)__ Учебный план набора _2008__года с изменениями ____20______года Распределение учебного времени
| ||||||||||||||||||||||||||||||||
| | ||||||||||||||||||||||||||||||||
Дата создания
Рабочая программа учебной дисциплины |  | Ф ТПУ 7.1 –21/01 |
ПРЕДИСЛОВИЕ
1. Рабочая программа составлена на основе ГОС по направлению 550800 «Химическая технология и биотехнология»
РАССМОТРЕНА И ОДОБРЕНА на заседании обеспечивающей кафедры физической и аналитической химии
" 1 " сентября 2009 г протокол № 1 .
2.Разработчик (и)
доцент кафедры ФАХ ________________ Н.М. Дубова
3.Зав. обеспечивающей кафедрой ____________ А.А. Бакибаев
4. Рабочая программа СОГЛАСОВАНА с факультетом, выпускающими кафедрами специальности, СООТВЕТСТВУЕТ действующему плану.
Зав. выпускающей кафедрой________________ А.А. Бакибаев
Д
ата создания
АННОТАЦИЯ
Аналитическая химия и физико-химические методы анализа
240100 (б)
Каф.ФАХ ХТФ
Доцент, к.х.н. Дубова Надежда Михайловна
Тел./факс (3822) 563832, e-mail:
Цель: формирование знаний и умений в области основ химических методов качественного и количественного методов анализа, физико-химических методов анализа, методов разделения и концентрирования.
Содержание: общие вопросы подготовки пробы к анализу, выбор метода анализа, метрологические аспекты аналитической химии, методики анализа некоторых промышленных и природных объектов, расчет результатов анализа с учетом метрологических объектов.
Курс 2/3 сем. – зачет; 3/6 сем.– зачет.
Всего 246часов, в т.ч. Лк – 26ч, Лб – 80 ч.
Annotation
The syllabus “Analytical Chemistry and Physicochemical Methods” is designed for training the specialists and bachelors of the Chemistry and Chemical Engineering Faculty on the following educational programs: 240100 “Chemical and Biological Technology”; 250400 "Natural Energy Transmitters and Carbon Materials Technology"? 251800 “Fundamental Processes in Chemical Manufacturing and Cybernetics”, 320700 “EnvironmentalProtection and Rational Utilisation of Natural Resources”. This syllabus is drawn up according to the State Educational Standards and the Professional Educational Program of TPU 550800. Its structure and contents corresponds to the Standard of TPU “STI TPU 2.0.01-99”. The syllabus includes the foundations of chemical analytical methods, physicochemical methods, methods of separation and concentration, general principles of sample preparation, choice of the analytical method, metrological aspects of analytical chemistry, methods of analysis of different natural and industrial samples, data handling. The order of the reading of lectures, performance of practices and laboratory works with the instruction of contact and self-study hours, a rating-list, and references are presented at the end of the syllabus. The syllabus is designed by N.M. Dubova, Ph.D., Associate Professor of the Physical & Analytical Chemistry Department at the Chemistry & Chemical Engineering Faculty.
E-mail: nnch@lab506.chtd.tpu.edu.ru
1. ЦЕЛИ И ЗАДАЧИ ДИСЦИПЛИНЫ
1.1. Цели преподавания дисциплины
Аналитическая химия - одна из основных химических дисциплин, изучаемых студентами химико-технологических специальностей.
Задача аналитической химии состоит в развитии принципов и методов идентификации химических соединений, определения качественного и количественного состава вещества. Аналитическая химия непосредственно связана с производством; методами аналитической химии осуществляется входной, технологический, арбитражный и экологический контроль. Студенту химико-технологического факультета, будущему инженеру-технологу, необходимо понимание сущности предмета "Аналитическая химия" и овладение минимумом знаний и навыков в области аналитической химии.
Цели преподавания дисциплины “Аналитическая химия и ФХМА” сводятся к следующим.
Студент должен:
понимать и иметь представление:
Федеральные требования
- основные теоретические положения, лежащие в основе химических (титриметрических, гравиметрических) и физико-химических (хроматографических, электрохимических, оптических) методов идентификации и определения веществ;
- природу и сущность явлений, процессов в различных химических системах, лежащих в основе химических и физико-химических методов анализа;
- специфичность аналитического сигнала и особенности его измерения в различных методах анализа;
знать и уметь использовать:
Федеральные требования
- Основы химических методов качественного и количественного анализа (титриметрии и гравиметрии) - специфические реакции, действия групповых реагентов по кислотно-основной классификации, рабочие растворы, определяемые вещества, индикаторы, кривые титрования, стадии гравиметрического определения.
- Основы физико-химических методов анализа
а) оптических (эмиссионный спектральный анализ, методы атомной и молекулярной абсорбционной спектроскопии и др.)
б) хроматографических (методы ионообменной хроматографиии, газожидкостной хроматографии и др.)
в) электрохимических методов анализа (вольтамперометрических, потенциометрических, электрогравиметрических и др.)
- Основные принципы и методы идентификации химических соединений химическими и физико-химическими методами
- Основные положения учета погрешностей на всех стадиях выполнения анализа и расчета результатов анализа с учетом метрологических характеристик
- Основные положения, лежащие в основе выбора метода анализа и схемы анализа.
иметь навыки:
Федеральные требования
- проведения качественного и количественного анализа химическими и физико-химическими методами на основе измерения величины аналитического сигнала
- выполнения анализа некоторых промышленных и природных объектов на основе самостоятельного выбора схемы анализа и методики его проведения
Университетские требования
- приготовления растворов заданной концентрации
- работы на аналитических установках и приборах
- оформления результатов анализа с учетом метрологических характеристик.
1.2. ЗАДАЧИ ИЗЛОЖЕНИЯ И ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
Для успешного овладения теоретическими знаниями и практическими умениями используется полный набор методического материала: учебники, учебные пособия, курс лекций, методические указания к проведению лабораторных работ, варианты домашних заданий и методические указания к их решению.
Объем, содержание и уровень лекционного курса позволяет студентам на базе имеющихся у них знаний общей, неорганической, органической, физической химии, физики понять основные теоретические положения, лежащие в основе химических и физико-химических методов идентификации и определения веществ и самостоятельно выбрать и обосновать наиболее оптимальный метод анализа, схему анализа. Для закрепления теоретических знаний, полученных на лекциях, а также в индивидуальной познавательной деятельности, предусмотрено решение индивидуальных домашних заданий, беседы с преподавателем в форме коллоквиума, выполнение различных тестовых и контрольных заданий.
Лабораторный практикум позволяет студентам приобрести необходимые навыки в использовании различных приемов, необходимых для проведения анализа, включающих технику взвешивания на аналитических весах, умение правильно пользоваться химической посудой, проведения основных стадий анализа и т.д., а также умения работы на химических установках и сложных аналитических приборах.
Все перечисленные выше методы усвоения теоретического материала и приобретения практических навыков должны приводить к тому, чтобы студент мог самостоятельно провести анализ некоторых промышленных и природных объектов и представить результат анализа с учетом метрологических характеристик.
Контроль знаний студентов осуществляется путем опросов по ходу выполнения лабораторных работ, проведением коллоквиумов по теоретическим основам методов, проведением тестовых контролей, контрольных работ, при выполнении индивидуальных расчетных заданий.
Курс аналитической химии рассчитан на два семестра: III семестр - химические методы анализа; VI семестр - физико-химические методы анализа. В каждом семестре студент получает оценку (дифференциальный зачет) с учетом рейтинга (баллов). Рейтинговая система учитывает не только итоговую оценку, но отражает и систематичность приобретения знаний в течение семестра, успешность прохождения контрольных точек (коллоквиумов), выполнения домашних заданий, работу, выполненную сверх обязательной программы (участие в олимпиадах, выполнение исследовательских работ, написание рефератов и др.).
2.1. СОДЕРЖАНИЕ ТЕОРЕТИЧЕСКОГО РАЗДЕЛА
дисциплины (лекции)
3 семестр
Тема 1. ВВЕДЕНИЕ В АНАЛИТИЧЕСКУЮ ХИМИЮ (2 часа).
Предмет аналитической химии (АХ). Место АХ среди других наук. Значение АХ в науке, технике, промышленности. Основные объекты анализа. Значение аналитической химии в науке, технике, промышленности. Краткая историческая справка развития АХ. Современное состояние АХ, основные аналитические проблемы. Химический контроль производства. Классификация методов количественного анализа. Сравнительная характеристика химических, физико-химических и физических методов анализа. Элементный, молекулярный, фазовый анализ. Качественный и количественный анализ.
Тема 2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КАЧЕСТВЕННОГО
АНАЛИЗА .Сущность количественного химического анализа (2 часа).
Введение в качественный анализ. Классификация химических методов качественного анализа. Особенности и характеристики аналитических реакций, способы и условия их проведения, чувствительность, активность и специфичность реакций. Дробный и систематический ход анализа. Классификация катионов и анионов.
Сущность количественного анализа. Классификация химических методов количественного анализа: титриметрические и гравиметрические. Основные этапы анализа различных объектов: отбор средней пробы и подготовка ее к анализу. Выбор метода анализа. Некоторые вопросы метрологии. Классификация погрешностей в количественном анализе. Точность и правильность анализа. Применение методов математической статистики при обработке результатов анализа.
Тема 3. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ АНАЛИЗА (2 часа)
Сущность титриметрии. Классификация титриметрических методов анализа. Способы титрования: прямое, обратное, косвенное. Методы пипетирования и отдельных навесок. Требования к реакциям, используемым в титриметрии. Способы приготовления и установки концентраций рабочих растворов.
Тема 4. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ (2 часа)
Сущность кислотно-основного титрования. Рабочие растворы, стандартные и определяемые вещества.
Кислотно-основное равновесие в водных растворах. Водные растворы сильных и слабых кислот, сильных и слабых оснований. Расчет рН. Буферные растворы в химическом анализе. Их состав, буферная емкость, расчет рН. Использование гидролиза в аналитической химии. Расчет рН в растворах гидролизующихся солей. Кривые титрования в методе нейтрализации. Расчет скачка на кривых титрования. Индикаторы в методе нейтрализации. Выбор индикаторов в методе нейтрализации. Практическое использование методов кислотно-основного титрования.
Тема 5. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДОВ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ (2 часа)
Сущность метода окислительно-восстановительного титрования. Особенность реакций окисления-восстановления, используемых в анализе. Окислительно-восстановительный потенциал. Уравнение Нернста. Константа равновесия окислительно-восстановительных реакций. Направление ОВР. Классификация методов окислительно-восстановительного титрования. Кривые титрования. Способы определения точки эквивалентности в методах окислительно-восстановительного титрования. Аналитические возможности методов окислительно-восстановительного титрования.
Тема 6. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДОВ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ (2 часа)
Общая характеристика метода использования реакций комплексообразования в аналитической химии. Равновесие аналитических реакций комплексообразования и их регулирование. Константы устойчивости. Сущность метода комплексонометрии. Комплексоны, их применение в химическом анализе. Металлоиндикаторы метода комплексонометрии, сущность их действия. Аналитические возможности комплексонометрического метода.
Тема 7. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ -
ОСАДОК-НАСЫЩЕННЫЙ РАСТВОР. ОСАЖДЕНИЕ И РАСТВОРЕНИЕ МАЛОРАСТВОРИМЫХ СОЕДИНЕНИЙ В ОСАДИТЕЛЬНОМ ТИТРОВАНИИ И ГРАВИМЕТРИИ (2 часа)
Использование гетерогенных систем в аналитической химии и их характеристика. Растворимость малорастворимых соединений. Правило произведения растворимости. Условия осаждения и растворения малорастворимых соединений. Понижение растворимости. Солевой эффект. Дробное осаждение. Превращение одних малорастворимых соединений в другие. Примеры использования этих явлений в химическом анализе.
Тема 8. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ (2 часа)
Требования, предъявляемые к реакциям осаждения в титриметрическом анализе. Классификация методов осадительного титрования. Кривая титрования. Индикаторы. Метод Мора, метод Фольгарда, метод Фаянса. Практическое применение метода осадительного титрования.
Тема 9. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ГРАВИМЕТРИЧЕСКОГО АНАЛИЗА (2 часа)
Сущность гравиметрического анализа. Классификация методов гравиметрии: методы отгонки, методы осаждения. Условия и правила аналитического осаждения. Получение аморфных и кристаллических осадков. Требования, предъявляемые к осаждаемой, весовой формам, осадителю. Вычисления в гравиметрии. Точность анализа. Примеры практического использования.
3.1. СОДЕРЖАНИЕ ПРАКТИЧЕСКОГО РАЗДЕЛА
Содержание лабораторных занятий (45 часов)
- Правила работы и техники безопасности в химической лаборатории. Способы выражения концентрации, приготовление растворов. Приготовление рабочего раствора HCl. (4 часа).
- Способы титрования. Весы и взвешивание. Приготовление стандартного раствора буры. Стандартизация HCl по буре ( 4 часа).
- Определение Na2CO3 в растворе методом нейтрализации. Коллоквиум №1 (Основные понятия в титриметрии). Расчет рН в растворах различных электролитов (4 часа).
- Определение органических кислот в растворе. Определение общей щелочности и общей кислотности природных вод. Расчеты скачка рН (4 часа).
- Определение NH3 в солях аммония методом замещения. Тестовый контроль по методу нейтрализации (4 часа).
- Коллоквиум «2 по методу нейтрализации (2 часа).
- Расчеты в редоксиметрии. Определение Fe (2+) в соли Мора методом перманганатометрии или определение окисляемости воды (4 часа).
- Определение Cu (2+) в медном купоросе методом иодометрии или определение растворенного кислорода в воде (ХПО) иодометрическим методом (2 часа).
- Тестовый контроль по перманганатометрии, иодометрии, бихроматометрии. Коллоквиум по методу редоксиметрии. Определение жесткости природной и питьевой воды комплексонометрическим титрованием (4 часа).
- Расчеты в осадительном титровании (2 часа).
- Зачетная лабораторная работа (4 часа).
- Коллоквиум по методу осаждения (2 часа).
- Итоговый контроль (4 часа).
На кафедре физической и аналитической химии ТПУ в каждую из лабораторных работ введены элементы, повышающие интерес студентов к ним и их познавательную активность. Например, в работе "Определение общей жесткости воды» выбирается в качестве объекта анализа водопроводная питьевая вода, знание жесткости которой имеет повседневный интерес.
Перед лабораторной работой преподаватель беседует со студентом по основным теоретическим вопросам (которые студент проработал самостоятельно) изучаемого аналитического процесса и особенностям лабораторной работы. При выполнении лабораторных работ каждый студент оформляет отчет, в котором указываются цели работы, ход работы, таблица численных результатов, вычисления и выводы.
4.1. ОРГАНИЗАЦИЯ САМОСТОЯТЕЛЬНОЙ ПОЗНАВАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ
Самостоятельная работа составляет 72 часа, в том числе:
- Освоение теоретического материала лекций, 9 часов
подготовка к коллоквиумам 24 часов
- Подготовка к лабораторным занятиям 7 часов
- Работа над индивидуальными домашними заданиями
по темам:
а) Химический эквивалент. Способы выражения
концентраций растворов
б) Способы приготовления растворов.
Расчеты по результатам титриметрического анализа. 18 часов
в) Кислотно-основное титрование.
г) Окислительно-восстановительное титрование.
д) Расчеты в гетерогенных системах "осадок-раствор".
Осадительное титрование
- Подготовка к зачетным лабораторным занятиям 4 часа
- Самостоятельная подготовка конспектов (4 часов):
а) Метод дихроматометрии. Определение Fe2+ в растворе.
б) Характеристика метода аргентометрии и роданометрии
6.Подготовка к итоговому контролю 6 часов

Итого 72 часа
5.1. ТЕКУЩИЙ И ИТОГОВЫЙ КОНТРОЛЬ РЕЗУЛЬТАТОВ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
5.1.1. СПОСОБЫ И ОСОБЕННОСТИ ОРГАНИЗАЦИИ
КОНТРОЛЯ
При изучении курса “Аналитическая химия” используется рейтинговая система оценки знаний студентов.
Максимальная рейтинговая оценка (общий рейтинг) дисциплины составляет 1000 баллов. В нее входят: 1) рейтинг лекционного контроля; 2) рейтинг лабораторных работ; 3) рейтинг домашнего задания; 4) тестовый контроль; 5) рейтинг коллоквиума.
Чтение лекций осуществляется в специализированной аудитории с обратной связью ( 50 компьютизированных мест ) в среде автоматизированной системы управления познавательной деятельностью студентов (АСУ ПДС).В ходе прослушивания лекций студенты выполняют различные тестовые задания ( входной ,текущий , и итоговый контроль. Рейтинг лекционного контроля включает посещение лекций и выполнение итоговых лекционных заданий.
Рейтинг лабораторных работ - это оценки за выполнение лабораторной работы, оформление отчета и его сдачу преподавателю.
Рейтинг домашнего задания - это оценки за решение домашнего задания. Если задача решена правильно и «сдана» в срок, то она оценивается в 10-15 баллов. Задачи, «сданные» с опозданием, оцениваются баллами в 2 раза меньше.
Рубежный контроль осуществляется выполнением пяти коллоквиумов и двух тестовых заданий по каждому разделу и оценивается максимально в 80 баллов каждый.
Студент считается сдавшим зачет, если он полностью выполнил учебный план (сдано домашнее задание, выполнены все лабораторные работы) и если его рейтинг более 550 баллов.
Примерный тип рейтинг – листа приводится ниже.
РЕЙТИНГ – ЛИСТ
по дисциплине «Аналитическая химия» для студентов по направлению 550800 и специальностям 250400, 251800, 320700 на третий семестр.
Плановый объем учебной нагрузки:
Лекции 18 часов
Лабораторные занятия 45 часа
Итого 63часа
Виды выполняемых работ и их значение в баллах
- Лекционный контроль: 9 лек. (1025) баллов = 210 баллов
- Лабораторные работы
(выполнение
и их защита) 11 лб. (2550) баллов = 215 баллов
- Выполнение
домашних заданий 5 зад. (30) баллов = 150баллов
- Коллоквиумы,
тестовый контроль 6 контр. (50) баллов = 300 баллов
- Сдача конспектов 2консп. 25 баллов 50 баллов
- Итоговый контроль 1 контр. 100 баллов = 75 баллов
6.
Итого 1000 баллов
Зачет :651 балл
Рейтинг поощряет активных студентов дополнительными баллами за участие в химических олимпиадах, написание рефератов, занятия на курсах дополнительной химической подготовки, выполнение заданий повышенной сложности.
5.1.2. Контролирующие материалы
- Коллоквиум № 1: "Основные понятия в титриметрии" предусматривает текущий контроль усвоения материала по темам: Сущность титриметрических методов анализа, классификация титриметрических методов, рабочие растворы и определяемые вещества, способы выражения концентраций, приготовление растворов, способы и приемы титрования.
Образец варианта коллоквиума № 1
- Рабочие растворы в титриметрии. Способы установки концентраций рабочих растворов (метод отдельных навесок, метод пипетирования)
- Вычислить f, Mэкв реагирующих веществ в реакциях:
2HCl + Mg(OH)2 = MgCl2 +2H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
2KMnO4 + 5K2SO3 + 3H2SO4 = K2SO4 + 2MnSO4 + 3H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe(SO4)3 + K2SO4 + Cr2(SO4)3 + 7 H2O
- Сколько миллилитров 1М H2SO4 необходимо взять для приготовления 200 мл 0,1 н раствора.
- Какова масса навески Na2B4O7 · 10H2O на титрование которой израсходовано 20 мл 0,2 н раствора HCl?
- Коллоквиум № 2 по методу нейтрализации предусматривает текущий контроль усвоения материала по темам: равновесие в гомогенных системах: в растворах слабых и сильных кислот и оснований, гидролизующихся солях, буферных системах; расчет рН в растворах различных электролитов, кривые титрования и индикаторы метода нейтрализации.
Образец варианта коллоквиума № 2
- Гидролиз солей. Константа гидролиза. Степень гидролиза.
- Определение слабых органических кислот (на примере определения уксусной кислоты).
- Рассчитать скачок на кривой титрования при титровании 10,00 мл 0,25 н HCOOH 0,25 н NaOH (погрешность 0,1%), обосновать выбор индикатора.
- Сколько граммов ацетата натрия (NaCH3COO) необходимо растворить в 200 мл Н2О, чтобы получить раствор с рН = 8?
-
Образец тестового контроля по методу нейтрализации.
- Какие вещества могут быть использованы для стандартизации NaOH?
а) (NH4)2SO4; б) NaHCO3; в) C6H5COOH; г) Н2С2О4 2Н2О;
д) Н2С4Н4О4.
- Чему равен рН 0,001М раствора НСl?
а) рН = 2; б) рН = 3; в) рН = 1.
- Какие соединения подвергаются гидролизу? Запишите реакции гидролиза.
а) FeCl3; б) CoCl2; в) KClO3; г) HCOONa.
- Рассчитайте скачок на кривой титрования 100мл 0,2 М НСООН 0,2 н раствором NaOH.
- К 5 мл 0,3 М СН3СООН прилили 10 мл Н2О. Чему равен рН полученного раствора?
а) 0,52; б) 1,00; в) 0,88.
- В присутствии какого индикатора можно оттитровать 10 мл 0,1 н раствора НClO4 0,1 н раствором NaOH?
а) метилоранж ( рН = 3,1 4,4);
б) фенолфталеин ( рН = 8 10);
в) тропеолин ( рН = 1,4 3,2).
- Коллоквиум № 3 "Теоретические основы окислительно-восстановительного титрования" предусматривает текущий контроль усвоения материала по темам: окислитьно-восстановительный потенциал, константа равновесия, направление и скорость реакций, кривые титрования в методе редоксиметрии, способы фиксирования точки эквивалентности.
Образец варианта коллоквиума № 3
- Уравнение Нернста. Факторы, влияющие на величину потенциала.
- Рассчитать скачок на кривой титрования 10 мл 0,05н раствора соли Мора 0,05 н раствором перманганата калия в сернокислой среде.
- Определение содержания Cu2+ в растворе методом йодометрии.
-
Образец тестового контроля по методу редоксиметрии
- Какие из перечисленных веществ можно определять методом перманганатометрии в кислой среде? Докажите расчетом.
а) (NH4)2Fe(SO4)2 6H2O; б) NaNO3; в) NaNO2; г) FeCl3.
- Рассчитайте равновесный потенциал редокс-пары: MnO4-/Mn2+ в полуреакции:
MnO4- + 8 H+ + 5e- Mn2+ + 4H2O
если MnO4- = Mn2+, tо = 25оС, рН = 0.
а) 1,52 В; б) 1,55 В; в) 1,51 В; г) 1,61 В.
- Какую навеску К4Fe(CN)6 3 H2O следует взять для приготовления 300 мл раствора, необходимого для стандартизации 0,02 н раствора КMnO4? Какими весами при этом следует воспользоваться?
а) 0,4224г, соль взвесить на технических весах;
б) 1,7г, соль взвесить на аналитических весах;
в) 0,8г, навеску взять на технических весах;
г) 2,5320г, соль взвесить на аналитических весах.
- Как ведет себя КMnO4 в роли окислителя в щелочной среде?
а) образует осадок гидроксида:
MnO4- + 4 H2О + 5e- Mn(ОН)2 + 6OН –
б) Восстанавливается до манганат-иона:
MnO4- + е- MnО42-
в) Восстанавливается до диоксида марганца:
MnO4- + 2Н2О + 3e- MnО2 + 4ОН –
г) Восстанавливается до ионов Мn2+:
MnO4- + 4Н2О + 5e- Mn2+ + 8ОН –
- Смешали 5 мл 0,02 н раствора Н2О2, 10мл 0,02 н раствора КMnO4 в сернокислой среде с Н+ = 1 моль/л. Вычислить окислительно-восстановительный потенциал системы.
Образец №2
- Какие из математических выражений соответствуют потенциалу процесса 2Na2S2O3 + I2 = 2NaI + Na2S4O6, когда раствор перетитрован на 0,1%. Концентрация реагирующих веществ одинаковы, титрантом является раствор иода.
а)
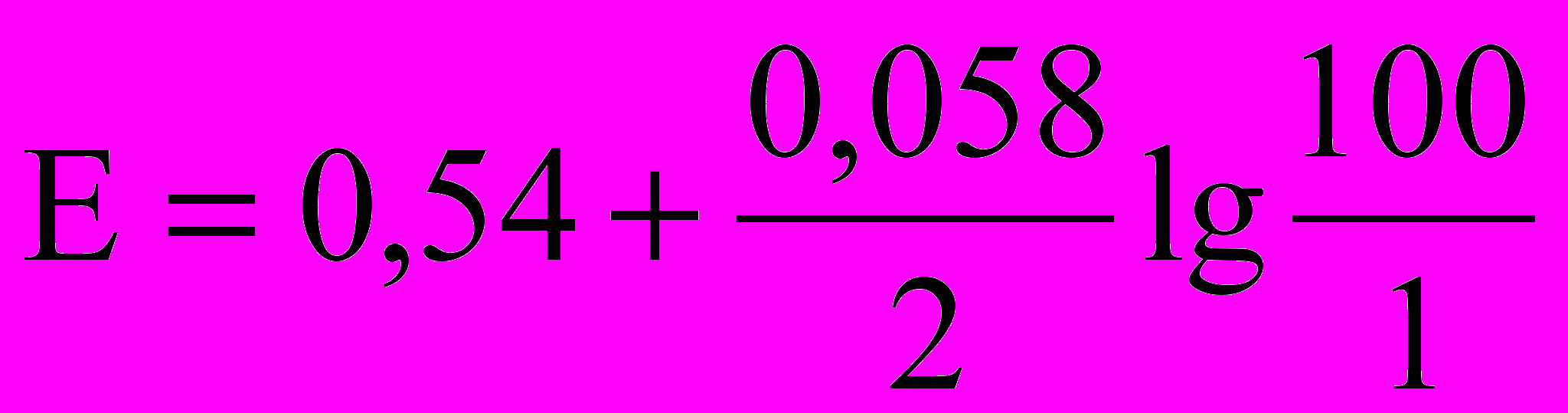
б)
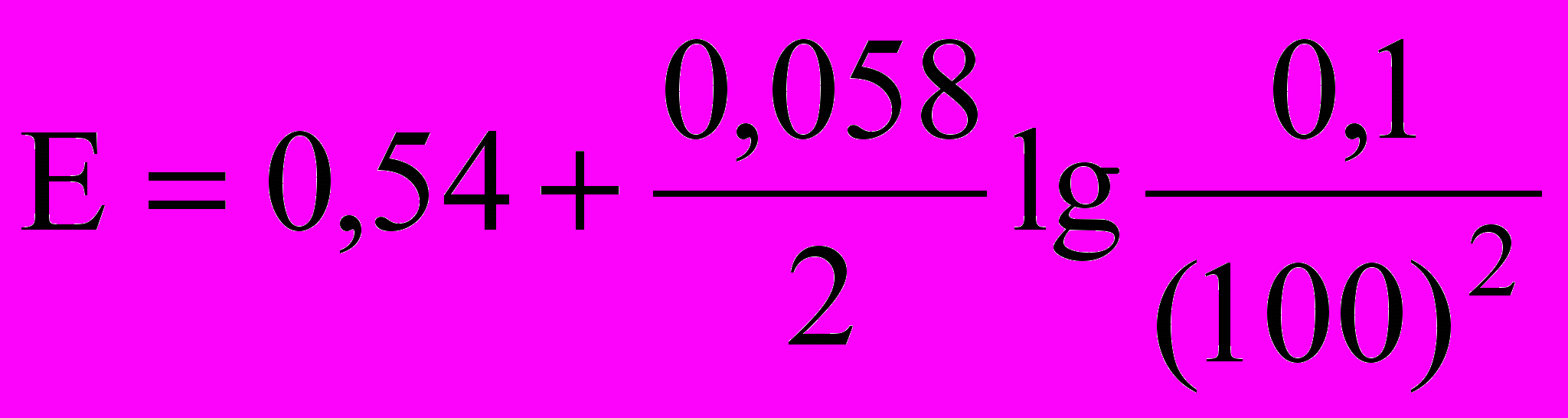
в)
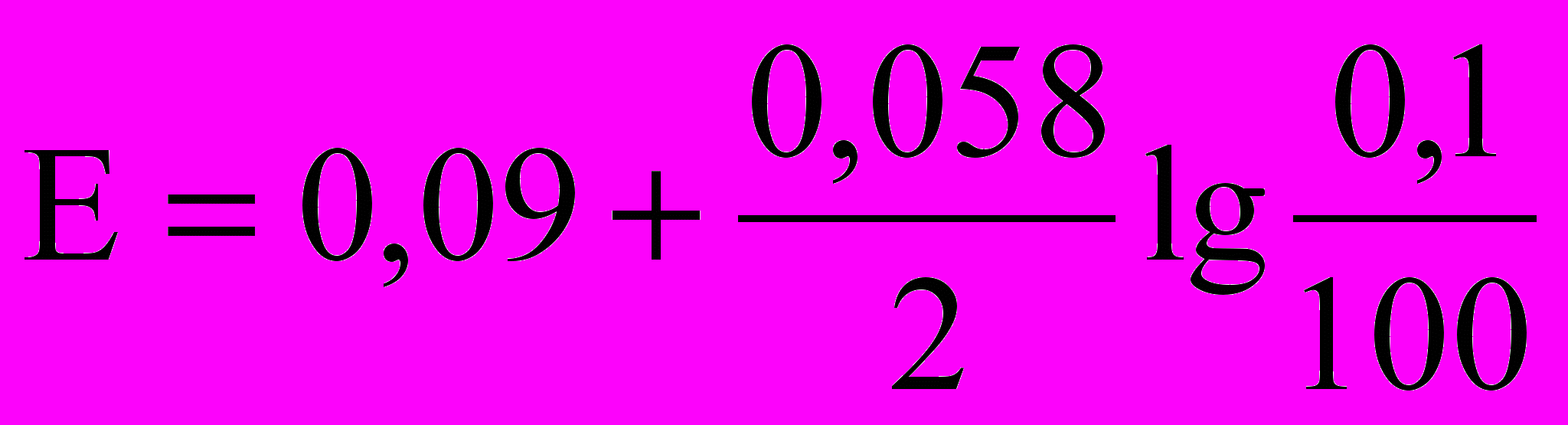
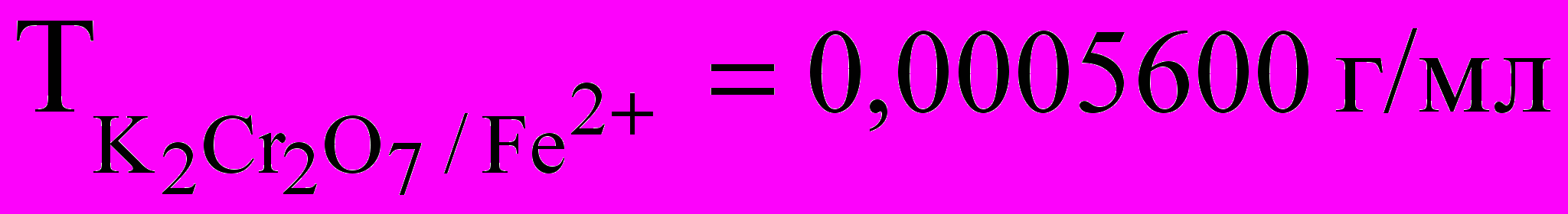 . Вычислить молярную концентрацию эквивалента бихромата калия. С какой целью используют H3PO4 в бихроматометрическом определении железа?
. Вычислить молярную концентрацию эквивалента бихромата калия. С какой целью используют H3PO4 в бихроматометрическом определении железа?
- К 25 мл бромной воды прибавили KI. На титрование выделившегося йода израсходовано 20 мл 0,1 н Na2S2O3. Какое из математических выражений соответствует содержанию Br2 в 1 литре бромной воды?
а)
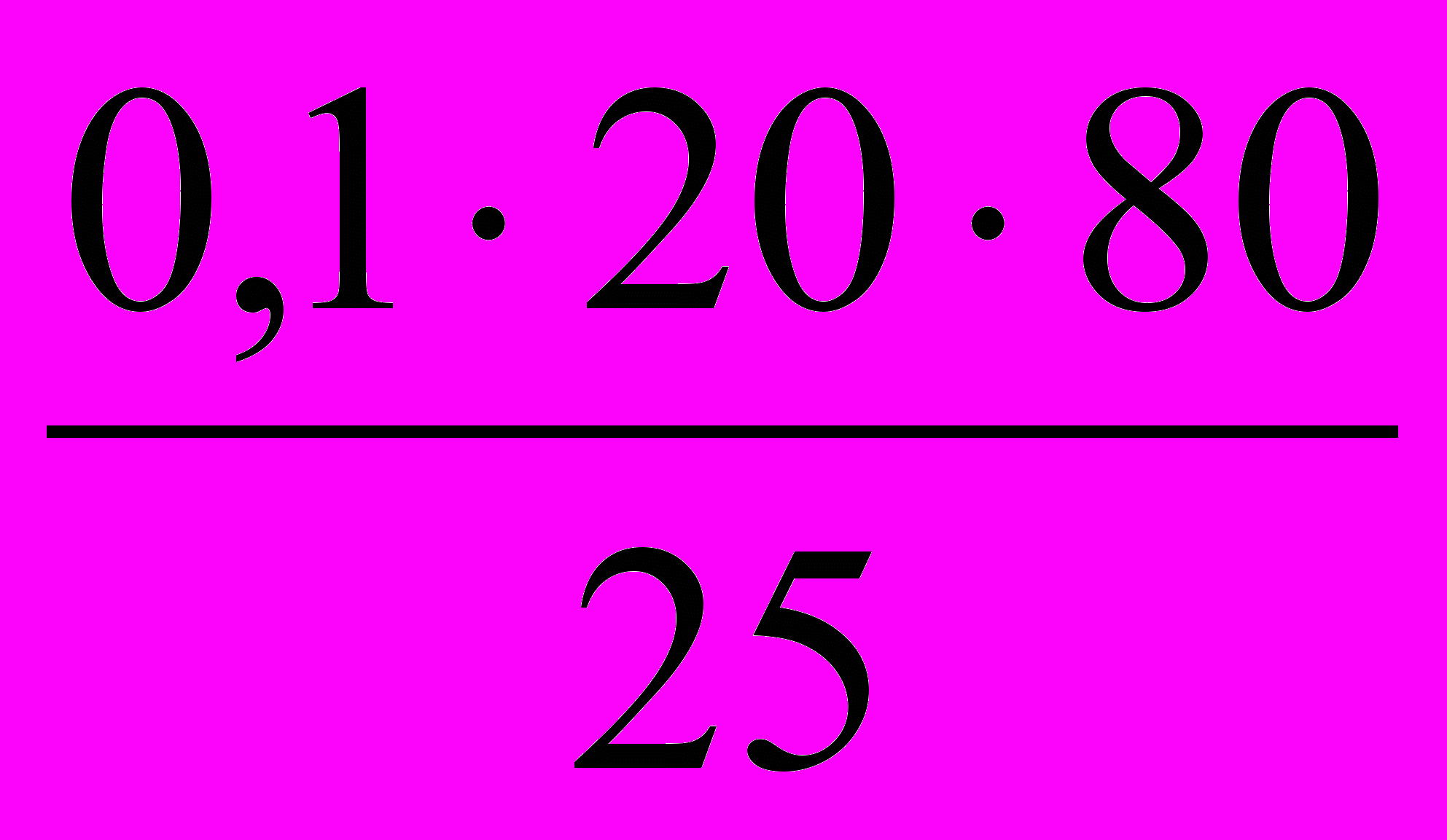 ; б)
; б) 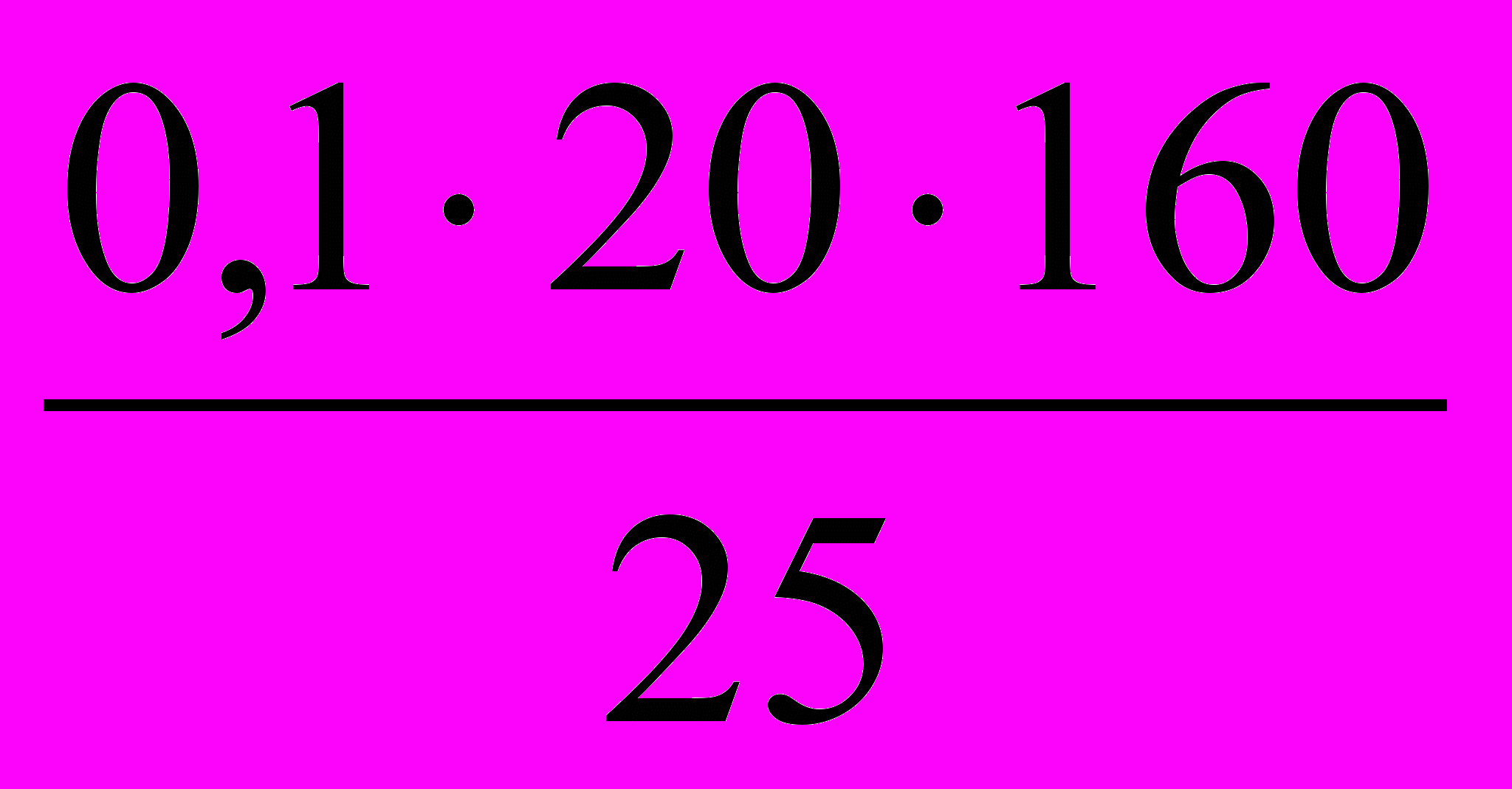 ; в)
; в) 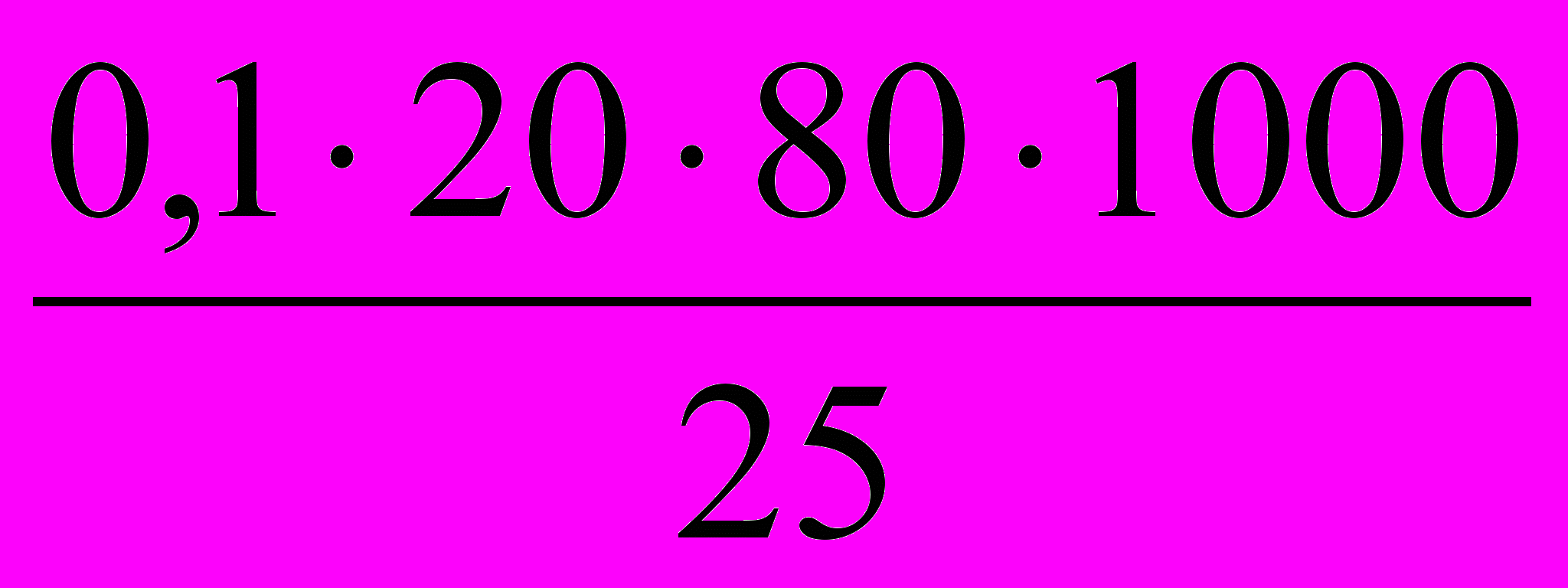
- Коллоквиум № 4 "Теоретические основы метода осаждения и комплексообразования. Гравиметрический анализ" предусматривает текущий контроль усвоения материала по темам: гетерогенное равновесие в системе: осадок-насыщенный раствор; кривые титрования, индикаторы и способы фиксирования точки эквивалентности в методах осаждения и комплексообразования, основные стадии гравиметрического анализа, условия получения аморфных и кристаллических осадков, виды соосаждения, расчеты.
Образец варианта коллоквиума № 4
- Равновесие в системе осадок-насыщенный раствор. Правило произведения растворимости, произведения активности.
- Индикаторы, используемые в методе комплексообразования.
- Вычислить растворимость AgI в Н2О и 0,1М растворе KCl.
- Выпадет ли осадок при сливании 50 мл 1·10-3 М раствора AgNO3 и 25 мл 1·10-4 М KCl.
VII. Образец варианта итогового задания контрольного
- Сколько требуется HCl (1:1) для приготовления 1 л 0,2 М НСl? Разбавленная HCl (1:1) приготовлена из концентрированной, содержащей 37,24 % HCl (= 1,185 г/см3)
- Рассчитать массу навески руды, содержащей около 10 % Fe2O3, чтобы при титровании раствора железа (II), полученного при обработке ее, расходовалось 15 мл 0,1 н раствора KMnO4.
- Рассчитать рН раствора, полученного при сливании 50 мл 0,2 М CH3COOH и: а) 100 мл 0,1 М NaOH; б) 110 мл 0,1 М NaOH.
- Вычислить потерю массы в процентах 50 мг осадка AgCl при промывании его 200 мл H2O.
- Вычислить окислительно-восстановительные потенциалы растворов, в которых соотношение концентраций ионов Sn4+ и Sn2+ равно 1) 1000:1; 2)1:100.
6.1. УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ДИСЦИПЛИНЫ
Для изучения «Аналитической химии» преподавателями кафедры создан комплект учебно-методического обеспечения дисциплины:
- Наглядные средства обучения – таблицы, плакаты по темам:
а) способы выражения концентрации растворов;
б) расчеты рН в растворах различных электролитов;
в) кривые титрования;
г) стандартные окислительно-восстановительные потенциалы;
д) рН-индикаторы.
- Варианты индивидуальных домашних заданий с методическими указаниями по их решению.
- Методические указания к выполнению лабораторных работ.
- Справочники по аналитической химии.
6.1.1.Источники учебной информации, обеспечивающие подготовку студентов по дисциплине «Аналитическая химия».
Основная литература
- Золотов Ю.А.Основы аналитической химии. - М.: Химия, т.1,1999
- Васильев В.П. Аналитическая химия. - М.: Высшая школа, ч.1. 1989.-320 с.
- Пилипенко А.Г., Пятницкий И.А. Аналитическая химия. - М.: Химия, ч.1.-1990. - 480 с.
- Цитович И.К. Курс аналитической химии. -М.: Высшая школа, 1994.-495 с.
Дополнительная литература
- Лурье Ю.Ю. Справочник по аналитической химии.-М.: Химия, 1989.-448 с.
- Алексеев В.Н. Курс качественного химического полумикроанализа. - М.: Химия, 1973. - 584 с
- .8. Алексеев В.Н. Количественный анализ. - М.: Химия, 1972. - 504с.
- Г.Н. Сутягина, Н.М. Дубова, Е.Е. Чернова. Аналитическая химия. Учебное пособие. Томск, типография ТПУ, 123 с.
9. Н.М.Дубова, Г.Н. Сутягина, Т.М. Гиндуллина .Аналитическая химия ..Химические методы анализа./Видеолекция для дистанцинного обучения.- Томск.: изд-во ТПУ, 2000.- Видеокассета, 180 мин. Рег. №181 от1.12 .2000г.
10. Г.Н .Сутягина, Н.П.Михеева , НМ. Дубова.. Титриметрическиеметоды анализа Методические указания к выполнению лабораторных работ по дисциплине «Аналитическая химия»-Томск: Изд. ТПУ 2001.-24 с.
11.. Дубова Н. М. Аналитическая химия .Способы выражения концентраций .Варианты контрольных заданий и методические указания к их решению .-Томсс:Изд-во ТПУ,2003.-27с.
12.Дубова Н.М.Аналитическая химия.Расчеты при приготовлении растворов и определении результатов титриметрического анализа.Методические указания и варианты контрольных заданий.-Томск:,Изд-во ТПУ.2004.-24с.
13.Дубова Н.М.Расчеты рН водных растворов различных электролитов.Индивидуальные задания для самостоятельной работы студентов.-Томск. Изд-во ТПУ,200 -10с.
14.Дубова Н.М. Окислительно-восстановительное титрование.Индивидуальные задания для САР.-Томск.Изд-во ТПУ,1996.-12с.
15.Дубова Н.М Расчеты в гетерогенных системахИндивидуальные задания для САР студентов. Томск. Изд-во ТПУ.1992 .-10с
16.Дубова Н.М. Электронный конспект лекций « Аналитическая химия в образовательной технологии АСУ ПДС .»,Рег.№8,от 23.01.2004г,Томск : Изд-во ТПУ.
17.Дубова Н.М. Тестовые задания в АХ в образовательной технологии АСУ ПДС.Рег. №7 ,от 23.01.2004г.Томск: Изд-во ТПУ.
18.Дубова Н.М. Рабочая программа « Аналитическая химия и ФХМА» для направления 550800 –Химическая технология и биотехнология, Рег.№192,от15.10. 2003 .Томск: Изд. ТПУ.
2.2. СОДЕРЖАНИЕ ЛЕКЦИЙ
6-й семестр
Физико-химические методы анализа
Тема 1. ВВЕДЕНИЕ В ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА (2 часа).
Общая характеристика ФХМА (чувствительность, точность, достоинства, недостатки). Классификация ФХМА. Виды аналитических сигналов, характеристики аналитических сигналов.
Тема 2. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА(2часа) Принципы хроматографического разделения веществ. Классификация хроматографических методов анализа по агрегатному состоянию фаз, по механизму разделения, по аппаратурному оформлению, по способу проведения процесса. Хроматограмма. Качественный и количественный анализ по хроматограмме. Селективность сорбента, критерии селективности. Эффективность хроматографического процесса. Понятие ВЭТТ. Газовая хроматография: классификация методов. Принципиальная схема хроматографа. Неподвижные фазы, подвижные фазы, требования к ним. Детекторы, их классификация.
Тема 3. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА (2 часа).
Классификация электрохимических методов анализа. Основные понятия, используемые в методе. Потенциометрические методы анализа: сущность метода, системы электродов. Требования к индикаторным электродам и электродам сравнения. Прямая потенциометрия, потенциометрическое титрование. Метрологические характеристики метода. Вольтамперометрия. Сущность метода. Принципиальная схема установки. Электроды. Качественный и количественный полярографический анализ. Амперометрия. Сущность метода, принципиальная схема установки. Выбор системы электродов, выбор потенциала индикаторного электрода. Типы кривых титрования. Метрологические характеристики метода. Электрогравиметрия: общая характеристика метода
Тема 4 .Основы спектроскопических методов анализа (2часа)
Классификация спектроскопических методов. Происхождение спектров испускания. Качественный и количественный анализ по спектрам испускания. Классификация методов абсорбционной спектроскопии. Происхождение абсорбционных спектров. Качественный и количественный анализ по спектрам поглощения. Аппаратура для спектрального анализа. Метрологические характеристики спектральных методов анализа.
3.2. СОДЕРЖАНИЕ ПРАКТИЧЕСКОГО РАЗДЕЛА
Дисциплины
Перечень лабораторных работ (35часа)
Фотоколориметрия (12 часов)
- Определение сульфосалициловой кислоты методом градуировочного графика
- Определение железа (2+) методом добавок
- Определение констант ионизации слабых органических кислот
- Определение меди (2+) методом дифференциальной фотометрии
- Определение состава комплексных соединений
- Определение хрома и марганца при совместном присутствии
Хроматографические методы анализа (11 часов)
- Идентификация органических соединений по параметрам удерживания в ГЖХ
- Количественное определение веществ методом внутренней нормализации с учетом калибровочных коэффициентов
- Количественное определение ацетона методом внутреннего стандарта
- Определение динамической обменной емкости катионита КУ-2
- Выделение неорганических кислот из солей методом ионного обмена
- Количественный анализ смеси ионов никеля и цинка с применением анионитов
- Разделение ионов железа (3+) и меди (2+) с использованием катионообменника
- Определение полной динамической обменной емкости.
Электрохимические методы анализа (12 часов)
- Определение рН растворов с помощью рН-метра
- Определение содержания уксусной кислоты и ее константы ионизации методом потенциометрического титрования
- Количественное определение органических оснований (моноэтаноламина, триэтаноламина) методом потенциометрического титрования
- Количественное определение фосфорной кислоты, констант ионизации
- Количественное определение содержания железа методом амперометрического титрования
- Количественное определение ванадия методом амперометрического титрования
- Количественное определение марганца методом амперометрического титрования
- Электрогравиметрическое определение меди в растворе
- Ионометрическое определение аммонийного азота в сточных водах
- Определение нитратов в природной или питьевой воде и технических образцах методом ионометрии.
4.2. ПРОГРАММА САМОСТОЯТЕЛЬНОЙ ПОЗНАВАТЕЛЬНОЙ
ДЕЯТЕЛЬНОСТИ (68 часОВ)
Самостоятельная работа студентов по разделу «ФХМА» организована путем выполнения индивидуальных домашних заданий; самостоятельной проработки теоретического материала, для чего используются учебные пособия, подготовленные на кафедре; проработки лекционного материала и подготовки к лабораторным работам.
Подготовка к лабораторным работам контролируется опросом в виде беседы с преподавателем и теоретическим коллоквиумом.
Виды самостоятельной работы студентов:
- Домашнее задание по теме
«Электрохимические методы анализа»- 4 час.
- Домашнее задание по теме
«Хроматографические методы анализа»- 4 час.
- Домашнее задание по теме
«Абсорбционная молекулярная спектроскопия»
фотоколориметрический анализ
4 час.
- Домашнее задание по теме: « Способы приготовления растворов» . 3час.
- Проработка лекционного материала для работы в лекционной аудитории с обратной связью (№ 204 ) 10 час.
- Самостоятельное изучение тем:
Тонкослойная хроматография.
Критерии разделения и эффективности хроматографических колонок. Внутренний электролиз. Физические и химические
факторы , влияющие на получение осадков в электрогравиметрии. Электрогравиметрическое определение меди в растворе. Кулонометрия.
Основы эмиссионного спектрального анализа.
.Составление конспектов. 12 час.
- Подготовка к коллоквиумам по темам:
абсорбционная молекулярная спектроскопия 8 час.
фотоколориметрия (количественный анализ) электрохимические методы анализа 8час.
хроматографические методы анализа 8 час.
8.Итоговый контроль. Основные этапы анализа.
Методы разделения и концентрирования. Методы оценки количества вещества. 7час.
5.2. ТЕКУЩИЙ И ИТОГОВЫЙ КОНТРОЛЬ РЕЗУЛЬТАТОВ
ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
5.1. Способы и особенности организации контроля
При изучении курса “Аналитическая химия и ФХМА” используется рейтинговая система оценка знаний студентов.
Максимальная рейтинговая оценка (общий рейтинг) дисциплины составляет 1000 баллов.
Примерный тип рейтинг – листа приводится ниже.
РЕЙТИНГ – ЛИСТ
- Лекции: 3÷ лекций 50 баллов+ 40 = 190 баллов
- Лабораторные работы
(выполнение и защита): 3 модуля 60 баллов = 180 баллов
- Коллоквиумы 3 кол. 90 баллов = 270 баллов
- Дом.задания 3 зад. 50 баллов +40 бал = 190 баллов
5. Самостоятельная проработка тем. Конспекты. 3х40= 120 баллов
- Итоговый контроль 50 баллов
Итого 1000 баллов
Для получения зачета необходимо выполнить все виды деятельности и набрать не менее 651 балл.
Рейтинг поощряет активных студентов дополнительными баллами за участие в химических олимпиадах, написание рефератов, занятия на курсах дополнительной химической подготовки, выполнение заданий повышенной сложности.
5.2. КОНТРОЛИРУЮЩИЕ МАТЕРИАЛЫ
I. Коллоквиум по модулю "Электрохимические методы анализа" включает следующие темы: (1) классификация электрохимических методов анализа; (2) теоретические основы методов вольтамперометрии, потенциометрии , электрогравиметрии , кулонометрии , кондуктометрии; (3) сравнительная характеристика методов анализа и их практическое применение.
Образец варианта
- Классификация электрохимических методов анализа.
- Сущность амперометрического титрования.
- Определение содержания слабых кислот в растворе, констант их диссоциации методом потенциометрического титрования.
- Коллоквиум по модулю "Спектроскопические (оптические) методы анализа включает следующие темы.
Характеристики электромагнитного излучения. Классификация методов спектроскопии. Происхождение спектров поглощения (электронных и колебательных). Понятия: спектр вещества, полоса поглощения, их характеристики в спектрах поглощения. Принципиальная схема спектрофотометра (фотоэлектроколориметра). Основной закон светопоглощения, причины отклонения от закона. Качественный анализ соединений по ИК-спектрам. Основные этапы количественного анализа по спектрам поглощения. Методы определения количества вещества на основе закона светопоглощения. Дифференциальная спектрофотометрия. Области применения и метрологические характеристики анализа.
Образец варианта задания на коллоквиуме по модулю "ИК-спектроскопия".
- Основной закон светопоглощения, причины отклонения от закона
- Характеристики спектров поглощения
- Определение содержания меди (2+) методом дифференциальной фотометрии.
III. Коллоквиум по модулю "Хроматографические методы анализа" включает следующие темы:
Классификация хроматографических методов анализа, сущность тонкослойной хроматографии, ионнообменной и газожидкостной хроматографии, качественный и количественный анализ, расчеты, практическое использование методов.
Образец варианта задания
- Классификация хроматографических методов анализа по способу хроматографирования (проявительный, вытеснительный, фронтальный).
- Принципиальная схема хроматографа - основные узлы.
- Определение нейтральных солей методом ионообменной хроматографии.
6. УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
Для изучения «Аналитическая химия и ФХМА» преподавателями кафедры создан комплект учебно-методического обеспечения дисциплины:
- Наглядные средства обучения – таблицы, плакаты.
- Раздаточный материал по темам: ИК-спектроскопия, газовая хроматография.
- Варианты индивидуальных домашних заданий с методическими указаниями по их решению.
- Методические указания к выполнению лабораторных работ.
- Справочники по аналитической химии.
6.1. Источники учебной информации, обеспечивающие подготовку студентов по дисциплине «Аналитическая химия и ФХМА».
Основная литература
- Золотов Ю.А.Основы аналитической химии.- М.: Химия, т.1,2,1999
- Васильев В.П. Аналитическая химия. - М.: Высшая школа, ч.2. 1989.-320 с.
- Лурье Ю.Ю. Справочник по аналитической химии.-М.: Химия, 1989.-448 с.
4.Пилипенко А.Г., Пятницкий И.А. Аналитическая химия. - М.: Химия, ч.2.- 5.Дубова Н.М. Рабочая программа « Аналитическая химия и ФХМА» для направления 550800 –Химическая технология и биотехнология,Рег.№192,от15.10.2003.Томск:Изд.ТПУ.1990. - 480 с.
Дополнительная литература по спектроскопическим методам анализа
1Коган Р.М., Чернышова Н.Н. Абсорбционная спектроскопия в органической химии Томск, типография ТПУ, 1988, 96 с.
2 Практикум по физико-химическим методам анализа. Под ред. Петрухина О.М. М.: Высшая школа, 1988, 244 c
3Дубова Н.М., Гиндуллина Т.М., Сутягина Г.Н., Короткова Е.И.. Физико-химические методы анализа. Учебное пособие. Дистанционное обучение. Томск, Изд-во ТПУ, 1999, 122 с.
4.Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия, 1986, 376 с.
5. Смит А. Прикладная ИК- спектроскопия. М.:Мир, 1981, 328 с
6.Т.М.Гиндуллина. Фотометрические методы анализа. Методические указания к выполнению лабораторных работ .-Томск: Изд. ТПУ ,2002 -48с.
7.Т.М.Гиндуллина , Р.М.Коган. Абсорбционная спектроскопия. Количественный анализ. Варианты контрольных заданий и методические указания.Томск : Изд. ТПУ, 1999. -28с.
Дополнительная литература по хроматографическим методам анализа
1. Практикум по физико-химическим методам анализа. Под ред. Петрухина О.М. М.: Высшая школа, 1988, 244 c
2.Столяров Б.В. Руководство к практическим.работам по газовой хроматографии. М.: Химия, 1988, 210 с.
3Дубова Н.М., Гиндуллина Т.М., Сутягина Г.Н., Короткова Е.И.. Физико-химические методы анализа. Учебное пособие. Дистанционное обучение. Томск, Изд-во ТПУ, 1999, 122 с.
4.Г.Н. Сутягина.Хроматографические методы анализа.Методические указания к выполнению лабораторных работ .Томск.изд.ТПИ.1990.-21с
5.Г.Н.Сутягина.Хроматографические методы анализа.Методические указания к решению индивидуальных домашних заданий и варианты домашних заданий.Томск:Изд.ТПУ,2002.-24с.
Дополнительная литература по электрохимическим методам анализа.
1.Гороховский В.И., Гороховская В.М. Практикум по электрохимическим методам анализа. М.: Высшая школа, 1987, 120 с.
2.Практикум по физико-химическим методам анализа. Под ред. Петрухина О.М. М.: Высшая школа, 1988, 244 c
3Дубова Н.М., Гиндуллина Т.М., Сутягина Г.Н., Короткова Е.И.. Физико-химические методы анализа. Учебное пособие. Дистанционное обучение. Томск, Изд-во ТПУ, 1999, 122 с
- Дубова Н.М. Электрохимические методы анализа .Методические указания к выполнению лабораторных работ по дисциплине «Физико-химические методы анализа».Томск:Изд.ТПУ,2002.-44с.
- Н.П.Михеева. Электрохимические методы анализа.. Варианты контрольных заданий и методические указания.-Томск:Изд.ТПУ,2000.-24с
Томский политехнический университет
Источники учебной информации, обеспечивающие
подготовку по направлению
| № п.п | Дисциплина | Авторы | Название учебного пособия | Год изд. | Кол. экз. |
| 1 | Аналитическая химия | В. П. Васильев. | Аналитическая химия Ч.1,2 | 1989 | 60 |
| 2 | Ю..А.Золотов | Основы аналитической химии | 1999 | 25 | |
| 3 | И. К. Цитович | Курс аналитической химии | 1994. | 25 | |
| 4 | В. Н. Алексеев | Количественный анализ. | 1972 | 206 | |
| 5 | А. Т. Пилипенко, И. В. Пятницкий | Аналитическая химия Ч.1,2 | 1990 | 60 | |
| 6 | Г. Н. Сутягина, Н. М. Дубова, Е. Е. Чернова. | Аналитическая химия | 1998 | 100 | |
| 7 | . В. Н. Алексеев. | Курс качественного полумикроанализа. | 1973 | 150 | |
| 8 | Н. М. Дубова, Т. М. Гиндуллина, Г. Н. Сутягина, Е. И. Короткова. | Физико-химические методы анализа | 1999 | 100 | |
| 9 | | Практикум по физико-химическим методам анализа./Под ред. Петрухина А.Г | 1987 | 30 | |
| 10 | В. И. Гороховский, В. М. Гороховская. | Практикум по электрохимическим методам анализа. | 1983 | 30 | |
| 11 | Р. М. Коган, Н. Н. Чернышова | Абсорбционная спектроскопия в органической химии | 1988 | 30 | |
| 12 | Ю. Ю. Лурье | .Справочник по аналитической химии. | 1989 | 50 |
