Развитие критического мышления на уроках химии
| Вид материала | Урок |
- Задачи проекта: Изучение и освоение технологии развития критического мышления, 58.82kb.
- Приведенная выше схема наглядно представляет место технологии развития критического, 187.15kb.
- Планирование урока по методике критического мышления Распаковка приемов, используемых, 89.96kb.
- А. В. Федоров Развитие медиакомпетентности и критического мышления студентов педагогического, 10315.67kb.
- Применение технологий «Методики критического мышления», 179.16kb.
- Е. А. Столбникова Развитие критического мышления студентов педагогического вуза в процессе, 2363.51kb.
- Технология развития критического мышления в преподавании курса психологии менеджмента, 26.59kb.
- Задачи: провести диагностическое исследование уровня развития творческого мышления, 149.7kb.
- Е. В. Мурюкина развитие критического мышления и медиакомпетентности студентов в процессе, 4252.96kb.
- И. В. Челышева развитие критического мышления студентов педагогического вуза в рамках, 2923.31kb.
Развитие критического мышления на уроках химии
Гамзина Ольга Викторовна
учитель химии, МОУ "Лицей № 82"

Актуальным в образовании в последние годы стал вопрос о педагогических технологиях. В настоящее время существует множество позиций разных авторов, касающихся самого определения педагогической технологии.
Я работаю в лицее № 82 г. Челябинска Металлургического р-на 16 лет. Наше учебное учреждение отличает то, что мы по иному должны относиться к судьбе детей с высокими показателями интеллектуальных возможностей. Им нужна мощная мотивация саморазвития, реализация своих творческих способностей.
Я придерживаюсь мнения тех ученых, которые считают, что творческие способности можно развить, создав для этого специальные условия. Если школьник с самого начала подготавливается к тому, что он должен создавать, придумывать, находить оригинальные решения известным проблемам, то личность этого школьника будет формироваться не так, как формируется личность ребенка, обучаемого в рамках идеологии - повторение сказанного учителем.
Современному педагогу становится ясно, что ни одна наука в одиночку не может дать ответа ни на один заявленный вопрос, ни одна педагогическая технология, взятая в отрыве от других социальных ситуаций взаимодействия, не обеспечит растущему поколению ориентацию на самореализацию в мире современной науки.
Именно поэтому организация учебного процесса, связанная с развитием склонностей к критическому мышлению, представляется нам (мне и моим коллегам) инструментом, который позволяет разрешить противоречия между консервативными установками традиционного образования и авангардными идеями, позволит в большей степени реализовать те педагогические задачи, о которых было сказано выше.
"Критическое мышление" - обозначение некоторого педагогического подхода. Это педагогическая технология построения урока на базе критического отношения к тексту. "Критическое мышление" - новый взгляд на урок, эта технология дает освоение нового способа познания. Школа - это то место, где ребенку отвечают на вопросы, которые он не задавал. Уроки, выстроенные по технологии "критического мышления", побуждают детей самих задавать вопросы и активизируют к поиску ответа.
Технология "критического мышления" позволяет активизировать интеллектуальную и эмоциональную деятельность ребенка, вовлечь в процесс обучения личностное начало ребенка.
Одна из основных целей технологии развития критического мышления — научить ученика самостоятельно мыслить, осмысливать, структурировать и передавать информацию, чтобы другие узнали о том, что новое он открыл для себя.
Технологию развития критического мышления предложили в середине 90-х годов XX в. американские педагоги Дж.Стил, К.Мередит, Ч.Темпл как особую методику обучения, отвечающую на вопрос: как учить мыслить [2].
Критическое мышление, по мнению американских педагогов, означает, что человек использует исследовательские методы в обучении, ставит перед собой вопросы и планомерно ищет на них ответы. А.П.Чернявская [4] отмечает, что технология развития критического мышления, или РКМЧП, это разновидность личностно-ориентированного обучения. “Разница лишь в том, что в данном варианте личностно-ориентированное обучение не останавливается на общих лозунгах, а достигает уровня технологической проработки метода”.
Раскрывая особенности технологии развития критического мышления как интегративного способа обучения, Е.О.Галицких выделяет четыре существенных компонента группового задания для самостоятельной работы учащихся:
- оно содержит ситуацию выбора, который делают учащиеся, ориентируясь на собственные ценности;
- предполагает смену ролевых позиций учащихся;
- настраивает на доверие участников группы друг к другу;
- выполняется приемами, которыми человек пользуется постоянно (сравнение, систематизация, анализ, обобщение и др.).
Выполняя групповое задание, общаясь между собой, ученики участвуют в активном построении знаний, в добывании необходимой информации для решения проблемы. Школьники приобретают новое качество, характеризующее развитие интеллекта на новом этапе, способность критически мыслить. Ученые-педагоги выделяют следующие признаки критического мышления:
- мышление продуктивное, в ходе которого формируется позитивный опыт из всего, что происходит с человеком;
- самостоятельное, ответственное;
- аргументированное, поскольку убедительные доводы позволяют принимать продуманные решения;
- многогранное, так как оно проявляется в умении рассматривать явление с разных сторон;
- индивидуальное, ибо оно формирует личностную культуру работы с информацией;
социальное, поскольку работа осуществляется в парах, группах; основной прием взаимодействия - дискуссия.
Критическое мышление начинается с вопросов и проблем, а не с ответов на вопросы преподавателя. Человек нуждается в критическом мышлении, которое помогает ему жить среди людей, социализироваться.
Эта модель описана С.И.Заир-Бек [2]. Ее основу составляет трехфазный процесс: вызов - реализация смысла (осмысление содержания) - рефлексия (размышление).
Структура занятия в концепции "критического мышления":
1 этап -"Вызов" (ликвидация чистого листа). Ребенок ставит перед собой вопрос "Что я знаю?" по данной проблеме.
Можно предложить ребенку работу с вопросами по проблеме. Работа с вопросами может проходить в два этапа: "я сам", "мы вместе" (парная или групповая работа). Хороший прием, который может использоваться на данной стадии - это "мозговая атака". На стадии вызова у ребенка должно сформироваться представление, чего же он не знает, "Что хочу узнать?".
2 этап - "Осмысление" (реализация осмысления).
На данной стадии ребенок под руководством учителя и с помощью своих товарищей ответит на те вопросы, которые сам поставил перед собой на первой стадии (что хочу знать).
Здесь может быть предложена работа с текстом: прочитать, пересказать, растолковать соседу (группе), заполнение матричной таблицы, чтение с пометками текста (“V” - уже знаю ; “+” - новое; “-” - противоречит взглядам; “?” - “хочу узнать подробнее”), выписка из текста.
3 этап - "Рефлексия" (размышление).
Размышление и обобщение того, “что узнал” ребенок на уроке по данной проблеме. На этой стадии может быть составлен опорный конспект в тетради учащегося. Кроме того, могут быть осуществлены: а) возврат к стадии вызова; б) возврат к ключевым словам; в) возврат к перевернутым логическим цепочкам; г) возврат к кластерам.
Методические приемы критического мышления
Вызов
- Парная мозговая атака.
- Групповая мозговая атака. (В случае отказа: напиши, почему отказываешься? Посиди в группе и послушай).
- Работа с ключевыми терминами.
- Перевёрнутые логические цепи (связать последовательность элементов информации в нужной последовательности).
- Свободное письмо (задаётся тема, а способ воплощения - нет; пишите всё, что приходит в голову: это может быть связанный текст, или опорные словосочетания).
- Разбивка на кластеры (построение логографа-выделение блоков идей).
- Механизм ЗХУ (знаю, хочу узнать, узнал).
Стадия осмысления
- Маркировочная таблица ( 5 - я так и думал, + - новая информация, + ! - очень ценная информация , - - у меня по-другому, ? - не очень понятно, я удивлён).
- Взаимоопрос и взаимообучение (например, задать друг другу вопросы).
- Двойной дневник (страница делиться на две части: слева - что понравилось, запомнилось, справа - почему, какие ассоциации).
Рефлексия
- Возврат к стадии вызова (обсудить, что совпало).
- Возврат к ключевым словам.
- Возврат к перевернутым логическим цепочкам.
- Возврат к кластерам (их заполнение).
- Возврат к ЗХУ.
Дополнительные приемы
А) Трёхчастный дневник (В третьей колонке - письмо учителю, описание впечатлений, предложения ).
Б) Графическая организация материала (Концептуальная таблица).
В) Кубик. Грани
- Дай описание.
- Сравни с чем-нибудь.
- Проассоциируй (на что похоже).
- Проанализируй (из чего состоит).
- Примени это.
- Приведи примеры.
Г) Синквейн-способ творческой рефлексии - “стихотворение”, написанное по определенным правилам:
1 строка - одно существительное,
2-ая - два прилагательных,
3-я - три глагола,
4-ая - крылатая фраза,
5-ая - одно существительное, которое выражает суть.
"Критическое мышление" можно смело отнести к инновационным технологиям, так как она соответствует основным параметрам инновационного обучения.
Разработки уроков на основе технологии развития критического мышления
Урок №1
Теория электролитической диссоциации - 9 класс
(Урок проведён по технологии “Критического мышления”)
Цели урока:
1. Сформировать основные понятия: электролиты, неэлекторлиты, электролитическая диссоциация, катионы, анионы.
2. Дать представление о механизме электролитической диссоциации.
3. Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
4. Обучать аргументировано защищать свою точку зрения.
5. Развитие коммуникативных способностей.
Оборудование: прибор для проверки проводимости водных растворов электролитов.
Водные растворы: дистиллированная вода, кристаллы поваренной соли, раствор соляной кислоты, раствор щелочи, водный раствор спирта.
План урока
I. Стадия “Вызова”
- Вступление
Мы приступаем к изучению проводимости растворов некоторых классов веществ. Электрический ток в металлах и растворах некоторых веществ вы изучали в курсе 7-го класса. Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти.
- а) Стадия “ Вызова”
Расчертите листок на три части и подпишите графы.
-
Я знаю
Хочу узнать
Что узнал?
В течение 5-ти минут каждый из вас заполнит графу, отвечая на вопросы: см. приложение №1.
Приложение № 1
Электрический ток в металлах и в растворах щелочей, кислот, солей
Прочти следующие вопросы:
1. На какие частицы распадаются при растворении в воде вещества?
2. Какие два рода электрических зарядов существуют в природе?
3. На какие две группы делятся вещества по способности проводить электрические заряды?
4. Что представляет собой электрический ток в водных растворах солей, кислот, щелочей?
5. Как называют растворы этих веществ?
6. Как возникают заряженные частицы в водном растворе этих веществ?
Очень кратко запиши свои ответы в первой колонке таблицы № 1.
б) Перескажите друг другу ваши записи. (15 мин.)
в) Выделите ключевые понятия по теме “Электрический ток” в электролитах и в растворах щелочей, кислот, солей.
г) Какая информация у вас осталась неполной?
Заполните 2-ю графу таблицы «Не знаю».
Как правило, 80% учащихся осознают проблему в том, что открытие вопроса остаётся на пункте: №6. Как возникают заряжённые частицы в одном растворе этих веществ?
Возникает ещё одна проблема - откуда у веществ с молекулярной решёткой в растворе появляются ионы.
Демонстрация опыта и заполнение таблицы приложения №2.
См. приложение №2.
Приложение №2
Демонстрационный опыт
Исследовать электрическую проводимость веществ с различным типом связи.
ЦЕЛЬ: Установить на какие частицы (молекулы, ионы) распадаются при растворении вещества с различным типом связи.
ИНСТРУКЦИЯ
1. Внимательно прочитайте задание и цель исследования.
2. Систематизируйте вещества по характеру химической связи и типу кристаллической решетки.
3. Выскажите предложения, какие из исследуемых веществ при растворении в воде будут распадаться на молекулы, а какие на ионы.
4. Пронаблюдайте опыт.
5. Результаты опыта сформулируйте в виде таблицы.
II. Стадия “Осмысление”
См. опорный конспект.
Опорный конспект
Сущность процесса электролитической диссоциации
Электролиты - вещества, проводящие в растворенном или расплавленном состоянии электрический ток, вследствие распада их на ионы.
Примеры электролитов: соли, щелочи, кислоты. В этих веществах имеется ионная или ковалентная сильнополярная связь.
Неэлектролиты - вещества, водные растворы которых не проводят электрический ток. К таким веществам относят кислород, водород, сахар, глицерин. Для них характерна ковалентная неполярная или малополярная связь. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электрической диссоциацией.
Для правильного понимания механизма растворения в воде веществ следует учесть строение молекулы воды и вид связи растворяемого вещества.
В молекулах воды между атомами водорода н кислорода имеются ковалентные сильнополярные связи:
Поэтому молекулы воды полярны:
 диполь.
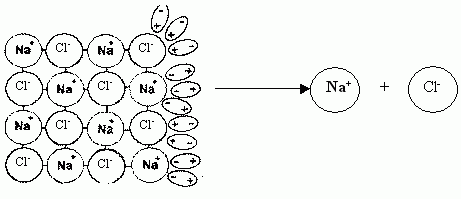
диполь.Вследствие этого, например, при растворении хлорида натрия молекулы воды притягиваются отрицательными полюсами к положительно заряженным ионам натрия кристаллической решетки, а положительными полюсами - к отрицательно заряженным ионам натрия. Такой процесс называется гидратацией, он идет с выделением энергии. Энергия гидратация приводит к разрушению кристаллической решетки и вещество распадается на ноны.
Притяжение и действие полярных молекул воды на кристаллическую решётку хлорида натрия.
При растворении в воде веществ с ковалентной сильнополярной связью, например хлороводорода НС1, происходит изменение характера химической связи, т.е. под влиянием энергии гидратации ковалентная связь превращается в ионную и далее процесс протекает как у веществ с ионной связью.
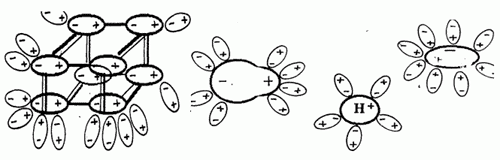
При расплавлении электролитов усиливаются колебательные движения частиц, что приводит к ослаблению связи между ними. В результате также разрушается кристаллическая решетка и образуются ионы.
В растворе и расплаве электролита ионы движутся хаотически.
Идёт работа с текстом и его маркировка, учащимся предлагается по ходу текста ставить следующие знаки:
V - уже известно
+ абсолютно новое, неожиданное;
- противоречит твоим представлениям;
? хочется узнать что-то больше.
На данной стадии идёт соотношение уже известного с тем, “что узнал”. Происходит структурная организация информации в памяти. Можно спросить, у учащихся какие у них были знаки?
III. Стадия “размышления” (рефлексия)
Учащиеся должны попробовать выразить информацию, которую получили своими словами. (Работа с графой №3 таблицы - "Что узнал?").
- Выяснили, какие новые понятия они увидели в тексте. (Эти пояснения записываем в 3-ю колонку).
- Рассказать о механизме диссоциации веществ с ионным типом связи.
- Рассказать о механизме диссоциации веществ с ковалентным типом связи.
Домашнее задание: § 1. Выучить понятия, знать механизм диссоциации. Ответить на вопрос: процесс растворения физический или химический. Подобрать доказательства в пользу каждого процесса.
Урок №2.
Тема: Ковалентная связь и геометрия молекул
Профильное обучение, согласно тематическому планированию – 11кл.
Цели урока:
- Раскрыть универсальный характер понятия «гибридизация орбиталей».
- Показать зависимость пространственного строения молекул веществ от типа гибридизации электронных орбиталей.
- Показать зависимость физических свойств от геометрии молекул.
Форма урока: Комбинированный урок
Особенности урока: Проведён по технологии «развитие критического мышления» с применением мультимедийного комплекса.
Оборудование:
- Модели гибридных облаков для магнитной доски.
- Тексты для работы учащихся.
- Вопросы для 1-го этапа урока «Знаю» (Приложение I).
- Текст для «критического чтения» (Приложение II).
- Мультимедийный комплекс для демонстрации фрагментов темы «Химическая связь» (1, 2, 3 фрагменты).
- Вопросы для 1-го этапа урока «Знаю» (Приложение I).
- Компакт-диск «Химия общая и неорганическая 10-11 класс» Лаборатория систем мультимедиа, МарГТУ. Предназначен для изучения химии в 10-11 классах.
Задачи:
- Научить учащихся критически мыслить.
- Научить учащихся добывать знания.
Ожидаемые результаты:
- Учащиеся должны предсказывать геометрию молекул, применяя теорию гибридизации электронных орбиталей.
Этапы урока:
- Стадия «Вызова»
- Записать тему урока.
- Разделить развёрнутый двойной лист на 3 колонки: «Знаю», «Хочу знать», «Узнал».
- Учащиеся читают вопросы (Приложение I) и выписывают те понятия, которые знают в 1-ую колонку – «Знаю».
- Во вторую колонку – «Хочу знать» выписывают проблемы, возникающие в ходе ответов на вопросы.
Приложение №1.
Приложение I
Ковалентная связь. Её характеристики.
- Что такое ковалентная связь?
- Какова классификация ковалентной связи по способу перекрывания электронных орбиталей?
- Какова классификация ковалентной связи по кратности?
- Что такое длина связи?
- Какая связь бывает по степени смещённости?
- Какой величиной оценивают полярность связи?
- Почему следует отличать полярность связи от полярности молекулы?
- Что такое направленность связи?
- По каким связям определяют угол (σ или π)?
- Молекулы CO2 и SO2 отвечают общей формуле AB2. Почему молекула CO2 – линейная, а SO2 – угловая?
- Почему растворимость SO2 лучше, чем у CO2.
Предполагаемые проблемы, записанные во второй колонке:
- Почему возникает направленность связи?
- Каким образом определяется направленность связи?
- Почему геометрия молекул влияет на физические свойства?
- Стадия «Осмысления»
- Демонстрация фрагмента №1 «Направленность электронных облаков». Во фрагменте в динамике показываются электронные облака и их перекрывания. Диктор делает вывод, что направленность связи возникает из-за направленности перекрывающихся облаков.
- Фрагмент №2. В отрывке рассказывается о том, что перед образованием связи облака гибридизируются.
- Чтение текста с маркировкой: «Знаю» V, «Узнал» +, «Удивило» ?
См. приложение №2.
Приложение II
Гибридизация электронных орбиталей и геометрия молекул
В основе модели максимального перекрывания облаков (МП) форма молекул сопоставляется с типом гибридизации орбиталей центрального атома (ЦА).
При образовании химической связи орбитали ЦА гибридизируются (гибридизация осуществляется при возбуждении атома). Гибридизация – это выравнивание орбиталей по форме и по энергии. Возможно шесть сочетаний гибридизирующихся орбиталей: sp, sd, sf, pd, pf, df. Рассмотрим простейшие способы гибридизации орбиталей sp:
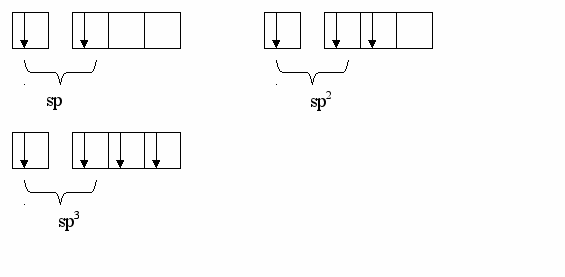
Мы встречались со всеми этими способами гибридизации в курсе органической химии. У атома углерода в молекуле метана наблюдается sp3, в молекуле этилена sp2, в молекуле ацетилена sp-гибридизация.
SP3-гибридизация обуславливает тетраэдрическое строение молекулы метана, sp2-плоскостное в молекуле этилена, а sp-линейное строение молекулы ацетилена.
Гибридизация орбиталей – понятие универсальное, т.е. применяется для молекул неорганических веществ. У элементов, имеющих два, три и четыре валентных электрона (в ЦА), можно рассматривать указанные виды гибридизации орбиталей sp.
Попробуйте определить геометрию (углы) молекул AB2: ВеCl2 и H2O на основе теории гибридизации электронных орбиталей, рассмотрев электронно-графические формулы этих элементов и зарисовать перекрывание всех облаков в этих молекулах.
- Этап «Рефлексия».
- Учащиеся отвечают на вопросы по второй колонке – «Хочу знать».
- Учащиеся рисуют гибридизацию электронных облаков в молекулах BeCl2 и H2O, шарострержневые модели и делают вывод о типе гибридизации и геометрии.
- Демонстрируют шаростержневые молекулы.
- Делается вывод, что молекула состава AB2 могут быть линейные или угловые. Демонстрируется фрагмент №3. Фрагмент показывает тип гибридизации электронных орбиталей в молекулах NH3 и CH4 и геометрию этих молекул.
Домашнее задание:
Учебник Габриелян О.С. 11 кл. Зарисовать перекрывание облаков в молекуле CO2, BCl3. Ответить на вопрос №11: «Почему растворимость SO2 лучше, чем CO2?»
Урок №3
Тема: Глюкоза. Строение глюкозы. 10 класс
Тип урока: Изучение нового материала (Урок новых знаний)
Цели:
I. Обучающие
1. изучение структуры глюкозы - структурной формулы
2. закрепление навыков проведения лабораторных опытов
II. Развивающие
1. овладение универсальными методами познания -
критическим мышлением.
2. научить ученика самостоятельно мыслить, осмысливать,
структурировать и передавать информацию.
3. умение формулировать проблему и находить пути ее
решения
III. Воспитывающие
1. Создание повышенной мотивации изучения нового
материала.
Оборудование:
Глюкоза (тв), вода в стаканчике, раствор сульфата меди (II),
гидроксид калия, держатель, спиртовка, спички, магниты,
транспаранты с фразами
"Знаю"
"Хочу знать"
"Узнал"
"Синквейн"
Особенности урока:
Урок проведен по технологии «Развитие критического мышления»
Ход урока.
| | |
| 1.Рассказ (вступительное слово учителя) | 1.0рганизационный момент |
| П. 1 .Ответы на вопросы учителя и заполнение колонки "Знаю" Постановка проблемы учащихся и начало заполнения "Хочу знать" 2.Проведение лабораторного опыта "Изучение свойств глюкозы" и заполнение колонки "Узнал" Постановка новой проблемы в колонке "Хочу знать" и работа с книгой Продолжение колонки "Узнал" | 2.Изучение нового материала 1 .Стадия "Вызова" 2. Стадия "Осмысление" (добыча знаний) |
| III. 1 .Анализ колонки "Узнал", сравнение ее с колонкой "Знаю", "Хочу знать" 2.Построение структурной формулы глюкозы на основе изученных свойств. 3.Написание синквейна на тему "Строение и свойства глюкозы" | Ш.Стадия "Рефлексия" |
| IV. 1 .На основе полученной структуры и изученных свойств глюкозы записать уравнения реакций | 4.Домашнее задание |
Вступительное слово учителя.
На прошлом уроке мы познакомились с общим представлением об углеводах,
их классификацией. Одним из представителей класса моносахаридов
является глюкоза. Наша цель - изучить строение глюкозы, т.е. вывести ее
структурную формулу. Добывать знания вы будете сами - строить гипотезы и
искать им доказательства. Работаем сегодня с вами в стиле " развития критического мышления" (Учащиеся работают по этой технологии не в первый раз, т.е. знают этапы и некоторые приемы). Откройте тетради и запишите тему « Глюкоза. Строение глюкозы.»
Разделите тетрадный лист на 3 части и подпишите колонки: "Знаю", "Хочу
знать", "Узнал".
Работаем с 1-ой колонкой.
Из курса биологии вы знаете молекулярную формулу глюкозы.
Назовите формулу и запишите в первую колонку. О наличии каких функциональных групп мы можем сделать предположение исходя из состава.
Учащиеся заполняют колонку «хочу знать». После постановки гипотезы проделывают лабораторную работу на наличие многоатомности и обнаружение альдегидной группы.
На основе опытов учащиеся строят структурную формулу глюкозы.
Вид доски.
Тема: Глюкоза. Строение глюкозы.
| Знаю | Хочу узнать | Узнал | Синквейн |
| Гипотезы: 1. Глюкоза – кислородосодержащее вещество 2. Глюкоза - углевод 3. С6Н12О6 | 1 .К какому классу веществ можно отнести глюкозу? а)к альдегидам б)к многоатомным спиртам в)к карбоновым кислотам 2.Какая углеродная цепь - линейная или разветвленная? 3.Сколько гидроксильных групп содержит глюкоза? | Лабораторная работа "Изучение свойств глюкозы" 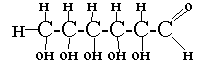 | существительное три прилагательных два глагола крылатая фраза существительное |
По данной технологии записей больше у учащихся, поэтому представляю вид записей у учащихся (см. следующую стр.) записи в тетради у у чащихся. На доске я только напоминаю форму и распределение записей в колонках у
учащихся (ступенчатый)
Вид записи в тетради у учащихся.
Тема: Глюкоза. Строение глюкозы.
| Знаю | Хочу узнать | Узнал |
| Гипотезы: 1. Глюкоза – кислородосодержащее вещество 2. Глюкоза - углевод 3. С6Н12О6 | 1 .К какому классу веществ можно отнести глюкозу? а)к альдегидам б)к многоатомным спиртам в)к карбоновым кислотам 2.Какая углеродная цепь - линейная или разветвленная? 3.Сколько гидроксильных групп содержит глюкоза? | Лабораторная работа:"Изучение свойств глюкозы" 1.гидроксидмеди (II) от раствора глюкозы синеет —> глюкоза многоатомный спирт 2. раствор глюкозы с гидроксидом меди (II) при нагревании краснеет —> глюкоза содержит альдегидную группу 3. присоединяет до 5 молекул уксусной кислоты—> 5 гидроксильных групп 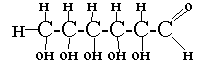 Синквейн: Глюкоза Сладкая, растворимая, энергетическая Краснеет и синеет от Cu(OH)2 Хочешь лучше думать – съешь глюкозу Альдегидоспирт. |
Домашнее задание:
- Учебник Габриелян О.С. 10 кл. §22, моносахариды
- Записать уравнения реакций по третьей колонке «Узнал»:
1. Глюкоза – альдегид 2. Глюкоза – многоатомный спирт (На основе лабораторной работы).
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеивание альфа-частиц, проходящих через тоненькую золотую фольгу и падавших на экран. Альфа-частицы обычно чуть отклонялись от первона-чального направления, всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг – о чудо! – исследователи заметили, что некоторые альфа-частицы резко меняли направление своего пути, будто наталки-вались на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда альфа-частицы, отразившись от атомов золота, летели прямо в противо-положных направлениях.
Расчеты показали, что наблюдаемые ими явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном цент-ральном ядре. радиус ядра, как выяснилось, в сто тысяч раз меньше радиуса всего ато-ма, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро – футбольному мячу, положенному в центр поля.
Атом любого химического элемента – как бы крохотная Солнечная система. поэтому такую модель атома, предложенную Резерфордом называют планетарной.
Но и это не все. Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов. Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое чис-ло изотопа атома алюминия:
13 + 14 = 27
число число массовое
протонов нейтронов число
Протоны имеют заряд, равный заряду электрона, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Обозна-чаются протоны знаком 11p (или p+). Нейтроны не несут заряда, они нейтральны и име-ют массу, равную массе протона, то есть 1. Обозначают нейтроны знаком 01n (или n0).
Так как массой электрона, ничтожно малой, можно пренебречь, то, очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e.
Поскольку атом электронейтрален, то также очевидно, что число протонов и эле-ктронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенного ему в периодической системе. Например, в ядре атома железа содерж-ится 26 протонов, а вокруг ядра вращается 26 электронов.
А как определить число нейтронов?
Как вам уже известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z) и относительную атомную массу (Ar) (окру-гленное ее значение), можно найти число нейтронов (N) по формуле: N = Ar - Z
Вид записи в тетрадях учащегося:
| Знаю | Хочу знать | Узнал |
| 1. Атом – “неделимый” (до середины 19 века) | 1. Какие научные открытия доказали, что атом делим? | 1. Катодные лучи (поток е) 2. Явление радиоактивности ( соль урана испускает из-лучение 3 видов: альфа-лучи (+ тяжелые), бета-лучи (поток е), гамма-лучи (электрочастица) 3. Атом имеет сложное строение |
| 2. Атом ядро электрон е протон нейтрон p n планетарная модель строения атома | 2. Как устроен атом? 3. Какими опытами объясняется данная модель? 4. Какое соотношение между размерами атома и ядра? | Опыты Э. Резерфорда по рассеиванию альфа-частиц, проходящих через тонень-кую золотую фольгу и па-давших на экран ядро 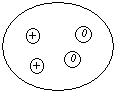 + - протон 11p + - протон 11p масса атома 01n – нейтроны p = е = N n = Ar – Z Fe: p=26; n(Fe)=56-26=30 |
| 3. | 3. Почему Ar не целое число? Каким образом частицы удерживаются в ядре? | N N=7 → p=7, e=7, n=14-7=7 P N=15 |
Домашнее задание:
Урок № 6
Общая характеристика неметаллов – 9 класс
Цели урока:
1. Используя антитезу с металлами, рассмотреть положение неметаллов в Периодической системе и особенности строения их атомов.
2. Повторить понятие аллотропии и кристаллического строении неметаллов, а следовательно, рассмотреть и их физические свойства.
3. Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
4. Научить учащихся критически мыслить
5. Развести понятие неметаллы-элементы и неметаллы-вещества
Оборудование:
1. Образцы неметаллов, простых веществ S,I2, Br2 (в ампуле), активированный уголь, пьезозажигалка
2. Тексты для работы учащихся.
а. Вопросы для первого этапа урока «знаю» (Приложение №1)
б. Текст для «критического чтения» (Приложение №2)
в. Текст для стадии «узнал» (Приложение №3)
г. Мультемедийный комплекс для демонстрации фрагментов темы «Аллотропия кислорода»
Этапы урока:
I. Стадия вызова
1. Записать тему урока
2. Разделить развернутый лист на 3 колонки: «Знаю», «Хочу знать», «Узнал»
3. Учащиеся читают вопросы и выписывают те понятие которые знают в 1 колонку «Знаю»
4. Во вторую колонку – «Хочу знать» выписывают проблемы, возникающие в ходе ответов на вопросы
Приложение 1
Неметаллы.
Общая характеристика неметаллов.
Неметаллы: атомы и простые вещества.
Вопросы
Что такое химический элемент?
Химический элемент имеет три формы существования. Какие?
Какие характеристики вы бы отнесли к понятию атом ?
Перечислите характеристики атомов металлов.
Перечислите характеристики веществ металлов.
Что такое антитеза?
Перечислите характеристики атомов неметаллов.
Перечислите характеристики веществ неметаллов.
Каких элементов в Периодической системе больше: элементов неметаллов или элементов металлов?
Почему простых веществ больше, чем химических элементов, которые их образуют?
II. Стадия «Осмысление»
1. Демонстрация фрагментов №1 и №2. «Аллотропии кислорода» и «Аллотропия углерода»
2. Чтение текста с маркировкой: «Знаю» \/, «Узнал» +, «Удивило» ? (Приложение № 2)
Приложение 2
НЕМЕТАЛЛЫ: атомы и простые вещества.
Само слово “неметаллы” указывает, что свойства неметаллических элементов и соответствующих им простых веществ противоположны свойствам металлов.
Если для металлов характерны сравнительно большие радиусы и небольшое число на внешнем уровне (1e-3e), то атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8.
Отсюда и строение атомов металлов к отдачи внешних электронов, т.е. восстановительные свойств, а для атомов неметаллов – стремление к приёму недостающих до заветной восьмёрки электронов, т.е. окислительные свойства.
Среди 119 известных сегодня химических элементов (из них 88 элементов найдено в природе) к неметаллам относят 22 элемента. Металлы в периодической системе расположены под диагональю В-Аt , а неметаллы – по этой диагонали и над ней.
Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием, хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки.
Судите сами: водород Н2, кислород О2 и озон О3, фтор F2, азот N2 – газы при обычных условиях, бром – жидкость, бор, углерод (алмаз, графит), кремний, фосфор (красный, белый), селен, йод I 2 – твердые вещества.
Температура плавления неметаллов также лежат в очень широком интервале: от 38000 С, у графита до 2100С. Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, белый – у брона, желтый – у серы, желто-зеленый – у хлора.
Эта особенность свойств неметаллов является следствием образования ими два типов кристаллических решеток: молекулярной (О2, N2, галогены, белый фосфор) и атомной (алмаз, графит, кремний, бор) Разные строения кристаллических решёток, объясняется явлением аллотропии (вспомните что это такое).
Например, элемент фосфора образует простое вещество с молекулярной решеткой – белый фосфор Р4 , и простые вещества с атомной кристаллической решеткой – красный фосфор Р и чёрный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример – простые вещества, образуемые элементом кислорода: обычный кислород О2 и озон О3.
3. Демонстрация опыта с пьезозажигалкой в близи влажной йодкрахмальной бумаги
III. Этап «»
1. Учащиеся отвечают на вопросы по второй колонки «Хочу узнать»
2. Учащиеся читают текст и вписывают в текст: «Элемент», «Вещество»
Приложение 3
Кислород в природе.
............. кислород – самый распространённый на Земле. Окружающий нас воздух – атмосфера содержит 23 % ....... кислорода по массе.
Ещё больше ....... кислорода содержится в земной коре – 47% по массе. Так в чрезвычайно распространённом продукте выветривания многих горных пород – глине – Al2O3*2SiO2*2H2O содержится ....... кислорода 62%.
В гидросфере – водах океанов, морей ....... кислорода содержится 89%.
В состав живых организмов входит до 65% ....... кислорода.
В лаборатории ....... кислород получают при разложении сложных кислородосодержащих веществ; например: 2H2O=2H2O +O2
В промышленности ....... кислород получают из воздуха, который представляет собой смесь различных газов; основные компоненты в нём ....... азот – 78% по объёму, ....... кислород – 21% по объёму.
Основной источник поступления ....... кислорода в атмосферу – процесс фотосинтеза.
Аллотропными видоизменениями ....... кислорода являются ....... кислород и ....... озон.
В отличие от бесцветного ....... кислорода, не имеющего запаха, озон – это светло-синий газ с сильным запахом. Примесь озона в воздухе, появляющаяся после грозы, даёт ощущение приятной свежести, содержится озон и в воздухе сосновых лесов и морского побережья.
....... Озон имеет большое значение для сохранения всего живого на нашей планете. Озоновый пояс Земли, расположенный на высоте 20-25 км, задерживает губительные ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов.
Домашнее задание: О.С. Габриелян § 15 упр. 5,6.
Неметаллы.
Общая характеристика неметаллов.
Неметаллы: атомы и простые вещества.
Вопросы
- Что такое химический элемент?
- Химический элемент имеет три формы существования. Какие?
- Какие характеристики вы бы отнесли к понятию атом ?
- Перечислите характеристики атомов металлов.
- Перечислите характеристики веществ металлов.
- Что такое антитеза?
- Перечислите характеристики атомов неметаллов.
- Перечислите характеристики веществ неметаллов.
- Каких элементов в Периодической системе больше: элементов неметаллов или элементов металлов?
- Почему простых веществ больше, чем химических элементов, которые их образуют?
НЕМЕТАЛЛЫ: атомы и простые вещества.
Само слово “неметаллы” указывает, что свойства неметаллических элементов и соответствующих им простых веществ противоположны свойствам металлов.
Если для металлов характерны сравнительно большие радиусы и небольшое число на внешнем уровне (1e-3e),
то атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8.
Отсюда и строение атомов металлов к отдачи внешних электронов, т.е. восстановительные свойств, а для атомов неметаллов – стремление к приёму недостающих до заветной восьмёрки электронов, т.е. окислительные свойства.
Среди 119 известных сегодня химических элементов (из них 88 элементов найдено в природе) к неметаллам относят 22 элемента. Металлы в периодической системе расположены под диагональю В-Аt , а неметаллы – по этой диагонали и над ней.
Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием, хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки.
Судите сами: водород Н2, кислород О2 и озон О3, фтор F2, азот N2 – газы при обычных условиях, бром – жидкость, бор, углерод (алмаз, графит), кремний, фосфор (красный, белый), селен, йод I 2 – твердые вещества.
Температура плавления неметаллов также лежат в очень широком интервале: от 38000 С, у графита до 2100С. Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, белый – у брома, желтый – у серы, желто-зеленый – у хлора.
Эта особенность свойств неметаллов является следствием образования ими два типов кристаллических решеток: молекулярной (О2, N2, галогены, белый фосфор) и атомной (алмаз, графит, кремний, бор)
Разные строения кристаллических решёток, объясняется явлением аллотропии (вспомните что это такое).
Например, элемент фосфора образует простое вещество с молекулярной решеткой – белый фосфор Р4 , и простые вещества с атомной кристаллической решеткой – красный фосфор Р и чёрный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример – простые вещества, образуемые элементом кислорода: обычный кислород О2 и озон О3.
Кислород в природе.
............. кислород – самый распространённый на Земле. Окружающий нас воздух – атмосфера содержит 23 % ....... кислорода по массе.
Ещё больше ....... кислорода содержится в земной коре – 47% по массе. Так в чрезвычайно распространённом продукте выветривания многих горных пород – глине – Al2O3*2SiO2*2H2O содержится ....... кислорода 62%.
В гидросфере – водах океанов, морей ....... кислорода содержится 89%.
В состав живых организмов входит до 65% ....... кислорода.
В лаборатории ....... кислород получают при разложении сложных кислородосодержащих веществ; например: 2H2O=2H2O +O2
В промышленности ....... кислород получают из воздуха, который представляет собой смесь различных газов; основные компоненты в нём ....... азот – 78% по объёму, ....... кислород – 21% по объёму.
Основной источник поступления ....... кислорода в атмосферу – процесс фотосинтеза.
Аллотропными видоизменениями ....... кислорода являются ....... кислород и ....... озон.
В отличие от бесцветного ....... кислорода, не имеющего запаха, озон – это светло-синий газ с сильным запахом. Примесь озона в воздухе, появляющаяся после грозы, даёт ощущение приятной свежести, содержится озон и в воздухе сосновых лесов и морского побережья.
....... Озон имеет большое значение для сохранения всего живого на нашей планете. Озоновый пояс Земли, расположенный на высоте 20-25 км, задерживает губительные ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов.
Тема: Вещества и их свойства
Цели и задачи
- Обучающие:
- знать определение предмета химии;
- знать определение вещество, свойства.
2) Развивающие:
- умение выделить главное;
- умение сравнить и находить существенные признаки;
- учить пользоваться логическими приёмами: анализ, синтез, обобщение.
3) Воспитывающие:
- развитие коммуникативных способностей.
- Стадия - «Вызова»
Мы приступаем к изучению нового предмета – химии. Химия это наука, относящаяся к естественным наукам.
Есть науки точные – математика, есть гуманитарные (литература, история), есть естественные (физика, география, биология).
Вы что-то слышали о науке химии на других предметах – географии, естествознании, биологии…
Попробуйте ответить на вопросы, написанные на доске:
- Что изучает химия?
- Зачем нужно изучать химию?
Каждый ученик быстро пишет свои мысли (не задумываясь над стилистикой, орфографией), заполняя первую колонку таблицы «Знаю»(5 мин)
| Знаю | Хочу узнать | Узнали |
- обсудить в паре свои записи (каждый рассказывает друг другу);
- выберите ключевые слова ваших записей.( Предполагаемые термины – атомы, молекулы, вещества, элементы...)
2. Стадия – «Осмысление»
(чтение с маркировкой)
Читаем текст пар. 1 стр. 5-6 до слов…велика роль химии в техническом прогрессе» и маркируем текст (ставьте знаки):
V Уже известно
- Противоречит твоим знаниям
+ Абсолютно новое
? Непонятно, или хочется узнать больше.
После чтения, выслушиваю несколько учеников. Предлагаю заполнить вторую колонку таблицы «Хочу знать» исходя из маркировочного чтения.
Записываем на доске термины и разбираем их.
Вещество, тело
Свойства
Химия
Физические свойства
Свойства тела
Свойства вещества
Химический диктант. Распределите перечисленные слова в две колонки: вещество, тело, ртуть, парафин, стакан, железо, стекло, ключ, свеча, вода, доска, льдинка.
- Стадия – «Рефлексия»
Заполняют третью колонку таблицы. «Узнал»
Домашнее задание: Габриелян О.С.. §. 1, выучить термины, написать мини-сочинение
«Какими качествами необходимо обладать для успешного изучения химии».
