Модуль Поверхневі явища. Дисперсні системи. Високомолекулярні речовини та їх розчини Донецьк 2011
| Вид материала | Документы |
СодержаниеСтійкість та коагуляція дисперсних систем. Поріг коагуляції, коагуляцій на здатність, константа швидкості коагуляції Цілі навчання Короткі методичні вказівки до роботи на практичному занятті |
- Тема. Будова речовини. Атоми та молекули. Взаємодія молекул. Явище дифузії. Мета, 108.53kb.
- Сучасна колоїдна хімія це велика, самостійна частина хімічної науки, що вивчає дисперсний, 136.55kb.
- Науково-практичної інтернет-конференції економічна політика країн єс 17 жовтня 2011, 3470.85kb.
- Янки, заочеревинного простору, малого тазу, верхніх та нижніх кінцівок методичні вказівки, 1038.09kb.
- Ренція «комплексне використанння природних ресурсів» (12 грудня 2011 року, м. Донецьк,, 2132.33kb.
- З хімії для вступу на перший курс навчання до Вінницького національного технічного, 99.03kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Завідувач кафедри М. П. Рагозін затверджено: на засіданні навчально-видавничої ради, 230.44kb.
- Явища природи. Механічні явища. 5 клас. Мета, 60.42kb.
- Назва реферату: Значення м’ясних страв у харчуванні, їх класифікація Розділ, 96.33kb.
Заняття 22
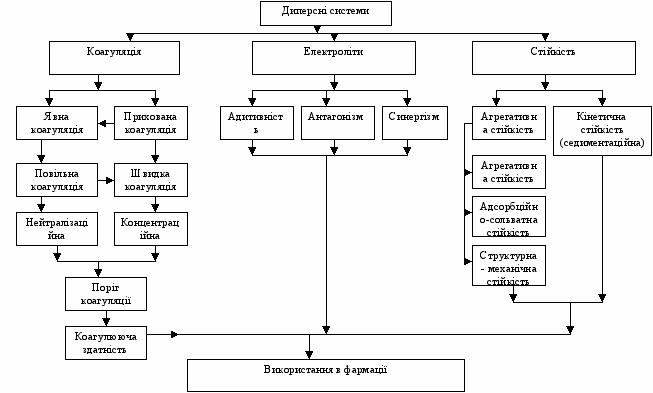
Стійкість та коагуляція дисперсних систем. Поріг коагуляції, коагуляцій на здатність, константа швидкості коагуляції
Актуальність теми
Дуже велика кількість лікарських засобів, які виготовляються фармацевтичними заводами, являються дисперсними системи. Дуже важливо в техніці виготовлення лікарських препаратів, щоб вони були стійкими до дії мікроорганізмів та мали довгий термін зберігання. Коагуляція – це процес злипання колоїдних частинок в більш крупні агрегати. Коагуляція лікарських препаратів призводить до втрати їх властивостей. Тому треба вміти запобігати коагуляції.
Цілі навчання
Загальна мета:
ВМІТИ визначати поріг та константу швидкості коагуляції.
Конкретні цілі:
ВМІТИ:
- Трактувати теорії стійкості і коагуляції.
- Визначати поріг коагуляції та коагуляційну здатність.
- Визначати константу швидкості коагуляції.
- Інтерпретувати використання коагуляції дисперсних систем в фармації.
Зміст навчання
Теоретичні питання:
- Стійкість ліофобного золю. Види і фактори стійкості.
- Коагуляція колоїдних розчинів. Коагуляція під дією електролітів.
- Кінетика коагуляції.
- Фізична теорія стійкості і коагуляції.
- Оосбливі випадки коагуляції.
- Коагуляція сумішами електролітів.
- Використання стійкості та коагуляції дисперсних систем в фармації.
Граф логічної структури теми “Коагуляція та стабілізація дисперсних систем”
Джерела інформації
Основна література:
- Физическая и коллоидная химия / В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др.; Под ред. В.И. Кабачного. – Харьков: изд-во НФАУ, 2001. – с. 298-307.
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999. –с. 298-307.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001. – с. 142-157.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Биофизическая химия / Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко; Под ред. Л.П. Садовничая.- Киев: изд-во „Высшая школа”, 1986. – с.222-234.
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.- с. 175-178.
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.- с. 201-212.
Орієнтовна основа дії
Див. Заняття 16. Алгоритм рішення задач з фізичної хімії.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
В лабораторії отриман колоїдний розчин лікарської речовини. З якою метою до нього додають ВМР?
А. Для зниження його стійкості
B. Для підвищення його стійкості
C. Для коагуляції
D. Для седиментації
E. Для підсилення дії електроліту-стабілізатору
Тест 2
В фармацевтичної лабораторії одержан гідрозоль срібла. Які з нижчеприведених речовин необхідно додати до цього золю, щоб підвищити його стійкість.
A. Стеарат плюмбуму
B. Олеат калію
C. Каолін
D. етіловий спирт
E. желатін
Тест 3
Золь АgСl одержан за реакцією подвійного обміну в надлишку NаСl. Для вивчення процесу коагуляції к отриманному золю додали розчини наступних електролитів: КВr, Ва(NО3)2, К2СrО4, АlCl3, МgSО4. Для якого з електролітів поріг коагуляції має найменше значення?
A. МgSО4
B. Ва(NО3)2
C. АlCl3
D. КВr
E. К2СrО4
Тест 4
Пороги коагуляції золя лікарської речовини електролітами МgSО4, NаСl, Аl(ОН)3 дорівнюють 0,81; 51,0; 0,095 ммоль/л. Який з іонів електролітів виявляє найбільшу коагулюючу дію?
A. Аl 3+
B. Мg2+
C. Nа+
D. Сl-
E. SО42-
Тест 5
Золь аргентуму броміду одержали в присутності надлишку нітрату срібла. При додаванні якого з приведених елекролітів спостерігається найменший поріг коагуляції.
A. NаСl
B. ВаСl2
C. Аl(NО3)3
D. К3РО4
E. СuSО4
Тест 6
У три пробірки налито по 5 мл золю гідроксиду заліза (ІІІ). Коагуляція золю настає, якщо додати до першої пробірки 1,05 мл розчину КCl із концентрацією 0,5 моль/л, до другої – 3,0 мл розчину K2SO4 із концентрацією 0,02 моль/л, до третьої – 0,9 мл розчину К3РО4 із концентрацією 0,003 моль/л. Розрахуйте пороги коагуляції золю електролітами.
A. γ КCl =105 ммоль/л; γ К2SО4 =12 ммоль/л; γ К3РО4 =0,54 ммоль/л
B. γ КCl =100 ммоль/л; γ К2SО4 =10 ммоль/л; γ К3РО4 =0,50 ммоль/л
C. γ КCl =105 моль/л; γ К2SО4 =12 моль/л; γ К3РО4 =0,54 моль/л
D. γ КCl =55 ммоль/л; γ К2SО4 =5 ммоль/л; γ К3РО4 =0,54 ммоль/л
E. γ КCl =12 ммоль/л; γ К2SО4 =105 ммоль/л; γ К3РО4 =0,54 ммоль/л
Еталони відповідей до цільових навчальних завдань:
Тест 1 – В, Тест 5- Д, Тест 6 - А
Розв'язання.
| Дано: V1= V2= V3= 5мл V КCl = 1,05 мл V К2SО4 = 3 мл V К3РО4 = 0,9 мл С КCl = 0,5 моль/л С К2SО4 = 0,02 моль/л С К3РО4 = 0,03 моль/л | 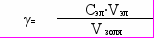 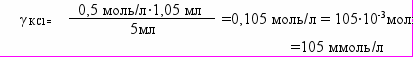 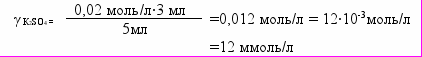 | | |
| γ1-? γ2-? γ3-? | | ||
| | γ К3РО4 = | 0,003 моль/л∙0,9 мл | =0,00054 моль/л = 0,54∙10-3моль/л=0,54 ммоль/л |
| | 5мл |
Відповідь: γ КCl =105 ммоль/л; γ К2SО4 =12 ммоль/л; γ К3РО4 =0,54 ммоль/л.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленість студентів до заняття шляхом тестування, або усного опитування, проводиться інструктаж з техніки безпеки з хімічними реактивами. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
