Модуль Поверхневі явища. Дисперсні системи. Високомолекулярні речовини та їх розчини Донецьк 2011
| Вид материала | Документы |
- Тема. Будова речовини. Атоми та молекули. Взаємодія молекул. Явище дифузії. Мета, 108.53kb.
- Сучасна колоїдна хімія це велика, самостійна частина хімічної науки, що вивчає дисперсний, 136.55kb.
- Науково-практичної інтернет-конференції економічна політика країн єс 17 жовтня 2011, 3470.85kb.
- Янки, заочеревинного простору, малого тазу, верхніх та нижніх кінцівок методичні вказівки, 1038.09kb.
- Ренція «комплексне використанння природних ресурсів» (12 грудня 2011 року, м. Донецьк,, 2132.33kb.
- З хімії для вступу на перший курс навчання до Вінницького національного технічного, 99.03kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Завідувач кафедри М. П. Рагозін затверджено: на засіданні навчально-видавничої ради, 230.44kb.
- Явища природи. Механічні явища. 5 клас. Мета, 60.42kb.
- Назва реферату: Значення м’ясних страв у харчуванні, їх класифікація Розділ, 96.33kb.
Заняття 28
Властивості розчинів ВМС. Набухання ВМС
Актуальність теми
Розчини ВМР знаходять широке застосування в медицині та фармації. Так, в медичній практиці їх використовують як плазмозамінники, кровозамінники (розчини полівінілового спирту, полівінілпіролідону). У фармації їх застосовують для пролонгованої дії лікарських речовин. Для більш широкого використання розчинів ВМР у медиціні і фармації слід добре знати закономірності взаємодії ВМР з низькомолекулярними рідинами.
Цілі навчання
Загальна мета:
ВМІТИ: трактувати характеристику та властивості розчинів ВМР.
Конкретні цілі:
ВМІТИ:
- Трактувати властивості розчинів ВМР.
- Розраховувати ступінь набухвння полімерів.
- Інтерпретувати використання розчинів ВМР у фармації.
Зміст навчання
Теоретичні питання:
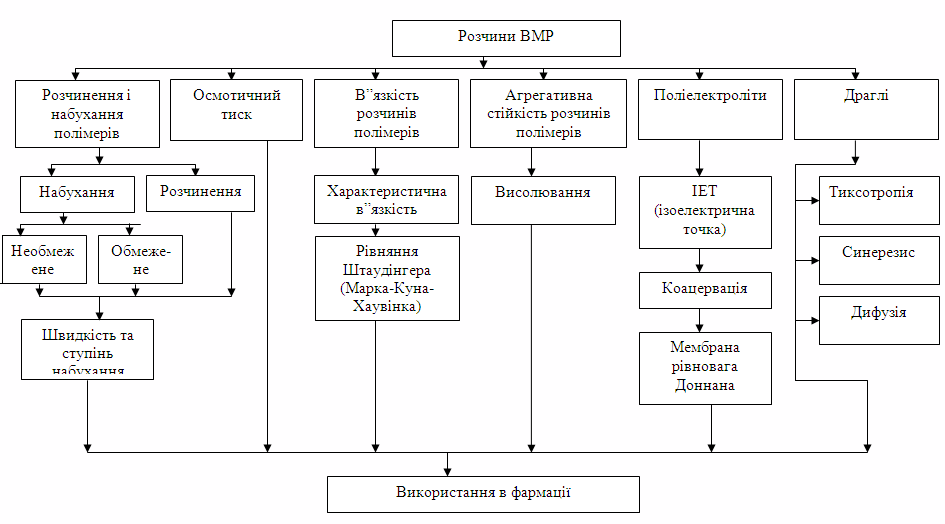
- Розчинення і набухання полімерів. Визначення набухання. Обмежене та необмежене набухання.
- Ступінь та швидкість набухання. Константа швидкості набухання.
- Осмотичний тиск розчинів ВМР. В'язкість розчинів полімерів. Структурна в'язкість.
- Рівняння Штаудінгера.
- Агрегативна стійкість розчинів ВМР. Висолювання.
- Поліелектроліти. Визначення поліелектролітів.
- Ізоелектрична точка (ІЕТ).
- Коацервація.
- Мембранна рівновага Доннана.
- Драглі. Тіксотропія. Синерезіс. Дифузія.
- Використання розчинів ВМР у фармації.
Граф логічної структури теми: „Розчини ВМР”
Джерела інформації
Основна література:
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999. –с. 343-356.
- Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005. – с. 312-318.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001. – с. 142-157.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.- с. 188-195.
Орієнтовна основа дії
Див. заняття 16. Алгоритм рішення задач з фізичної хімії.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
ВМР при певних умовах утворюють студні, які широко використовуються при виготовленні лікарських форм. Яке явище відбувається при старінні цих лікарських форм?
A. Тіксотропія
B. Набухання
C. Синерезис
D. Сольватація
E. Дифузія
Тест 2
Білки відіграють велику роль у процесах життєдіяльності. При якому значенні рН електрофоретична рухомість желатину дорівнює нулю (ізоелектрична точка желатину дорівнює 4,7)?
A. 7,0
B. 14,0
C. 5,5
D. 4,7
E. 9,4
Тест 3
Білки відіграють велику роль у процесах життєдіяльності. Ізоелектрична точка білка дорівнює 4,7. При якому рН макроіон білка рухається до катода?
A. 11,5
B. 7,0
C. 5,0
D. 4,7
E. 3,5
Тест 4
Вкажіть колігативну властивість розчинів, на якій базується метод визначення при 298К молекулярної маси біополімера.
A. Осмос
B. зниження тиску пари над розчином
C. кріоскопія
D. ебуліоскопія
E. Дифузія
Тест 5
Синтетичні високомолекулярні сполуки контактних лінз набрякають у вологому середовищі очей. Матеріал лінз має певну кількість води у набряклому стані. Це приклад:
A. обмеженого набрякання
B. необмеженого набрякання
C. синтетичного набрякання
D. кінетичного набрякання
E. адгезійного набрякання
Тест 6
Розрахуйте молекулярну масу полістиролу за величиною характеристичної в”язкості [η] = 0.105 л/г. Розчинник – толуол, константи рівняння Штаудінгера дорівнюють: К = 1,7·10-5; α= 0,69.
A.
B.
C.
D.
E.
Тест 7
До якого електрода буде переміщуватися частинка желатину при електрофорезі, якщо його ізоелектрична точка дорівнює 4,7, а рН розчину становить 4,1?
A.
B.
C.
D.
E.
Еталони відповідей до цільових навчальних завдань:
Тест 2 – Д, Тест 4- А, Тест 6-А, Тест 7-А
Тест 6
| Дано: [η] = 0,105 л/г. К = 1,7·10-5 α= 0,69 | Розв'язання. [η] = К·М α
Відповідь: М = 3,12·105 | |||||||||
| М-? |
Тест 7
| Дано: ІЕТ=4,7 рН=4,1 | Розв'язання. Залежно від рН розчину макроіони білка мають позитивний (у кислому середовищі за рахунок груп – NН3+) або негативний (у лужному середовищі за рахунок груп –СОО-) заряд: RNH2СООН+Н+→ RNH3+СООН RNH2СООН+ОН-→RNH2СОО-+Н2О рН розчину менший за ізоелектричну точку, тому дисоціація білка проходить за першим рівнянням. Отже, частинка желатину заряджається позитивно і переміщується при електрофорезі до катода. |
| До якого електроду переміщується? |
Відповідь: частинки желатину при електрофорезі переміщуються до катоду.
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленість студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 29
Колоквіум з теми: «Високомолекулярні сполуки»
Актуальність теми
Біологічні молекули (білки, жири, вуглеводи) є природними полімерами. ВМС використовуються при виготовленні лікарських препаратів в якості стабілізаторів колоїдних систем, драглів, тощо. Тому тема “ВМС” є важливою в підготовці спеціалістів - фармацевтів.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Класифікація ВМР.
- Значення ВМР в фармації.
- Методи отримання ВМР.
- Полідисперсність. Середня молекулярна маса ВМР. Методи визначення.
- Фазові і фізичні стани ВМР.
- Розчинення і набухання полімерів. Параметри набухання.
- Осмотичний тиск розчинів ВМР.
- В'язкість розчинів полімерів. Структурна в'язкість.
- Рівняння Штаудінгера.
- Агрегативна стійкість розчинів ВМР. Висолювання.
- Поліелектроліти. Визначення поліелектролітів.
- Ізоелектрична точка (ІЕТ).
- Коацервація.
- Мембранна рівновага Доннана.
- Драглі. Тиксотропія. Синерезіс. Дифузія.
- Використання розчинів ВМР у фармації.
Джерела інформації
Основна література:
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999.
- Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.
- Биофизическая химия / Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко; Под ред. Л.П. Садовничая.- Киев: изд-во „Высшая школа”, 1986.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент має виконати тестовий контроль (20-30 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 3 завдання, які охоплюють матеріал тем, що стосуються ВМС. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів ВМР (молекулярна маса, швидкість набуханння, тощо). Студенти працюють самостійно з наборами завдань за темою. Відповіді оформлюються на бланках. Потім викладач перевіряє роботи, аналізує помилки, підводить підсумки заняття.
Заняття 30
Підсумковий модульний контроль № 2
Актуальність теми
Колоїдна хімія знаходиться в тісному зв'язку з біохімією, технологією ліків, фармакологією, фармацевтичною та токсикологічною хімією та іншими предметами циклу підготовки майбутніх провізорів. Глибоке розуміння явищ колоїдної хімії необхідно для повноцінної професійної підготовки фармацевтів-провізорів.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Поверхневі явища та їх значення у фармації.
- Поверхнева енергія і поверхневий натяг.
- Змочування. Адгезія. Когезія. Їх значення у фармації.
- Сорбційні процеси та їх класифікація.
- Адсорбція. Емпіричне рівняння адсорбції Фрейндліха, його практичне застосування у фармації.
- Поверхнево-активні і поверхнево-інактивні речовини. Поверхнева активність, її визначення. Правило Дюкло-Траубе.
- Ізотерма поверхневого натягу розчинів поверхнево-активних речовин (ПАР).
- Теорія мономолекулярної адсорбції Ленгмюра. Рівняння ізотерми адсорбції Ленгмюра, його виведення і аналіз.
- Будова мономолекулярного шару. Визначення розмірів молекули ПАР.
- Теорія полімолекулярної адсорбції (БЕТ, Поляні).
- Використання адсорбції та ПАР.
- Адсорбційні плівки. Правило Дюкло-Траубе
- Молекулярна адсорбція із розчинів. Іонообмінна рівновага. Використання в фармації.
- Визначення дисперсної системи. Характеристика дисперсних систем. Класифікація дисперсних систем.
- Одержання дисперсних систем. Диспергаційні методи. Конденсаційні методи. Фізична конденсація. Хімічна конденсація.
- Очищення дисперсних систем. Діаліз. Електрофорез. Електроосмос.
- Застосування дисперсних систем у виготовленні лікарських засобів.
- Молекулярно-кінетичні властивості дисперсних систем. Броунівський рух. Дифузія. Осмотичний тиск. Седиментація. Седиментаційно-дифузна рівновага. Седиментаційний аналіз.
- Оптичні властивості дисперсних систем. Розсіяння світла.
- Оптичні методи дослідження дисперсних систем. Ультрамікроскопія. Нефелометрія. Турбідіметрія. Світлова і електронна мікроскопія
- Застосування молекулярно-кінетичних та оптичних властивостей дисперсних систем у виготовленні лікарських засобів.
- Подвійний електричний шар. Утворення подвійного електричного шару. Будова подвійного електричного шару.
- Вплив різних факторів на електрокінетичний потенціал.
- Електрокінетичні явища. Електрофорез. Електроосмос.
- Будова колоїдної міцели.
- Значення електрокінетичних явищ для фармації та медицини.
- Стійкість ліофобного золю. Види і фактори стійкості.
- Коагуляція колоїдних розчинів. Коагуляція під дією електролітів. Кінетика коагуляції. Фізична теорія стійкості і коагуляції.
- Коагуляція сумішами електролітів. Взаємна коагуляція електролітів.
- Використання стійкості та коагуляції дисперсних систем в фармації.
- Взаємна коагуляція колоїдів.
- Явища звикання золів.
- Механізм колоїдного захисту і сенсибілізація. Захисне число.
- Колоїдні поверхнево-активні речовини. Класифікація колоїдних ПАР.
- Причини міцелоутворення. Крітична концентрація міцелоутворення (ККМ).
- Використання КПАР в фармації.
- Системи з газовим дисперсійним середовищем. Аерозолі. Порошки.
- Система з рідким дисперсійним середовищем. Суспензії. Емульсії. Одержання. Стійкість.
- Використання в фармацевтичній галузі.
- Класифікація ВМР.
- Методи отримання ВМР. Полімеризація. Поліконденсація.
- Полідисперсність. Середньочисельна молекулярна маса. Середньомасова молекулярна маса. Коефіцієнт полідисперсності. Методи визначення.
- Гнучкість макромолекул. Фазові і фізичні стани ВМР.
- Значення ВМР для фармації.
- Розчинення і набухання полімерів. Визначення набухання. Обмежене та необмежене набухання. Ступінь і швидкість набухання. Константа швидкості набухання.
- Осмотичний тиск розчинів ВМР. В'язкість розчинів полімерів. Структурна в'язкість.
- Агрегативна стійкість розчинів ВМР. Висолювання.
- Поліелектроліти. Визначення поліелектролітів. Ізоелектрична точка (ІЕТ). Коацервація.
- Мембранна рівновага Доннана.
- Драглі. Тиксотропія. Синерезіс. Дифузія.
- Ви користання розчинів ВМР у фармації.
Джерела інформації
Основна література:
- Физическая и коллоидная химия / В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др.; Под ред. В.И. Кабачного. – Харьков: изд-во НФАУ, 2001.
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999.
- Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.
- Биофизическая химия / Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко; Под ред. Л.П. Садовничая.- Киев: изд-во „Высшая школа”, 1986.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент повинен виконати тестовий контроль (30-50 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 5 завдань, які охоплюють матеріал всього модуля. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів явищ колоїдної хімії. Студенти працюють самостійно з наборами завдань за темою. Відповіді оформлюються на бланках та віддаються викладачеві для перевірки.
