Модуль Поверхневі явища. Дисперсні системи. Високомолекулярні речовини та їх розчини Донецьк 2011
| Вид материала | Документы |
- Тема. Будова речовини. Атоми та молекули. Взаємодія молекул. Явище дифузії. Мета, 108.53kb.
- Сучасна колоїдна хімія це велика, самостійна частина хімічної науки, що вивчає дисперсний, 136.55kb.
- Науково-практичної інтернет-конференції економічна політика країн єс 17 жовтня 2011, 3470.85kb.
- Янки, заочеревинного простору, малого тазу, верхніх та нижніх кінцівок методичні вказівки, 1038.09kb.
- Ренція «комплексне використанння природних ресурсів» (12 грудня 2011 року, м. Донецьк,, 2132.33kb.
- З хімії для вступу на перший курс навчання до Вінницького національного технічного, 99.03kb.
- Програма для загальноосвітніх навчальних закладів 7 9 класи пояснювальна записка, 286.52kb.
- Завідувач кафедри М. П. Рагозін затверджено: на засіданні навчально-видавничої ради, 230.44kb.
- Явища природи. Механічні явища. 5 клас. Мета, 60.42kb.
- Назва реферату: Значення м’ясних страв у харчуванні, їх класифікація Розділ, 96.33kb.
Заняття 26
Колоквіум з теми: «Колоїдні дисперсні системи»
Актуальність теми
Деякі біологічні рідини є колоїдними системами. Існує багато лікарських форм, які представляють собою колоїдні розчини. Тому фармацевт-провізор має добре засвоїти методи створення та стабілізації колоїдів.
Цілі навчання
Загальна мета: вміти продемонструвати знання-уміння за темою.
Конректні цілі:
ВМІТИ:
- Інтерпретувати теоретичний матеріал за темою.
- Розрахувати параметри досліджуваних явищ з теми.
Теоретичні питання для самопідготовки:
- Визначення дисперсної системи. Характеристика дисперсних систем.
- Класифікація дисперсних систем. Класифікація за дисперсністю. Класифікація за агрегатним станом. Класифікація за структурою. Класифікація за міжфазною взаємодією.
- Одержання дисперсних систем. Диспергаційні методи. Конденсаційні методи. Фізична конденсація. Хімічна конденсація
- Очищення дисперсних систем. Діаліз. Електрофорез. Електроосмос.
- Застосування дисперсних систем у виготовленні лікарських засобів.
- Молекулярно-кінетичні властивості дисперсних систем. Броунівський рух. Дифузія. Осмотичний тиск. Седиментація. Седиментаційно-дифузна рівновага. Седиментаційний аналіз.
- Оптичні властивості дисперсних систем. Розсіяння світла.
- Оптичні методи дослідження дисперсних систем. Ультрамікроскопія. Нефелометрія. Турбідіметрія. Світлова і електронна мікроскопія.
- Застосування молекулярно-кінетичних та оптичних властивостей дисперсних систем у виготовленні лікарських засобів.
- Подвійний електричний шар. Утворення подвійного електричного шару. Будова подвійного електричного шару.
- Вплив різних факторів на електрокінетичний потенціал.
- Електрокінетичні явища. Електрофорез. Електроосмос.
- Будова колоїдної міцели.
- Теорія Штерна.
- Значення електрокінетичних явищ для фармації та медицини.
- Стійкість ліофобного золю. Види і фактори стійкості.
- Коагуляція колоїдних розчинів. Коагуляція під дією електролітів.
- Кінетика коагуляції.
- Фізична теорія стійкості і коагуляції.
- Особливі випадки коагуляції.
- Чергування зон стійкості.
- Коагуляція сумішами електролітів. Взаємна коагуляція електролітів.
- Використання стійкості та коагуляції дисперсних систем в фармації.
- Взаємна коагуляція колоїдів.
- Явища звикання золей.
- Механізм колоїдного захисту і сенсибілізація.
- Колоїдний захист. Захисне число.
- Окремі класи дисперсних систем. Їх різноманітність.
- Колоїдні поверхнево-активні речовини.
- Класифікація колоїдних ПАР.
- Причини міцелоутворення. Критична концентрація міцелоутворення (ККМ).
- Солюбілізація.
- Використання КПАР в фармації.
- Системи з газовим дисперсійним середовищем. Аерозолі. Порошки.
- Система з рідким дисперсійним середовищем. Суспензії. Одержання суспензій. Молекулярно-кінетичні властивості. Оптичні властивості. Стійкість суспензій.
- Емульсії. Одержання емульсій. Класифікація емульсій. Стійкість емульсій. Емульгатори та їх механізм дії. Руйнування емульсій.
- Пасти. Піни.
Джерела інформації
Основна література:
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999.
- Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001.
- Лекції з фізичної та колоїдної хімії.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1964.
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.
- Биофизическая химия / Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко; Под ред. Л.П. Садовничая.- Киев: изд-во „Высшая школа”, 1986.
Короткі методичні вказівки до роботи на практичному занятті
Кожний студент повинен виконати тестовий контроль (20-30 тестів). Після того, як студент віддає тестову роботу викладачеві, він отримує 3 завдання, які охоплюють матеріал теми. Завдання передбачають вміння інтерпретувати матеріал за темою та проводити розрахунки параметрів утворення колоїдів, їх оптичних та електричних властивостей, тощо. Студенти працюють самостійно. Відповіді оформлюються на бланках. Потім викладач перевіряє роботи, аналізує помилки, підводить підсумки заняття.
Заняття 27
Характеристика та властивості високомолекулярних сполук (ВМС). Середня молекулярна маса ВМС
Актуальність теми
До високомолекулярних речовин (ВМР) відносять сполуки з молекулярною масою 104-106 і вище. ВМР мають велике значення у процесах життєдіяльності. До високомолекулярних речовин належать білки (казеїн, желатин, крохмаль), які складають основу харчування, нуклеїнові кислоти і інші біополімери. ВМР використовують у медицині та фармації. З полімерів виготовляють інструментарій, предмети догляду за хворими, протези для заміни втрачених органів. У фармації полімери використовують для виготовлення оболонок капсул, у які поміщають лікарські речовини для створення мазей і пластирів.
Цілі навчання
Загальна мета:
ВМІТИ трактувати характеристику та властивості ВМР.
Конкретні цілі:
ВМІТИ:
- Трактувати характеристику та класифікацію дисперсних систем.
- Інтерпретувати використання ВМР у фармації.
- Розраховувати середню молекулярну масу ВМР.
Зміст навчання
Теоретичні питання:
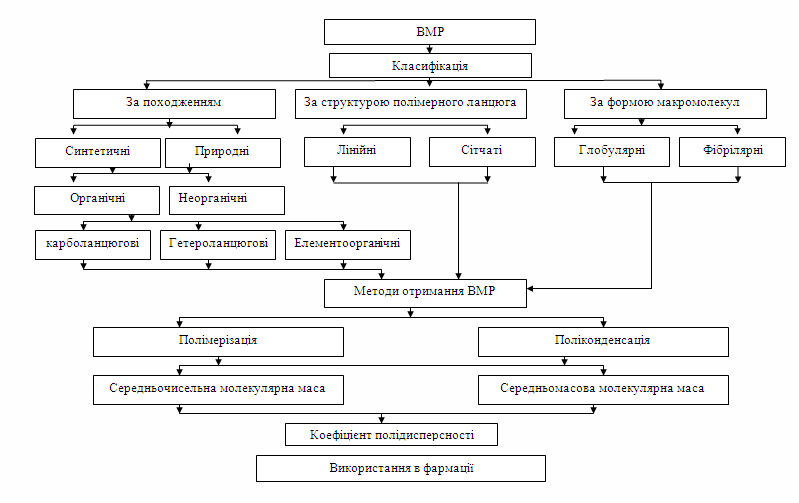
- Класифікація ВМР. Класифікація за походженням. Класифікація за структурою.
- Класифікація за формою. Класифікація за складом головного ланцюга макромолекул.
- Методи отримання ВМР. Полімеризація. Поліконденсація.
- Полідисперсність. Коефіцієнт полідисперсності.
- Середня молекулярна маса ВМР. Методи визначення.
- Середньочисельна молекулярна маса. Середньомасова молекулярна маса.
- Гнучкість макромолекул.
- Фазові і фізичні стани ВМР.
- Значення ВМР для фармації.
Граф логічної структури теми
“Високомолекулярні речовини. Молекулярна маса.”
Джерела інформації
Основна література:
- Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во УукФА „Прапор”, 1999. –с. 336-343
- Физическая и коллоидная химия/ В.И. Кабачный, л.к. Осипенко, Л.Д. Грицан; Под ред. В.И. Кабачного.- Харьков: изд-во НФаУ, 2005. – с. 312-318.
- Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. – Харьків: вид-во НФАУ „Золоті сторінки”, 2001. – с. 142-157.
- Лекції з фізичної та колоїдної хімії.
- Граф логічної структури.
Додаткова література:
- Физическая и коллоидная химия / М.И. Равич-Щербо, В.В.Новиков.; Под ред. М.И.Равич-Щербо.- Москва: изд-во «Высшая школа», 1975.- с. 188-195.
Орієнтовна основа дії
Див. Заняття 16. Алгоритм рішення задач з фізичної хімії.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
В лабораторії одержано колоїдний розчин лікарської речовини. З якою метою до нього додають ВМР?
A. Для підвищення його стійкості.
B. Для зниження його стійкості.
C. Для коагуляції.
D. Для седиментації.
E. Для посилення дії електроліту-стабілізатору.
Тест 2
В колоїдні засоби срібла (протаргол, коларгол) додають ВМР для підвищення стійкості. Чим визначають здатність ВМР захищати золь від коагуляції?
A. Порогом коагуляції
B. Розмірністю електрокінетичного потенціалу
C. Розмірністю електродінамічного потенціалу
D. Захисним числом
E. Електрофоретичною рухомістю
Тест 3
При боротьбі з шоком використовують розчин поліглюкіну. Як його отримують?
A. Пептизацією
B. Диспергуванням
C. Реакцією поліконденсації
D. Реакцією полімеризації
E. Розчиненням в відповідному розчиннику
Тест 4
ВМР при певних умовах утворюють драглі, які широко використовуються при виготовленні лікарських форм. Яке явище відбувається при старінні цих лікарських форм?
A. Тіксотропія
B. Набухання
C. Синерезис
D. Сольватація
E. Дифузія
Тест 5
Фармацевтичний препарат коларгол – це колоїдний розчин срібла, в склад якого входить ВМР. Яку функцію виконує ця сполука?
A. Визиває коагуляцію
B. Підвищує агрегативну стійкість
C. Співдіє седиментації
D. Знижує агрегативну стійкість
E. Збільшує ступінь дисперсності
Тест 6
Фармацевтичний засіб протаргол – це колоїдний засіб срібла. Для підвищення його агрегативної стійкості до нього додають ВМР (білки). Користуючись величинами срібного числа (в мг), оберіть ВМР, яке буде мати найбільше захисну дію.
A. Желатин – 0,035.
B. Декстрин – 100,0
C. Сапонін – 35,0
D. Яєчний альбумін – 2,5
E. Гемоглобін – 0,25.
Тест 7
У зразку ВМР містяться 0,5 молярної частки з молекулярною масою 100000 і 0,5 молярної частки з молекулярною масою 200000. Розрахуйте середньочисельну і середньомасову молекулярні маси наведеного зразка.
A. Мn=1,5·105; Мω=1,7·105
B. Мn=1·105; Мω=1·105
C. Мn=2,5·105; Мω=3,7·105
D. Мn=1·1010; Мω=1,7·105
E. Мn=2·105; Мω=2·105
Еталони відповідей до цільових навчальних завдань
Тест 7-А
| Дано: N1 = 0,5 М1= 100000= 1·105 N2 = 0,5 М2= 200000= 2·105 | 1. Розв'язання.
| ||||||||||||
| Мn=? Мω=? | |||||||||||||
| | Мn= | 0,5·1·105+0,5·2·105 | = | 0,5·105+1·105 | = | 1,5·105 | =1,5·105 | | |||||
| | 0,5+0,5 | 1,0 | 1 | | |||||||||
| | Мω= | n | | ||||||||||
| | ∑Ni·(Мi)2 | | |||||||||||
| | i=1 | | |||||||||||
| | n | | |||||||||||
| | ∑Ni·Мi | | |||||||||||
| | i=1 | | |||||||||||
| Мω= | 0,5·(1·105)2+0,5·(2·105)2 | = | 0,5·1010+0,5·4·1010 | = | 0,5·1010 +2·1010 | = | | ||||||
| 0,5·1·105+0,5·2·105 | 0,5·105+1·105 | 1,5·105 | | ||||||||||
| = | 2,5·1010 | =1,7·105 | | ||||||||||
| 1,5·105 | |
Відповідь: Мn=1,5·105; Мω=1,7·105
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленість студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
