Рецензенти: доц. Московського станкоинструментального інституту, канд техн наук Г. И. Гранітів; викладач Московського технікуму електронних приладів А. В. Закревская Гаркуша Ж. М
| Вид материала | Документы |
СодержаниеЕлектронів в атомах і спектри Квантові числа Будівля твердого тіла |
- Україна харківська міська рада харківської області виконавчий комітет управління освіти, 181.85kb.
- Гост 17623-87, 138.94kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Надійності та безпеки в будівництві, 692.13kb.
- Гост 5382-91, 1729.88kb.
- Д. М. Лаковский (руководитель темы); И. В. Колечицкая; С. А. Резник, канд техн наук;, 203.82kb.
- Гост 14637-89: Прокат толстолистовой из углеродистой стали обыкновенного качества Технические, 310.23kb.
- Государственный стандарт союза сср здания и сооружения Методы измерения яркости, 278.78kb.
- Гост 26824-86, 248.28kb.
- Строительные нормы и правила отопление, вентиляция и кондиционирование, 2477.63kb.
ЕЛЕКТРОНІВ В АТОМАХ І СПЕКТРИ
РЕНТГЕНІВСЬКИХ ПРОМЕНІВ
Повна енергія електрона в атомі складається з кінетичної енергії руху електрона по орбіті Ек і потенційної енергії Еп притягання електрона до ядра.
Кінетична енергія визначається швидкістю руху електрона по п-й орбіті:
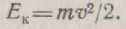
Потенційна енергія залежить від сили притягання електрона ядру; для атома водню

(1.6)
В атомі водню електрон обертається по орбіті з радіусом , якщо доцентрова сила, що утримує його на орбіті, врівноважується силою притягання електрона до ядра:

(1.7)
Користаючись цією рівністю, можна перетворити вираження ля Ек;
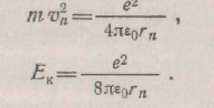
(1.8)
(1.7)
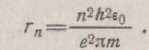
допомогою першого постулату Бора (1.5) і вираження знайдемо значення радіуса n-й орбіти:
(1.9)
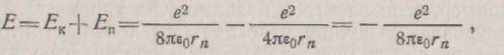
чи, використовуючи формулу (1.9),
Тоді вираження для сповненої енергії електрона можна представити у виді
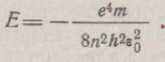
(1.10)
З формули (1.10) випливає, що енергія електрона в атомі негативна і визначається числом п, .яке називають головним квантовим числом. Головне квантове число визначає той енергетичний рівень, на якому знаходиться електрон. Значенню
15
n = 1 відповідає перший, найближчий до ядра, енергетичний рівень. Електрон на цьому рівні має мінімальну енергію.
Підставивши значення постійних параметрів у формулу (1.10), одержимо для атома водню
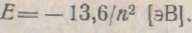 визначеному дозволеному значенню енергії. Всі інші значення енергії є забороненими, тобто електрон не може їх приймати (мал. 1.9).
визначеному дозволеному значенню енергії. Всі інші значення енергії є забороненими, тобто електрон не може їх приймати (мал. 1.9).З викладеного можна зробити висновок, що електрон в атомі здатний приймати тільки строго визначені, дискретні значення енергії. Зазначені значення представляються у виді енергетичної шкали, кожна риска на який відповідаєПерехід електрона з одного енергетичного рівня на іншій можливий тільки при дотриманні двох умов:
1)рівень, на який здійснюється перехід, повинний із тримати "вільне місце" для електрона;
2)для переходу на більш високий енергетичний рівень
електрону повинна бути повідомлена додаткова енергія в соотв.
с третім постулатом Бора. Наприклад, якщо електрон знаходиться на рівні Е1 те для переходу на рівень Е2 потрібно, щоб там мався незайнятий стан і щоб електрон одержав додаткову енергію Е = Е2- Е1.Стан атома буде стійким, якщо електронами заповнені самі нижні енергетичні рівні. Такому стану відповідає мінімальне значення енергії атома. Якщо під дією чи опромінення нагрівання електрон в атомі перейде на більш високий енергетичний рівень, то такий стан атома називають збудженим. Це стан хитливий, тому при припиненні опромінення електрон повертається у вихідний стан, випускаючи квант енергії. Практичним доказом дискретності енергетичних рівнів електронів в атомах служать спектри рентгенівських променів. Спектри ці бувають двох видів: суцільні, чи безупинні, і лінійчаті, чи характеристичні.
16
Спектри можна спостерігати за допомогою рентгенівської трубки; схема її найпростішої конструкції представлена на мал. 1.10. Між анодом (антикатодом) і катодом трубки підтримується різниця потенціалів порядку декількох десятків кіловольт. Як анод вибирають матеріал, рентгенівський спектр якого досліджується. У звичайних рентгенівських трубках використовують матеріали з великим атомним номером. При поступовому збільшенні напруги на трубці спочатку спостерігається суцільний спектр, а при великих, порядку декількох кіловольтів, напругах - лінійчатий.Електрон рухається в рентгенівській трубці під дією сил електричного полючи від катода до анода. При гальмуванні електрона на аноді виникають електромагнітні коливання, що складаються з набору хвиль різної довжини, що дають суцільний спектр так називаного гальмового випромінювання. Електромагнітні коливання, що виникають при гальмуванні електронів, створюють безупинний потік рентгенівських променів. Інтенсивність суцільного спектра збільшується з ростом напруги на трубці і зі збільшенням атомного номера речовини анода. При подальшому збільшенні напруги настає момент, коли крім суцільного спектра виникає і лінійчатий, чіткі лінії якого різко виділяються на тлі безупинного спектра.З ростом напруги на трубці, спочатку з'являються лінії м'яких серій слабкої інтенсивності. Якщо продовжувати збільшувати напруга, то з'являються промені більш твердих серій. Причина цього полягає в наступному.Під дією прискореного електрона, що знаходиться на внутрішній орбіті атома анода електрон викидається зі свого рівня на один з більш високих рівнів. Атом збуджується. ; У той же момент який-небудь електрон з більш вилученої від ядра орбіти, що володіє більшою енергією, переходить на місце, що звільнилося, па низькому рівні енергії. При такому переході атом випромінює квант енергії. У результаті збуджений атом цілком втрачає отриману їм енергію і повертається в нормальний незбуджений стан (мал. 1.11), Насуцільному спектрі з'являється лінія, що відповідає випущеному кванту енергії.
Атоми різних елементів поглинають і випускають різні "панти енергії, але завжди строго визначені для даного елемента. Чим більше атомний номер елемента, тим велику порцію енергії він може захопити і випустити.
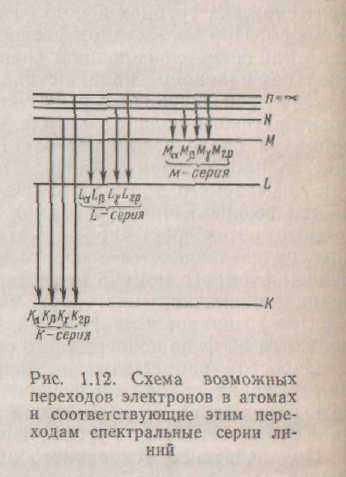
Кожен випущений квант енергії дає па спектрі лінію характеристичного спектра. Ці лінії утворять серію. Серії позначають буквами ДО, L, М, N. Лінії серії До виникають при переході електронів з різних орбіт на саму внутрішню орбіту, що позначається ДО; лінії серії L виникають при переході електронів на другу орбіту, що позначається L, і т.д. Лінії в
17
кожної серії позначають буквами а, ?, ? : лінії відрізняються друг від друга частотою випромінювання. Лінію, що відповідає переходу електрона з вільного стану на енергетичний рівень атома, називають граничною лінією серії (мал. 1.12). Лінії /(-серії- самі інтенсивні, але число ліній у цій серії найменше.
Для різних металів необхідно різна напруга для одержання лінійчатого спектра. Так, для молібденового анода при
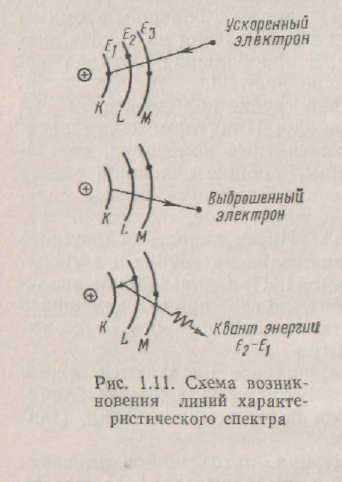
напрузі 0,06 кв виникають лінії N-серії, при 0,51 кв - лінії М-серії, при 2,87 кв - лінії L-серії, при 20 кв - До-серії. Для вольфрамового анода До-серія виникає при 69,3 кв, L- ceрия - при 12,1 кв.
§ 1.4. ХВИЛЬОВЕ РІВНЯННЯ ЕЛЕКТРОНА.
КВАНТОВІ ЧИСЛА
Завдяки наявності в електрона хвильових властивостей рух його в атомі може бути описане за допомогою хвильового рівняння. Уперше хвильове рівняння для електронів було отримано Шредингером і має його ім'я. Це рівняння зв'язує енергію електрона з просторовими координатами і так називаною хвильовою функцією ? Рівняння Шредингера складно, і його рішення дає вираження хвильової функції в комплексній формі, тому фізичний зміст має не сама функція, а її квадрат?2 Ця величина виражає щільність імовірності перебування електрона
18
у відповідній області простору в даний момент часу Іншими словами, імовірність виявлення електрона в деякому обсязі?V виражається добутком ?2??
Вирішуючи рівняння Шредингера для руху електрона, що знаходиться в потенційному полі ядра, можна одержати вираження (1,10) для енергії електрона.
Значення енергії електрона визначається головним квантовим числом. Найменше значення енергії електрона відповідає n - 1. Чим більше квантове число, тим більше енергія електрона. Стану електрона, обумовлені значеннями квантового числа п, називають енергетичними рівнями. Рівень, найближчий до ядра, називають До-рівнем, інші - L-, М-, N-рівнями.
Електрони в атомі можуть рухатися не тільки по кругових орбітах, але і по еліптичним, ексцентриситет яких визначається другим квантовим числом l, називаним побічним чи орбітальної. Фізично орбітальне число визначає момент кількості руху електрона навколо центра орбіти. Воно приймає значення цілих чисел від 0 до п- 1; значення / = 0 відповідає круговій орбіті; 1 = п-1 відповідає орбіті з найбільшим ексцентриситетом.
Енергетичні стани електрона, що характеризуються різними значеннями побічного квантового числа, називають подуровнями. Їм привласнені наступні літерні позначення:
/= 0 s-подуровень, І = 2 d-підрівень,
l = 1 р- підрівень, І = 3 підрівень.
Можливі орієнтації площини орбіти електрона характеризуються магнітним квантовим числом т. Це число має 2/+ 1 значень: від -/ до +1.Крім заряду і маси електрон характеризують моментом кількості руху навколо власної осі і зв'язаним з ним
магнітним моментом. Вектор моменту кількості рухи може
бути рівнобіжний чи антирівнобіжний, у залежності отнаправле-
ния обертання електрона, вектору орбітального моменту. Це з-
стояння електрона визначається четвертим квантовим числом s,
що називають спіновим чи просто спином. Спин електрона -ньому половині величини постійної Планка. Оскільки спини
часток прийнято вимірювати в одиницях Л, то спин електрона може
бути дорівнює +1/2 чи -1/2.
Якщо в атомі кілька електронів, потрібно враховувати взаємодія між ними. Потенційна енергія електрона залежитьне тільки від його відстані до ядра, але і від відстані до кожного з інших електронів. Дуже важливий тип взаємодіїміж електронами зв'язаний з відкриттям Паули "принципу виключення > - в атомі в кожнім квантовому стані може знаходити-
не більш одного електрона. Оскільки кожне квантове складаючись-
19
ние характеризується визначеним набором квантових чисел п, І, те, s, те принцип виключення означає, що в атомі деякою визначеною комбінацією цих чисел може володіти не більш ніж один електрон. Якщо один електрон знаходиться в деякому квантовому стані, то при введенні в атом іншого електрона останній виявиться в іншому стані.
Визначимо число можливих енергетичних станів на кожнім з енергетичних рівнів. Перший енергетичний рівень - ДО, нього відповідає п= 1. Значення п визначає значення І = О и m = 0. Спин завжди має значення +1/2 і - 1/2. Отже, на першому енергетичному рівні можна розмістити два електрони з однаковими квантовими числами п, І, m, що розрізняються спином. Це можна записати у виді: 1 , де 1-номер енергетичного рівня, s - стан електрона на цьому рівні (чи подуровне), 2--кількість електронів у даному стані.
На другому рівні п = 2 можливі два стани: s, що відповідає / = 0, і р, що відповідає /=1. Для s-стану m-0, а для p-стану m має три значення: -1, 0 і +1- Отже, у p-стані можна розмістити шістьох електронів. Таким чином, розглядаючи енергетичні стани на кожнім рівні, можна визначити максимальне число електронів у кожнім стані відповідно до принципу Паули. Заповнення енергетичних станів на кожнім рівні приведене в табл. 1.1.

Яквидно з таблиці, число можливих станів на рівні визначається номером чи рівня значенням головного квантового числа п. Наприклад, для п = 3 1=0, 1, 2. Кожен стан заповнюється окремо. Визначимо максимальне число електронів для = 2. У цьому випадку m = -2, -1, 0, 1, 2. Маючи значення чотирьох квантових чисел, можна скласти наступні їхні комбінації:
20

Отже, на третьому енергетичному рівні в стані d можна розмістити десять електронів.
§ 1.5. ЕЛЕКТРОННА БУДІВЛЯ АТОМІВ
При рішенні питання про розподіл електронів в атомах по можливим квантовим станом використовуються два принципи:
- в атомі не може бути двох електронів з однаковою комбінацією квантових чисел п, І,m , s -принцип Паули;
- у нормальному стані атома кожен електрон займає
квантовий стан з найменшою можливою енергією.
Розглянемо ряд елементів періодичної таблиці Менделєєва.
Водень, порядковий номер його в таблиці z=1 єдиний електрон водню розташовується на першому енергетичному рівні, тобто п = 1. Виходячи зі значення п, визначаємо значення опальних квантових чисел: І = 0, m = 0, s = і 1/2. Електрон водню може виявитися в кожнім із двох станів, обумовлених чотирма квантовими числами: п = 1, / = 0, m = 0, s = 1/2; п = 1, / - 0, m = 0, s = - 1/2. Положення електрона в атомі водню на першому енергетичному рівні в стані s можна коротко записати так: 1s1.
Гелій (м = 2). Два електрони гелію заповнюють обоє состоя-ния s; один виявляється в стані, обумовленому квантовими числами п= 1, 1 = 0, m = 0, s= 1/2, для іншого - п =1, / = 0, m - 0, s = -1/2. Короткий запис: 1 s2. Гелій дуже інертний хімічно через великий потенціал іонізації і відсутності вакантних електронних станів на рівні п = 1. Атом гелію поетому не може ні віддати, ні приєднати до себе електрон без витрати великої кількості енергії. Гелій не утворить молекули з жодним елементом.
Літій (2 = 3). Перші два електрони знаходяться в стані п - 1, / = 0, m = 0, s = ± 1/2 так само, як і електрони атома гелію, але тут вони в середньому знаходяться ближче до ядра і більш Міцно зв'язані. На рівні п = 1 вільних місць ні, тому
третій електрон виявляється в новому стані з п = 2, що відповідає більш високому значенню енергії. Для третього електрона п = 2, 1 = 0, т = 0, s=l/2. Короткий запис: 1s2 2s1.Бериллий ( z = 4). Спрощений запис: Іs2 2s2.Бор (z = 5). П'ятий електрон заповнює новий стан з / = 1 (п - 2, 1 = 1, т = - 1, s = 1/2). Спрощений запис: l522s22p'.Неон (z= 10). Цим елементом закінчується заповнення електронної оболонки з п = 2. Неон подібний гелію і хімічно зовсім інертний.Побудова електронних оболонок в елементів ІІІ періоду (від z- 11 до z=18) аналогічно. Аргон, що завершує цей період, має такий розподіл електронів по рівнях: 1s22s22p63s23p6.
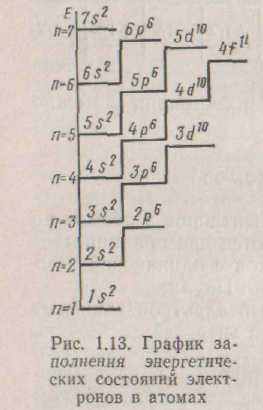
Побудова електронних оболонок в елементів четвертого і наступного періодів більш складно. Так, у калію (z=19) і кальцію (z=20) після заповнення стану Зр6 електрони заповнюють стан 4s. Подібним чином будуть заповнюватися стану 5s, 6s і 7s в елементів перших двох груп таблиці Менделєєва - рубідію Rb, цезію Cs, Франція Fr, барію Ва, радію Ra. Однак починаючи з елементів ІІІ групи електрони заповнюють стан d попереднього енергетичного рівня до 10 електронів і тільки після цього будуть заповнювати стан р.
Уперше правило побудови електронних оболонок було сформульовано радянським ученим Клечковским. Користаючись цим правилом, порядок заповнення енергетичних рівнів електронами можна записати в такому виді: 1s22s22p63s23p64s23dl04p65s24dlo5p66s24fl45dlo6p67s2.
Таке заповнення електронних оболонок відбувається відповідно до графіка, представленим на мал. 1.13. Наприклад, для германія (м =32): Іs22s22p63s23p64s23dіo4p2
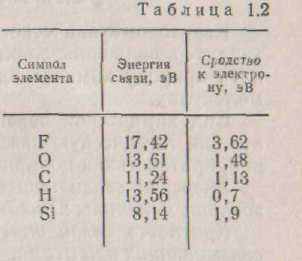
Атоми елементів кожної групи періодичної таблиці мають однакова будівля зовнішніх і достраивающихся електронних подуровней. Періодичність електронної будівлі виявляється в тім, що через визначене число елементів знову повторюються s, р, d і f - елементи з однаковими конфігураціями зовнішніх електронних подуровней. Періодичність електронних структур елементів приводить до періодичної зміни ряду фізичних властивостей елементів, зокрема атомних радіусів, енергії зв'язку і спорідненості до електрона. Енергією зв'язку називають роботу, яку потрібно зробити для видалення електрона з одиночного атома на нескінченну відстань. Спорідненість до електрона - це кількість енергії, що виділяється при приєднанні електрона до
22
нейтральному атому з утворенням негативно зарядженого
іона.
У табл. 1.2 приведені значення енергії зв'язку і спорідненості до електрона для деяких елементів.
Пройшло більш ста років із дня відкриття Д. И. Менделєєв одного з основних законів природи. За ці роки надзвичайно розширилися і поглибилися наші знання про будівлю речовини.
Однак Періодичний закон не толь-
до не померк, а, навпаки, придбав
найважливіше значення в дослідженнях
будівлі атомів, а пізніше й атомних
ядер. Цілком виправдалися пророчі словаД. И. Менделєєва про те,що "майбутнє не грозить Періодично
му закону руйнуванням, а обіцяєтільки надбудову і розвиток".
Паули, проаналізувавши закономірності системи Менделєєва з погляду квантової теорії, прийшов до своєму "принципу виключення". Надалі цей принцип ліг в основу теорії будівлі атомів і молекул, пророкування існування античастинок, теорії металів і напівпровідників, теорій надпровідності і надтекучості, теорії атомних ядер.
Контрольні питання і задачі
1.У чому полягає відмінність теорії Планка-Эйнштейна від
класичнихпредставлень процесів випущення і поглинання світла?
2. Чи можна за допомогою досвіду по дослідженню фотоефекта визначити роботу виходу?
3.Чому в різних твердих тіл значення роботи виходу по-різному?
4.Визначити масу фотона, довжина хвилі якого 10~8 див.
5.Яку енергію повинні мати фотони, щоб їхня маса була дорівнює масі
вільного електрона (mе=9,11*10~20 г)?
6.За допомогою яких досвідів можна довести, що електромагнітне випромениние має двоїстий характер?
7.У чому теорія будівлі атома Бора суперечить представленням класичної фізики?
8.Знайти частоту кругового руху електрона, якщо його швидкість v=
= 2,0-106 м/с, а радіус орбіти r=5,3-10~" м.
9.На підставі теорії Бора довести, що справедливо формулу, виведений
ная Бальмером для водневого спектра.
10.Що означає термін "дискретність" для енергетичних рівнів електронів в атомі?
11.У спектрі випущення водню є лінія, що відповідає частоті
v = 4,57-1014 Гц. Визначити зміна енергії атома водню при випромінюванні
світла, що відповідає даної спектральної лінії.
12.Однакові чи різні спектри гальмування рентгенівських променів длярізних матеріалів?
13.Чим порозумівається розходження лінійчатих спектрів рентгенівських променів урізних матеріалів?
14.Чим відрізняються лінії в кожній серії спектра?
15. Чи мається відмінність у поняттях "робота виходу" і "енергія зв'язку"?
23
РОЗДІЛ 2
БУДІВЛЯ ТВЕРДОГО ТІЛА
§ 2.1. ХІМІЧНИЙ ЗВ'ЯЗОК У МОЛЕКУЛАХ
Квантово механічне рівняння Шредингера, що описує характер руху електрона в атомі, дає можливість пояснити природу хімічних зв'язків, що виникають між атомами в молекулах.
Вид хімічного зв'язку визначається будівлею і властивостями атомів. Хімічний зв'язок можна характеризувати енергією, довжиною, кратністю і полярністю.
Енергією зв'язку називають енергію, що виділяється при утворенні молекули з нейтральних атомів.
Кратність зв'язку визначається кількістю електронних пар єднальних два атоми.
Довжиною зв'язку називають відстань між ядрами атомів.
Полярність зв'язку обумовлюється зсувом електронної пари до одному з атомів і залежить від электроотрицательности зв'язаних атомів.
Электроотрицательность - це величина, що характеризує здатність атома в молекулі притягати електрони, що беруть участь в утворенні хімічного зв'язку.
При зближенні атомів відбувається взаємне перекриття електронних оболонок і між атомами виникають сили електростатичної взаємодії. Важливою характеристикою взаємодії є зміна потенційної енергії атомів, що зближаються.
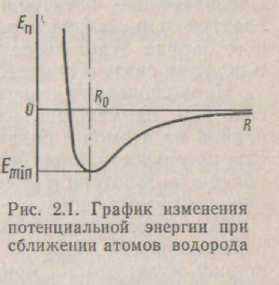
Розглянемо зміну потенційної енергії при утворенні молекули водню з нейтральних атомів. Графік зміни потенційної енергії для цього випадку приведений на мал. 2.1. При зближенні вилучених друг від друга атомів аж до деякої відстані R0 потенційна енергія зменшується. Це зменшення потенційної енергії зв'язано з перевагою сил електростатичного притягання над силами відштовхування. Починаючи з зазначеної відстані, між атомами переважають сили відштовхування, що веде до різкого зростання потенційної енергії. Відстань Ro відповідає рівності сил притягання і відштовхування, для молекули водню воно дорівнює 0,087нм.
Перекриття електронних оболонок атомів водню, що зближаються, приводить до усуспільнення електронів для обох ядер; цей ефект зветься обмінної взаємодії. Сили такої взаємодії називають обмінними силами, а їхню енергію - обмінною енергією.
У залежності від орієнтації спинов усуспільнених електронів обмінна взаємодія може привести до утворення або сил притягання, або сил відштовхування. Якщо спини рівнобіжні, то між атомами, що зближаються, виникають сили відштовхування, і молекула не утвориться. При антипаралельних спи-
24
вони виникають сили притягання, що сприяють утворенню молекули.
Усуспільнені електрони найчастіше знаходяться в області перекриття, оскільки там на них діють сили притягання обох ядер, що приводить до зменшення енергії електронів. Отже, в області перекриття електронних оболонок зростає щільність негативного заряду, що сприяє зближенню ядер взаємодіючих атомів, у результаті чого молекула стає стійкою.
Хімічний зв'язок, здійснюваний усуспільненими електронами, називається ковалентної.
В утворенні хімічного зв'язку беруть участь тільки валентні електрони, а оскільки всі атоми прагнуть мати стійку оболонку інертного газу, що відповідає найменшому запасу енергії, то кількість пара усуспільнених електронів відповідає валентності елемента. Наприклад, у кисню валентність дорівнює двом, тобто до стійкої оболонки йому не вистачає двох електронів, тому при утворенні молекули кисню виникають дві електронні пари. Схематично це можна представити так:
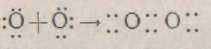
Кількість електронних пар, що виникають при утворенні молекул з атомів, здатних виявляти різну валентність, визначається числом неспарених електронів. В азоту валентність може бути дорівнює 2, 3, 4, 5, але число неспарених електронів у нього дорівнює трьом, тому і число електронних пар дорівнює трьом.
Ковалентні зв'язки мають властивість спрямованості. Наприклад, в атомі азоту в р- стані три електрони мають при однаковому орбітальному квантовому числі / = 1 різні магнітні квантові числа: m = - 1, 0 і 1, тобто їхні електронні орбіти орієнтовані в просторі по трьох взаємно перпендикулярних напрямках. Така спрямованість зберігається і при утворенні хімічних сполук. Наприклад, у молекулі аміаку
 атоми водню розташовані стосовно атома азоту приблизно по трьох взаємно перпендикулярних напрямках. Ця властивість є загальним для ковалентних зв'язків.
атоми водню розташовані стосовно атома азоту приблизно по трьох взаємно перпендикулярних напрямках. Ця властивість є загальним для ковалентних зв'язків.Якщо на зовнішній електронній оболонці атома частина електронів утворить між собою пари з антипаралельними спинами, а частина електронів не спарена, то при утворенні хімічної сполуки спарені електрони можуть перейти в межах свого електронного шару в неспарений стан, а витрачена на те енергія компенсується за рахунок хімічного зв'язку. Таке з-
25
стояння атома називають збудженим на відміну від нормального стаціонарного стану атома, якому відповідає мінімум енергії.
Якщо молекула утвориться з атомів з однакової электроотрицательностью, то зв'язок між атомами називають неполярним ковалентним зв'язком. Якщо ж молекулу утворять атоми з разног але близької электроотрицательностью, то зв'язок цю називають полярної ковалентний. У першому випадку усуспільнені електрони в однаковій мірі належать обом атомам, а в другому вони виявляються зміщеними убік одного з атомів. Чим більше электроотрицательность, тим сильніше атом притягає електрони Отже, електронні пари зміщаються убік більш електронегативного елемента. Середня щільність отрицатель ного заряду буде вище в більш електронегативного елемента і тому зв'язок стає полярною.
Найбільшої электроотрицательностью володіють фтор і інші галогени, найменшої - лужні метали. У молекулі, утвореної з атомів із сильно розрізняються значеннями электро заперечності, електронна пара настільки зміщається убік більш електронегативного атома, що її можна вважати приналежної цьому атому.
Така молекула складається вже не з нейтральних атомів, а з різнойменно заряджених попів. Розглянемо процес утворення іонної молекули на прикладі повареної солі Na Cl. Будівля електронних оболонок у натрію - 1s22s22p63sl в атомів хлору 1s22s32p63s23p5.
На останній оболонці натрій має один зайвий електрон, а в хлору електрона не вистачає. Якщо атому натрію повідомити енергію, рівну енергії зв'язку, то відбудеться іонізація атома і він придбає стійку оболонку: 1s22s22p, а вільний електрон, що утворився, може бути приєднаний до атома хлору. При цьому виділиться енергія спорідненості електрона до атома хлору й утвориться нон хлору: 1s22s22pfі3s23p6. Між іонами, що утворилися, виникають сили електростатичного притягання, що сприяють утворенню іонної молекули. У чистому виді як іонна, так і ковалентний зв'язок зустрічається рідко. Існує багато з'єднань, у яких поряд з іонним зв'язком мається і ковалентна. Питання про характер зв'язку приходиться вирішувати для кожного данною з'єднання шляхом зіставлення ряду його властивостей, і все-таки в багатьох випадках характер зв'язку залишається спірним. Велика частина висновків, зроблених при розгляді питання про будівлю молекул і характер зв'язків у них, може бути перенесена на характер зв'язків у кристалах.
