Рецензенти: доц. Московського станкоинструментального інституту, канд техн наук Г. И. Гранітів; викладач Московського технікуму електронних приладів А. В. Закревская Гаркуша Ж. М
| Вид материала | Документы |
- Україна харківська міська рада харківської області виконавчий комітет управління освіти, 181.85kb.
- Гост 17623-87, 138.94kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Надійності та безпеки в будівництві, 692.13kb.
- Гост 5382-91, 1729.88kb.
- Д. М. Лаковский (руководитель темы); И. В. Колечицкая; С. А. Резник, канд техн наук;, 203.82kb.
- Гост 14637-89: Прокат толстолистовой из углеродистой стали обыкновенного качества Технические, 310.23kb.
- Государственный стандарт союза сср здания и сооружения Методы измерения яркости, 278.78kb.
- Гост 26824-86, 248.28kb.
- Строительные нормы и правила отопление, вентиляция и кондиционирование, 2477.63kb.
Для газоподібного стану речовини характерно рівномірне заповнення молекулами газу всього наданого їм обсягу. Якщо газ знаходиться в рівноважному стані, молекули
26
рухаються хаотично; будь-які напрямки їхнього руху равновероятны. Швидкості молекул при цьому можуть бути всілякими по величині. Зміна швидкостей молекул при зіткненнях відбувається випадковим образом: швидкості можуть зменшуватися і зростати з рівною імовірністю, але середня швидкість молекул, а отже, і їхня енергія будуть визначатися температурою газa.
Користаючись рівнянням стану ідеального газу і формулою для тиску, що робиться газом на стінки судини, можна вивести формулу середньої кінетичної енергії для молекул газу:
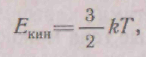
де k = 8,62-10-s ев/град = 1,380 10-23 Дж/ДО - постійного Больц-мaна; Г -температура, К.З формули видно, що середня енергія молекул газу залежить тільки від температури і не залежить від їхньої маси. Взаємодією молекул можна зневажити, оскільки відстань між молекулами набагато перевищує їхні розміри.
Рідкий стан займає проміжне положення між газоподібним і твердим. Для рідин характерна наявність визначеного обсягу, але разом з тим рідина приймає форму тієї судини, у який вона поміщена. У розташуванні часток Рідини спостерігається так називаний ближній порядок. Це означає, що стосовно будь-якої частки розташування найближчих до неї сусідніх часток є упорядкованим, однак у міру видалення від даної частки розташування стосовно неї інших часток стає усе менш упорядкованим і досить швидко загальний порядок у розташуванні часток цілком зникає. Рух часток рідини має складний характер. Кожна молекула протягом деякого часу коливається біля положення рівноваги. Час від часу молекула змінює місце рівноваги, стрибком переміщаючи в нове положення, що відстоїть від попереднього на відстань порядку розмірів самих молекул. Час перебування молекули в стані рівноваги може бути різним, але середня тривалість коливань молекули біля синього положення рівноваги є для кожної рідини визначеною величиною, що залежить від температури. Через відсутність у рідинах далекого порядку вони изотропны, тобто властивості їх однакові у всіх напрямках. Виключення складає лише особливий клас рідин, що одержали назву рідких кристалів.
Молекули рідини розташовуються настільки близько друг до
друга, що сили притягання між ними мають значну
величину. Кожна молекула усередині рідини випробує притягання з боку навколишніх її молекул, тому результуючих сил взаємодії буде дорівнює нулю. Якщо молекула знаходиться на поверхні, то притягання з боку молекул приповерхнього газу значно слабкіше притягання з боку молекул
27
самої рідини, тому на поверхневу молекулу буде діяти сила, спрямована усередину рідини. Отже, молекули на поверхні рідини володіють більшою потенційною енергією, чим молекули в обсязі рідини. Завдяки наявності поверхневої енергії рідина виявляє прагнення до скорочення своєї поверхні. Для рідин характерні висока щільність і мала стискальність.
Тверді тіла відрізняються упорядкованим розташуванням часток, що обумовлено значними силами взаємодії між ними. Тверді тіла підрозділяють па аморфні і кристалічні. Розходження між цими класами твердих речовин настільки велико, що аморфні тіла можна розглядати як сильно переохолоджені рідини з дуже високим коефіцієнтом в'язкості. Перше розходження у властивостях кристалічних і аморфних тіл виявляється у властивостях кристалізації і плавлення. Кристалічні тіла мають строго визначену температуру плавлення. Це означає, що розривши зв'язків між частками, що утворять тверді тіла, відбувається при цілком визначеному тепловому режимі, причому температура тіла, що нагрівається, не змінюється доти , поки весь зразок не розплавиться, і енергія, що повідомляється тілу ззовні, йде в цей час тільки на розрив зв'язків. Аморфні тіла при нагріванні розм'якшуються поступово, у широкому діапазоні температур. Енергія зв'язку між частками аморфного тіла різнаі і такі тіла не мають визначеної температури плавлення.
Характерна властивість кристалічних тіл - анизотропность, тобто розходження механічних, фізичних, теплових і інших властивостей по різних кристалографічних напрямках. Аморфні тіла изотропны.
Анизотропность кристалів обумовлена особливостями їхньої внутрішньої будівлі.
Таким чином, при порівнянні трьох агрегатних станів речовини, можна зробити висновок, що у твердому стані речовина існує в рівновазі при більш низьких температурах, чим у рідкому і газоподібному. Тверді тіла мають тому найнижчу внутрішню енергію.
§ 2.3. КРИСТАЛІЧНА СТРУКТУРА ТВЕРДОГО ТІЛА
У кристалічних твердих речовинах існує визначене для даної речовини розташування часток, що зберігається на всьому протязі тіла при всіх температурах, менші температури плавлення. Просторову сітку, у вузлах якої розташовані, частки, називають кристалічними ґратами. Найменший багатогранник, якому можна виділити в кристалічних ґратах і при переміщенні якого по трьох взаємно перпендикулярних напрямках можна одержати ці ґрати, називають елементарним осередком. Довжини ребер елементарного осередку називають постійними ґрати. Постійні ґрати -а, b, з -
28
можуть бути різні по величині в залежності від форми елементарного осередку. Крім постійних ґрат елементарний осередок характеризується кутами між ребрами-
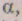
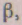
 (мал. 2.2).
(мал. 2.2).Всі існуючі кристали складають 14 типів кристалічних ґрат. Розрізняють ґрати прості, чи примітивні, базоцентрированные, объемно-центрированные і гранецентрированные. Якщо атоми розташовуються у вершинах паралелепіпеда, що утворить елементарний осередок, то такі ґрати називають простий (мал. 2.3, а). Якщо атоми розташовуються й у крапці перетинання просторових діагоналей, то ґрати називають обсяг-
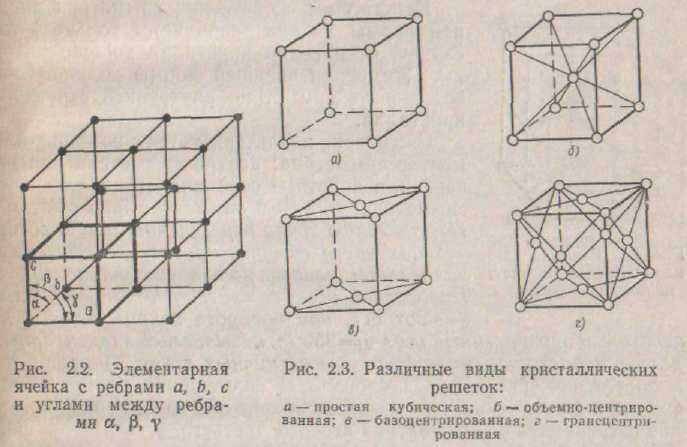
про-про-центрованої (мал. 2.3, б), якщо в центрі верхньої і нижньої основ -базоцентрированной (мал. 2.3, в), якщо в центрах усіх граней - гранецентрированной {мал. 2.3, г)..Не всі атоми елементарного осередку належать тільки їй. Наприклад, в объемно-центрированной ґратах атоми, що знаходяться у вершинах, належать і сусіднім елементарним осередкам, тобто на частку кожного елементарного осередку приходиться 1/8 атома. Кожному елементарному осередку, таким чином, належать всего два атоми: 1 + ('/8) X 8. У гранецентрированной ґратам елементарному осередку належать чотири атоми: 8 X ( -+ 6 X
І В залежності від типу ґрат по-різному не тільки число часток в елементарному осередку, але і відстань між ними, а виходить, і щільність упакування часток. Число найближчих до розглянутого атома сусідніх атомів називають координаційним числом. Чим воно більше, тим щільніше упаковані частки в кристалічних ґратах, і виходить, тим меншою внутрішньою енергією володіє кристал,
.
29
Для металів характерні гранецентрированные, кубічні і гексагональні ґрати з координаційним числом 12 і об'ємні з координаційним числом 8.
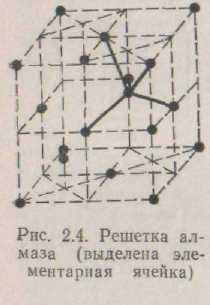
Напівпровідники утворять складні кристали. Германій і кремній мають кристалічні ґрати типу алмаза. Ґрати алмаза складаються з двох гранецентрированных кубічних ґрат, зрушених відносно один одного на одну чверть діагоналі куба (мал. 2.4). Координаційне число тут дорівнює чотирьом. Селенів і телур мають гексагональні ґрати; бор можуть існувати у виді декількох кристалічних модифікацій. Найбільш стабільної з них є ромбоэдрическая.
Кристаллам властива симетрія зовнішньої форми, але вона виявляється тільки в тому випадку, якщо грані кристала добре розвиті. Симетрії зовнішньої форми повинна відповідати симетрія внутрішньої структури кристала.
Симетрія характеризується за допомогою елементів симетрії: центра чи симетрії інверсії, поворотних осей симетрії, площини симетрії. Центром симетрії називають математичну крапку перетинання ліній, що з'єднують частини фігури, протилежні, рівнобіжні, рівні, але назад спрямовані. Поворотною віссю симетрії п-го порядку називають вісь, при повороті навколо який на
деякий визначений кут а = 360/п, називаний елементарним кутом, відбувається сполучення симетричних крапок. Порядок вісп п визначає, скільки разів відбудеться сполучення симетричної фігури із самої собою при повороті навколо осі на 360°. У кристалів зустрічаються осі симетрії другого, третього, четвертого і шостого порядків. Площина симетрії поділяє кристал на двох частин, що є дзеркальним відображенням одна іншої. Чи сингонією системою називають сукупність елементів симетрії однієї категорії з однаковим числом осей симетрії того самого порядку. По симетрії внутрішніх форм розрізняють сім сингонії: триклинну, моноклінну, ромбічну, гексагональну, ромбоэдрическую, тетрагональну і кубічну. Найбільшою симетрією володіє кубічна сингонія. Вона характеризується наявністю центра симетрії, дев'яти площин симетрії, чотирьох осей третього порядку, трьох осей четвертого порядку і шести другого порядку.
У 1867 р. російський академік А. В. Гадолин прийшов до висновку, що число форм кристалічних тіл повинне бути обмежено. Він установив, що існує усього лише 32 виду симетрії кристалів. У 1885 р. Е. С. Федоров, що видається росіянин кристаллограф, у результаті глибокого вивчення світу кристалів, закономірностей їхньої симетрії установив основні закони будівлі кристалічних тіл і показав, що усередині 32 класів симетрії
30
може існувати 230 різних просторових груп. Один
із законів Федорова визначає зв'язок між хімічним складом кристала і порядком його симетрії: чим простіше хімічний
склад кристала, тим вище його симетрія, у міру ускладнення
складу кристала, його симетрія стає нижче,
Дійсно, більшість кристалів хімічних елементів
має кубічну чи гексагональну сингонію.
Для елементарних напівпровідників і багатьох напівпровідникових
з'єднань характерний високий ступінь симетрії. Напівпровідники розподіляються по класах сингонії в такий спосіб:
- до кубічної сингонії відносяться алмаз, германій, кремній,
сіре олово, арсеніди, антимоніди і фосфіди галію, алюмінію
й індію, теллуриды свинцю і кадмію й ін.;
- до гексагональної сингонії - оксид цинку, сірчистий цинк, сернистыи кадмій, селенистий кадмій і ін.; - до тригональної сингонії - селенів.
Анизотропность має на увазі, що властивості кристала в будь-яких його внутрішніх крапках однакові в рівнобіжних і симетричних напрямках. Чим вище симетрія кристала, тим більше число симетричне рівних напрямків. Кристали кубічної сингонії тому ближче усього до ізотропних середовищ. Анизотропность яскраво виявляється в кристалах гексагональної, тетрагональної і тригональної сингонії.
Більшість речовин у твердому стані мають тільки один, переділений тип кристалічної структури. При нагріванні таких тіл їхня кристалічна будівля не змінюється аж до крапки плавлення. Інші речовини, такі, як вуглець, олово, кремнезем Sі2, глинозем А12ПРО3, можуть існувати у виді двох чи декількох кристалічних структур. Явище, коли речовина того самого хімічного складу існує в різних кристалічних модифікаціях, називають поліморфізмом. Самі модифікації називають аллотропическими. Вуглець може існувати як у виді графіту з гексагональною будівлею кристалічних ґрат шаруватого типу з координаційним числом 3, так і у виді алмаза, що утворить кубічні кристали з координаційним числом 4. Металеве олово (тетрагональні кристалічні ґрати) стійко тільки при температурах вище 13° С, а нижче цієї температури його ґрати приймають кубічну форму а- олова {сіре олово). Поліморфні перетворення можуть бути обумовлені зміною не тільки температури, але і тиску. Як правило, зниження температури і підвищення тиску сприяють поли- морфным перетворенням, при яких збільшується щільність упакування атомів у кристалічних ґратах і координаційне число. Навпаки, підвищення температури і зниження тискусупроводжуються посиленням теплових коливань ґрати, зростанням обсягу, що приходиться на один атом ґрат, і спосіб-
31
ствуют переходам до ґрат, що мають менше координаційне число.
Деякі речовини виявляють здатність утворювати змішані так називані тверді розчини- з іншими речовинами. Таке явище називають ізоморфізмом. Ізоморфізм виявляється в речовин з однотипними молекулами в тому випадку, якщо будівля їхніх елементарних осередків однаково, а розміри осередків досить близький друг до друга.
§ 2.4. ХІМІЧНІ ЗВ'ЯЗКИ В КРИСТАЛАХ
Кристали класифікують по типі хімічного зв'язку між частками. У загальному випадку між атомами, що утворять кристал, можуть діяти гравітаційні, магнітні й електричні сили. Перші два види сил набагато слабкіше електричних, тому можна вважати, що у встановленні хімічних зв'язний
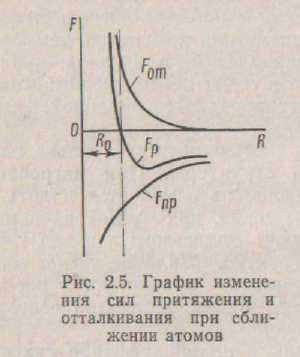
беруть участь електричні сили взаємодії валентних електронів. Сили хімічних зв'язків виникають при зближенні атомів до відстаней, що мають порядок суми радіусів вільних атомів. При зближенні атомів відбувається перекриття хвильових функцій, тому виникають сили притягання, що є причиною утворення хімічного зв'язку. При подальшому зближенні атомів починають діяти сили відштовхування; це короткодействующие сили, величина яких різко зростає при зменшенні межатомного відстані. У рівноважному стані сили притягання і відштовхування рівні між собою, що відповідає мінімальної енергії Ео взаємодіючих часток (мал. 2.5) і, отже, стійкому стану. По фізичній природі сил, що діють між частками ґрат, розрізняють зв'язку іонні, металеві, межмолекулярные і ковалентні.
32
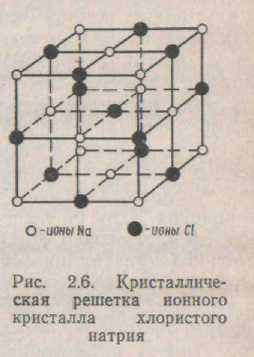
Іонний зв'язок. У вузлах кристалічних ґрат іонних кристалів знаходяться різнойменні іони (мал. 2.6). Атоми в іонних кристалах обмінюються електронами, утворити ноны зі стійкими зовнішніми оболонками. Кожен іон у ґратах оточений з усіх боків іонами протилежного знака, тому сили притягання між різнойменними іонами перевищують сили відштовхування, що виникають між іонами одного знака. Оскільки при взаємодії різнойменних зарядів потенційна енергія зменшується, а для невзаємодіючих іонів її можна прийняти рівної нулю, енергія сил притягання буде менше нуля:
Епр<0. Потенційна енергія сил відштовхування позитивна: Е>0. Повна енергія Е буде дорівнює їхній сумі (мал. 2.7).
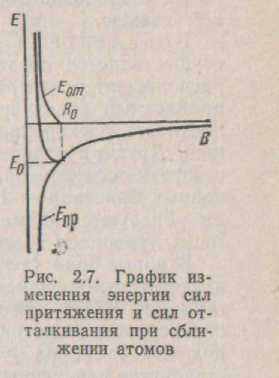
Положення Ео визначає величину енергії зв'язку між іонами. Іонним кристалам присуща висока енергія зв'язку. Іонний монокристалл можна розглядати як гігантську іонну молекулу, у якій кожний з іонів взаємодіє з всіма іншими. Тому іонний зв'язок є ненаправленої і ненасичений.Висока енергія зв'язку в іонних кристалах (для NaCl вона складає 16,5 ев при рівноважному межатомном відстані -0,28 їм) служить причиною високої міцності і високої температури плавлення іонних з'єднань. Багато іонних кристалів
і прозорі, діамагнітним і є ізоляторам.
Металевий зв'язок характерний для металів: увузлах ґрат металів знаходяться позитивно заряджені іони, хімічний зв'язок між який здійснюється за допомогою вільних електронів, що утворять електронний газ. Металевий зв'язок виникає в тому випадку, коли невелике число валентних електронів, а при цьому вони слабкіше зв'язані з ядрами. При утворенні металів електронні оболонки валентних електронів перекриваються, тому валентні електрони одержують можливість переходити від одного атома до іншого і вільно переміщатися по всьому кристалі. Вільні електрони зв'язують позитивні іони в міцну структуру. Металевий зв'язок більш гнучкий іпластична, чим іонна.
Межмолекулярная зв'язок спостерігається в молекулярних кристалах, що містять у своїх вузлах стійкі молекули. Між молекулами діють слабкі сили межмолекулярного взаємодії (сили притягання Ван-дер-Ваальса). Природа цих сил зводиться до взаємодії молекулярних диполів.Молекули, що утворять кристал, можуть бути полярними. Диполі молекул орієнтуються так, що звернені друг до друга кінці сусідніх диполів разнополярны, і сили притягання переважають
33
над силами відштовхування. Такі сили називають ориентационными. Молекули, що утворять кристал, можуть бути і неполярними. Однак через рух електронів і коливання ядер електричні центри ваги позитивних і негативних зарядів можуть зміститися - виникне миттєвий електричний момент диполя. Диполі орієнтуються відповідним чином, і між молекулами виникають сили притягання. Такі сили називають поляризаційними. Сили Ван-дер-Ваальса є короткодействующими, вони пропорційні R-?.
Більшість елементарних напівпровідників і напівпровідникових з'єднань утворять кристалічні ґрати з ковалентним зв'язком.
Ковалентний зв'язок у кристалах, як і в молекулах, здійснюється за допомогою електронних пар. У вузлах ґрат розташовуються нейтральні атоми. Ковалентний зв'язок має спрямований характер: вона утвориться в тім напрямку, де щільність електронної хмари спарених електронів найбільша. Іншими словами, кожен атом ґрат може взаємодіяти тільки з визначеними атомами, а не з усіма, як в іонних кристалах. Найбільш характерні ковалентні кристали утворяться елементами четвертої групи періодичної таблиці: вуглецем (алмаз), германієм і кремнієм.
У нормальному стані розподіл валентних електронів про атоми цих елементів наступне: для вуглецю 2s22p2, для германія 4s24p2, для кремнію 3s23p2. У процесі утворення кристала відбувається поділ спарених s електронів, і один з них переходить на р- рівень. У результаті всі чотири електрони стають ідентичними, з однаковим видом електронної хмари. У просторі ці хмари спрямовані таким чином, що зводять до мінімуму потенційну енергію системи. Цій вимозі відповідає утворення тетраэдрических зв'язків: кожен атом ґрати знаходяться в центрі тетраедра, валентні зв'язки спрямовані до його кутів. Кожен атом взаємодіє з чотирма іншими, тому ковалентний зв'язок є насиченої. Напрямок валентних зв'язків не збігається з напрямком ребер елементарного осередку. Межатомное рівноважна відстань між найближчими атомами (постійна ґрати) у ґратах алмаза, кремнію і германія дорівнює 0,356, 0,235 і 0,245 нм, а найкоротша відстань між атомами складає відповідно 0,1542, 0,235 і 0,245 нм. Різні величини цих параметрів говорять про те, що ступінь перекриття електронних оболонок в алмаза найбільша, отже, сама міцний ковалентний зв'язок утвориться в алмаза. Завдяки спрямованості зв'язку, ковалентні кристали упаковані менш щільно, чим іонні.У виробництві напівпровідникових приладів крім германія і кремнію широко використовуються з'єднання Л1П Bv. Ці з'єднання одержують у результаті взаємодії елементів третьої і п'ятої груп періодичної системи. Вони кристалізуються в ґратах типу чи сфалериту цинкової обманки. Одні атоми Л1П
34
ЧИ Bv займають вершини і центри граней куба, а інші - центри чотирьох з восьми малих кубів (мал. 2.8). Структура кристалів А111 BY аналогічна структурі алмаза з тією різницею, що центри малих кубів зайняті атомами іншого виду в порівнянні з вершинами і центрами граней великого куба. В елементарному осередку знаходиться всего вісім атомів - по чотирьох кожного виду- і кожен атом Аш зв'язаний з чотирма атомами Bv, а кожен атом Вv у свою чергу зв'язаний з чотирма атомами А111.

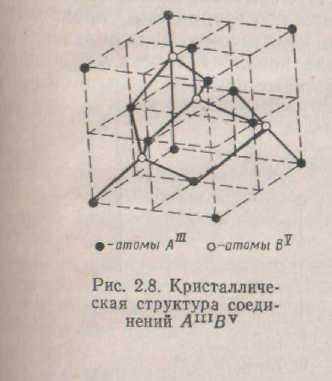
В атомів Аш на останньому рівні три валентних електрони, а в Bv до стійкої оболонки не вистачає трьох електронів (мал. 2.9)
Аш - s2pl, Bv-s-
Здавалося б, зв'язок у такім з'єднанні повинна бути іонної, але на основі рентгеноспектральних досліджень установлено, що в ґратах з'єднань Аш Bv спостерігається ковалентний зв'язок.
Три електронні пари утворяться за рахунок електронів s2pl в А111 і р3 у BY. Четверта пара утвориться за рахунок s2 електронів
v (мал. 2.10). Четверті електронні пари представлені на малюнку великими крапками. Ґрати А111 Ву складається з неоднакових атомів, тому електронні пари зміщаються убік більш електронегативних елементів Вv, і вони здобувають деякий негативний заряд, а атоми Аш - деякий позитивний заряд. Такий вид зв'язку спостерігається в арсенідів, фосфідів і антимонідів галію, алюмінію, індію. З інших напівпровідникових з'єднань у напівпровідниковій технології використовують карбід кремнію, диоксид міді. Карбід кремнію існує в двох модифікаціях: B-Sі і a-Sі. Кристали B-Sі мають ґрати цинкової обманки, у якій каж-
35
дый атом вуглецю зв'язаний з чотирма атомами кремнію і навпаки. Для a- Sі C характерна гексагональні ґрати. Практичне застосування знаходять тільки кристали a-Sі C.
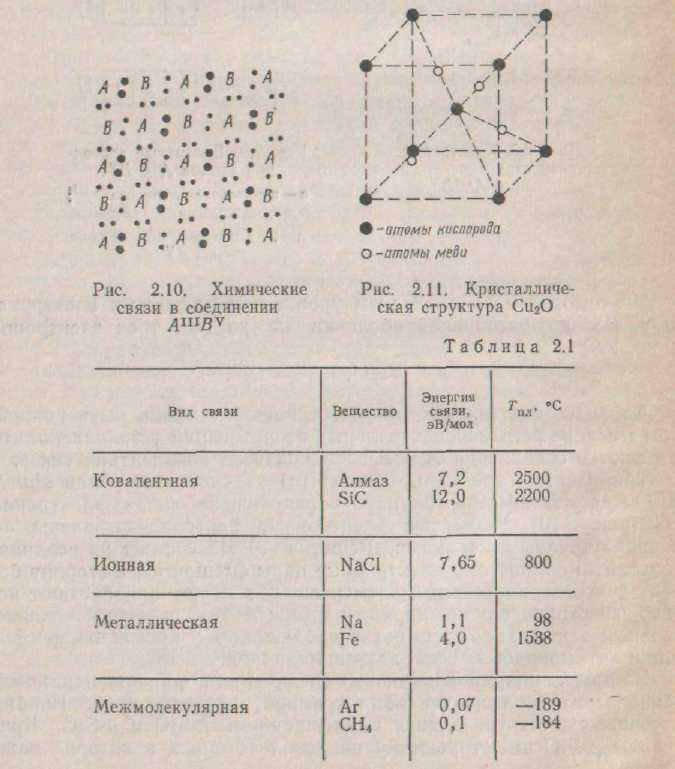
Диоксид міді кристалізується в кубічних ґратах. В елементарному осередку міститься чотири атоми міді і два атоми кисню. Атоми кисню знаходяться в центрі і вершинах осередку, атоми міді розташовані по тетраедрі в центрах октантів. Атом кисню оточений чотирма атомами міді, атоми міді - двома атомами кисню (мал. 2.11). У кисню шість валентних електронів, у міді один. На кожну групу Сuао приходиться вісім валентних електронів, що необхідно для утворення ковалентних зв'язків. У цьому випадку ковалентний зв'язок -з деяк часткою іонної, тому що електронні пари зміщені убік кисню.
36
У залежності від типу зв'язку і будівлі кристала сили взаємодії між його атомами можуть бути різні. Міцність зв'язків характеризується тією енергією, яку потрібно затратити шля роз'єднання кристала на складові атоми. Цю енергію називають енергією зв'язку.
Значення енергії зв'язку для різних видів хімічного зв'язку приведені в табл. 2.1.
З приведених даних випливає, що найбільшою енергією зв'язку володіють ковалентні й іонні кристали. Енергія зв'язку визначає основні фізичні властивості кристалів: температуру плавлення, механічну міцність, твердість і т.д..
