Научные основы биотестирования с использованием инфузорий 03. 00. 23 биотехнология
| Вид материала | Автореферат |
СодержаниеТест-реакция и тест-критерий Colpoda steinii Colpoda steinii Paramecium caudatum Paramecium caudatum Воздействия на тест-систему Colpoda steinii Colpoda steinii Colpoda steinii Paramecium caudatum |
- Научно-образовательный комплекс специальности 050701 «Биотехнология» опорные конспекты, 386.71kb.
- Научно-образовательный комплекс по специальности 6N0701 «Биотехнология» учебно-методический, 704kb.
- Общая биология и микробиология, 206.6kb.
- Научно-образовательный комплекс по специальности 050701 «Биотехнология» учебно-методический, 837.91kb.
- Комплекс дисциплины «Молекулярная генетика» образовательных профессиональных программ, 309.22kb.
- Научные основы технологий хлеба с использованием ржаной муки на заквасках с улучшенными, 1053.55kb.
- Рабочая программа по дисциплине «Основы научных и инженерных исследований» Направление, 83.71kb.
- Примерная программа наименование дисциплины «Вирусология и биотехнология» Рекомендуется, 844.41kb.
- Директор Инженерной Академии Док вет наук, проф. Е. Б. Никитин 2009 г. Автор: преподаватель, 952.2kb.
- Рабочая программа по дисциплине сд. 03 «Основы электрохимической технологии» подготовка, 399.82kb.
Тест-реакция и тест-критерий
В зависимости от природы и интенсивности возмущающего воздействия реакции тест-системы могут проявиться на различных уровнях ее функционирования. Например, катионы кадмия в концентрации порядка 10-3% вызывают гибель клеток инфузорий. В концентрации на порядок ниже этот агент уже не приводит клетки к гибели, но вызывает хемотаксическую реакцию. По данным многочисленных исследователей, наблюдение более тонких реакций, таких как угнетение роста, ингибирование ферментных систем, изменение частоты конъюгации и других, позволяет регистрировать еще меньшие концентрации токсичных веществ.
Кроме чувствительности, ответные реакции тест-систем характеризуются различной скоростью проявления и легкостью наблюдения. Существенное значение имеет и проблема адекватности тест-реакции моделируемому процессу воздействия внешнего фактора на биологические объекты, тесно связанная с уровнем организации тест-системы и интегральностью тест-реакции.
Таким образом, одним из важных вопросов биотестирования является выбор одной из ответных реакций тест-системы в качестве тест-реакции. Он может быть решен лишь с учетом специфических особенностей задач, стоящих перед исследователем в каждом отдельном случае. Но можно сформулировать общие требования, которым должна отвечать тест-реакция. По нашему мнению, они таковы: достаточная чувствительность к изучаемому фактору; высокая экспрессность; соответствие уровня организации тест-системы уровню моделируемого процесса; интегральность; нетребовательность к специальному оборудованию; нетребовательность к квалификации персонала.
Выбор тест-критерия ряд авторов также предлагают осуществлять согласно определенным требованиям. По нашему мнению, наиболее целесообразно использовать следующие: эффективность; универсальность; количественность и возможность выражения одним числом; наличие биологического смысла; простота и легкость интерпретации и вычисления; сопоставимость при получении в разные сроки наблюдения.
В наших исследованиях мы изучали две тест-реакции. Первая из них, тест-реакция гибели, была подробно исследована на модели инфузории Colpoda steinii. В качестве тест-критерия для оценки степени проявления этой тест-реакции можно регистрировать либо количество погибших особей за определенный промежуток времени, либо время, за которое погибает определенная часть задействованных в опыте животных. Поскольку при работе с инфузориями Colpoda steinii используют весьма значительное количество клеток, а также вследствие высокой степени синхронизированности культуры этой инфузории на постцистной стадии жизненного цикла, мы применяли второй из этих тест-критериев.
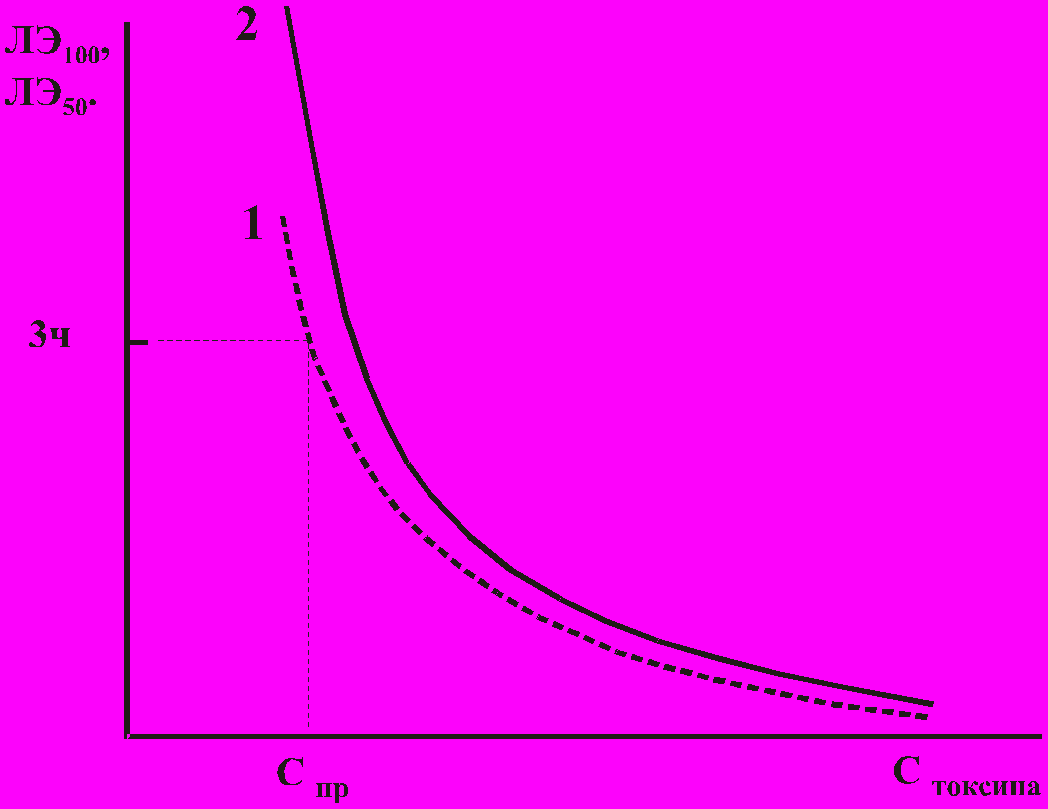
1 - кривая для ЛЭ50; 2 - кривая для ЛЭ100
Рисунок 2 – Обобщенные кривые "концентрация - время"
Была исследована реакция инфузорий на мертиолат, бутанол, глутаровый альдегид, фенол, о-толуидин, фенилгидразин сульфат, 2,4-Д, гексахлоран, хлорофос, метафос, этафос, а также на неорганические соли, содержащие катионы Cd2+, Cu2+, Hg2+, Pb2+ и Zn2+. Во всех изученных случаях зависимость времени гибели клеток инфузории от концентрации вызывающего эту гибель токсичного вещества ("концентрация - время") имела характерный вид. Обобщенные кривые, описывающие этот процесс, показаны на рис. 2. Уравнение регрессии для этих кривых представляет собою степенную функцию:
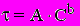
где: - время гибели некоторой доли организмов в популяции, C - концентрация токсичного вещества в растворе, A - нормирующий коэффициент, зависящий от регистрируемой доли гибнущих организмов, b - коэффициент в показателе степени, биологический смысл которого указан ниже.
Так как тест-система в общем случае представляет собой неоднородную совокупность клеток, их гибель происходит не одномоментно, а с некоторым временным разбросом. Поэтому графическое описание процесса взаимодействия токсичного вещества с популяцией живых организмов в координатах "концентрация - время" представляет собой семейство изоэффективных кривых, описываемых приведенной выше формулой, которые отличаются между собой только коэффициентом A. Вид полученных кривых "концентрация - время" для Colpoda steinii соответствует описанному в литературе для ракообразных Daphnia magna, что позволяет говорить об универсальности данной зависимости для живих систем. Использование изоэффективных уровней воздействия предполагает использование такой величины, как летальная экспозиция для 50% и 100% клеток (LE50 и LE100) вместо летальной концентрации (летальной дозы) этого вещества, вызывающей гибель 50% или 100% тест-объектов в течение фиксированного промежутка времени. Анализ зависимости "концентрация - время" позволяет получить единую систему параметров, характеризующих тест-систему, процесс ее взаимодействия с токсичным веществом и само исследуемое токсичное вещество. Использование этих кривых дает в руки токсикологов важный инструмент для сравнения различных тест-систем по их чувствительности и однородности. Величина временного разброса гибели клеток (а следовательно, и разница между нормирующими коэффициентами A1 и A2 и графиками на рис. 2) будет тем меньше, чем клетки ближе друг к другу генетически и по физиологическому состоянию, то есть, чем однороднее тест-система. Поэтому генетическая и физиологическая однородность тест-системы, как было сказано ранее, может быть охарактеризована при помощи индекса синхронизированности - отношения нормирующих коэффициентов A2 и A1:
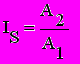
Токсичное вещество характеризуется уже двумя параметрами: пределом обнаружения, который показывает, в какой концентрации вещество вызывает гибель 50% клеток инфузорий в течение 3 часов:
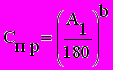
и коэффициентом b, который определяет вероятность возникновения неблагоприятного эффекта при повышении концентрации токсичного вещества, иными словами, токсикологическую широту действия вещества.
Необходимо отметить, что уравнение "концентрация - время" удачно описывает экспериментальные данные в области больших и средних концентраций токсичных веществ. В области же малых концентраций могут наблюдаться отклонения экспериментальных данных от теоретической кривой. Мы склонны объяснять этот факт проявлением различных адаптационных механизмов клеток инфузорий, частично компенсирующих воздействие повреждающего фактора. Кроме того, при большом времени экспозиции (несколько часов и более) может возникать эффект десинхронизации культуры. Вследствие этого кривые, которые должны ассимптотически приближаться к оси ординат, на самом деле не пересекают некоторую вертикальную линию, за которой концентрация токсичного вещества настолько мала, что не вызывает гибели клеток.
Сравнение чувствительности к токсичным веществам тест-реакции гибели Colpoda steinii и высших животных показывает, что инфузории реагируют на концентрации на один-два порядка ниже, чем теплокровные. Об этом наглядно свидетельствуют материалы таблицы 1. В последней графе указана концентрация токсичного вещества в экстракте исследуемого корма при соотношении экстрагента и навески пробы корма 5 : 1, полноте экстракции 100% и содержании токсина в пробе в количестве, приводящем к гибели 50% подопытных теплокровных животных, считая условно, что животное съедает в сутки количество корма, эквивалентное 10% своего веса.
Из материалов таблицы видно, что чувствительность данного тест-объекта к изученным токсичным веществам выше, чем у теплокровных животных. Таким образом, тест-реакция гибели инфузории Colpoda steinii может быть использована для анализа объектов внешней среды в области острой токсичности.
Таблица 1 – Оценка чувствительности тест-реакции гибели инфузории Colpoda steinii к токсичным веществам в сравнении с теплокровными животными
| Вещество | Предел обнаружения, % | ЛД50, мг/кг веса тела | Содержание в экстракте, % |
| Cu2+ | 1,56.10-3 | 248,5 | 49,7.10-3 |
| Cd2+ | 1,39.10-3 | 53,9 | 10,77.10-3 |
| Hg2+ | 1,52.10-4 | 12,9 | 25,86.10-4 |
| Мертиолат | 4,93.10-4 | 75,0 | 150,0.10-4 |
| 2,4-Д | 8,96.10-3 | 100,0 | 20,0.10-3 |
| Этафос | 1,81.10-3 | 250,0 | 50,0.10-3 |
Вторая тест-реакция, которую мы использовали в экспериментах, это тест-реакция хемотаксиса. В качестве тест-критерия нами было выбрано отношение показания прибора "Биотестер" в опыте к его показанию в контроле, выраженное в процентах. Данный тест-критерий характеризует относительное количество клеток инфузорий, перешедших в верхнюю фазу оптической кюветы, содержащую анализируемый образец, по сравнению с контролем.
Показано, что количество клеток инфузорий, перешедших в верхнюю фазу кюветы, содержащую токсичное вещество, за определенный промежуток времени находится в зависимости от концентрации этого вещества (зависимость "концентрация - эффект"). В области, в которой тест-критерий находится в пределах 10-70%, данная зависимость может быть описана уравнением прямой линии. За пределами этой области наблюдаются отклонения экспериментальных данных от линии регрессии. В качестве характеристики токсичности вещества мы выбрали концентрацию этого вещества, при которой величина тест-критерия составляет 50%.
Сопоставление чувствительности тест-реакции хемотаксиса инфузории Paramecium caudatum со стандартными характеристиками токсичных веществ (таблица 2) показывает, что данная тест-реакция может быть использована для оценки объектов окружающей среды при работе с концентрациями некоторых токсичных веществ, приближающихся к области предельно допустимых концентраций.
Таблица 2 – Оценка чувствительности тест-реакции хемотаксиса инфузории Paramecium caudatum к токсичным веществам в сравнении с гигиеническими параметрами
| Токсичное вещество | Cd2+ | Cu2+ | Zn2+ | Фенол |
| ПДК, % | 6,0.10-7 | 2,6.10-6 | 4,8.10-5 | 1,0.10-7 |
| C50, % | 8,0.10-5 | 6,6.10-5 | 8,3.10-5 | 7,1.10-3 |
В процессе экспериментов обе тест-реакции показали постоянные уровни чувствительности к изученным токсичным веществам, высокую экспрессность, информативность и удобство в использовании, что дает основания к рекомендации их для практического применения.
Воздействия на тест-систему
В общем случае ответные реакции формируются в тест-системе, как результат целого комплекса внешних воздействий. Основным из них, интересующим исследователя в первую очередь, является фактор исследуемого образца. Как правило, практические работники имеют дело с комплексным загрязнением исследуемых объектов окружающей среды. И ценность биотестирования во многом обусловлена возможностью проводить оценку интегральной токсичности объекта исследования. Однако проблема действия смесей токсичных веществ на живые организмы и, в частности, на инфузорий все еще остается недостаточно изученной. Поэтому важной частью нашей работы явилось исследование комбинированного воздействия различных токсичных веществ на используемые тест-системы. Были изучены бинарные смеси веществ с единым предполагаемым механизмом действия (катионы кадмия - катионы цинка, катионы кадмия - катионы меди) и смеси соединений, относящихся к различным группам токсичных веществ (катионы кадмия в сочетании с 2,4-Д, метафосом, фенолом, а также глутаровым альдегидом). В каждой серии опытов одно из двух веществ пребывало в постоянной концентрации и служило фоном, а концентрацию второго вещества мы меняли в некоторых пределах. Кривые “концентрация - время”, построенные по материалам исследований, позволили провести оценку характера комбинированного воздействия изученных бинарных смесей.
При этом удалось выявить два различных характера взаимовлияния токсичных веществ при их взаимодействии с тест-системой. Аддитивный тип взаимовлияния веществ наиболее ярко может быть продемонстрирован на примере раствора, содержащего катионы цинка и кадмия (рис. 3), а также катионы меди и кадмия. Токсический эффект, вызываемый смесью, складывается из токсических эффектов, вызываемых каждым компонентом такой смеси при их изолированном воздействии.
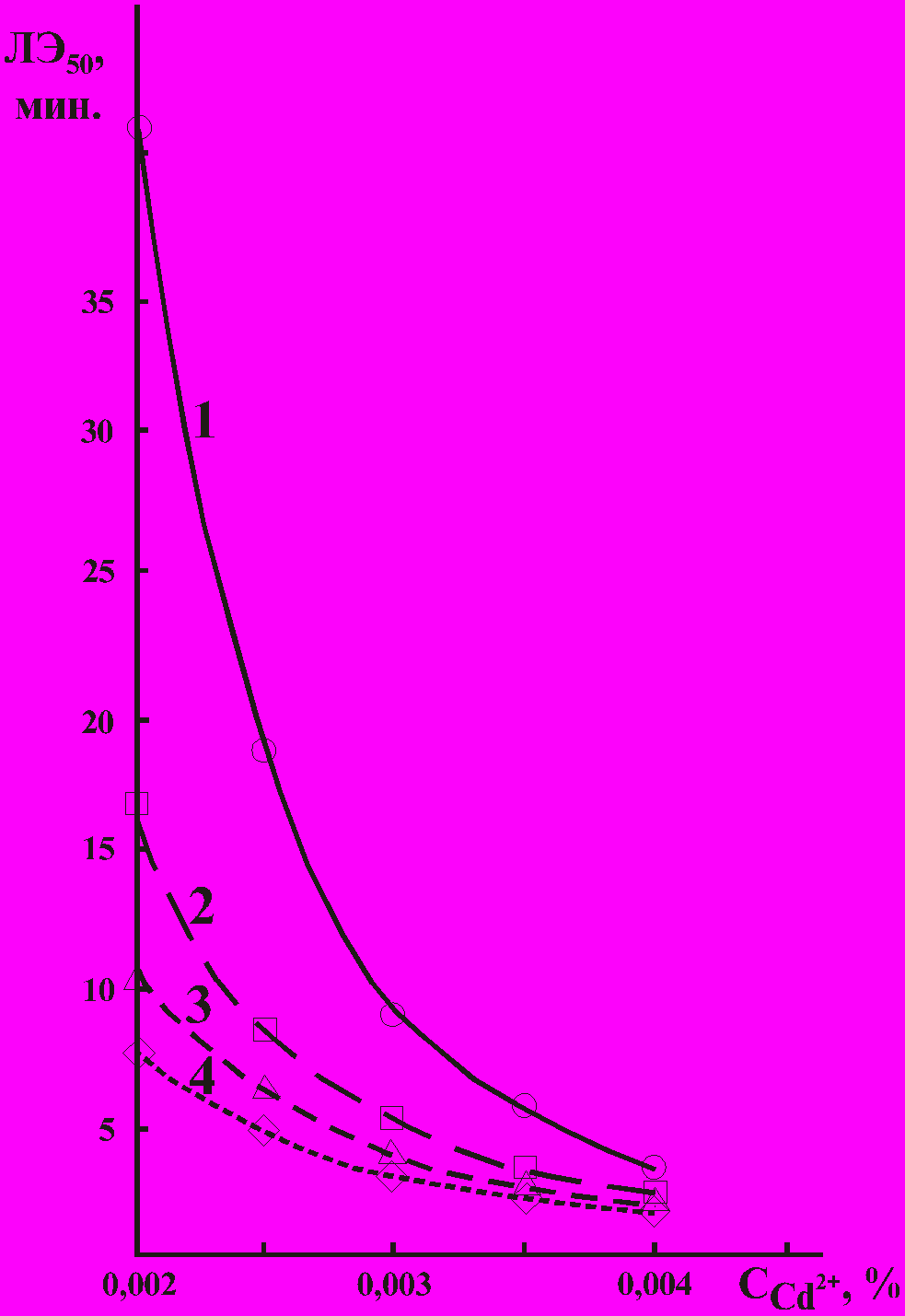
Фоновая концентрация катионов цинка: 1 - 0%; 2 - 0,8.10-3%; 3 - 1,25.10-3%;
4 - 1,7.10-3%.
Рисунок 3 – Комбинированное влияние катионов кадмия и цинка
на клетки Colpoda steinii
Происходит это, вероятно, по причине того, что механизм действия этих веществ на тест-систему един. При изменении концентрации фонового компонента кривая “концентрация - время” смещается вдоль оси абсцисс на величину, пропорциональную данному изменению (рисунок 4). При низких концентрациях фонового компонента данный процесс может быть описан формулой:
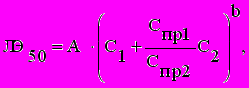
где: А - нормирующий коэффициент, b - коэффициент, определяющий токсикологическую широту действия основного компонента смеси, С1 - молярная концентрация основного компонента смеси, С2 - молярная концентрация фонового компонента смеси, Спр1 - предел обнаружения основного компонента смеси [моль/л], Спр2 - предел обнаружения фонового компонента смеси [моль/л].
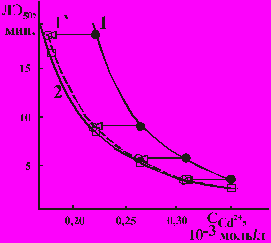
1 - кривая “концентрация - время” при отсутствии Zn2+;
2 – кривая “концентрация - время” при фоновой концентрации Zn2+ 0,8.10-3%;
1` - отображение профиля кривой 1, иллюстрирующее аддитивный характер
взаимодействия катионов двух металлов
Рисунок 4 – Характер комбинированного воздействия катионов Cd2+ и Zn2+
При повышении концентрации фонового компонента до величин, близких к пределу обнаружения, эффект действия смеси был несколько ниже суммы эффектов влияния компонентов при их изолированном применении, что говорит об отклонении характера действия смеси катионов тяжелых металлов от аддитивности в сторону антагонизма. При этом изменялась токсикологическая широта действия смеси, что сопровождалось изменением абсолютного значения коэффициента “b” в показателе степени уравнения. По нашему мнению, это обусловлено повышением вклада фонового компонента в суммарный эффект действия смеси, а также конкуренцией катионов тяжелых металлов, возникающей в процессе их взаимодействия с молекулами-мишенями.
Характер взаимовлияния токсичных компонентов близкий к аддитивному был выявлен также при исследовании смесей метафоса с катионами кадмия, а также фенола с катионами кадмия. Токсикологическая широта действия смеси метафоса и катионов кадмия при введении метафоса, как фонового компонента, расширялась. О смеси фенола и катионов кадмия подобного заключения сделать не удалось ввиду того, что кривые “концентрация - эффект” при комбинированном действии этих двух веществ не соответствуют виду степенной функции.
Антагонистический тип взаимовлияния токсичных компонентов смеси был выявлен при исследовании смесей 2,4-Д с катионами кадмия, а также глутарового альдегида с катионами кадмия. Хотя результат действия смесей этих веществ и превышал эффекты от их изолированного влияния, он был меньше суммы этих эффектов. При этом токсикологическая широта действия смеси при изменении соотношения ее компонентов либо не изменялась, как в случае с 2,4-Д и катионами кадмия, либо уменьшалась (смесь глутарового альдегида и катионов кадмия).
Помимо токсичных соединений, присутствующих в исследуемом образце изначально, в процессе постановки биологического теста могут участвовать и иные вещества, так как хотя одни объекты окружающей среды, такие как природные и сточные воды, удается исследовать непосредственно, другие предварительно приходится переводить в действующую форму, которая может представлять собой экстракт, эмульсию либо суспензию. В связи с использованием в этих целях органических растворителей и ПАВ встает вопрос об их воздействии на тест-систему. Нами была изучена чувствительность инфузорий к органическим растворителям - этанолу, ацетону, ДМСО и поверхностно-активным веществам - твину-80, тритону Х-305, додецилсульфату натрия, неонолу П-6 и неонолу П-9-12. Полученные данные позволяют говорить о том, что для суспензирования не растворимых в воде токсичных веществ целесообразно применять этанол, ДМСО, ацетон, тритон X-305 и твин-80, так как эти вещества не обладают высокой токсичностью по отношению к инфузориям. Токсическое действие ДСН и поверхностно-активных веществ группы неонолов, напротив, ярко выражено. Но при использовании указанных растворителей и ПАВ для подготовки действующих форм необходимо учитывать их влияние на чувствительность тест-систем к токсичным веществам.
Таблица 3 – Комбинированное действие органических растворителей и токсичных веществ ( Colpoda steinii, тест-реакция гибели)
| Растворитель | Токсичное вещество | ||||
| Наимен. | Конц-ия, % | Cd2+ Спр, %; b | Cu2+ Спр, %; b | Zn2+ Спр, %; b | фенол Спр, %; b |
| - | - | 1,39.10-3; -3,24 | 1,56.10-3; -2,79 | 2,05.10-3; -1,79 | 38,5.10-3; -1,90 |
| ДМСО | 2,5.10-3 | 0,65.10-3; -2,26 | 1,28.10-3; -2,49 | 1,09.10-3; -1,64 | 30,3.10-3; -1,89 |
| | 50.10-3 | 0,49.10-3; -2,15 | 1,19.10-3; -2,47 | 0,95.10-3; -1,59 | 28,0.10-3; -1,88 |
| ацетон | 0,5 | 0,45.10-3; -1,85 | 1,07.10-3; -2,37 | 0,65.10-3; -1,53 | 36,7.10-3; -1,90 |
| | 2,5 | 0,32.10-3; -1,67 | 1,05.10-3; -2,36 | 0,48.10-3; -1,45 | 35,1.10-3; -1,90 |
| | 0,96 | - | 1,34.10-3; -2,79 | - | - |
| этанол | 1,90 | 0,58.10-3; -1,78 | - | 0,93.10-3; -1,61 | 26,9.10-3; -1,92 |
| | 3,20 | 0,51.10-3; -1,73 | - | - | 24,2.10-3; -1,91 |
Нами изучены комбинации растворов, содержащих фенол и катионы тяжелых металлов (кадмия, меди и цинка) в сочетании с ДМСО, ацетоном, этанолом, твином-80, ДСН и тритоном Х-305, использованными в качестве фонового компонента в концентрациях, которые при изолированном действии не вызывали заметного эффекта. Для каждой пары веществ были построены серии кривых “концентрация - время”, по этим кривым была проведена оценка характера комбинированного воздействия веществ. Во всех изученных сочетаниях токсичных веществ с органическими растворителями наблюдался эффект потенцирования, то есть эффект действия смеси значительно превышал сумму эффектов ее компонентов при их изолированном воздействии. При этом предел обнаружения токсичного вещества снижался в 1,5 - 4 раза. Токсикологическая широта действия при добавлении органического растворителя повышалась лишь у катионов тяжелых металлов, а у фенола статистически достоверных изменений не претерпевала (таблица 3).
Таблица 4 – Комбинированное действие ПАВ и токсичных веществ ( Colpoda steinii, тест-реакция гибели)
| ПАВ | Токсичное вещество | |||
| Наимен. | Конц-ия, % | Cd2+ Спр, %; b | Zn2+ Спр, %; b | фенол Спр, %; b |
| - | - | 1,39.10-3; -3,24 | 2,05.10-3; -1,79 | 38,5.10-3; -1,90 |
| Твин-80 | 2.10-3 | 0,45.10-3; -1,57 | 0,57.10-3; -1,43 | 18,3.10-3; -1,91 |
| | 20.10-3 | 0,28.10-3; -1,54 | - | - |
| | 0,2.10-3 | 1,06.10-3; -3,23 | - | - |
| ДСН | 2.10-3 | 0,56.10-3; -3,19 | 0,55.10-3; -1,45 | 25,8.10-3; -1,88 |
| | 20.10-3 | - | - | 18,0.10-3; -1,89 |
| Тритон X-305 | 2.10-3 | 1,11.10-3; -3,23 | 0,59.10-3; -1,45 | 19,7.10-3; -1,65 |
| | 20.10-3 | 0,99.10-3; -3,24 | 0,41.10-3; -1,41 | 17,7.10-3; -1,63 |
Влияние поверхностно-активных веществ было во многом подобно действию органических растворителей. Во всех изученных смесях наблюдали эффект потенцирования. При этом предел обраружения изученных токсичных веществ снижался в 2-5 раз. Однако токсикологическая широта действия изменялась не во всех случаях. Так, тритон X-305 и додецилсульфат натрия не снижали коэффициент “b” для катионов кадмия, а твин-80 и додецилсульфат натрия не снижали этот коэффициент для фенола (таблица 4).
Влияние органических растворителей и поверхностно-активных веществ на чувствительность хемотаксической реакции инфузорий к изученным токсичным веществам также оказалось ярко выраженным.
Таблица 5 – Комбинированное действие органических растворителей, ПАВ и токсичных веществ ( Paramecium caudatum, тест-реакция хемотаксиса)
| Растворитель | Токсичное вещество | ||||
| Наимен. | Конц-ия, % | Cd2+ C50, % | Cu2+ C50, % | Zn2+ C50, % | фенол C50, % |
| - | - | 8,0.10-5 | 6,6.10-5 | 8,3.10-5 | 7,1.10-3 |
| Твин-80 | 0,1 | - | - | - | 1,8.10-3 |
| | 1,0 | 1,8.10-5 | 2,8.10-5 | 6,8.10-5 | - |
| ДСН | 0,001 | 5,5.10-5 | 5,5.10-5 | 5,8.10-5 | 6,2.10-3 |
| | 0,002 | 2,2.10-5 | 1,0.10-5 | 3,8.10-5 | 2,7.10-3 |
| ДМСО | 0,01 | 3,4.10-5 | 6,1.10-5 | 5,1.10-5 | 6,9.10-3 |
| | 0,1 | - | 4,3.10-5 | 3,0.10-5 | 4,3.10-3 |
Так, в присутствии твина-80, додецилсульфата натрия или ДМСО концентрация изученных токсичных веществ, которая создавала уровень относительной токсичности равный 50% (C50), снижалась в 2-6 раз (таблица 5), при этом чувствительность тест-реакции возрастала настолько, что вплотную приближалась к показателям ПДК катионов цинка и меди.
Исходя из вышеизложенного можно заключить, что токсичность при комбинированном воздействии нескольких различных веществ в общем случае не является аддитивной величиной. Некоторые токсичные вещества способны снижать эффект воздействия в сочетании с другими веществами, а иные, не являясь сами по себе токсичными, могут увеличивать токсический эффект действия токсикантов. По этой причине мы полагаем, что термин "суммарная токсичность", часто используемый в литературе, не адекватно отражает описываемое явление. Более правильно применять термин "интегральная токсичность". Кроме того, результаты экспериментов говорят о том, что только методы биотестирования могут дать адекватное представление о воздействии смесей различных химических веществ на живые системы.
Изучение влияния органических растворителей и ПАВ на чувствительность тест-систем к токсичным веществам имеет и другой важный аспект. Практическое использование биологических тестов часто ставит перед исследователями задачу целенаправленного искусственного изменения порога реагирования тест-системы на внешние воздействия. Для этого могут быть использованы так называемые физиологические (функциональные) нагрузки. Их роль заключается в искусственном изменении состояния тест-системы путем того или иного стрессового воздействия. Механизмы подобных воздействий на живую клетку могут быть достаточно разнообразными. В одних случаях клетка вынуждена компенсировать влияние нагрузки путем перестройки метаболизма и расходовать на это часть своих внутренних ресурсов. При этом снижаются возможности клетки для противодействия влиянию исследуемого токсичного вещества и, соответственно, увеличивается чувствительность к нему. Другие факторы, изменяя транспортные возможности поверхностных структур клетки, облегчают проникновение токсичных веществ в цитоплазму, тем самым усиливая их влияние на клетку. В числе последних факторов особый интерес вызывают органические растворители и ПАВ.
В качестве характеристики влияния вещества, выбранного в качестве функциональной нагрузки, мы использовали коэффициенты потенцирования, которые представляют собой отношения пределов обнаружения токсичного вещества при изолированном действии и в присутствии фонового компонента:
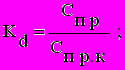
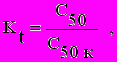
где: Kd и Kt - коэффициенты потенцирования для тест-реакций гибели и хемотаксиса соответственно, Cпр и Cпр.к - пределы обнаружения вещества по тест-реакции гибели при изолированном действии и в присутствии фонового компонента, C50 и C50к - пределы обнаружения вещества по тест-реакции хемотаксиса при изолированном действии и в присутствии фонового компонента.
Таблица 6 – Коэффициенты потенцирования при комбинированном действии ПАВ и органических растворителей с токсичными веществами на тест-системы
| ПАВ или | Конц-ия, | Токсичное вещество | |||
| растворитель | % | Cd2+ | Cu2+ | Zn2+ | фенол |
| | | Kd (вне скобок) и Kt (в скобках) | |||
| | 2,5.10-3 | 2,1 | 1,2 | 1,9 | 1,3 |
| ДМСО | 10.10-3 | (2,4) | (1,1) | (1,6) | (1,0) |
| | 50.10-3 | 2,8 | 1,3 | 2,2 | 1,4 |
| | 100.10-3 | - | (1,5) | (2,8) | (1,7) |
| Ацетон | 0,5 | 3,1 | 1,5 | 3,2 | 1,1 |
| | 2,5 | 4,3 | 1,5 | 4,3 | 1,1 |
| | 0,96 | - | 1,2 | - | - |
| Этанол | 1,90 | 2,4 | - | 2,2 | 1,4 |
| | 3,20 | 2,7 | - | - | 1,6 |
| | 2.10-3 | 3,1 | - | 3,6 | 2,1 |
| Твин-80 | 20.10-3 | 5,0 | - | - | - |
| | 100.10-3 | - | - | - | (3,9) |
| | 1,0 | (4,4) | (2,4) | (1,2) | - |
| | 0,2.10-3 | 1,3 | - | - | - |
| ДСН | 1.10-3 | (1,5) | (1,2) | (1,4) | (1,2) |
| | 2.10-3 | 2,5 (3,6) | (6,6) | 3,7 (2,2) | 1,5 (2,6) |
| | 20.10-3 | - | - | - | 2,1 |
| Тритон X-305 | 2.10-3 | 1,3 | - | 3,5 | 2,0 |
| | 20.10-3 | 1,4 | - | 5,0 | 2,2 |
Из представленных в таблице 6 данных можно заключить, что тест-система поддается внешнему целенаправленному регулированию. Порог ее чувствительности ко внешним воздействиям может быть искусственно изменен путем применения функциональной нагрузки. Для повышения чувствительности тест-реакции гибели клеток наиболее целесообразно использовать диметилсульфоксид в концентрации 50.10-3%, а из поверхностно-активных веществ - твин-80 в концентрациях от 2.10-3% до 20.10-3%. Для повышения чувствительности тест-реакции хемотаксиса более эффективным оказался додецилсульфат натрия в концентрации от 1.10-3% до 2.10-3%.
Третью группу внешних воздействий на тест-систему составляют "шумовые" факторы. Как правило, их воздействие обусловлено теми манипуляциями, которые производят с тест-системой в процессе осуществления ее контакта с исследуемым образцом. К ним относятся колебания температуры, изменения кислотности среды, осмотические воздействия и так называемый "ударный" эффект. Воздействие этих факторов на тест-систему обычно не приводит к значительному искажению результатов, однако определенный вклад в погрешность при определении тест-критерия они вносят. Поэтому, хотя эти факторы не всегда удается учитывать и устранять в процессе постановки биологического теста, следует принимать меры для их минимизации.
Разработка теоретической концепции биотестирования как метода научного исследования дала нам возможность перейти к ее практическому воплощению.
