Исследование генетического разнообразия и процессов видообразования эндемичного семейства рыб озера байкал голомянок (comephoridae) 03. 00. 15 Генетика
| Вид материала | Исследование |
- Межлабораторные семинары отдела экологии и микробиологии иоэб со ран время, 11.06kb.
- Нко «За Байкал!» по проекту фцп «Охрана озера Байкал и социально-экономическое развитие, 61.53kb.
- Большая Байкальская Тропа иФонда Форда (сша) объявляет ежегодный конкурс, 48.96kb.
- Конспект интегрированного урока «Байкал жемчужина Сибири», 194.24kb.
- Генетика, селекция, гибридизация рыб. Тезисы докладов, 21.08kb.
- План I. Введение II. Байкал жемчужина России Байкал зарождающийся океан, 263.71kb.
- Особенности распределения и молекулярная детекция бактерий рода caulobacter озера байкал, 232.61kb.
- Автореферат диссертации на соискание ученой степени кандидата, 1242.08kb.
- Исследование окислительно-антиокислительных процессов в крови антарктических рыб, 153kb.
- Геоэкологические основы организации рекреационного природопользования на восточном, 373.58kb.
На правах рукописи
ТЕТЕРИНА ВЕРОНИКА ИГОРЕВНА
ИССЛЕДОВАНИЕ ГЕНЕТИЧЕСКОГО РАЗНООБРАЗИЯ И ПРОЦЕССОВ ВИДООБРАЗОВАНИЯ ЭНДЕМИЧНОГО СЕМЕЙСТВА РЫБ ОЗЕРА БАЙКАЛ – ГОЛОМЯНОК (COMEPHORIDAE)
03.00.15 - ГЕНЕТИКА
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск
2008
Работа выполнена в лаборатории биологии рыб и водных млекопитающих
Лимнологического института СО РАН, г. Иркутск
Научный руководитель: кандидат биологических наук
Кирильчик Сергей Васильевич
Лимнологический институт
СО РАН, г. Иркутск
Официальные оппоненты: доктор биологических наук
Щербаков Дмитрий Юрьевич
доктор биологических наук
Бородин Павел Михайлович
Ведущее учреждение: Сибирский институт физиологии
и биохимии растений СО РАН,
г. Иркутск
Защита диссертации состоится «__»______________2008 г. на утреннем заседании диссертационного совета по защите диссертаций на соискание ученой степени доктора наук (Д – 003.011.01) в Институте цитологии и генетики СО РАН в конференц-зале института по адресу: 630090, г. Новосибирск, проспект Лаврентьева, 10, тел/факс: (383)-333-12-78, e-mail: dissov@bionet.nsc.ru
С диссертацией можно ознакомиться в библиотеке Института цитологии и генетики СО РАН.
Автореферат разослан «__»_______________2008 г.
Ученый секретарь
диссертационного совета,
доктор биологических наук А.Д.Груздев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Группы близкородственных видов рыб, таких, как рогатковидные Байкала, обитающие в небольших, относительно замкнутых водоемах могут рассматриваться в качестве удобного объекта для изучения процессов симпатрического видообразования и эволюции в целом. Среди них наиболее интересный пример симпатрических видов демонстрируют голомянки.
В открытой пелагиали Байкала обитает два вида рогатковидных рыб - большая ( Comephorus baicalensis Pallas, 1776) и малая (C.dybowski Korotneff, 1905) голомянки. Согласно современной классификации голомянки - единственные представители эндемичного рода Comephorus семейства Comephoridae букета видов рогатковидных рыб оз. Байкал. Привлекательность Comephoridae для изучения процессов видообразования у симпатрических видов связана со следующими их особенностями: 1. Голомянки - это близкородственные виды. Согласно молекулярно-генетическим исследованиям время, прошедшее с момента отделения видов от предковой формы, может исчисляться десятками тысяч лет (Kontula et al., 2003). 2. Ареалы обитания видов в значительной степени перекрываются - представители малой и большой голомянок распространены по всему Байкалу, за исключением прибрежной зоны, и встречаются на всех глубинах озера. 3. По сравнению с другими видами байкальских рогатковидных, голомянки наиболее хорошо изучены.
Однако, несмотря на многочисленность исследований по голомянкам, до сих пор нет единого мнения об их популяционной структуре. Исследования, проведенные с использованием комплекса морфометрических признаков, не дали конкретного ответа на вопрос о подразделенности на популяции данных видов или ее отсутствии (Коряков, 1964; Стариков, 1977; Аношко, 1998). Остаются, также, неясными причины и время появления двух сестринских видов, роль геологической истории водоема в процессах видообразования.
В настоящей работе для исследования внутривидового генетического полиморфизма и процессов видообразования семейства Comephoridae использован анализ полиморфизма микросателлитной ДНК и анализ нуклеотидной последовательности митохондриального гена цитохрома b.
Цели и задачи исследования. Цель настоящей работы состояла в исследовании генетического разнообразия и эволюционной истории семейства голомянок (Comephoridae) с помощью молекулярно-генетических методов.
В конкретные задачи работы входило:
1. Провести исследования внутривидового генетического полиморфизма двух видов семейства голомянок на основе полиморфизма длин микросателлитных локусов и на основе анализа нуклеотидных последовательностей митохондриального гена цитохрома b.
2. Оценить степень генетической изоляции между особями собранными из разных котловин Байкала - южной, средней и северной.
3. Сравнить результаты анализа внутривидового генетического полиморфизма и межвидовой дивергенции полученные с помощью маркеров микросателлитной и митохондриальной ДНК.
4. Провести оценку времени дивергенции видов и реконструировать эволюционную историю семейства голомянок.
Научная новизна. Впервые для популяционно-генетического исследования байкальских организмов применен анализ полиморфизма микросателлитных локусов. Показано, что эти генетические маркеры, разработанные для внебайкальских рогатковидных рыб, могут быть использованы для байкальских видов. Впервые на основе молекулярно-генетических данных определена популяционная структура двух видов семейства голомянок. Исследованы филогенетические взаимоотношения этих видов между собой. С помощью анализа митоходриального гена цитохрома b выявлено наличие двух генетических групп у большой голомянки. Показано происхождение малой голомянки от предковой формы большой голомянки. Сделаны предположения о возможных факторах, имевших место в геологическом прошлом Байкальского региона, которые могли способствовать разделению предковой популяции на генетические группы и виды.
Положения, выносимые на защиту.
- Малая голомянка представлена в Байкале единой генетически не подразделенной популяцией.
- Большая голомянка генетически не подразделена в пределах озера Байкал по ядерным маркерам, однако имеет две генетические группы, различающиеся по митохондриальной ДНК.
- Образование двух видов голомянок и генетических групп большой голомянки связано с резкими изменениями климата в ледниковую стадию MIS4 45-75 тыс. лет назад.
Научно-практическое значение. Результаты исследований генетического разнообразия и эволюции голомянок могут помочь в понимании особенностей протекания эволюционных процессов в пелагиали озера Байкал, а также процессов микроэволюции в целом. За время работы были определены и депонированы в международную базу данных GenBank 34 нуклеотидных последовательности митохондриального гена цитохрома b малой (номера доступа EU693082 - EU693115) и 37 нуклеотидных последовательностей большой (номера доступа EU699772 - EU699808) голомянок. Проведенные в данной работе выбор, тестирование и оптимизация семи микросателлитных локусов позволят в дальнейшем использовать их для изучения других видов байкальских Cottoidei.
Апробация работы и публикации. Результаты работы представлялись:
На 3-ем международном совещании: «Видообразование в древних озерах мира» (SIAL) Иркутск, Россия 2002 г.; на региональной научно-практической конференции «Структура и функционирование экосистем Байкальского региона» в г. Улан-Удэ в 2003 г.; на первом Байкальском симпозиуме по эволюционной биологии (BWEB) в Иркутске в 2004 г.; на VIII Всероссийском популяционном семинаре «Популяции в пространстве и времени» в 2005 в Нижнем Новгороде; на Четвертой Верещагинской Байкальской конференции в Иркутске в 2005; на Международной конференции «Проблемы популяционной экологии животных» в г. Томске в 2006 г.
По результатам работы опубликовано 8 печатных работ, в том числе две в рецензируемых журналах.
Структура и объем диссертации. Работа включает следующие разделы: введение, обзор литературы, материалы и методы, результаты, обсуждение, выводы, список литературы (201 источник). Диссертация изложена на 113 страницах, содержит 18 рисунков и 15 таблиц.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор образцов и выделение ДНК. Образцы малой и большой голомянок были собраны в течение 2000 - 2004 годов. Размер выборок каждого вида из каждой котловины Байкала (Южной, Средней и Северной) составил около 30 особей. Экстракцию проводили стандартным методом, описанным Сэмбруком и соавт. (Sambrook et al., 1989) с некоторыми модификациями.
Амплификация ДНК. Микросателлитные локусы амплифицировали методом ПЦР, используя праймеры Cgo56MEHU, Cgo1016PBBE, Cgo1033PBBE, Cgo1114PBBE, Cgo05ZIM, Cgo33ZIM, Cgo42ZIM разработанные для европейского подкаменщика Cottus gobio и описанные в (Englbrecht et al., 1999).
Участок ДНК, содержащий последовательность гена цитохрома b, амплифицирован методом ПЦР с использованием праймеров L15361, L15772, L16192, H16170, H16553 (Kontula et al., 2003), H15786 (Kocher et al., 1989) и L16063 5’ TCTTTCCACCCTTACTTTTCTTACAA 3’ (предложен автором).
Анализ микросателлитных локусов. Разделение меченных изотопом фосфора 32Р фрагментов микросателлитной ДНК по длине проводили в 6% денатурирующем полиакриламидном геле. Картину, полученную в результате электрофореза, визуализировали на рентгеновской пленке. Для визуализации немеченого маркера молекулярного веса и в случаях, когда радиоактивная метка не использовалась, гель окрашивали серебром (Bassam et al, 1991). Для определения размеров микросателлитных фрагментов использовался маркер молекулярного веса с шагом 25 пн фирмы «Promega», а также набор фрагментов для определения нуклеотидной последовательности ДНК фага M13mp18.
Определение нуклеотидных последовательностей митохондриального гена цитохрома b (cytb) проводилось с использованием автоматических секвенаторов ABI 373 и CEQ8800 (Beckman Coulter).
Компьютерная обработка данных микросателлитного анализа. Оценку соответствия характера распределения частот генотипов равновесию Харди-Вайнберга проводили с помощью точного теста, предложенного Гуо и Томсоном (Guo, Thomson, 1992). Присутствие “нулевых” аллелей выявляли с помощью программы Micro-Checker (Van Oosterhout, 2004) c использованием оценок Брукфилда (Brookfield, 1996). Наблюдаемую (Hо) и ожидаемую (Hе) гетерозиготности и частоты аллелей рассчитывали в программе POPGENE ver. 1.32 (Yeh, Boyle, 1997). Значения FST (Weir and Cockerham, 1984) и RST (Rousset, 1996;. Michalakis, Excoffier, 1996), отражающие степень подразделенности видов, подсчитывали с помощью программы ARLEQUIN ver.2.000 (Schneider et al., 2000). Наличие или отсутствие стадии «бутылочного горлышка» определяли по стандартным алгоритмам в программе BOTTLENECK ver. 1.2.02 (Cornuet, Luikart, 1996). В программе Population 1.2.28 (Langella, 2002) методом ближайших соседей (NJ) было построено дерево, основанное на полиморфизме микросателлитных локусов малой и большой голомянок. Для построения данного дерева использовались генетические расстояния DAS, основанные на частоте общих аллелей (Chakraborty, Jin, 1993).
Компьютерная обработка данных анализа мтДНК. Предварительный анализ нуклеотидных последовательностей, расчет индексов разнообразия гаплотипов (Hd) и уровней нуклеотидной изменчивости (π) осуществляли с использованием программы DnaSP 4.10.3 (Rozas, et. al.2003). Ранее проведенные исследования, показали, что нуклеотидная последовательность гена цитохрома b байкальских рогатковидных при попарном сравнении имеет большое количество несинонимичных замен по сравнению с небайкальскими видами при равном количестве синонимичных точечных мутаций. Для того, чтобы выяснить была ли вызвана дивергенция двух видов голомянок действием какого-либо вида естественного отбора, был проведен тест Макдональда-Крейтмана (McDonald, Kreitman 1991), реализованный в программе DnaSP 4.10.3. Построение медианной сети гаплотипов осуществляли в программе NETWORK 4.5 (Bandelt et al., 1999) с использованием алгоритма соединения медиан (“median-joining”). Анализ молекулярной вариации (АМОВА) проводили с помощью программы ARLEQUIN 2.000 (Schneider et al., 2000). Для АМОВА особи были сгруппированы согласно их выборкам по котловинам. Для оценки эффективного размера (Ne) и времени до наиболее недавнего общего предка (t) использовался метод цепей Маркова и Монте Карло симуляций (MCMC), реализованный в программе IM (Hey и Nielsen, 2004). Дополнительно, оценки времени дивергенции были рассчитаны с помощью программы MEGA 4 (Tamura et al., 2007) на основе генетических расстояний с учетом внутрипопуляционного генетического полиморфизма (Net average distances). Для подсчета генетических расстояний использовался метод Памило-Бьянчи-Ли (Pamilo, Bianchi, 1993; Li, 1993). Поскольку ранее было показано, что несинонимичные замены у байкальских рогатковидных могут накапливаться в ускоренном темпе (Кирильчик, Слободянюк, 1997, Kontula et al., 2003) для оценки времени дивергенции использовалиь только синонимичные замены.
Построение филогенетического древа осуществляли баесовским методом с помощью программы MrBayes 3.1.2 (Ronquist, Huelsenbeck, 2003). Тип модели молекулярной эволюции был выбран GTR+I+Γ. В качестве внешней группы использовали нуклеотидные последовательности CytB других видов байкальских рогатковидных рыб, находящиеся в GenBank под номерами AY116341 - AY116354, AY116357 - AY116358 и AY116362 (Kontula et al., 2003).
РЕЗУЛЬТАТЫ
Анализ полиморфизма микросателлитной ДНК голомянок
Для используемых микросателитных локусов подобраны оптимальные условия проведения ПЦР и акриламидного электрофореза и последующей визуализации ДНК. Данное исследование показало, что микросателлитные фрагменты могут быть вполне успешно визуализированы при окраске геля серебром. Вместе с тем, применительно к микросателлитному анализу этот метод имеет как определенные преимущества, так и ряд недостатков и ограничений. Среди преимуществ можно отметить высокую чувствительность, относительную дешевизну и быстроту проявления. Недостатком, по сравнению с использованием радиоактивной метки, является присутствие, в некоторых случаях дополнительных артефактных полос. В результате этого зачастую анализ геля становится практически невозможным (рис. 1).
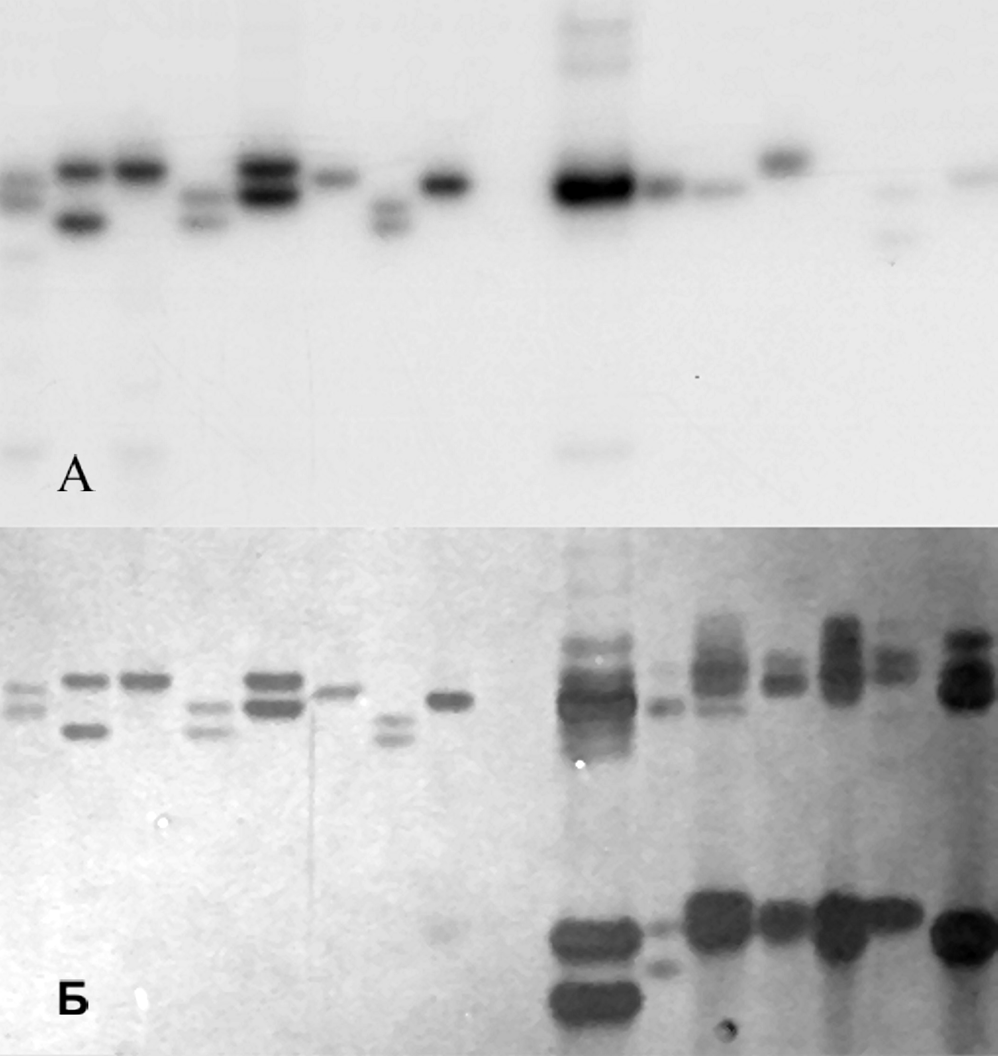
Рисунок 1. Электрофоретическое фракционирование продуктов ПЦР микросателлитных локусов малой голомянки. А – продукт ПЦР визуализирован с помощью радиоактивной метки; Б – тот же гель после окрашивания серебром.
Анализ генетического полиморфизма малой голомянки по микросателлитным локусам. Каждый из семи микросателлитных локусов был протестирован на 82-90 особях малой голомянки. Сравнивались выборки из трех котловин Байкала. Во всех исследованных выборках с использованием χ2-критерия по всем локусам кроме Cgo1016PBBE с высокой достоверностью выявлены отклонения наблюдаемых частот генотипов от теоретически ожидаемых при равновесии Харди-Вайнберга. Причиной этого может быть присутствие неамплифицирующихся «нулевых» аллелей. Наличие «нулевых» аллелей у шести локусов и отсутствие таковых у локуса Cgo1016PBBE показано с помощью программы Micro-Checker.
Всего в выборках малой голомянки по шести локусам выявлен 71 аллель, число аллелей в выборке с южного Байкала составило 65, со среднего и северного по 63. Анализ частот аллелей (программа BOTTLENECK) показал их L-образное распределение и отсутствие стадии «бутылочного горлышка» за последние 4Ne поколений.
В таблице 1 показаны значения критериев генетической подразделенности Fst и Rst, рассчитанные по каждому локусу отдельно и по совокупности локусов между парами выборок. Наибольшие значения получены для локусов Cgo1016PBBE (Fst = 0.111, Южный Байкал – Средний Байкал и Rst = 0.048, Средний Байкал – Северный Байкал), Cgo42ZIM (Rst = 0.053, Средний Байкал – Северный Байкал) и Cgo1114PBBE (Rst = 0.049, Южный Байкал – Средний Байкал). Однако эти данные не могут быть приняты как показатели популяционной подразделенности. Генетические расстояния для этих локусов показывают, согласно классификации Райта (Wright, 1978) слабую или умеренную генетическую дифференциацию между разными парами выборок из смежных котловин озера, а генетические расстояния между выборками из Южного и Северного Байкала остаются незначительными. Кроме этого, величины одного критерия не отражают степень генетической изоляции, выявленную по другому критерию, - соответствующие генетические расстояния невелики. Значения, полученные по другим локусам индивидуально, а также по совокупности локусов, либо положительны, но очень малы и незначительно отличаются от нуля (P > 0.95), либо отрицательны.
Анализ генетического полиморфизма большой голомянки по микросателлитным локусам. По локусу Cgo1033PBBE не удалось получить ПЦР - продукта более чем для половины образцов большой голомянки, поэтому этот локус был исключен из данного анализа. Каждый из шести оставшихся локусов был протестирован на 74-83 особях из трех котловин Байкала.
Таблица 1. Матрица генетических расстояний между выборками малой голомянки (над диагональю – значения Rst, под диагональю – Fst; в скобках указан уровень значимости (Р), полученный на основе 10100.
| Локус | Место сбора | Южный Байкал | Средний Байкал | Северный Байкал |
| Cgo56MEHU | Южный Байкал Средний Байкал Северный Байкал | - -0.006 (0.8252) -0.005 (0.7686) | 0.005 (0.4014) - -0.007 (0.8193) | -0.013 (0.6543) -0.011 (0.6162) - |
| Cgo1016PBBE | Южный Байкал Средний Байкал Северный Байкал | - 0.111 (0.0010) -0.0024 (0.5576) | -0.005 (0.4766) - 0.048 (0.0176) | -0.013 (0.6514) -0.015 (0.7891) - |
| Cgo1033PBBE | Южный Байкал Средний Байкал Северный Байкал | - 0.004 (0.4961) -0.006 (0.8975) | -0.016 (0.8115) - -0.007 (0.9443) | -0.010 (0.6055) -0.015 (0.7520) - |
| Cgo1114PBBE | Южный Байкал Средний Байкал Северный Байкал | - 0.001 (0.4639) 0.007 (0.3496) | 0.049 (0.0840) - 0.018 (0.1816) | -0.012 (0.6104) 0.007 (0.2891) - |
| Cgo05ZIM | Южный Байкал Средний Байкал Северный Байкал | - 0.006 (0.4795) 0.019 (0.1709) | -0.017 (0.9190) - 0.010 (0.2783) | -0.017 (0.8965) -0.015 (0.8369) - |
| Cgo33ZIM | Южный Байкал Средний Байкал Северный Байкал | - 0.000 (0.4863) -0.010 (0.8232) | -0.001 (0.3945) - -0.004 (0.6885) | -0.007 (0.5127) -0.017 (0.8818) - |
| Cgo42ZIM | Южный Байкал Средний Байкал Северный Байкал | - 0.002 (0.4609) 0.002 (0.4453) | -0.015 (0.7803) - 0.003 (0.4170) | 0.019 (0.2285) 0.053 (0.0732) - |
| Среднее | Южный Байкал Средний Байкал Северный Байкал | - 0.016 (0.0166) 0.000 (0.7637) | -0.023 (0.9820) - 0.009 (0.1387) | -0.022 (0.9279) -0.015 (0.8739) - |
Во всех исследованных выборках с использованием χ2-критерия по всем локусам выявлены отклонения наблюдаемых частот генотипов от теоретически ожидаемых при равновесии Харди-Вайнберга. Причиной этого может быть присутствие неамплифицирующихся «нулевых» аллелей, выявленных с помощью программы Micro-Checker. Всего в выборках большой голомянки по шести локусам выявлен 51 аллель, число аллелей в выборке с южного Байкала составило 39, со среднего – 44, с северного – 42. Анализ частот аллелей (программа BOTTLENECK) показал их L-образное распределение и отсутствие стадии «бутылочного горлышка» за последние 4Ne поколений.
В таблице 2 показаны значения критериев Fst и Rst, рассчитанные по каждому локусу отдельно и по совокупности локусов между парами выборок. Показатели, соответствующие согласно классификации Райта умеренной генетической подразделенности (значения Fst и Rst в пределах от 0.05 до 0.15) (Wright, 1978), получены по ряду пар выборок для локусов Cgo05ZIM (Rst = 0.052, Южный Байкал – Средний Байкал), Cgo33ZIM (Rst = 0.078, Средний Байкал – Северный Байкал), Cgo42ZIM (Rst = 0.086, Южный Байкал – Северный Байкал) и Cgo1114PBBE (Fst = 0.064, Rst = 0.083, Южный Байкал – Северный Байкал и Rst = 0.118 Средний Байкал – Северный Байкал). Только по одному локусу Cgo1114PBBE в случае сравнения выборок с Южного и Северного Байкала высокие величины получены не только в случае Rst, но и Fst. По локусам Cgo05ZIM, Cgo33ZIM и Cgo42ZIM значения Fst не отражают степень генетической изоляции, выявленную по Rst-критерию, - соответствующие расстояния Fst невелики.
Таблица 2. Матрица генетических расстояний между выборками большой голомянки (над диагональю – значения Rst, под диагональю – Fst); в скобках указан уровень значимости (P), полученный на основе 10100 пермутаций.
| Локус | Место сбора | Южный Байкал | Средний Байкал | Северный Байкал |
| Cgo56MEHU | Южный Байкал Средний Байкал Северный Байкал | - -0.012 (0.9828) -0.013 (0.9905) | -0.005 (0.5316) - -0.010 (0.9660) | -0.020 (0.9702) -0.007 (0.5220) - |
| Cgo1016PBBE | Южный Байкал Средний Байкал Северный Байкал | - -0.016 (0.9535) 0.001 (0.4121) | 0.006 (0.3109) - 0.004 (0.3750) | -0.016 (0.6977) -0.009 (0.4505) - |
| Cgo1114PBBE | Южный Байкал Средний Байкал Северный Байкал | - -0.012 (0.9125) 0.064 (0.0571) | -0.018 (0.9130) - 0.042 (0.1477) | 0.083 (0.0869) 0.118 (0.0423) - |
| Cgo05ZIM | Южный Байкал Средний Байкал Северный Байкал | - -0.001 (0.6180) 0.005 (0.4988) | 0.052 (0.1155) - 0.013 (0.3142) | -0.019 (0.8297) 0.019 (0.2631) - |
| Cgo33ZIM | Южный Байкал Средний Байкал Северный Байкал | - 0.021 (0.2289) 0.031 (0.1502) | 0.025 (0.2612) - 0.014 (0.2985) | -0.017 (0.8003) 0.078 (0.0460) - |
| Cgo42ZIM | Южный Байкал Средний Байкал Северный Байкал | - -0.003 (0.6939) 0.029 (0.1323) | 0.014 (0.3621) - 0.042 (0.0545) | 0.086 (0.0946) 0.006 (0.4120) |
| Среднее | Южный Байкал Средний Байкал Северный Байкал | - -0.004 (0.9425) 0.019 (0.1238) | 0.016 (0.3217) - 0.015 (0.2042) | 0.013 (0.3821) 0.016 (0.3124) - |

Рисунок 2. Уровни ожидаемой и наблюдаемой гетерозиготности малой и большой голомянок по микросателлитным локусам.
На рис. 3 представлены диаграммы распределения частот аллельных вариантов малой и большой голомянок. По локусам Cgo1016PBBE, Cgo1114PBBE, Cgo33ZIM и Cgo42ZIM по сравнению с малой голомянкой, у большой голомянки преобладали низкомолекулярные аллели. Кроме этого, у большой голомянки по четырем локусам (Cgo1016PBBE, Cgo05ZIM, Cgo33ZIM, Cgo42ZIM) из шести наблюдалось меньшее количество аллелей, чем у малой. В совокупности по шести локусам у малой голомянки обнаружено 57 аллелей, у большой 51. Разницу в количестве аллелей между малой и большой голомянками так же, как и различия в уровнях гетерозиготности можно объяснить различием в количестве нулевых аллелей (нулевых аллелей у большой голомянки больше).
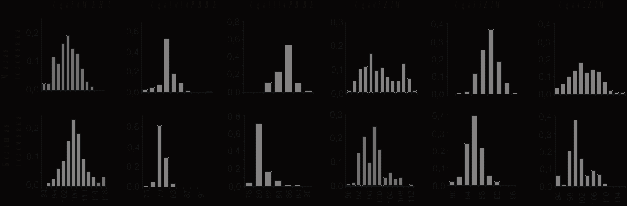
Рисунок 3. Диаграммы распределения частот аллелей малой и большой голомянок. По осям абсцисс – длина аллелей; по осям ординат – частота встречаемости в долях.
Индексы генетической дифференциации между совокупными выборками малой и большой голомянок колебались в случае Fst от 0.011 (Cgo56MENU) до 0.418 (Cgo1114PBBE), в случае Rst от 0.056 (Cgo05ZIM) до 0.793 (Cgo1114PBBE). Общие значения по всем локусам (Fst = 0.138, Rst = 0.244, P=0,0000) соответствуют значительной генетической подразделенности (Wright, 1978) и согласуются с уровнем данных критериев встречающихся в литературе по другим комплексам близких друг другу пелагических рыб (Shaw et al., 2000; Rico et al., 2003).
Анализ нуклеотидных последовательностей cytb малой и большой голомянок. Нуклеотидная последовательность гена цитохрома b размером 1140 пн определена для 63 экземпляров малой голомянки и 52 экземпляров большой голомянки. Данные последовательности помещены в GenBank под номерами доступа EU693082 - EU693115 (малая голомянка) и EU699772 - EU699808 (большая голомянка). Анализ полученных последовательностей выявил 91 вариабельную позицию, из них 14 в первых позициях кодонов, три - во вторых. 34 позиции являются филогенетически информативными. В 22 позициях наблюдались замены типа трансверсий. Замены в 77 позициях являются синонимичными. Мутации в 12 позициях приводят к заменам аминокислот. Два вида голомянок разделены четырьмя фиксированными заменами в нуклеотидных последовательностях. Две из них являются синонимичными транзициями. Две другие являются трансверсиями, которые приводят к замене аминокислот и в обоих случаях это - лейцин ↔ изолейцин.
Тест Макдональда-Крейтмана и индекс нейтральности (ИН=0.123) показывают, что фиксированного состояния быстрее достигают несинонимичные замены. Это может являться показателем отбора в несинонимичных сайтах и наличия адаптивной эволюции. Однако эти замены приводят лишь к смене гидрофобной аминокислоты на гидрофобную (лейцин ↔ изолейцин). Кроме того, позиции, в которых произошли замены аминокислот, находятся в трансмембранных участках белка цитохрома b, во II и V доменах. Эти аминокислотные участки не участвуют в образовании реакционных центров. Поэтому, возможно, что замены этих аминокислот не влияют на функции белка, и, соответственно, могут быть селективно нейтральными. В связи с этим, выявленные различия между нуклеотидными последовательностями малой и большой голомянок не позволяют нам однозначно ответить на вопрос о характере эволюции, адаптивном или нейтральном.
Анализ молекулярной вариации (АМОВА) показал, что около 89% генетической изменчивости малой голомянки приходится на изменчивость внутри выборок из разных котловин Байкала и 11% на изменчивость между выборками. При разложении генетической изменчивости выборок большой голомянки из разных котловин Байкала с использованием АМОВА, оказалось, что все разнообразие приходиться на изменчивость в пределах выборок.
С
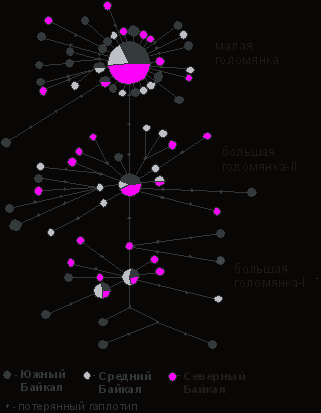 помощью программы NETWORK 4.5 было получено несколько медианных сетей, имеющих равное минимальное количество мутационных шагов. Схемы незначительно отличались по расположению некоторых ветвей, но т.к. это не влияет на выводы, здесь представлена только одна из них (рис. 4). В данном древе малая голомянка образует единый кластер с 34 гаплотипами. В центре кластера располагается гаплотип, имеющий максимальную частоту. Данный гаплотип преобладает во всех трех выборках малой голомянки и представляет 42.9 % исследованных особей. Большинство остальных гаплотипов удалены от центрального на одно мутационное событие. Трем гаплотипам соответствует по две последовательности. Остальные 25 гаплотипов являются уникальными.
помощью программы NETWORK 4.5 было получено несколько медианных сетей, имеющих равное минимальное количество мутационных шагов. Схемы незначительно отличались по расположению некоторых ветвей, но т.к. это не влияет на выводы, здесь представлена только одна из них (рис. 4). В данном древе малая голомянка образует единый кластер с 34 гаплотипами. В центре кластера располагается гаплотип, имеющий максимальную частоту. Данный гаплотип преобладает во всех трех выборках малой голомянки и представляет 42.9 % исследованных особей. Большинство остальных гаплотипов удалены от центрального на одно мутационное событие. Трем гаплотипам соответствует по две последовательности. Остальные 25 гаплотипов являются уникальными. Рисунок 4. Медианная сеть гаплотипов малой и большой голомянки, построенное на основе нуклеотидных последовательностей гена цитохрома b. Размер окружностей пропорционален количеству особей представляющих соответствующий гаплотип. Длина ветвей соединяющих гаплотипы пропорциональна количеству мутационных шагов.
Большая голомянка распадается на две генетические группы. При этом группа I генетически дальше от малой голомянки, чем группа II. Группу I образуют 16 гаплотипов, группу II – 21. Расстояние между центральными гаплотипами этих двух групп большой голомянки близко расстоянию между двумя видами голомянок, малой и большой.
Д
 ля проверки того насколько полученные результаты согласуются с результатами, полученными по ядерному геному, было проведено сравнение данных по полиморфизму длин микросателлитов у двух групп большой голомянки. Средние значения индексов генетический дифференциации по микросателлитным локусам между двумя группами большой голомянки, не выявили достоверных различий и составили Fst = 0.012 (Р = 0.6305) и Rst = 0.008 (Р = 0.5691). На основе данных полиморфизма микросателлитных локусов методом объединения ближайших соседей было построено дерево, представленное на рисунке 5. На данной схеме особи из двух групп большой голомянки не образуют отдельных кластеров и перемешаны друг с другом.
ля проверки того насколько полученные результаты согласуются с результатами, полученными по ядерному геному, было проведено сравнение данных по полиморфизму длин микросателлитов у двух групп большой голомянки. Средние значения индексов генетический дифференциации по микросателлитным локусам между двумя группами большой голомянки, не выявили достоверных различий и составили Fst = 0.012 (Р = 0.6305) и Rst = 0.008 (Р = 0.5691). На основе данных полиморфизма микросателлитных локусов методом объединения ближайших соседей было построено дерево, представленное на рисунке 5. На данной схеме особи из двух групп большой голомянки не образуют отдельных кластеров и перемешаны друг с другом. Рисунок 5. Дерево, основанное на полиморфизме микросателлитной ДНК большой и малой голомянок, построенное на основе генетических расстояний DAS с помощью метода объединения ближайших соседей. Тонкие линии – малая голомянка, жирные – большая голомянка, где:
------ - большая голомянка I,
······ - большая голомянка II.
На рисунке 6 представлены диаграммы параметров разнообразия гаплотипов (Hd) и уровней нуклеотидной изменчивости (π) большой и малой голомянок. Индексы Hd в первой и во второй группах большой голомянки были сходными (0.937 и 0.943, соответственно) и более высокими, чем у малой голомянки (0.819).
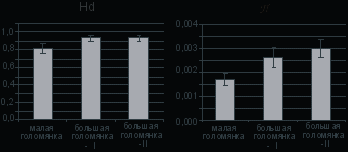
Рисунок 6. Диаграммы индексов генетического разнообразия (Hd - разнообразие гаплотипов и π - нуклеотидная изменчивость) гена цитохрома b большой и малой голомянок.
Уровень индекса π группы II большой голомянки (0.00299) был несколько выше, чем у группы I (0.00261). При этом, уровень нуклеотидной изменчивости малой голомянки (π =0.00167) был значительно ниже, в сравнении с обеими группами большой голомянки. Более низкий уровень генетического разнообразия характерный для малой голомянки может быть следствием меньшего по сравнению с большой голомянкой эффективного размера популяции и/или меньшего эволюционного возраста. Не исключено, что популяция малой голомянки могла в более недавнее, относительно большой голомянки, время пройти через стадию «бутылочного горлышка». Предположение о меньшем эффективном размере популяции у малой голомянки противоречит литературным данным, согласно которым численность малой голомянки выше, чем у большой (Стариков, 1977).
Для оценки демографических параметров популяций и времени дивергенции (t) голомянок было проведено две серии запусков программы IM (Hey, Nielsen, 2004). В первой серии использовались нуклеотидные последовательности малой голомянки и группы II большой голомянки. Во второй серии запусков проводился анализ двух генетических групп большой голомянки. В каждой серии все три запуска программы IM выдавали сходные результаты. На рисунке 7 приводятся кривые плотностей апостериорных вероятностей для параметров модели, шкалированных с помощью мутационной скорости. В качестве мутационной скорости (u) использовались скорости накопления синонимичных замен гена цитохрома b рыб, предложенные Т. Контула с соавторами (Kontula et al, 2003). Полученные ими значения находились в диапазоне от 2.3% до 5.8% замен в миллион лет.
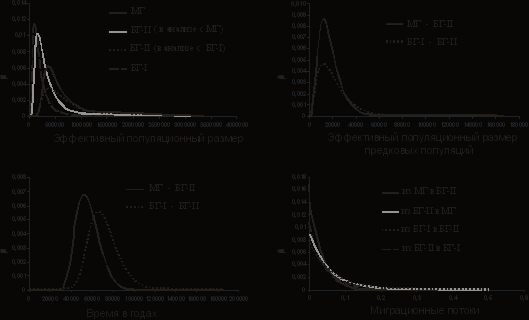
Рисунок 7. Кривые плотностей апостериорного распределения для демографических параметров, полученных с помощью программы IM (Hey, Nielsen, 2004). МГ- малая голомянка, БГ- большая голомянка.
Пики кривых для миграционного параметра во всех случаях были близки к нулю. Это показывает отсутствие в настоящее время обмена митохондриальными генами между малой и группой II большой голомянки, а также между двумя группами большой голомянки. Полученное в программе значение эффективного размера современной популяции малой голомянки составило около 329 – 359 тыс. особей. Оценки популяционного размера группы II большой голомянки в двух разных сериях запусков программы различались более чем в два раза. В запусках малая голомянка – большая голомянка - II он был около 182 – 189 тыс., в то время как в запусках большая голомянка – I – большая голомянка - II – около 399 – 440 тыс. Эффективный популяционный размер группы I большой голомянки составил примерно 115 – 118 тыс. особей. Эффективный размер общей предковой для двух современных видов голомянок популяции был значительно, в десятки раз, ниже, чем у ныне существующих популяций и составил 12 - 13 тыс. особей. Эффективный размер предковой популяции давшей начало двум группам большой голомянки также составил 12 – 13 тыс. особей. Вероятно, это является показателем того, что предковые популяции претерпели значительное сокращение численности в прошлом, пройдя через «бутылочное горлышко». Наличие «бутылочного горлышка» подтверждено анализом не спаренного распределения (mismatch distribution), проведенным с помощью программы DnaSP 4.10.3 (Rozas, et. al.2003).
Также, с помощью программы IM было получено время до наиболее недавнего общего предка для двух видов голомянок и для генетических групп большой голомянки. Для двух видов голомянок время составило 39 - 74 тыс. лет (HiPt - 53-54 тыс. лет). Время начала дивергенции двух генетических групп большой голомянки – 48 – 94 тыс. лет назад (HiPt - 66 - 67 тыс. лет). Эти значения близки к оценкам, полученным на основе расстояний Памило-Бьянчи-Ли (Pamilo, Bianchi, 1993; Li, 1993). В данном случае, время, прошедшее с начала дивергенции малой и большой голомянки составило 43-109 тыс. лет, а двух групп большой голомянки 60 - 152 тыс. лет.

Рисунок 8. Схема филогенетических взаимоотношений голомянок с другими представителями байкальских Cottoidei, построенная байесовским методом на основе нуклеотидных последовательностей гена цитохрома b мтДНК. Арабскими цифрами указаны апостериорные вероятности в %.
Чтобы определить характер взаимоотношения голомянок между собой и их положение в общем филогенетическом древе рогатковидных рыб Байкала, использовался метод Байеса, реализованный в программе MrBayes 3.1.2 (Ronquist, Huelsenbeck, 2003). Филогенетическая схема представлена на рисунке 8. На данной схеме весь род голомянок образует со 100-процентной вероятностью монофилетичную группу внутри букета видов рогатковидных рыб. Топология данного дерева показывает, что малая голомянка произошла от предковой формы большой голомянки группы - II. Это подтверждается высокими значениями апостериорных вероятностей (100%). Разделение большой голомянки на два кластера также имеет высокую статистическую поддержку в 95%.
ОБСУЖДЕНИЕ
Одной из задач исследования было решение вопроса о популяционной структурированности голомянок. Озеро Байкал имеет значительную протяженность (более 600 км) и разделено высокими поднятиями дна на три глубоководные котловины. Так как голомянки не совершают активных горизонтальных миграций и встречаются на всех глубинах озера, можно предположить, что между группами рыб, обитающих в разных котловинах, существует определенная степень генетической изоляции. Однако, анализ полиморфизма микросателлитной ДНК как малой, так и большой голомянки не выявил генетических различий между выборками из разных котловин Байкала. Фактором, способствующим панмиксии голомянок, возможно, является пассивный перенос молоди и взрослых особей водными течениями.
Отсутствие какой-либо генетической подразделенности малой голомянки подтверждается исследованием нуклеотидной последовательности митохондриального гена цитохрома b мтДНК. Анализ распределения гаплотипов малой голомянки показал, что все гаплотипы собраны в одну гаплогруппу, в которой доминирует один центральный гаплотип. В отличие от этого анализ распределения гаплотипов митохондриальной ДНК большой голомянки показал, что данный вид подразделяется на две генетические группы. Распределение гаплотипов не зависит от места сбора материала. По нашему мнению, одной из возможных причин деления большой голомянки на две генетические группы является расхождение этих групп по срокам нереста. Известно, что большая голомянка нерестится круглый год, но имеет два явных перекрывающихся пика появления личинок - в августе - сентябре и декабре (Дзюба, Мельник, 2001). Наличие двух пиков нереста у большой голомянки также подтверждают гистологический анализ гонад (Зубина и др., 2001) и данные по эмбриогенезу голомянок (Черняев, 1974). Поскольку пики нереста C.baicalensis в значительной степени перекрываются, выявление особей той или иной группы нереста достаточно сложный процесс, поэтому проверка этой гипотезы будет являться темой отдельного исследования.
Филогенетический анализ показал, что исходной формой для всего семейства голомянок является предковая форма одной из выявленных генетических групп большой голомянки (большая голомянка - II). От данной группы отделилась группа I большой голомянки и ветвь малой голомянки. При этом, согласно полученным оценкам времен дивергенции, первой отделилась большая голомянка - I (66 - 67 тыс. лет назад), а затем малая голомянка (53 - 54 тыс. лет назад). Таким образом, с высокой достоверностью показано происхождение малой голомянки от предковой формы большой голомянки. Предположение о том, что более молодым из двух видов является малая голомянка подтверждается более низким уровнем генетического разнообразия данного вида. Разнообразие гаплотипов и, особенно, нуклеотидная изменчивость малой голомянки имеют более низкие значения, чем у большой голомянки (рис. 6). Это противоречит мнению ряда ихтиологов, считающих, что предковой линией для двух видов голомянок является линия малой голомянки. Например, Д.Н.Талиев (1955) на основании остеологических признаков, различий в удельном весе и эврибионтности делает вывод, что малая голомянка является более примитивной формой, нежели большая и «большая голомянка является производным малой». Кроме того, ряд исследователей свое предположение объясняют тем, что большая голомянка является более хищной формой, в питании которой большую долю занимает молодь голомянок и в значительной степени - молодь малой голомянки (устные коммуникации).
Возможны несколько причин появления двух генетических групп большой голомянки и объясняющих несогласованность результатов полученных по митохондриальной и микросателлитной ДНК:
1. Высокая скорость мутирования микросателлитной ДНК могла привести к «эффекту насыщения» мутациями. В результате «эффекта насыщения» степень дивергенции между генетическими группами большой голомянки может оказаться недооцененной. Вместе с тем, те же самые микросателлитные маркеры оказались вполне информативными при сравнении малой и большой голомянок, поэтому данная версия представляется нам маловероятной.
2. Можно предположить, что в прошлом существовало две обособленные группы большой голомянки, которые в настоящее время объединились в одну. За счет меньшей скорости мутирования мтДНК, следы демографических событий сохраняются в ней на протяжении более длительного периода, чем в микросателлитной ДНК. Однако, мы не располагаем какой-либо стройной гипотезой, объясняющей по каким причинам две формы, существовавшие раздельно на протяжении десятков тысяч лет могли бы объединиться в одну.
3. Также возможна интрогрессивная гибридизация митохондриальной ДНК (Egger at al., 2007; Абрамсон, 2007). Группа II большой голомянки могла возникнуть в результате интрогрессии митохондриальной ДНК малой голомянки в геном группы I большой голомянки. В этом случае, генетический полиморфизм группы II большой голомянки должен быть таким же или меньше полиморфизма малой голомянки. Однако группа II большой голомянки самое высокое генетическое разнообразие в сравнении с малой голомянкой и группой I большой голомянки (рис. 6). Поэтому, наличие в прошлом интрогрессивной гибридизации между двумя видами голомянок маловероятно.
4. Наиболее вероятной, по нашему мнению причиной несогласованности результатов может быть следующее. Разделение по срокам нереста на группы существует только у самок большой голомянки, в то время как самцы могут участвовать в скрещивании с самками из обеих нерестовых групп. Между двумя группами происходит обмен ядерными генами за счет самцов. В отличие от этого мтДНК представителей обеих групп в силу материнского характера наследования не смешивается. Подобная картина наблюдается, например, у морских млекопитающих и у акул, у которых самки разделены на географически изолированные группы и не совершают больших миграций, в отличие от кочующих самцов (Pardini et al., 2001).
Для описания возможного сценария видообразования у голомянок и причин формирования внутривидовой структуры большой голомянки необходимо привлечение данных по палеогеологической истории Байкальского региона. На сегодняшний день нет оснований считать, что во время ледниковий в пелагиале Байкала существовали географические барьеры. Понижение уровня Байкала вследствие сокращения стока рек в озеро, как предполагается, было не более 30 м. (Гольдберг и др., 2005), что незначительно по сравнению с отметками глубин межкотловинных перемычек (350-400 м). Поэтому, можно считать, что видообразование в семействе голомянок и формирование внутривидовой структуры большой голомянки имеет симпатрический характер. В результате возможны следующие причины, которые могли сыграть ключевую роль в дивергенции генетических групп и видов голомянок:
1. Полученные в настоящей работе интервалы времен дивергенции совпадают с эпохой глобального ледниковья (рис. 9), протекавшей 45-75 тыс. лет назад (MIS4, Морская изотопная стадия 4). Согласно исследованиям по количеству захороненных урана и фосфора в осадках озера, в начале этой ледниковой стадии 74,5 тыс. лет назад произошел один из эпизодов массовой гибели гидробионтов Байкала (Чебыкин и др., 2004).

Рисунок 9. Содержание створок диатомовых водорослей в осадках озера Байкал, коррелирующее с климатическими изменениями (Гольдберг и др., 2005).
Согласно нашим расчетам, после этого периода (66 - 67 тыс. лет назад) началось разделение большой голомянки на две генетические группы. Во время ледниковий притоки замерзали, сток биогенных элементов в озеро уменьшался, сокращалась мощность фотической зоны за счет повышения мутности воды. Все это вызывало снижение общей первичной продукции и недостаток пищевых ресурсов. Сокращение пищевых ресурсов могло привести к разделению предкового вида голомянки на группы, различающиеся по срокам нереста. Это позволяло им, обитая на одной территории, более рационально использовать пищевые ресурсы.
2. Причиной появления малой голомянки может быть следующее. В Байкале существует два пика численности фитопланктона в течение года – весенний (подледный) и осенний. Фитопланктон является главным первичным продуцентом озера. Массовое размножение водорослей вызывает развитие и зоопланктона, основного объекта питания молоди бычков. Основную массу фитопланктона Байкала составляют такие эндемичные виды диатомовых как Aulacoseira baicalensis и Сyclotella minuta. С. minuta встречается круглый год с максимумом развития осенью (Поповская и др., 2002). К моменту массового размножения этой водоросли приурочен пик появления личинок большой голомянки. В отличие от этого A. baicalensis в Байкале массово вегетирует в весенний период. В это время происходит нерест малой голомянки. Формирование современного комплекса фитопланктона произошло во время незначительного потепления климата в MIS3 (24-59 тыс. лет назад). Весенневегетирующая водоросль A. baicalensis стала доминировать в планктоне Байкала во начале MIS3 52 тыс. лет назад (Khursevich et al., 2000). Этому периоду близко и полученное нами время появления малой голомянки (53 - 54 тыс. лет назад). Возможно, в условиях недостатка пищевых ресурсов, характерных для ледниковья, часть особей Comephoridae перешло на использование других источников питания.
Таким образом, в настоящем исследовании показана молодость семейства Comephoridae. Первой из двух видов голомянок сформировалась большая голомянка, впоследствии дав начало малой голомянки. Период времени формирования двух современных видов голомянок, вероятно, не превышает 100000 лет. Видообразование голомянок, возможно, проходило на фоне резкого сокращения численности в результате сильнейшего похолодания в регионе и недостатка пищевых ресурсов. Сокращение численности могло сопровождаться разделением предкового вида на нерестовые популяции, что позволяло более рационально использовать пищевые ресурсы.
ВЫВОДЫ
- Согласно анализу микросателлитной ДНК и нуклеотидной последовательности митохондриального гена цитохрома b малая голомянка представлена в Байкале единой генетически не подразделенной популяцией.
- Анализ полиморфизма микросателлитной ДНК не выявил какой-либо генетической подразделенности большой голомянки в пределах озера Байкал.
- Анализ нуклеотидной последовательности митохондриального гена цитохрома b выявил наличие двух генетических групп большой голомянки. Распределение особей по группам не зависит от места сбора материала.
- Филогенетический анализ полученных данных с привлечением нуклеотидных последовательностей гена цитохрома b других представителей байкальских рогатковидных рыб показал, что малая голомянка произошла от предковой формы большой голомянки.
- Время, прошедшее с начала дивергенции малой и большой голомянки составило 39 - 74 тыс. лет, а двух групп большой голомянки 48 – 94 тыс.лет.
- Возможными причинами дивергенции генетических групп и видов голомянок являются резкие изменения климата в ледниковую стадию MIS4 45-75 тыс. лет назад.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
- Teterina V.I., Kirilchik S.V., Sukhanova L.V. Significance of Microsatellite obtained from the bullhead Cottus gobio in the oilfish Comephorus dybowskii an endemic of lake Baikal // Abs. Of the third international symposium of the series speciation in ancient lakes (SIAL-3): Ancient lakes: speciation, development in time and space, natural history.- Novosibirsk: Nauka, 2002.- P. 185.
- Тетерина В.И., Кирильчик С.В., Суханова Л.В. Пригодность микросателлитных маркеров, полученных на европейском обыкновенном подкаменщике, Cottus gobio для исследования популяционной структуры малой голомянки, Comephorus dybowski, эндемика Байкала//Материалы региональной научно-практической конференции "Структура и функционирование экосистем Байкальского региона".- Улан-Удэ: Бурятский гос. ун-т, 2003.
- Teterina V.I., Sukhanova L.V., Bogdanov B.E., Anoshko P.N., Kirilchik S.V. Intra-species genetic polymorphism of a little Baikal oilfish – Comephorus dybowski revealed by microsatellite analysis // The first Baikal Workshop on Evolutionary Biology. Abstracts. Irkutsk, Russia. 2004. P. 23-24.
- Тетерина В.И., Суханова Л.В., Богданов Б.Э., Кирильчик С.В. Внитривидовой генетический полиморфизм малой Comephorus dybowski и больщой Comephorus baicalensis голомянок // Сборник материалов VIII Всероссийского популяционного семинара «Популяции в пространстве и времени». 11-15 апреля 2005 г. Нижний Новгород, Россия; 2005; 417-419.
- Тетерина В.И., Суханова Л.В., Богданов Б.Э., Аношко П.Н., Кирильчик С.В. Анализ генетического полиморфизма пелагического вида рыб оз. Байкал - малой голомянки (Comephorus dybowski) по микросателлитным локусам // Генетика, 2005, том 41, № 7, с. 919-924.
- Тетерина В.И., Гайкалов И.В., Суханова Л.В., Кирильчик С.В. Эволюционные исследования рыб Байкала методами молекулярной биологии: основные результаты и перспективы // Тезисы докладов и стендовых сообщений Четвертой Верещагинской Байкальской конференции. Иркутск. 2005. С. 182-183.
- Тетерина В.И., Суханова Л.В., Богданов Б.Э., Кирильчик С.В. Исследования темпов молекулярной дивергенции и видообразования на примере трех видов байкальских рогатковидных рыб // Популяционная экология животных: материалы Международной конференции «Проблемы популяционной экологии животных». – Томск. 2006. С. 257-258.
- Тетерина В.И., Суханова Л.В., Кирильчик С.В. Полиморфизм микросателлитной ДНК эндемичного рода рыб оз. Байкал – голомянок (Comephorus Lacepede, 1801) // Экологическая генетика, 2007, том V, №2, с. 50-57.
БЛАГОДАРНОСТИ
Пользуясь случаем, автор выражает искреннюю благодарность научному руководителю - к.б.н. Кирильчику С.В. за внимательное и конструктивное руководство, а также к.б.н. Сухановой Л.В., к.б.н. Дзюба Е.В., к.б.н. Богданову Б.Э. за ценные консультации на всех этапах исследования. Глубокую благодарность автор выражает заведующей лабораторией биологии рыб ЛИН СО РАН к.б.н. Мельник Н.Г. и сотрудникам лаборатории Аношко П.Н. и Ханаеву И.В. за содействие в сборе материала. Автор выражает признательность к.б.н. Бондаренко Н.А. и к.б.н. Воробьевой С.С. за неоценимую помощь в интерпретации полученных в данном исследовании результатов. Особую благодарность выражаю своим родителям за постоянную и всестороннюю моральную и финансовую поддержку.
Работа выполнялась при финансовой поддержке гранта РФФИ, проект № 01-04-48939.
