Строение атома. Периодический закон
| Вид материала | Закон |
- Модуль Теория строения атома. Периодический закон и периодическая система Д. И. Менделеева, 401.18kb.
- Темы рефератов или презентаций Биотехнология и генная инженерия технологии XXI века, 47.96kb.
- Тема урока: «Периодический закон и периодическая система химических элементов, 266.68kb.
- И. А. Моу «исош №1» п. Ивня Игра по химии «Умники и умницы» Тема: «Периодический закон, 114.97kb.
- 56. Атомная физика. Строение атома. Радиоактивность. Строение ядра, 83.3kb.
- Урок: физика + химия по теме: "Строение атома", 86.73kb.
- Физические основы действия ионизирующих излучений строение атома и изотопы, 258kb.
- Тема урока: «Фосфор. Строение атома, аллотропия, свойства и применение фосфора», 43.99kb.
- Cтроение атома и периодический закон д. И. Менделеева сложность строения атомов, 278.71kb.
- Химическая конференция (к 176-летию со дня рождения Д. И. Менделеева), 204.32kb.
СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН
- Открытие периодического закона. Структура периодической системы
Периодический закон был открыт Д.И. Менделеевым в 1869 г. Открытие периодического закона дало Менделееву основу для системы классификации химических элементов – периодической системы (п.с.).
В настоящее время известно 109 химических элементов. Последние элементы получены в количестве всего нескольких атомов и практического значения не имеют. Тем не менее, п.с. может быть расширена и дальше.
Свойства элементов, а также свойства образуемых ими веществ находятся в периодической зависимости от величины заряда ядер их атомов.
Периодическая система состоит из семи периодов, расположенных в таблице горизонтально, и восьми групп, расположенных вертикально.
Период – это горизонтальный ряд элементов, начинающийся (за исключением 1-го периода) щелочным металлом и заканчивающийся инертным (благородным) газом.
1-й период содержит 2 элемента, 2-й и трети1 периоды – по 8 элементов. Первый, второй и третий периоды называются малыми (короткими) периодами. 4-й и 5-й периоды содержат по 18 элементов, 6-й период – 32 элемента, 7-й период содержит элементы с 87 и далее, вплоть до последнего из известных на настоящее время элементов – 109-го. Четвертый, пятый, шестой и седьмой периоды называются большими (длинными) периодами.
Каждая группа п.с. состоит из двух подгрупп: главной подгруппы (А) и побочной подгруппы (В).
Свойства простых веществ и соединений элементов изменяются монотонно в каждом периоде и скачкообразно на границах периодов.
В периодах слева направо неметаллические свойства элементов монотонно усиливаются, а металлические – ослабевают. Например, Li – активный металл, Be – металл, образующий амфотерный оксид и, соответственно амфотерный гидроксид, D, C, N, O – типичные неметаллы, F – самый активный неметалл, Ne - инертный газ.
В главных подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические – ослабевают. Например в подгруппе IVА: C, Si – неметаллы, Ge, Sn, Pb – металлы, причем Pb и Sn – более типичные металлы, чем Ge.
2. Строение ядра атома
Заряд ядра атома главная характеристика химического элемента. Химический элемент – это множество атомов с одинаковым зарядом ядра.
Характеристика частиц в составе атома
| Частица | Символ | Заряд | Масса | ||
| Кл | Относительная единица | кг | А.е.м. | ||
| Протон |  | 1,6.10-19 | +1 | 1,7.10-27 | 1 |
| Нейтрон |  | 0 | 0 | 1,7.10-27 | 1 |
| Электрон |  | 1,6.10-19 | -1 | 9,1.10-31 | 1/1840 |
Массовое число атома (А) равно сумме числа протонов N(p) и числа нейтронов N(n) в ядре атома:
А = N(p) + N(n)
Массовое число – это наиболее близкое к относительной атомной массе целое число, т.е. А ≈ Аr. Число протонов в ядре атома равно заряду ядра, а следовательно, порядковому номеру элемента в п.с.:
N(p) =Z
Число нейтронов можно найти из разности
N(n) = A – N(p) = A Z
Итак, порядковый номер элемента в п.с. указывает заряд ядра атома, число протонов в ядре и число электронов в атоме.
Природные химические элементы существуют в виде смеси изотопов.
Изотопами называются атомы одного элемента, которые имеют одинаковый заряд ядра, но разные массовые числа.
3. Состояние электрона в атоме. Квантовые числа
Квантово-механическая теория содержит два основных положения.
- Электрон имеет двойствественную природу. Он облает свойствами и частицы, и волны одновременно. Как частица электрон имеет массу и заряд, но движение электронов – это волновой процесс. Например, электронам свойственно явление дифракции (поток электронов огибает препятствие).
- Положение электрона в атоме неопределенно. Это значит, что невозможно одновременно точно определить и скорость электрона, и его координаты в пространстве.
Гипотеза о наличии у электрона волновых свойств была выдвинута в 1924 г. Луи де Бройлем. Количественно корпускулярно-волновой дуализм электрона и других элементарных частиц описывается уравнением де Бройля:

где h – постоянная Планка, m – масса электрона, v – его скорость, p – импульс электрона.
Движение электрона подчиняется принципу неопределенности Гейзенберга, согласно которому невозможно одновременно измерить сколь угодно точно такие, например, пары независимых величин, как импульс и координату частицы, или время и её энергию. Принцип неопределенности можно выразить следующим образом:
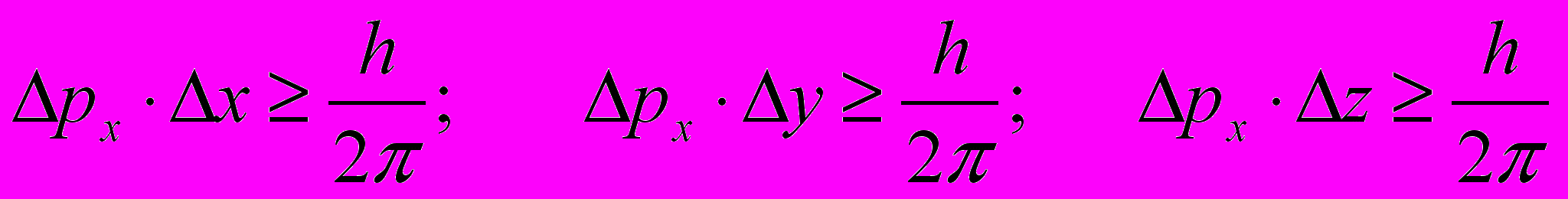
где px, py и pz – проекция импульса электрона на соответствующие оси.
Для описания свойств электрона используется волновая функция – ψ. Квадрат её модуля |ψ|2 пропорционален вероятности обнаружения электрона в данной точке пространства в указанное время.
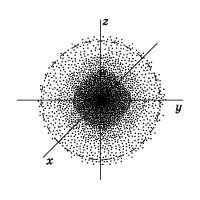 1 |
| Рисунок 1. Электронное облако атома водорода |
Для химической характеристики элемента, определяемой состоянием электронов в электронной оболочке его атома, а также для выяснения связей, которые атом данного элемента может образовывать с другими атомами, важно знать: энергию электрона в атоме (точнее энергию системы, состоящей из этого электрона, других электронов и ядра) и форму, образуемого данным электроном электронного облака.
По энергии электроны в атоме распределяются по энергетическим уровням и подуровням. Состояние электрона в атоме характеризуется набором четырех квантовых чисел.
- Главное квантовое число (n) - характеризует энергетический уровень и определяет размер электронного облака, т.е. среднее расстояние от электрона до ядра. Главное квантовое число принимает только целочисленные значения: 1, 2, 3, 4, … n. Чем больше n, тем выше энергия электрона.
- Орбитальное или побочное квантовое число (l) – характеризует энергетический подуровень и определяет форму электронного облака. Орбитальное или побочное квантовое число принимает целочисленные значения от 0 до (n-1). Значения l обычно обозначаются буквами:
l = 0 1 2 3
s p d f Пример:
При n = 1 l = 0
n = 2 l = 0, 1
n = 3 l = 0, 1, 2
n = 4 l = 0, 1, 2, 3
Энергия электронов на разных подуровнях одного уровня изменяется в зависимости от l следующим образом: каждому значению l соответствует определенная форма электронного облака:
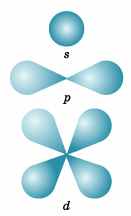
| 2 |
| |
s – сфера, p – гантель (объемная восьмерка), d – объемная четырехлепестковая розетка или более сложная форма.
- Магнитное квантовое число (ml) – характеризует ориентацию электронного облака в магнитном поле, принимает целочисленные значения от –l до l.
ml = -l, … 0 … l (всего 2l+1 значений).
- Спиновое квантовое число (ms, s) характеризует собственный момент количества движения электрона (спин). Может принимать два значения:

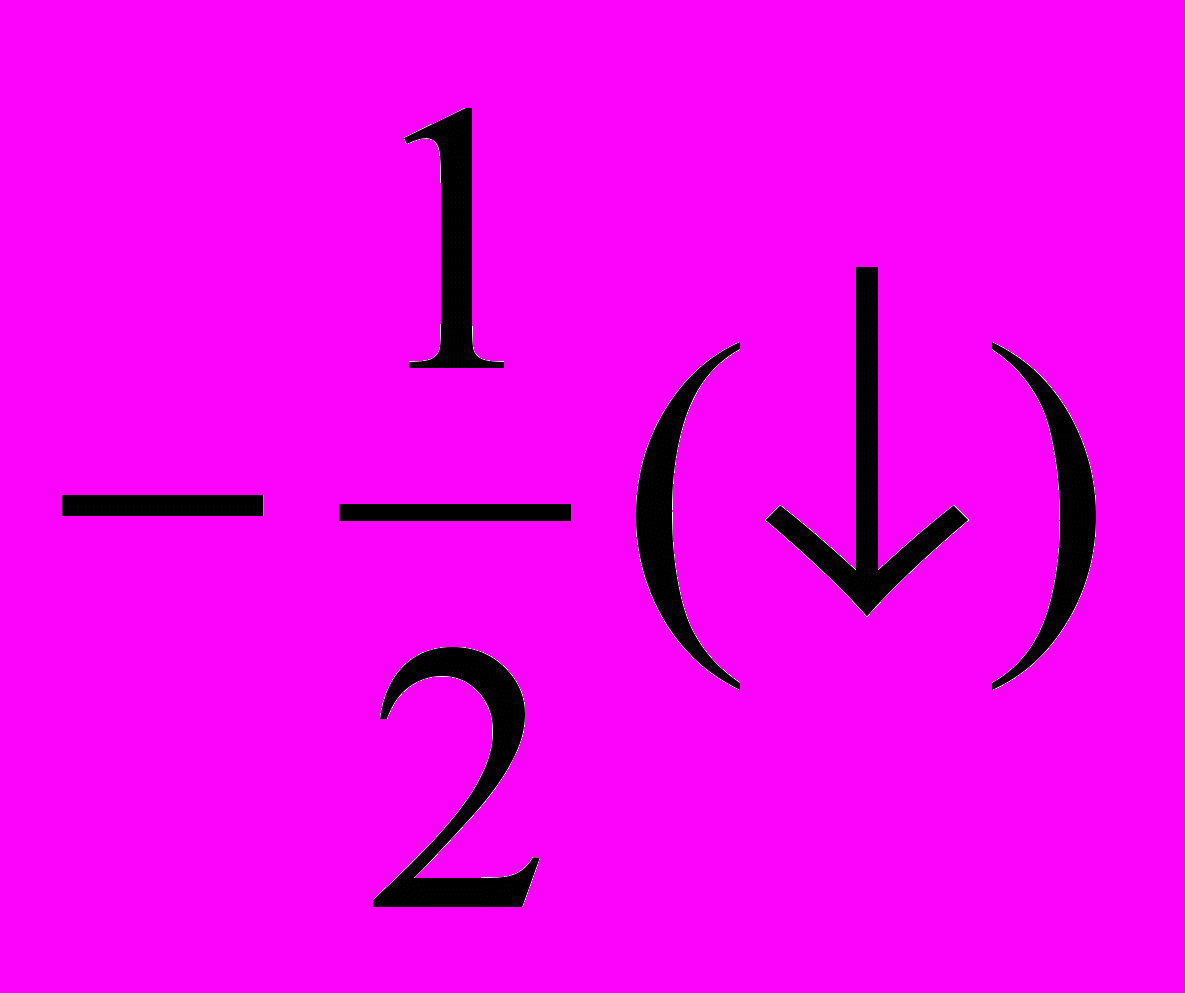 .
.
Принято следующее графическое изображение орбиталей в подуровнях s, p, d и f.
-
f
d
p
S
На рисунке 2. представлена схема, отражающая число, форму и положение в пространстве электронных орбиталей первых четырех электронных слоев отдельного атома.
 3 |
| Рисунок 2. Форма и размер электронных орбиталей атомов элементов |
Два электрона, имеющие противоположные спины и находящиеся на одной орбитали называются спаренными. Один электрон на орбитали является неспаренным.
Заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атома определяется следующими закономерностями.
- Принцип минимума энергии: в устойчивом состоянии электроны находятся на наиболее низких уровнях и подуровнях.
- Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. На одной орбитали не может быть более двух электронов, и различаться они будут значением четвертого, спинового числа.
- Правило Хунда: при формировании электронных подуровней электроны заполняют максимальное число свободных орбиталей так, чтобы число неспаренных электронов было наибольшим.
- Правила Клечковского:
- Увеличение энергии электронных подуровней идет в порядке увеличения суммы главного и орбитального квантовых чисел (n+l).
- В случае равенства суммы увеличение энергии подуровней идет в порядке увеличения главного квантового числа.
Таким образом, порядок заполнения орбиталей таков:
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p…
4. Электронные формулы атомов и ионов
Число электронов в атоме определяется порядковым номером элемента в периодической системе.
Используя правила размещения электронов в атоме, для атома Al имеем:
Al (13 e) 1s22s22p63s23p3
-




3p
3s
Для атома Fe имеем:
Fe(26)
1s22s22p63s23p64s23d6
-






4s
3d
Исключения – «проскок электрона»
Cr, Mo, W – конфигурация ns1(n-1)d5
-






ns
(n-1)d
Cu, Ag, Au: ns1(n-1)d10
-






ns
(n-1)d
В отрицательно заряженном ионе число электронов увеличивается на величину заряда:
S2- (16+2e) 1s22s22p63s23p6
-




3p
3s
В положительно заряженном ионе число электронов уменьшается на величину заряда:
Al3+ (13 -3e) 1s22s22p63s23p0
-

3p
3s
Для иона Fe2+ имеем:
Fe2+(26-2е)
1s22s22p63s23p64s03d6
-





4s
3d
-
Энергетические характеристики атома. Электроотрицательность
Атомы могут терять электроны, превращаясь в положительнозаряженные ионы, например:
Na0 – e-  Na+ (ион натрия)
Na+ (ион натрия)
Al0 – 3e-
 Al3+ (ион алюминия)
Al3+ (ион алюминия)Энергия, необходимая для отрыва электрона от нейтрального атома, называется энергией ионизации (I, кДж/моль) или потенциалом ионизации (I, эВ).
Атомы металлов на внешнем уровне обычно имеют один или два электрона (Al – 3 электрона, Pb, Ge, и Sn – 4 электрона). Внешние электроны в атомах металлов слабо связаны с ядром и имеют низкие энергии ионизации. Вследствие этого атомы металлов легко теряют внешние электроны и превращаются в положительные ионы. Наименьшие значения энергии ионизации имеют металлы главных подгрупп I и II групп.
Атомы неметаллов могут не только терять, но и присоединять электроны с образованием отрицательных ионов, например:
Cl0 + e-
 Cl-
Cl- Энергия, которая выделяется при присоединении электрона к нейтральному атому неметалла, называется энергией сродства к электрону (Е, кДж/моль, эВ).
Таким образом, металлы могут только отдавать электроны, а неметаллы – и отдавать и присоединять электроны. Поэтому металлы проявляют только положительные степени окисления, а неметаллы – и положительные, и отрицательные.
Электроотрицательность (χ) характеризует способность атомов этого элемента удерживать электроны (как электроны своей электронной оболочки, так и дополнительные электроны – в случае неметаллов). Относительная электроотрицательность (измеренная относительно электроотрицательности эталонного элемента) является важной характеристикой элемента. Значение χ указывает на металлический или неметаллический характер элемента. Чем меньше значение χ, тем сильнее выражены металлические свойства элемента. И наоборот, чем больше значение χ, те м сильнее неметаллические свойства элемента.
Ряд электроотрицательности некоторых элементов
| Na | Li | Be | Si | B | H | P | C | S | Br | Cl | N | O | F |
| 0,9 | 1 | 1,5 | 1,8 | 2 | 2,1 | 2,1 | 2,5 | 2,5 | 2,8 | 3 | 3 | 3,5 | 4 |

Усиление электроотрицательности
Распространенность элементов на Земле
Распространенность элементов литосфере, атмосфере и гидросфере следующая. Обычно содержание элемента (его массовую долю, выраженную в %) называют «кларком» этого элемента по имени этого ученого.

