Физические основы действия ионизирующих излучений строение атома и изотопы
| Вид материала | Документы |
- Свойства ионизирующих излучений взаимодействие ионизирующих излучений с веществом, 90.21kb.
- Тематический план практических занятий по радиационной медицине hа IX семестр для студентов, 49.44kb.
- Тема урока: «Фосфор. Строение атома, аллотропия, свойства и применение фосфора», 43.99kb.
- Тематический план лекций по радиологии для студеhтов 3 курса медицинского факультета, 72.26kb.
- 56. Атомная физика. Строение атома. Радиоактивность. Строение ядра, 83.3kb.
- Вопросы механизм биологического действия ионизирующих излучений, 455.56kb.
- Урок: физика + химия по теме: "Строение атома", 86.73kb.
- Основные санитарные правила работы с радиоактивными веществами и другими источниками, 361.11kb.
- Ароматические углеводороды. Бензол представитель аренов. Строение молекулы и физические, 54.51kb.
- Основные свойства ионизирующих излучений, 51.14kb.
ТЕМА 1
ФИЗИЧЕСКИЕ ОСНОВЫ ДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
1.1. Строение атома и изотопы
По своему строению атом похож на Солнечную систему в миниатюре: вокруг ядра движутся по орбитам электроны. Размеры ядра чрезвычайно малы по сравнению с пространственными характеристиками самого ядра: если диаметр атома составляет приблизительно 10-8см, то диаметр ядра – порядка 10-13см, т.е. ядро в сто тысяч раз меньше размеров атома. Масса атома настолько мала (10-22 – 10-24г), что ее принято выражать в относительных единицах атомных единицах массы (а.е.м.). 1 а.е.м. равна 1/12 массы атома углерода и соответствует 1,66·10-24г. Плотность ядра велика и масса ядра почти равна массе всего атома, практически вся масса атома заключена в его ядре.
Ядро, как правило, состоит из нескольких более мелких частиц – протонов и нейтронов, которые плотно сцеплены друг с другом. Протоны и нейтроны имеют общее название — нуклоны. Атом состоит из положительно заряженного ядра и оболочки из отрицательно заряженных электронов, которые могут располагаться только на определенных орбитах.
В зависимости от энергии, которая удерживает электроны при вращении вокруг ядра, они группируются на той или иной электронной орбите. Электронную орбиту называют еще уровнем или слоем. Число слоев у разных атомов неодинаково. В атомах с большой массой число орбит достигает семи. Их обозначают или цифрами, или буквами латинского алфавита: K,L,M,N,O,P,Q; K – ближайший к ядру слой. Число электронов в каждом слое строго определенное: K-слой имеет не более двух электронов, L-слой – до 8; M-слой – 18 электронов; N-слой – 32 электрона и т.д. Соответственно числу электронных слоев в Периодической системе химических элементов Д.И. Менделеева все элементы размещаются в семи периодах.
Электрон – устойчивая элементарная частица с массой покоя (масса частицы, скорость которой равно 0) равной 0,000548 а.е.м., а в абсолютных единицах массы – 9,1∙ 10-28г. (Энергетический эквивалент 1 а.е.м. составляет 931МэВ). Энергетический эквивалент электрона составляет 0,000548 · 931 = 0,511МэВ.
Электрон несет один элементарный отрицательный заряд электричества, т.е. наименьшее количество электричества, встречающееся в природе – 1,6·10-19Кл. Поэтому в ядерной физике заряд электрона принят за единицу.
Электроны на внутренних оболочках связаны с ядром наиболее прочно, на внешней (валентной) оболочке прочность связи наименьшая, так как взаимное отталкивание электронов в многоэлектронном атоме существенно уменьшает их связь с ядром.
Структура орбит и количество электронов на внешней оболочке определяют химическую индивидуальность элемента — его валентность, степень окисления и другие свойства. Таким образом, каждый электрон несет единичный (элементарный) электрический заряд, а общий отрицательный заряд электронной оболочки атома равен числу электронов.
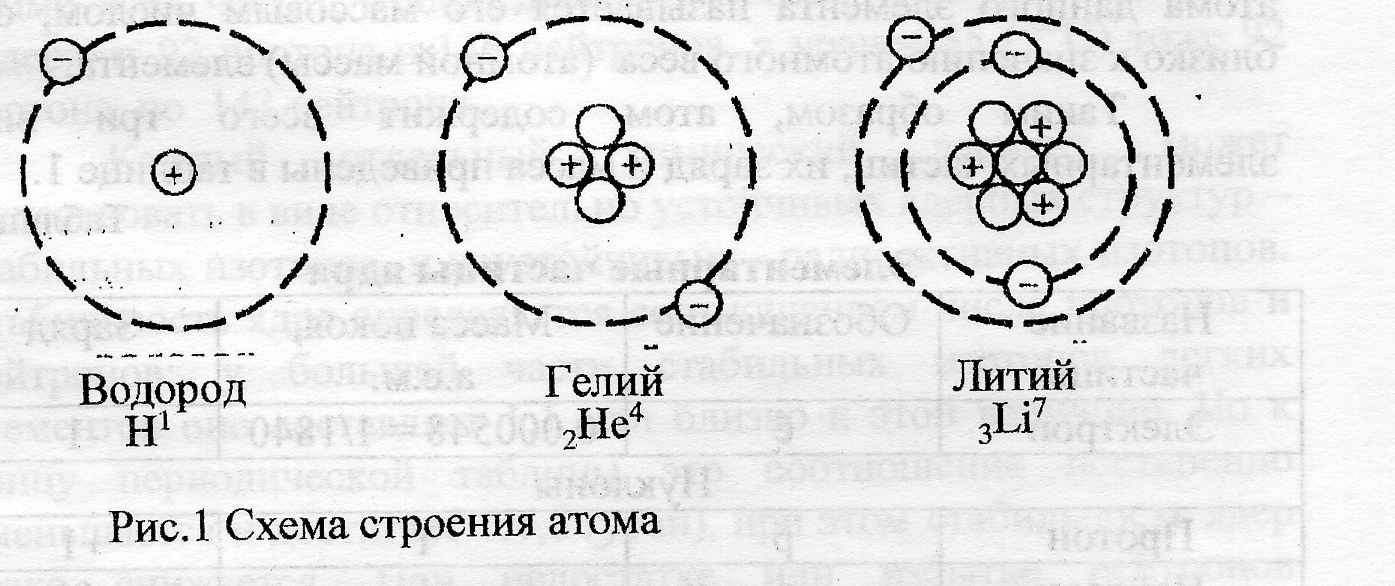
Атомы электронейтральны, поэтому ядро должно численно иметь тот же заряд, но со знаком (+). Носителями заряда в ядре являются протоны, каждый из которых обладает одним элементарным положительным зарядом (1,6·10-19Кл), следовательно, число протонов в ядре должно быть равно числу электронов на оболочках атома. Число протонов в ядре строго постоянно для атомов каждого данного элемента и соответствует порядковому номеру в Периодической таблице Д.И.Менделеева. Таким образом, число протонов в ядре определяет, к какому химическому элементу относится данный атом. Например (рис.1), 1 протон - в ядре водорода (первый период), 2 протона – в ядре гелия (первый период), 3 протона – в ядре лития (второй период). В ядре цезия (шестой период) – 55 протонов, а уран содержит 92 протона. Находясь вне ядра, протоны стабильны и не испытывают превращений.
Кроме того, в ядре содержатся нейтроны — частицы примерно той же массы, что и протоны, но не имеющие заряда, т.е. электрически нейтральные. Нейтроны в ядрах стабильны, а в свободном состоянии неустойчивы. При распаде нейтрон, испуская электрон и антинейтрино, высвобождает некоторое количество энергии (0,78МэВ) и превращается в протон.
Итак, в каждом атоме число электронов в точности равно числу протонов в ядре; каждый электрон несет отрицательный заряд, равный по абсолютной величине заряду протона, так что в целом атом нейтрален. Присутствие в ядре того или иного числа нейтронов отражается на общей массе атома, но не на его химических свойствах. Сумма числа протонов и нейтронов в ядре атома данного элемента называется его массовым числом, оно близко к значению атомного веса (атомной массы) элемента.
Таким образом, атом содержит всего три вида элементарных частиц, их заряд и масса приведены в табл. 1.
Таблица 1
Элементарные частицы ядра
| Название частицы | Обозначение | Масса покоя, а.е.м. | Заряд |
| Электрон | ē | 0,000548 = 1/1840 | -1 |
| Нуклоны | |||
| Протон | р | 1 | +1 |
| Нейтрон | n | 1 | 0 |
Так как масса электрона в 1840 раз меньше массы протона или нейтрона, то суммарная масса атома почти целиком (на 99,97 - 99,98%) сосредоточена в ядре, тогда как на все орбитальные электроны приходится чуть больше 0,02% общей массы атома. При этом ядро в атоме занимает чрезвычайно малый объем. Линейные размеры атома имеют порядок 10-10м, а ядра – 10-15 м, т. е. в сотни тысяч раз меньше. Соответственно плотность материи в ядре – 1017кг/м3 (105т/мм3). Все остальное пространство в атоме (кроме ядра и электронов) представляет собой пустоту. Это важно иметь в виду при рассмотрении вопросов взаимодействия и поглощения излучений в веществе, т.е. для оценки вероятности столкновения (и электрического взаимодействия) при пролете частиц через атомы среды.
Атомы, имеющие определенный состав и структуру ядра, называются нуклидами. Индивидуальность нуклида определяется зарядом ядра (числом протонов), Но один и тот же элемент может иметь несколько разновидностей, которые различаются числом нейтронов, следовательно, атомной массой, сохраняя при этом практически одинаковые химические свойства.
Атомы, имеющие ядра с одинаковым числом протонов, но различающиеся по числу нейтронов, относящиеся к разновидностям одного и того же химического элемента, называемым изотопами (isos – одинаковый; topos – место) данного элемента. Такие элементы имеют одинаковый номер в таблице Менделеева, но разное массовое число. Чтобы отличить их друг от друга, к символу элемента приписывают число, равное сумме всех частиц в ядре данного изотопа. Так уран-238 (238U) содержит 92 протона и 146 нейтронов, в уране-235 (235U) тоже 92 протона, но 143 нейтрона.
Каждый отдельный химический элемент может существовать в виде относительно устойчивых ядерных структур – стабильных изотопов, и неустойчивых – радиоактивных изотопов. Стабильность ядра определяется соотношением числа протонов и нейтронов: у большей части стабильных изотопов легких элементов оно составляет 1:1 или близко к этой величине. Но к концу периодической таблицы это соотношение постепенно уменьшается и достигает 1:1,6 (уран), при этом стабильность ядер резко снижается. При недостатке или избытке нейтронов (относительно некоего оптимального для данного элемента соотношения) ядерные структуры оказываются неустойчивыми, что приводит к возникновению радиоактивного распада. Это характерно для радиоактивных элементов, расположенных в конце таблицы Менделеева, образующих радиоактивные семейства (например, семейство 238U, 232Th и др.).
Понятия изотоп и радиоизотоп применимы лишь для обозначения разновидностей атомов одного элемента. Как уже говорилось, если атомы отличаются друг от друга не только массовым числом, но и химическими свойствами, то их называют нуклидами, а в том случае, если они обладают свойствами радиоактивности - радионуклидами. Некоторые нуклиды стабильны, т. е. в отсутствие внешнего воздействия никогда не претерпевают никаких превращений.
Радиоактивный распад происходит самопроизвольно: это внутриядерный процесс, на который обычные физические или химические факторы воздействовать не могут, т.е. не могут задержать или ускорить ход радиоактивных превращений.
Большинство нуклидов нестабильны. В качестве примера возьмем атом урана-238 (92 протона и 146 нейтронов), в ядре которого протоны и нейтроны едва удерживаются вместе силами сцепления. Время от времени из него вырывается компактная группа из четырех частиц: двух протонов и двух нейтронов (ά-частица). Уран-238 превращается, таким образом, в торий-234, в ядре которого содержится 90 протонов и 144 нейтрона. Но торий-234 также нестабилен. Его превращение происходит, однако, не так, как в предыдущем случае: один из его нейтронов превращается в протон, и торий-234 превращается в протактиний-234, в ядре которого содержатся 91 протон и 143 нейтрона. Эта метаморфоза, произошедшая в ядре, сказывается и на движущихся по своим орбитам электронах: один из них становится неспаренным и вылетает из атома.
Протактиний очень нестабилен и ему требуется совсем немного времени на превращение. Далее следуют иные превращения, сопровождаемые излучениями, и вся эта цепочка в конце концов оканчивается появлением атомов нового стабильного химического элемента, нуклида свинца. В конечном счете, схема распада урана-238 выглядит так:
Уран-238 Торий-234 Протактиний-234 Уран-234 Торий-230 Радий-226 Радон-222 Полоний-218 Свинец-214 Висмут-214 Полоний-214 Свинец-210 Висмут-210 Полоний-210 Свинец-206 (стабильный)
Существует много таких цепочек самопроизвольных превращений (распадов) разных нуклидов по разным схемам превращений и их комбинациям. При каждом таком акте распада высвобождается энергия, которая передается дальше в виде излучения.
Итак, радиоактивность – это свойство атомных ядер определенных химических элементов самопроизвольно (без каких-либо внешних воздействий) превращаться в ядра других элементов с испусканием особого рода излучения, называемого радиоактивным. Само явление называется радиоактивным распадом. Таким образом, радиоактивность является исключительно свойством атомного ядра и зависит только от его внутреннего состояния. Нельзя повлиять на течение радиоактивного процесса, не изменив состояние атомного ядра.
На скорость течения радиоактивных превращений не оказывают никакого воздействия изменения температуры и давления, наличие магнитного или электрического полей, вид химического соединения данного радиоактивного элемента и его агрегатное состояние.
Радиоактивные явления, происходящие в природе, называют естественной радиоактивностью; аналогичные процессы, происходящие в искусственно полученных веществах (через соответствующие ядерные реакции) – искусственной радиоактивностью. Это деление весьма условно, так как оба эти вида радиоактивности подчиняются одним и тем же законам.
1.2. Закон радиоактивного распада
Главное свойство радиоактивного вещества - способность к спонтанному распаду. Это означает, что ядра вещества распадаются по случайному, статистическому закону. Невозможно точно определить, сколько времени проживет отдельное ядро, прежде чем оно распадется. Как было отмечено, радиоактивный распад – это свойство атомного ядра, определяющееся только его внутренним состоянием и не зависящее от внешних условий.
При исследовании радиоактивного распада Резерфорд установил опытным путем характер зависимости активности радиоактивных веществ от времени — основной закон радиоактивного распада. Оказалось, что для каждого радиоактивного вещества существует определенный интервал времени, на протяжении которого активность убывает в 2 раза. Этот интервал носит название периода полураспада. Период полураспада Т — это то время, в течение которого распадается половина наличного числа радиоактивных атомов.
Примем, что в начальный момент времени (t = 0) число радиоактивных атомов равно N0. Тогда по истечении периода полураспада это число будет равно N0/2. Спустя еще один такой же интервал времени это число станет равным: 1/2•(N0/2) = N0/4 = N0/22. По истечении времени t = п•Т, т. е. спустя п периодов полураспада Т, радиоактивных атомов останется: N = No•(1 / 2n) или N=No• (2-t/T) - это и есть основной закон радиоактивного полураспада, согласно которому число ядер радиоактивного изотопа уменьшается с течением времени по экспоненциальному закону, приведенному на рис.2: с увеличением числа периодов полураспада число не распавшихся атомов убывает, постепенно приближаясь к нулю.
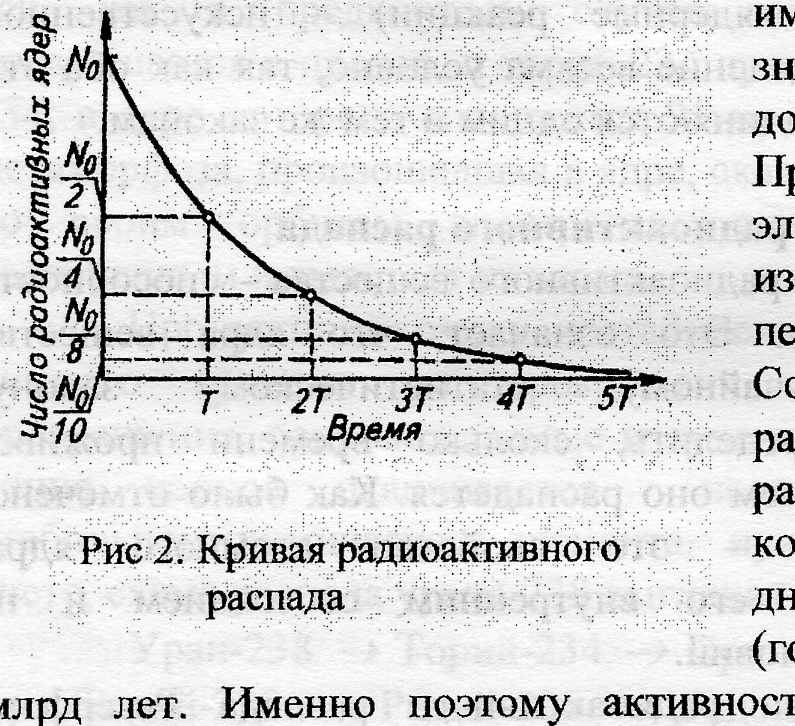
Итак, период полураспада — основная величина, характеризующая скорость радиоактивного распада, т.е. это время, в течение которого распадается половина исходного количества радиоактивных ядер.
Для разных веществ он имеет различающиеся значения от долей секунды до миллиардов лет.
Причем у одного и того же элемента могут быть изотопы с различными периодами полураспада. Соответственно и радиоактивные элементы разделяются на короткоживущие (часы, дни) и долгоживущие (годы). Так, для урана Т=4,5 млрд лет. Именно поэтому активность урана на протяжении отрезка времени в несколько лет заметно не меняется. Для радия Т=1600 лет. Поэтому активность радия значительно больше, чем урана. Чем меньше период полураспада, тем интенсивнее протекает распад. Есть радиоактивные элементы с периодом полураспада в миллионные доли секунды. Период полураспада можно определить, подсчитав число атомов, распавшихся за некоторый промежуток времени, и зная число атомов в начальный момент. Сам закон радиоактивного распада довольно прост. Но физический смысл этого закона представить себе нелегко. Действительно, согласно этому закону за любой интервал времени распадается одна и та же доля имеющихся атомов (за период полураспада — половина атомов). Значит, с течением времени скорость распада нисколько не меняется. Это главное свойство статистического закона радиоактивного распада иногда формулируют в виде утверждения, что радиоактивные ядра не стареют.
Время существования отдельных атомов может колебаться от долей секунды до миллиардов лет. Предсказать, когда произойдет распад данного атома, невозможно. Определенный смысл имеют только утверждения о поведении в среднем большой совокупности атомов. Именно в среднем число атомов, распадающихся за данный интервал времени, определяется законом радиоактивного распада.
Закон радиоактивного распада является статистическим законом. Он справедлив в среднем для большого количества частиц. Для малого числа атомов говорить об определенном законе радиоактивного распада не имеет смысла.
Количество радиоактивного вещества обычно определяется не единицами массы, а активностью данного вещества, которая равна числу распадов в единицу времени. Чем больше радиоактивных превращений испытывают атомы данного препарата в секунду, тем больше его активность. Как следует из закона радиоактивного распада, активность радионуклида пропорциональна числу радиоактивных атомов, т.е. возрастает с увеличением количества данного вещества. Поскольку скорость распада радиоактивных изотопов различна, то одинаковые по массе количества различных радионуклидов имеют разную активность. Единицей активности в системе единиц (СИ) служит распад в секунду (расп/сек). Этой единице присвоено название беккерель (Бк). 1Бк = 1с-1.
Наиболее часто употребляемая внесистемная международная единица - кюри (Ки). Кюри – это такое количество любого радиоактивного вещества, в котором число радиоактивных распадов в секунду равно 3,7 · 1010. Единица кюри соответствует радиоактивности 1г радия.
Кюри – очень большая величина, поэтому обычно употребляют дробные производные единицы: милликюри (1мКи = 10-3Ки), микрокюри (1мкКи=10-6Ки) и т.д. (Приложение, табл. 1,2).
1.3. Виды излучений и их проникающая способность
Радиация — это все виды электромагнитного излучения: свет, радиоволны, энергия солнца и множество иных излучений вокруг нас. Источниками проникающей радиации, создающими природный фон облучения, являются галактическое и солнечное излучение, наличие радиоактивных элементов в почве, воздухе и материалах, используемых в хозяйственной деятельности, а также изотопов, главным образом, калия в тканях живого организма. Одним из наиболее весомых естественных источников радиации является радон – газ, не имеющий вкуса и запаха.
Интерес представляет не любая радиация, а ионизирующая, которая, проходя сквозь ткани и клетки живых организмов, способна передавать им свою энергию, разрывая химические связи внутри молекул и вызывая серьезные изменения в их структуре.
Ионизирующее излучение возникает при радиоактивном распаде, ядерных превращениях, торможении заряженных частиц в веществе и образует при взаимодействии со средой ионы разных знаков.
Таблица 2
Основные виды радиоактивных излучений
| Вид излучения | Название частиц | Масса покоя, а.е.м. | Заряд |
| Электромагнитное излучение | |||
| γ, фотонное | Фотон | 0 | 0 |
| Корпускулярное излучение | |||
| α | α-частица | 4 | +2 |
| β- | Электрон | 0,000548 | -1 |
| β+ | Позитрон | 0,000548 | +1 |
| Нейтронное | Нейтрон | 1 | 0 |
| Нейтринное | Нейтрино | Близка к нулю | 0 |
| | Антинейтрино | Близка к нулю | 0 |
Ионизирующие излучения получили свое название благодаря способности вызывать ионизацию атомов и молекул в облучаемом веществе (образование положительных и отрицательных ионов и свободных электронов из электрически нейтральных атомов и молекул). По своей природе ионизирующие излучения подразделяются на электромагнитные и корпускулярные (табл. 2).
1.3.1. Электромагнитные (фотонные) излучения.
К электромагнитным излучениям относятся:
- рентгеновское излучение;
- γ-излучения радиоактивных элементов;
- видимый свет и радиоволны.
Рентгеновское излучение - электромагнитное излучение, занимающее спектральную область между ультрафиолетовым излучением и гамма-излучением, в пределах длин волн от 10-12 до 10-15см. Различают жесткое рентгеновское излучение (с длиной волны до 2нм; 1нм=10-9м) и мягкое. Жесткое излучение проникает через различные материалы и мягкие ткани человеческого тела (это свойство рентгеновского излучения (Х-лучи) нашло применение в медицине).
Гамма-излучение - коротковолновое электромагнитное излучение с длиной волны менее 0,01нм. На шкале электромагнитных волн оно граничит с жёстким рентгеновским излучением, занимая область более высоких частот. Гамма-излучение обладает чрезвычайно малой длиной волны (менее 0.05нм.) и вследствие этого ярко выраженными корпускулярными свойствами, т. е. ведёт себя подобно потоку частиц - гамма-квантов, или фотонов. Гамма-излучение испускается возбужденными атомными ядрами при ядерных реакциях, радиоактивных превращениях атомных ядер, при аннигиляции (превращении при столкновении частицы и античастицы в другие частицы) электрона и позитрона и при других превращениях элементарных частиц.
Фотон – носитель электромагнитного излучения – является в одинаковой мере и квантом энергии, проявляющим волновые свойства, и частицей (корпускулой). Фотоны могут существовать только в движении, их масса покоя равна нулю, но это не значит, что они вообще не имеют массы. Так, при энергии гамма-излучения в 1МэВ масса фотона составляет 1/940 (0,001 а.е.м.).
Видимый свет и радиоволны – тоже электромагнитные излучения, но они не ионизируют, т.к. характеризуются большей длиной волны и соответственно меньшей энергией.
1.3.2. Корпускулярные излучения
Корпускулярное излучение состоит как из заряженных, так и из нейтральных частиц с массой отличной от нуля (табл.2):
- альфа – частицы;
- бета – частицы;
- космическое излучении;
- нейтроны;
- продукты деления, содержащиеся в радиоактивных отходах переработанного топлива ядерных реакторов;
- протоны, ионы, в основном получающиеся на ускорителях.
Космическое излучение, в состав которого входят преимущественно протоны и ядра гелия. Проникая вглубь атмосферы, космическое излучение взаимодействует с ядрами, входящими в состав атмосферы, и образует потоки вторичных частиц (мезоны, гамма-кванты, нейтроны и др.).
Нейтрино и антинейтрино, образующиеся при β-распаде – частицы очень малого размера и чрезвычайно высокой проникающей способности в силу того, что они из-за своего малого размера крайне редко взаимодействуют с веществом, хотя и уносят с собой значительную часть энергии радиоактивного распада (эти частицы свободно проходят сквозь Землю и Солнце).
Нейтронное излучение. Нейтроны - единственные незаряженные частицы, образующиеся при некоторых реакциях деления ядер атомов урана или плутония. Поскольку эти частицы электронейтральны, они глубоко проникают во всякое вещество, включая живые ткани, и теряют свою энергию практически только при соударении с ядрами атомов. Отличительной особенностью нейтронного излучения является его способность превращать атомы стабильных элементов в их радиоактивные изотопы, т.е. создавать наведенную радиацию, что резко повышает опасность нейтронного излучения. Проникающая способность нейтронов сравнима с гамма-излучением. В зависимости от уровня носимой энергии условно различают нейтроны быстрые (обладающие энергией от 0,2 до 20МэВ) и тепловые (от 0,25 до 0,5МэВ). Это различие учитывается при проведении защитных мероприятий. Быстрые нейтроны замедляются, теряя энергию ионизации, веществами с малым атомным весом (так называемыми водородсодержащими: парафин, вода, пластмассы и др.). Тепловые нейтроны поглощаются материалами, содержащими бор и кадмий.
Альфа-излучение: α-частицы — состоят из двух протонов и двух нейтронов; это положительно заряженные ядра атомов гелия, испускаемые при радиоактивном распаде изотопов тяжелых элементов — урана или радия. Они обладают малой проникающей способностью (пробег в воздухе - не более 10см), даже человеческая кожа является для них непреодолимым препятствием. В биотканях пробег α-частицы редко превышает 40-60мкм, т.е. действие ее обычно ограничено размерами одной клетки. Опасны они лишь при попадании внутрь организма, так как способны выбивать электроны из оболочки нейтрального атома любого вещества, в том числе и тела человека, и превращать его в положительно заряженный ион со всеми вытекающими последствиями.
Бета-излучение: β-частицы — отрицательно заряженные электроны и положительно заряженные позитроны, испускаемые во время радиоактивного распада ядерных элементов с промежуточной ионизирующей и проникающей способностью. β-частица намного легче, чем α-частица поэтому, чтобы потерять ту же энергию, ей потребуется переместиться на большее расстояние, чем α-частица. Пробег β-частицы в воздухе достигает 10м и более, но в плотных слоях невелик, всего несколько миллиметров. Поэтому в случае радионуклидного загрязнения β-излучение не представляет серьезной опасности при внешнем облучении от поверхности земли. Даже небольшого перемещения нуклидов с поверхности земли в глубь почвы оказывается достаточно для поглощения β-излучения почвой.
1.4. Особенности взаимодействия ионизирующих излучений с веществом
Как уже было сказано, негативное воздействие на организмы связано со способностью высокоэнергетических частиц излучения выбивать электроны из атомов живой материи (вызывать ионизацию) или переводить электроны в возбужденное состояние.
Обнаружение и регистрация всех видов ядерных излучений, выбор материала для защиты от них, оценка биологического действия излучений на организмы возможны при понимании того, каким образом различные по природе излучения (альфа-, бета-частицы, гамма-кванты, нейтроны и т. д.) взаимодействуют с веществом.
Если, приложив соответствующую энергию, один или несколько электронов оторвать от электронной оболочки, произойдет ионизация атома. Если под действием приложенной энергии электрон переходит на другую орбиту, более удаленную от ядра, но не покидает атом, - происходит возбуждение атома. Этот переход сопровождается поглощением энергии. Переход электрона на более низкий уровень сопровождается испусканием энергии. Величина поглощенной или испускаемой энергии строго определенная: она равна разности энергий начального и конечного энергетических уровней.
Существует, как уже упоминалось, два вида ионизирующих излучений – электромагнитные и корпускулярные, физическая природа этих излучений различна и определяет особенности их взаимодействия с веществом.
1.4.1 Корпускулярные излучения.
Механизм передачи энергии от всех заряженных частиц в объекте характеризуется тем, что при прохождении через вещество заряженная частица теряет свою энергию, вызывая ионизацию и возбуждение атомов до тех пор, пока общий запас ее энергии не уменьшится настолько, что частица утратит ионизирующую способность.
В зависимости от знака заряда при пролете в веществе частица, испытывая электростатическое взаимодействие, притягивается или отталкивается от положительно заряженных ядер. Чем больше масса летящей частицы, тем меньше она отклоняется от первоначального направления. Поэтому траектория протонов и более тяжелых ядерных частиц практически прямолинейна, а траектория электронов сильно изломана в результате рассеяния на орбитальных электронах и ядрах атомов.
При взаимодействии заряженных частиц с веществом выделяют упругое и неупругое взаимодействие. При упругом взаимодействии (упругое столкновение) суммарная кинетическая энергия частиц до взаимодействия равна суммарной кинетической энергии после их взаимодействия. Следствие такого взаимодействия — лишь изменение направления движения частиц.
Неупругое взаимодействие (неупругое столкновение) — это процесс, при котором часть кинетической энергии частиц расходуется на ионизацию и возбуждение атомов, возбуждение ядер, расщепление ядер или тормозное излучение. При таком взаимодействии суммарная кинетическая энергия частиц до взаимодействия будет равна суммарной кинетической энергии частиц после взаимодействия плюс энергия, затраченная на ионизацию и возбуждение атомов, возбуждение и расщепление ядер (тормозное излучение). Неупругое взаимодействие наблюдается при прохождении электрона очень высокой энергии вблизи ядра. При этом скорость летящего электрона снижается, и часть его энергии испускается в виде фотона электромагнитного (тормозного) излучения
1.4.1.1 Основные эффекты взаимодействия альфа-излучения с веществом.
Альфа-излучение – представляет собой поток тяжелых частиц, представляющих собой ядро атома гелия (4He), состоящих из двух протонов и двух нейтронов, обладающих положительным зарядом (+2), суммарная масса которых (4а.е.м.) значительно больше массы электрона (0,000548а.е.м.). Это излучение задерживается даже листом бумаги и практически не способно проникнуть через наружный слой кожи. Поэтому оно не представляет опасности при внешнем облучении, т.е. до тех пор, пока альфа-частицы не попадут внутрь организма через открытую рану, с пищей или с вдыханием воздуха. В этом случае они становятся очень опасными.
При взаимодействия альфа-излучения с веществом возможны следующие ситуации:
1. Упругое рассеяние частиц на атомных ядрах. Поскольку алфа-частица несет положительный заряд, то при взаимодействии с ядром возникают кулоновские силы и частица отталкивается, изменяя направление своего движения.
2. Неупругое взаимодействие альфа-частиц с орбитальными электронами:
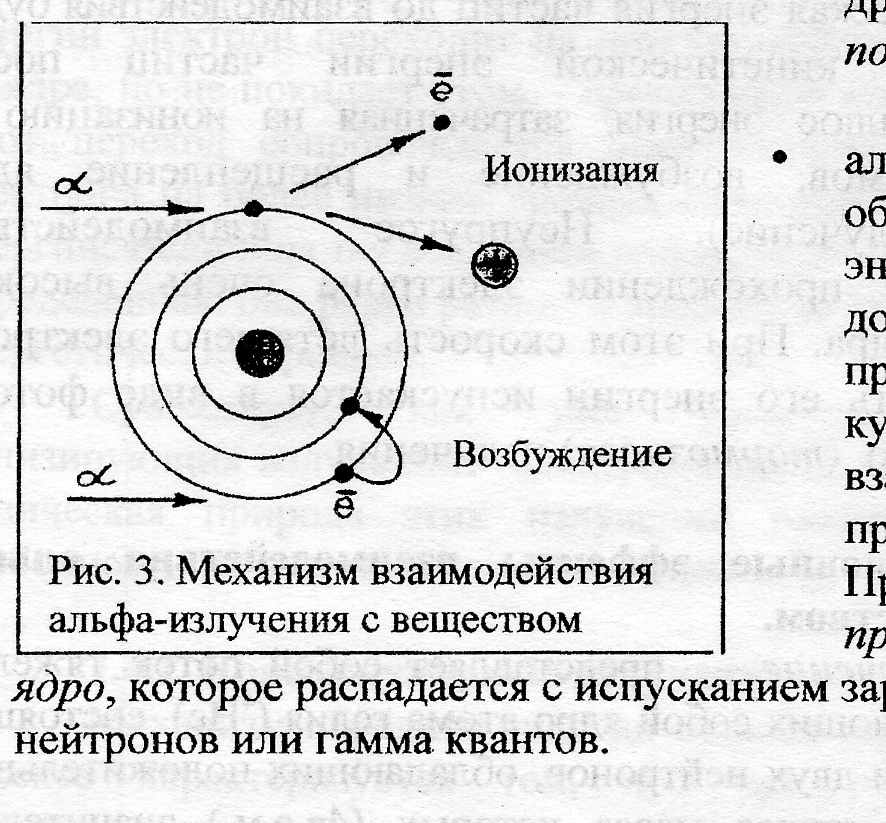
- ионизация нейтральных атомов (рис.3), при которой образуется свободный электрон и положительно заряженный ион;
- возбуждение электронов атомных оболочек (рис.3), при котором орбитальные электроны, получая дополнительную энергию, переходят в возбужденное состояние, переходя на другую орбиту, но не покидают атом.
- альфа-частица, обладающая энергией, достаточной для преодоления кулоновских сил взаимодействия, проникает в ядро. При этом образуется промежуточное ядро, которое распадается с испусканием заряженных частиц, нейтронов или гамма квантов.
1.4.1.2 Основные эффекты взаимодействия бета-излучения с веществом.
Бета-излучение – поток частиц, имеющих отрицательно заряженные электроны и положительно заряженные позитроны. Для большинства природных и искусственных радионуклидов характерен электронный или отрицательный (β-) распад. Значительно реже встречается позитронный (β+) распад, свойственный отдельным искусственным радионуклидам. При их взаимодействии с веществом тоже наблюдаются все варианты взаимодействия.
1. Упругое взаимодействие бета-частиц с атомными ядрами наблюдается в результате притяжения бета-частиц (β-) к положительно заряженным ядрам атомов. Следствие такого взаимодействия — изменение направления движения частиц. Основную роль в рассеянии электронов играет упругое рассеяние на атомных ядрах, хотя электроны рассеиваются и на электронах атомных оболочек.
2. Неупругое рассеяние бета-частиц:
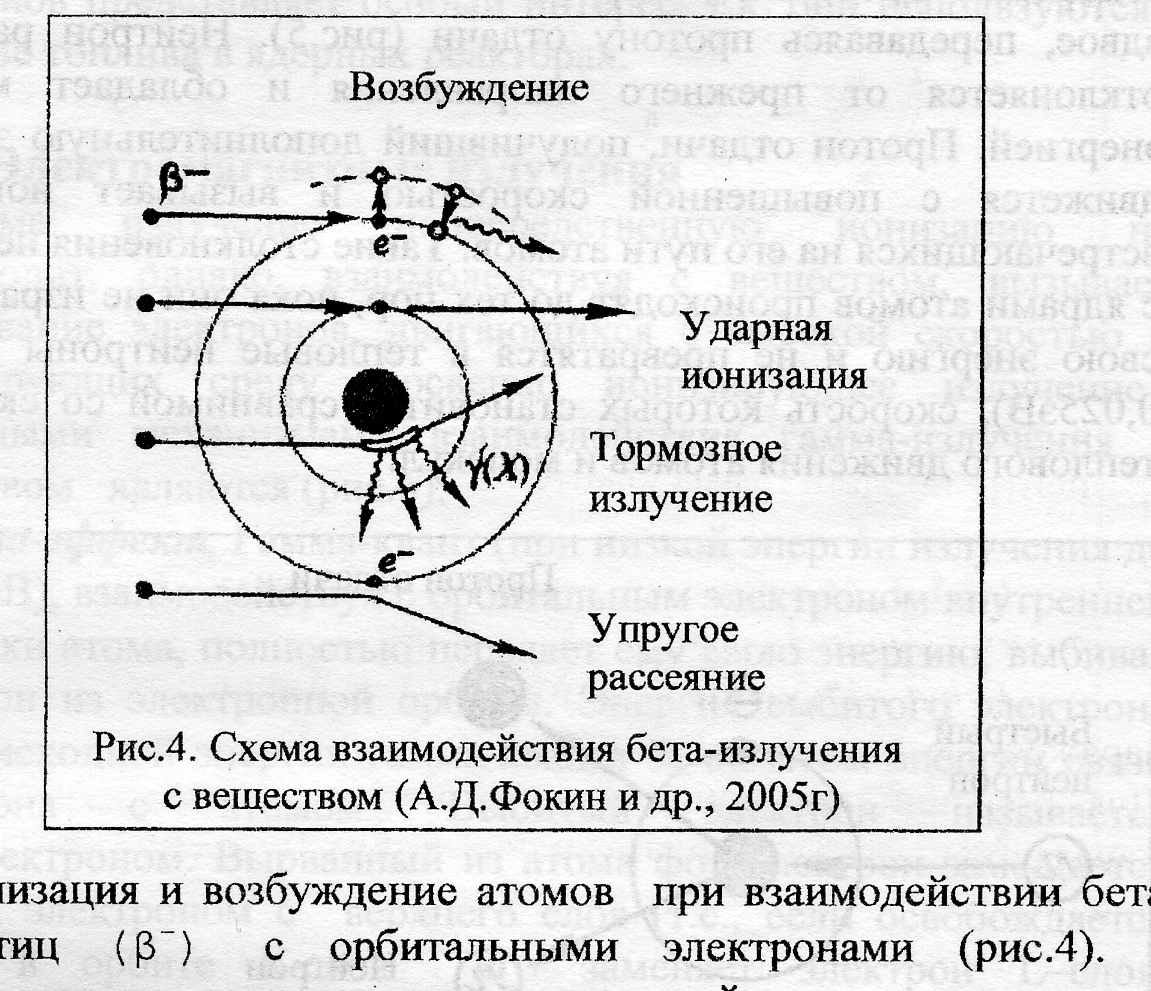
- Рассеяние бета-частиц на атомных ядрах: наблюдается, если бета-частица (β-) имеет высокую энергию, а поглотителем служит материал большой плотности (имеет большой атомный номер), при этом бета-частица тормозится в электрическом поле ядра и теряет часть своей энергии. В результате возникает тормозное излучение. Интенсивность тормозного излучения определяется энергией бета-частиц и атомным номером вещества-поглотителя. В практике такой вариант взаимодействия используют для получения рентгеновского излучения в рентгеновской трубке (рис.4).
- Ионизация и возбуждение атомов при взаимодействии бета-частиц (β-) с орбитальными электронами (рис.4). В зависимости от количества переданной энергии происходит возбуждение или ионизация атомов вещества. В этом и другом случае воздействующий электрон теряет свою энергию. Чтобы описать интенсивность процесса ионизации применяется термин удельная ионизация – число пар ионов, образуемых ионизирующей частицей на единицу длины пробега.
1.4.1.3. Взаимодействие нейтронов с веществом
Нейтроны не имеют заряда, что позволяет им беспрепятственно проникать в глубь атомов, в атомные ядра. При этом возможно упругое и неупругое рассеяние нейтронов на ядрах. Их масса (1а.е.м.) много больше массы электронов (0,000548а.е.м.), поэтому они теряют свою энергию практически только при соударении с ядрами атомов. Достигая ядер, они либо поглощаются ими, либо рассеиваются на них. При упругом рассеянии на ядрах углерода, азота, кислорода и других элементов, входящих в состав тканей, нейтрон теряет лишь 10-15% энергии, а при столкновении с почти равными с ним по массе ядрами водорода – протонами, энергия нейтрона уменьшается в среднем вдвое, передаваясь протону отдачи (рис.5). Нейтрон рассеяния отклоняется от прежнего направления и обладает меньшей энергией. Протон отдачи, получивший дополнительную энергию, движется с повышенной скоростью и вызывает ионизацию встречающихся на его пути атомов. Такие столкновения нейтронов с ядрами атомов происходят до тех пор, пока они не израсходуют свою энергию и не превратятся в тепловые нейтроны (энергия 0,025эВ), скорость которых становится сравнимой со скоростью теплового движения атомов и молекул.
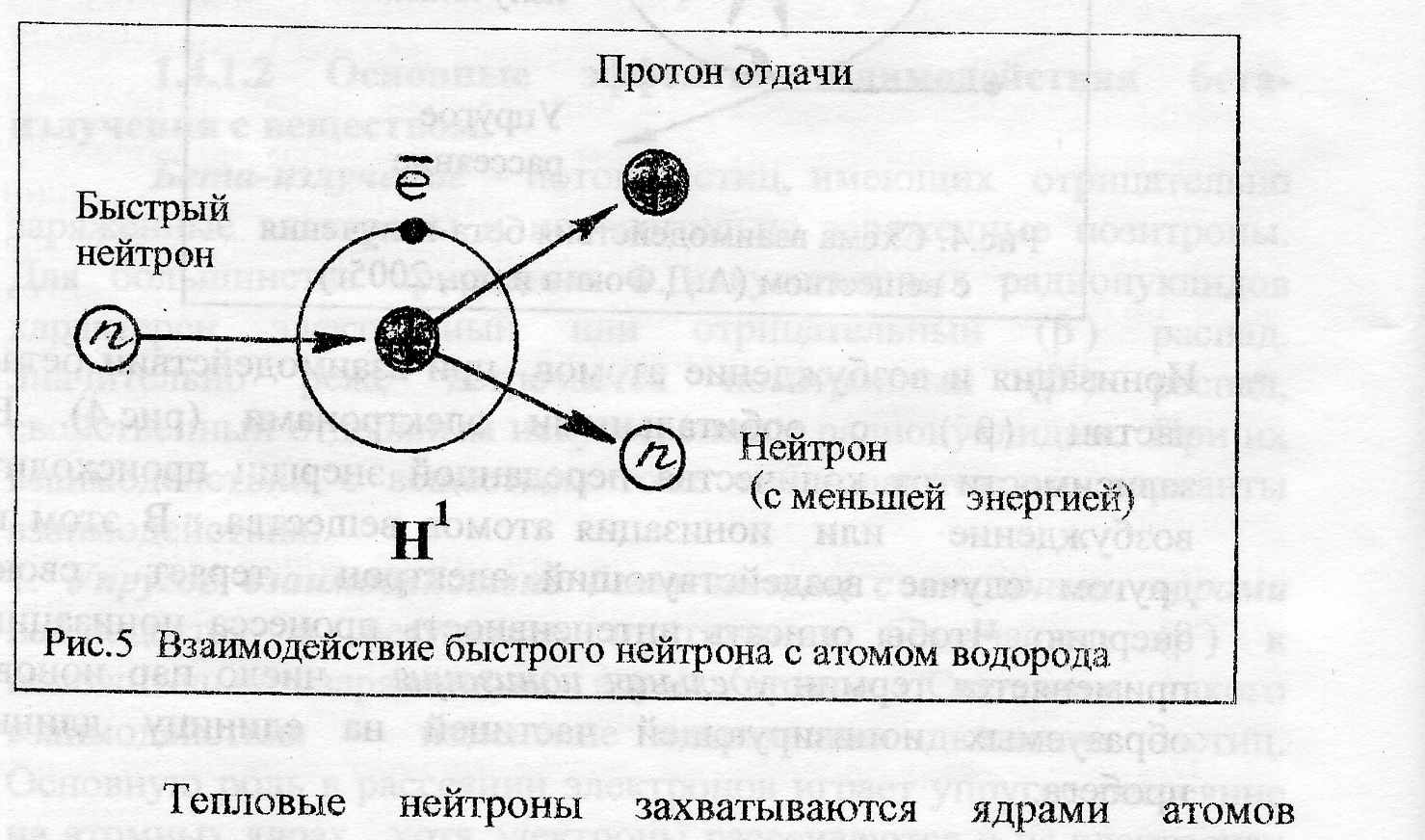
Тепловые нейтроны захватываются ядрами атомов элементов, увеличивая его массовое число на единицу (например 235U превращается в 236U), при этом ядро становится возбужденным, энергетически неустойчивым. Переход возбужденного ядра на более низкие энергетические уровни сопровождается испусканием гамма-квантов (наведенная радиоактивность). Образовавшиеся гамма-кванты вызывают ионизацию. Захват медленного нейтрона (энергия менее 1 кэВ) ядрами урана-233, 235 и плутония-239 вызывает деление ядер на два и более осколков, которые представляют собой ядра радионуклидов, находящихся в средней части Периодической таблицы от номера 30 (цинк) до 65 (тербий).
Процесс деления изотопов урана 238U и 235U под действием нейтронов представляет особый интерес, т.к. они используются в качестве топлива в ядерных реакторах.
1.4.2. Электромагнитные излучения
Гамма излучение непосредственную ионизацию не производит, однако, взаимодействуя с веществом, вызывает образование электронов, двигающихся с высокой скоростью и ионизирующих среду (косвенно ионизирующее излучение). Основными механизмами взаимодействия гамма-излучения с веществом являются (рис.6):
- Фото-эффект. Гамма-квант (при низкой энергии излучения до 0,05МэВ), взаимодействуя с орбитальным электроном внутренней оболочки атома, полностью передает ему свою энергию, выбивая электрон из электронной орбиты. Энергия выбитого электрона равна исходной энергии гамма-кванта за вычетом энергии связи электрона с атомом. Выбитый электрон называется фотоэлектроном. Вырванный из атома фотоэлектрон замещается другим электроном с верхнего слоя (т.е., если освобождается место в орбите К-слоя его заменяет электрон L–слоя, освободившееся место L–слоя замещается электроном с М-слоя и т.д.). Это явление сопровождается испусканием рентгеновского (Х) излучения (рис.6) и дополнительного электрона с малой энергией и малым пробегом (электрон Оже). Вероятность фотоэлектрического эффекта увеличивается с возрастанием атомного номера элемента.
2. Эффект Комптона или комптоновское рассеяние.
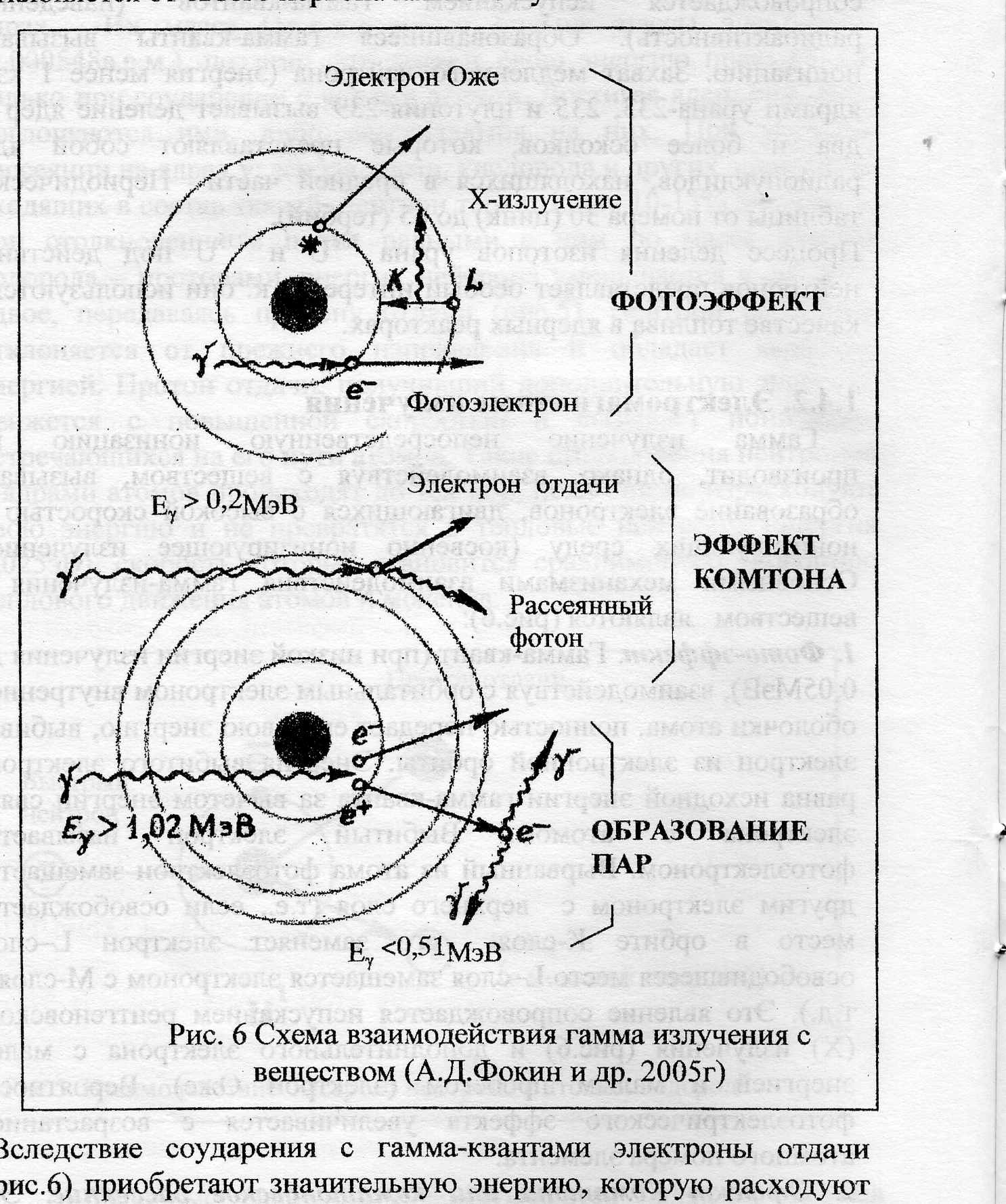
Это эффект упругого столкновения гамма-фотонов со слабо связанными орбитальными электронами. Он состоит в том, что гамма-квант (при средних энергиях облучения более 0,2МэВ) передает орбитальному электрону только лишь часть своей энергии, превращается в гамма-квант с меньшей энергией и отклоняется от своего первоначального пути.
Вследствие соударения с гамма-квантами электроны отдачи (рис.6) приобретают значительную энергию, которую расходуют на ионизацию вещества (вторичная ионизация).
3. Образование электрон-позитронных пар. Это явление наблюдается при прохождении гамма-фотона на очень близком расстоянии от ядра и при условии, что энергия фотона превышает величину 1,02МэВ. При этих условия некоторые гамма-кванты, проходя через вещество, превращаются под действием сильного электрического поля вблизи ядра в пару «электрон ē –позитрон е+». Образовавшиеся частицы расходуют свою энергию на ионизацию и возбуждение атомов среды, т.е. вызывают вторичную ионизацию в веществе (рис.6.). При этом позитрон, встречая на своем пути электрон, соединяется с ним, в результате чего образуются два фотона, но
уже с энергией 0,51МэВ (явление аннигиляции).
Ядерный эффект. Этот эффект бывает крайне редко и состоит в том, что при высоких энергиях гамма-квантов (8МэВ и более) они взаимодействуют с ядрами атомов облучаемого вещества, при этом происходит выбивание из ядра протона, и оно становится радиоактивным (ядерный эффект).
ВОПРОСЫ
- Какие элементарные частицы входят в состав атома?
- Почему отрицательно заряженные электроны с оболочки атома не поглощаются положительно заряженным ядром?
- Чем вызвана неустойчивость ядерных структур радиоактивных изотопов?
- Что такое явление изотопии?
- Перечислите все виды радиоактивных излучений
- Что такое естественная и искусственная радиоактивность?
- В чем практическое значение закона радиоактивного распада?
- Почему обычные физические и химические воздействия не оказывают влияния на скорость течения радиоактивных процессов?
- Можно ли ускорить или замедлить процесс распада радиоактивных атомов?
- Что такое «ионизирующее излучение» и «ионизация»?
- Почему одни виды электромагнитного излучения опасны для человека, а другие нет?
- В чем причина различных проникающих способностей альфа- и бета-частиц?
- В чем особенности ионизирующего действия гамма-излучения?
- Что означает «активность препарата» и от чего она зависит?
- Что такое наведенная радиоактивность, где и в каких случаях она может проявляться?
- Почему количество радиоактивного вещества определяют в единицах активности, а не массы?
- Какие эффекты возникают при взаимодействии корпускулярных и электромагнитных излучений с веществом?
