Обучающе-развивающие тесты для школьников в увязке с разделами учебной программы по химии Москва 2009 г
| Вид материала | Тесты |
СодержаниеПолный необратимый гидролиз Тип гибридизации Основные классы органических соединений и соответствующие функциональные группы |
- Методические рекомендации по содержательному и организационно-методическому обеспечению, 450.09kb.
- Программа «Специальная химия» (элективный курс по выбору профильной подготовки для, 68.39kb.
- Методические рекомендации по разработке заданий для школьного этапаВсероссийской олимпиады, 450.39kb.
- Центра Федерации Интернет-образования Морев И. А. М 79 Образовательные информационные, 2884.31kb.
- Юрова Галина Юрьевна учитель химии. Объём различных форм учебной работы: Всего занятий, 85.83kb.
- Анализ районных олимпиадных работ по химии 2009 2010 учебного год, 22.03kb.
- Образовательные программы теория и методика преподавания химии и биологии 2009/10 учебный, 918.31kb.
- Приказ от 2009 г № «Рабочая программа по музыке для 1-7 класса» (программа составлена, 1359.77kb.
- Методические рекомендации по разработке заданий для школьного и муниципального этапов, 455.04kb.
- Методические рекомендации по разработке заданий для школьного и муниципального этапов, 300.53kb.
Департамент образования города Москвы
Некоммерческая организация «Ассоциация московских вузов»
Государственное образовательное учреждение высшего профессионального образования
Московский государственный институт электронной техники (технический университет)
Полное название вуза
Научно-образовательный материал
Обучающе-развивающие тесты для школьников в увязке с разделами учебной программы по химии
Москва 2009 г.
Комплект учебно-методических материалов.
Фрагмент лекции, раздел: «Гидролиз солей».
Гидролиз соли – это взаимодействие ионов соли с водой, ведущее к изменению рН раствора. Гидролиз является процессом, обратным реакции нейтрализации. Так как соли сильные электролиты и находятся в водном растворе в виде ионов, то реакции гидролиза следует записывать в форме сокращенных молекулярно-ионных уравнений.
Любую соль можно рассматривать как продукт взаимодействия двух компонентов – основания и кислоты, слабых или сильных. Гидролизу подвергаются соли, образованные одним слабым компонентом – другим сильным, или двумя слабы ми. Соль, образованная двумя сильными компонентами, например, NaCl гидролизу не подвергается (рН =7).
| | Компоненты | |
| Сильные | Слабые | |
| Кислоты | HCl, H2SO4, HNO3, HClO4 и др. | HCN, CH3COOH, HNO2,H2S, и др. |
| Основания | KOH, NaOH, Ca(OH)2 Ba(OH)2, | NH4OH, Zn(OH)2, Al(OH)3 и др. |
Рассмотрим ступенчатый гидролиз солей, слабый компонент у которых или многоосновная кислота (H2S) или многокислотное основание Zn(OH)2.
- K2S – соль образована сильным основанием и слабой многоосновной кислотой (гидролиз по аниону).
( Соль образована KOH + Н2S ). Слабый компонент подчеркнем. По 1-й ступени из него образуется кислая соль; сильный компонент (КОН) появится в продуктах реакции и будет определять рН раствора:
I ступень. С водой (с одной молекулой Н2О) взаимодействуют ионы слабой кислоты – сульфид-ионы:
S‾2 + HOН OH‾ + HS‾
рН >7
K2S + HOН KOH + KHS
II ступень. С водой взаимодействуют ионы слабой кислоты HS‾:
HS‾ + HOН OH‾ + H2S идет ничтожно мало!
KHS + HOН KOH + H2S
2. ZnCl2 – соль, образованная слабым многокислотным основанием и сильной кислотой (гидролиз по катиону)
(Соль образована Zn(OH)2 + HCl ) По 1-й ступени из слабого двухосновного основания образуется основная соль; сильный компонент (HCl) появится в продуктах реакции и будет определять рН раствора:
I ступень.
Zn+2 + HOН ZnOH+ + H+ (рН<7)
ZnCl2 + HOН (ZnOH)Cl + HCl
II ступень:
ZnOH+ + HOН Zn(OH)2 + H+ II ступень – идет ничтожно мало !
(ZnOH)Cl + HOН Zn(OH)2 + HCl
3. ( NH4)2S – соль, образованная слабым основанием и слабой многоосновной кислотой (гидролиз по катиону и по аниону)
(Соль образована NH4OH + H2S ). По первой ступени образуется кислая соль и слабое однокислотное основание NH4OH. Гидролиз идет почти необратимо и II ступень практически не идет. О значении рН можно судить по величинам констант диссоциации кислоты HS‾ и основания NH4OH. , K(NH4OH) намного порядков больше K(HS‾) . Поэтому среда будет слабо щелочной, рН >7.
I ступень:
NH4+ + S2‾ + HOН = HS‾ + NH4OH
K(HS‾) = 1,2∙10‾15, K(NH4OH) = 1,79∙10‾5
( NH4)2S + HOН = NH4HS + NH4OH
Полный необратимый гидролиз
Соли Al2S3, Cr2S3 , Al2(CO3)3, Cr2(CO3)3, Fe2(CO3)3 – в воде существовать не могут, т.к. подвергаются полному гидролизу:
2AlCl3 + 3Na2CO3 +6Н2О 2Al(OH)3 + 3H2CO3
3H2O +3CO2
Образец обучающего теста
Тема: Электролитическая диссоциация. Гидролиз. рН.
Вариант 1
1.Угольная кислота Н2CО3 по первой ступени диссоциирует на ионы:
1) H+ + CO32–; 2) H+ + HCO3–; 3) 2H+ + HCO3–; 4) H+ + CO3–.
Решение. Кислота Н2CО3 является двухосновной, поэтому ее диссоциация будет происходить по двум ступеням:
первая ступень: Н2CО3 H+ + HCO3–
вторая ступень: HCO3– H+ + CO32–
Правильный ответ: 2)
2. Сокращенное ионное уравнение реакции взаимодействия амфотерного электролита гидроксида цинка Zn(OH)2 с кислотой HCl :
1) Zn(OH)2 + 2OH– = [Zn(OH)4]2– ; 2) Zn(OH)2 + 4OH– = [Zn(OH)4]2–;
3) Zn(OH)2 +2H+ = Zn2+ + 2H2O; 4) Zn(OH)2 +HCl=ZnCl2 + 2H2O.
Решение. Гидроксид цинка можно рассматривать как основание (Zn(OH)2) и как кислоту ( H2ZnO2 ):
Zn(OH)2 ≡ H2ZnO2
гидроксид цинковая
цинка кислота
При взаимодействии с кислотой он ведет себя как основание:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
или в сокращенном ионном виде:
Zn(OH)2 +2H+ = Zn2+ + 2H2O;
Правильный ответ: 3).
3. Укажите, какая из перечисленных реакций возможна в водном растворе:
- хлорид алюминия + сульфат натрия
- гидроксид калия + нитрат натрия
- гидроксид хрома + гидроксид калия
- нитрат меди (II) + хлорид кальция
Решение. Реакция идет до конца при условии: образуется осадок, выделяется газ, образуется слабый электролит (или вода).
Из приведенных реакций в растворе возможна только 3), т.к. результатом этой реакции является образование слабодиссоциирующего комплексного иона
Cr(OH)3 + 3KOH = K3[Cr(OH)6] или в сокращенном ионном виде:
Cr(OH)3 + 3OH– = [Cr(OH)6]3–.
Правильный ответ: 3).
4.Укажите, молекула какого вещества при диссоциации по первой ступени образует катион с зарядом +1:
- гидроксид железа (III);
- сульфат гидроксоалюминия;
- хлорид кальция;
- сульфaт магния.
Решение. Рассмотрим уравнения диссоциации указанных четырех соединений:
Fe(OH)3 Fe(OH)2+ + OH–
AlOHSO4 AlOH 2+ + SO42–
CaCl2 Ca2+ + 2Cl–
MgSO4 Mg2+ + SO42–
Из приведенных уравнений видно, что только в случае диссоциации Fe(OH)3 по первой ступени образуется частица с зарядом +1, а именно Fe(OH)2+.
Правильный ответ: 1).
5. Вычислите концентрацию ионов H+ (в моль/л) и рН в 0,1 М растворе NaOH:
1) [H+] = 10–1; рН = 1 ; 2) [H+] = 10–2; рН = 2 ;
3) [H+] = 10–7; рН = 7 ; 4) [H+] = 10–13; рН = 13.
Решение. Гидроксид натрия полностью диссоциирует:
NaOH = Na+ + OH–; концентрация [OH–] = 0,1 моль/л = 10–1 моль/л;
рОН = –lg[ОH–] = – lg 10–1 = 1; рН + рОН = 14;
рН = 14 –1 = 13; [H+] = 10–13 моль/л.
Правильный ответ: 4).
6. Определите концентрацию ионов водорода в 0,02 М растворе муравьиной кислоты НСООН, если константа диссоциации ее равна Кдис.= 2·10–4.
1) 4·10–1 ; 2) 4·10–2 ; 3) 4·10–5 ; 4) 4·10–4.
Решение. Зная концентрацию раствора кислоты (0,02 М) и константу ее диссоциации (Кдис.), степень диссоциации определим по закону разбавления Оствальда для слабых электролитов:
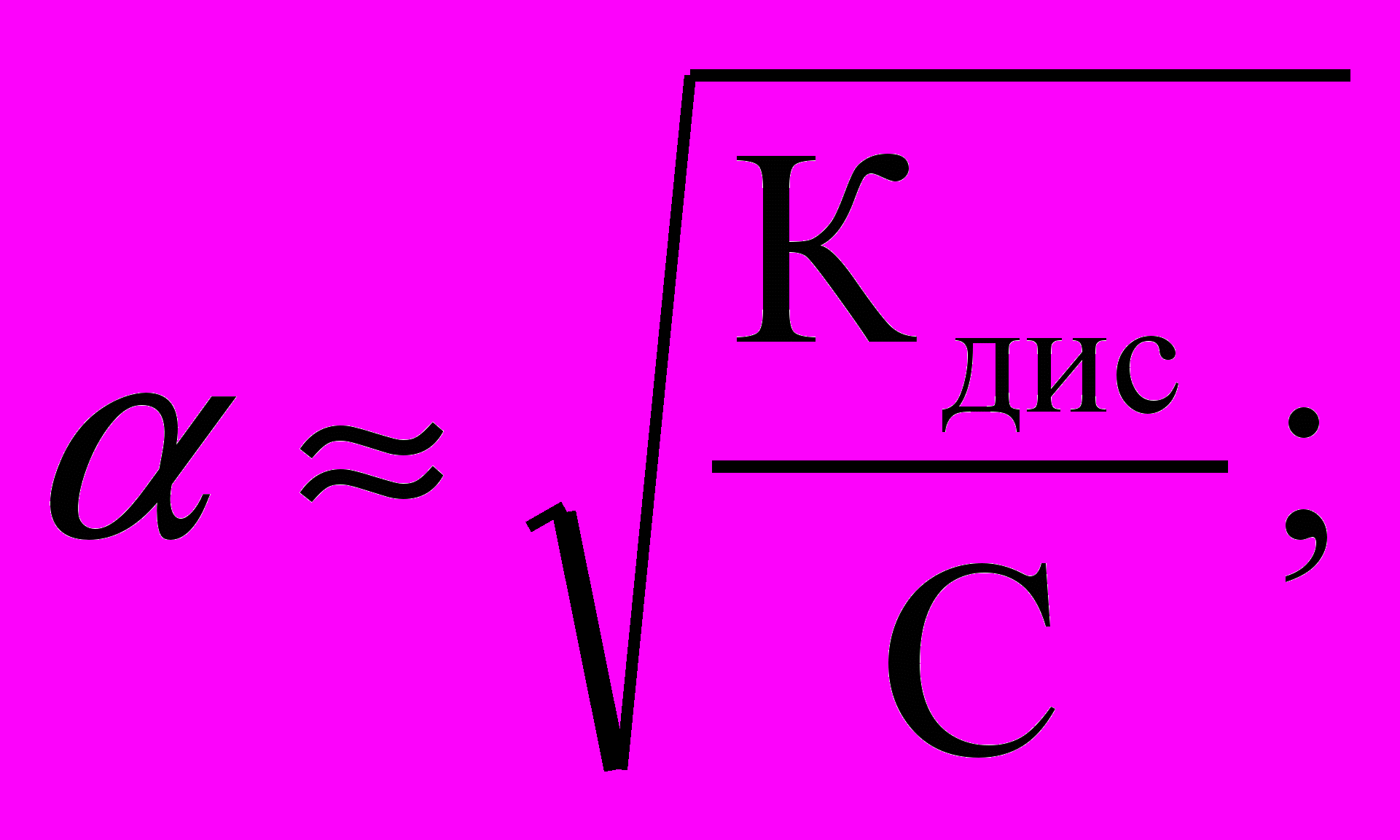
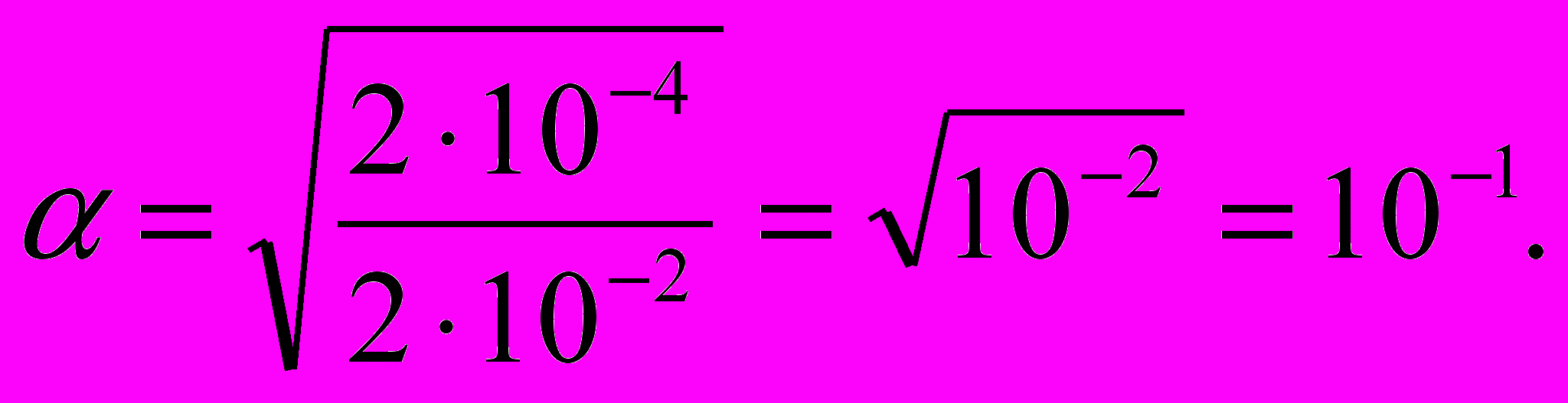 ; [H+] = Скис.· α= 0.02·0,1=2·10–3моль/л.
; [H+] = Скис.· α= 0.02·0,1=2·10–3моль/л.Концентрация ионов водорода будет равна Скис (0,02 М) α:
[Н+] = 0,02 · 2·10–3 = 4·10–5 моль/л.
Правильный ответ: 3).
7. Константа диссоциации гидроксида аммония NН4ОН имеет вид:
1)
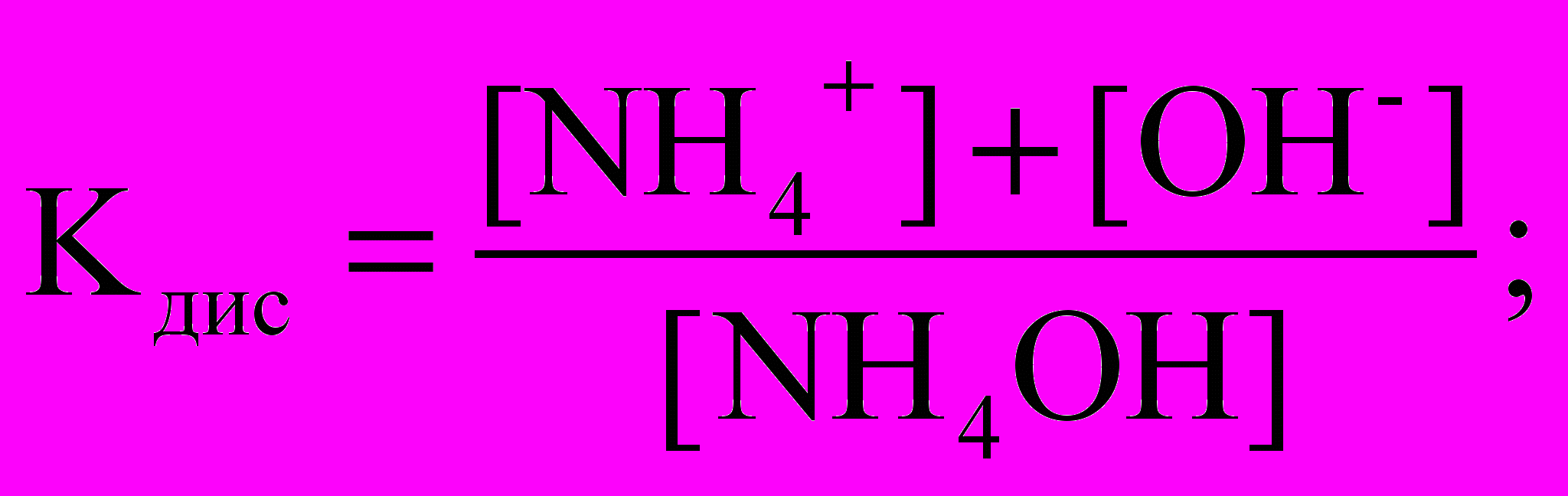 ; 2)
; 2) 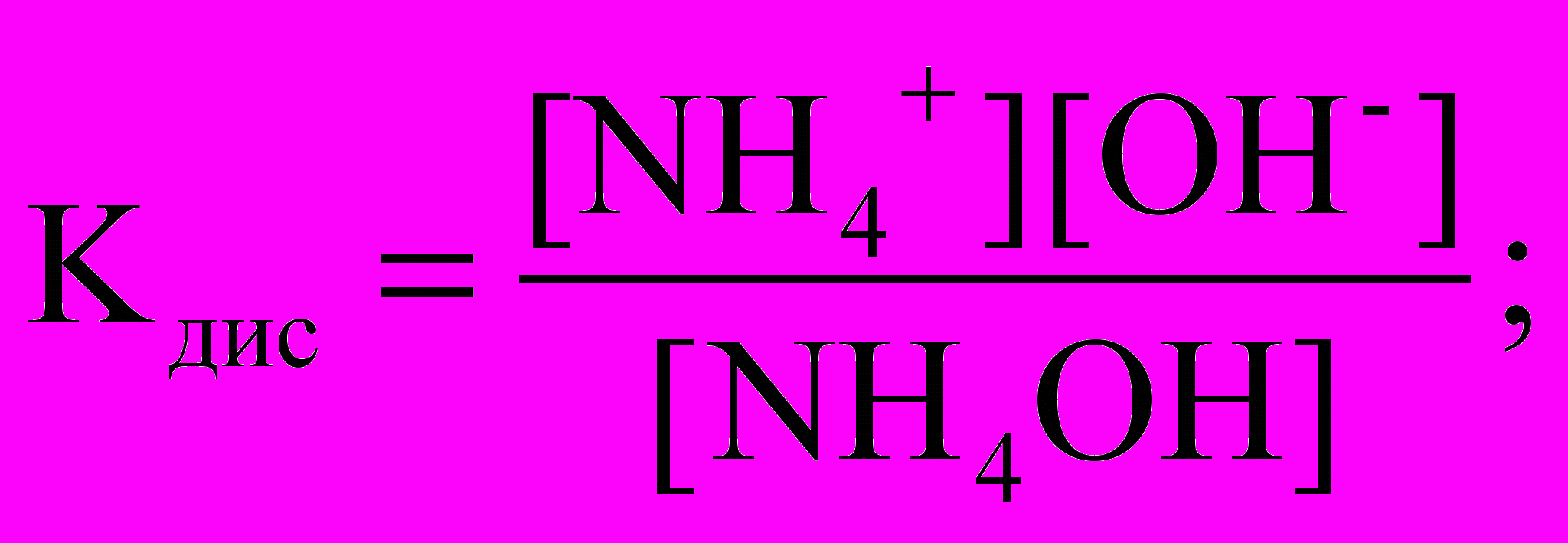
3)
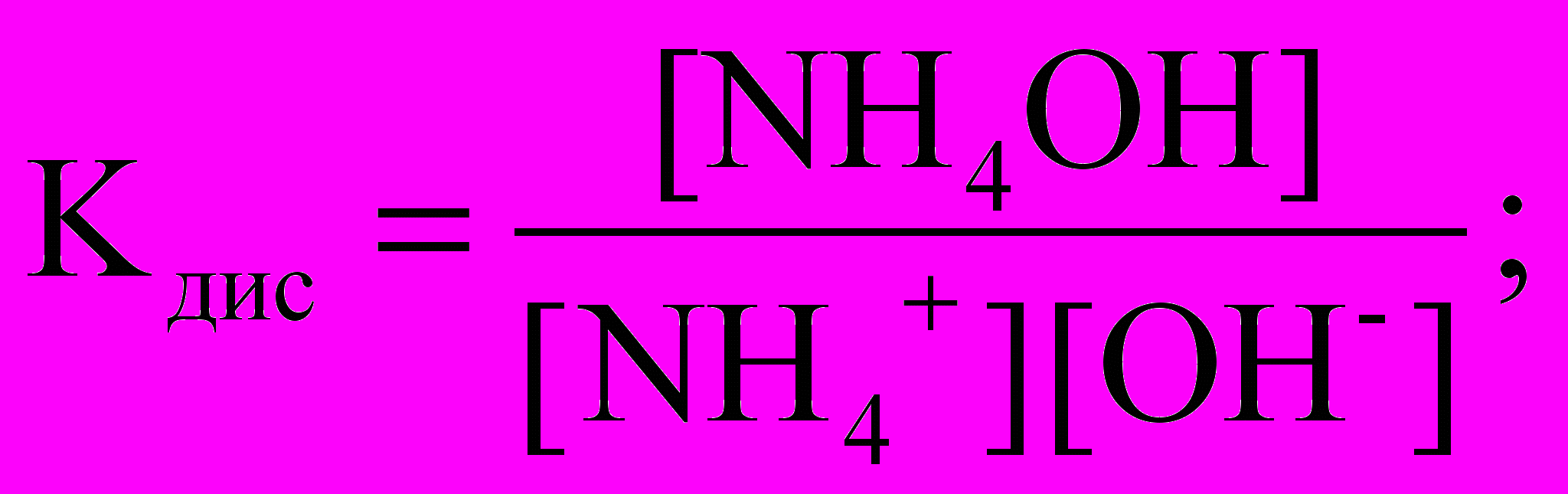 4)
4) 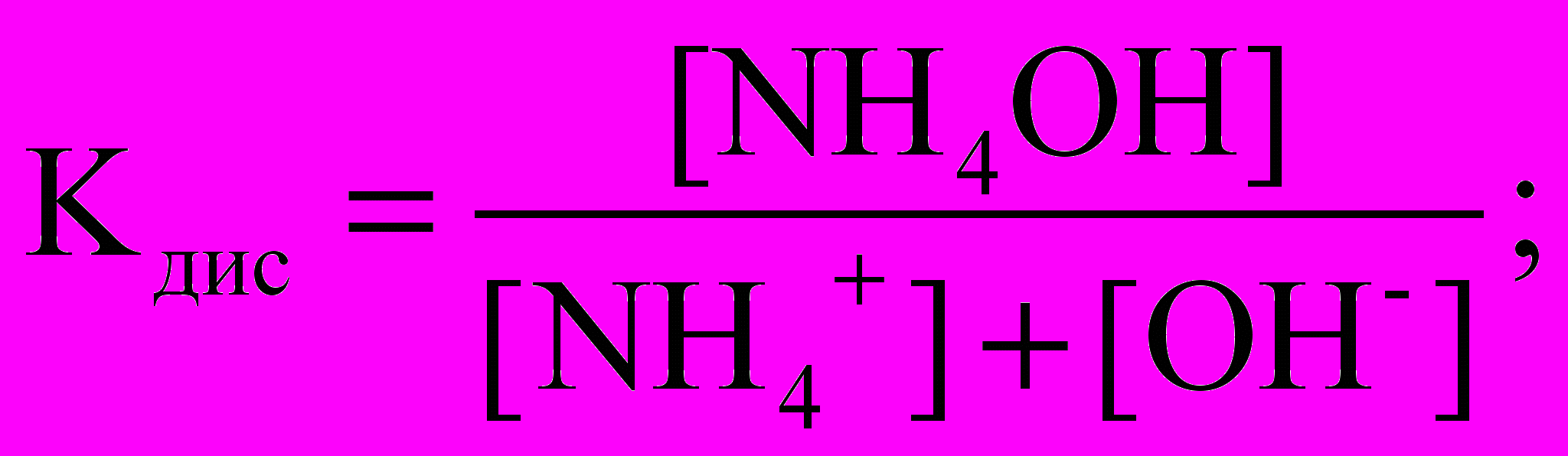
Решение. Слабое основание гидроксид аммония диссоциирует:
NН4ОН NН4+ + ОН–
Константа диссоциации слабого электролита – отношение произведения концентраций ионов, образующихся при диссоциации на концентрацию непродиссоциированных молекул.
Правильный ответ: 2).
8. Определите Кдис. угольной кислоты, если ее степень диссоциации по первой ступени в 0,1 М растворе равна 0.173% .
1) 3·10–3; 2) 3·10–5; 3) 3·10–7; 4) 3·10–9.
Решение. Зная концентрацию раствора кислоты (0,1 М) и степень ее диссоциации (α), константу диссоциации (Кдис.) определим по закону разбавления Оствальда:
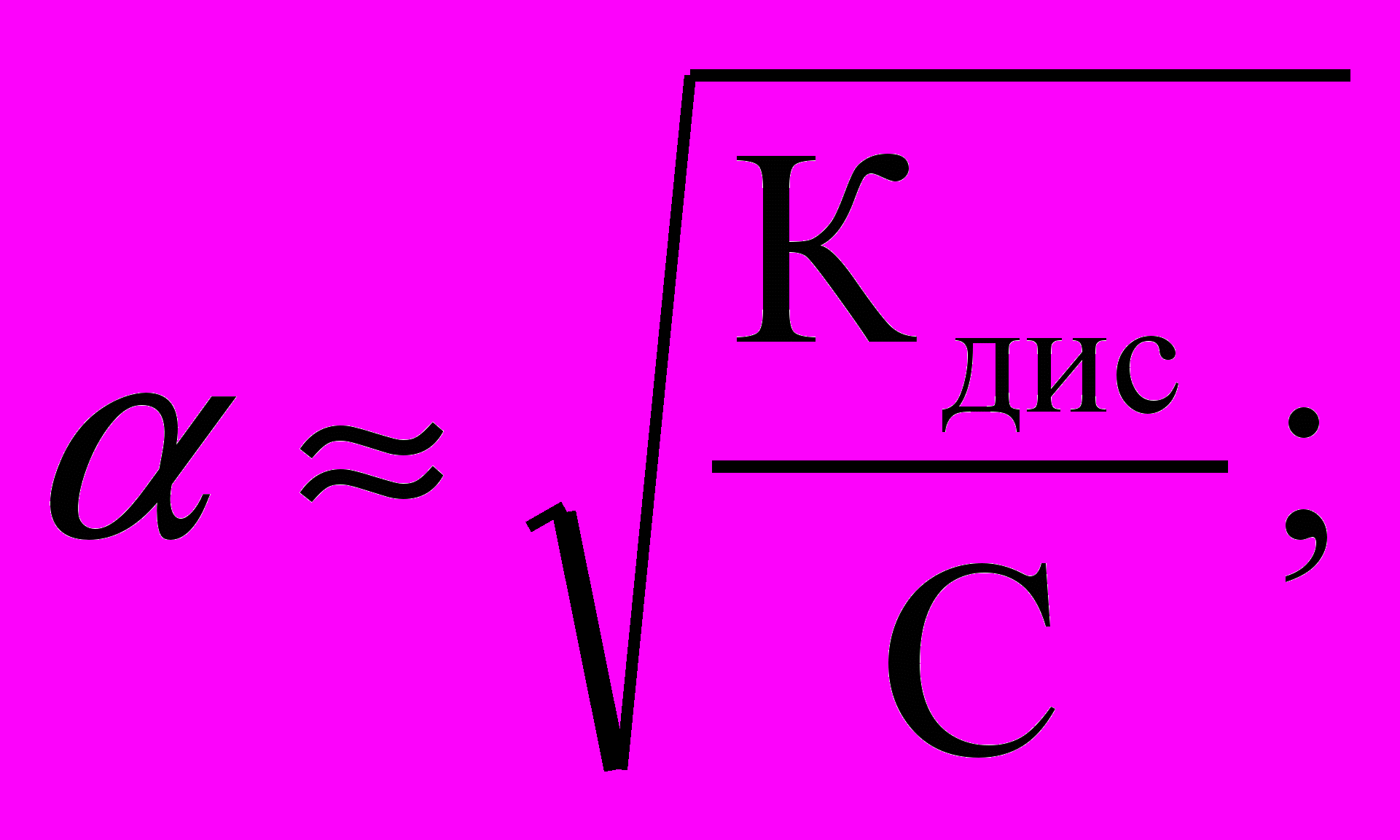 α2 С = Кдис ; Кдис = (0,00173)2·0,1 = 3·10–7.
α2 С = Кдис ; Кдис = (0,00173)2·0,1 = 3·10–7.Правильный ответ: 3).
9. Укажите, гидролиз какой из перечисленных ниже солей приводит к образованию слабого основания и слабой кислоты.
1) NН4CN 2) Cr2(SO4)3 3) CuSO4 4) BaCl2
Решение. При гидролизе соли, образованной однокислотным слабым основанием и одноосновной слабой кислотой образуются слабое основание и слабая кислота. Такой солью из перечисленных является соль NН4CN:
NН4+ + CN– + HOH NН4OH + HCN
Правильный ответ: 1).
10. Уравнение реакции гидролиза хлорида железа (III) FeCl3 по первой ступени в сокращенной ионной форме:
1) Fe3+ + 3Cl– + HOH Fe(ОН)3 + H+ + 3Cl–
2) Fe3+ + 3Cl– + HOH Fe(ОН)2+ H+ + 3Cl–
3) Fe3+ + 3Cl– + HOH Fe(ОН)2+ H+ + 3Cl–
4) Fe3+ + HOH Fe(ОН)2+ + H+
Решение. Хлорид железа (III) – соль, образованная сильной кислотой НСl и слабым трехкислотным основанием Fe(ОН)3. По первой ступени образуется основная соль, в которой появится одна группа ОН–, по второй – в основной соле присутствуют две группы ОН–, а по третьей – гидроксид железа Fe(ОН)3 . В сокращенной ионной форме – образуются ионы Fe(ОН)2+ и H+.
Правильный ответ: 4).
11. Полному необратимому гидролизу подвергаются соли:
1) Al2(SO4)3; 2) (NH4)2S; 3) Al2S3; 4) MgCO3.
Решение. Соли Al2S3, Cr2S3 , Al2(CO3)3, Cr2(CO3)3, Fe2(CO3)3 – в воде существовать не могут, т.к. подвергаются полному гидролизу. Эти соли образованы двумя слабыми компонентами – многокислотными основаниями и многоосновными кислотами.
Правильный ответ: 3).
12. Укажите, гидролиз какой из перечисленных солей по первой ступени, приводит к образованию основной соли:
1) K2SO4; 2) Al2S3; 3) CrCl3; 4) (NH4)2CO3
Решение. Основная соль образуется при гидролизе соли, образованной слабым многокислотным основанием и сильной кислотой. Такой солью является соль CrCl3 (образована Cr(ОН)3 и НCl).
CrCl3 + НОН Cr(ОН)2Cl + НCl
Правильный ответ: 3).
13. Укажите, какая из перечисленных ниже солей создает в водном растворе среду с рН = 7.
1) Na2CO3; 2) Al2(SO4)3; 3) КCl; 4) Fe(CNS)3.
Решение. рН = 7 (нейтральная среда) будет у соли, образованной сильным основанием и сильной кислотой (соль не подвергается гидролизу). Такой солью из перечисленных является КCl.
Правильный ответ: 3).
14. Укажите, какое из приведенных уравнений отвечает гидролизу (NН4)2S по первой ступени в молекулярной форме:
1) (NН4)2S + HOH NН4HS + NН4OH;
2) (NН4)2S + 2HOH H2S + 2NН4OH;
3) S2– + NН4+ + HOH HS– + NН4OH;
4) 2NН4++S2–+HOH NН4++HS–+NН4+ + OH–
Решение. (NH4)2S – соль, образована слабым основанием NH4OH и слабой двухосновной кислотой H2S (гидролиз по катиону и по аниону) По первой ступени образуется кислая соль и слабое однокислотное основание NH4OH:
NH4+ + S2‾ + HOН = HS‾ + NH4OH
или в молекулярной форме:
( NH4)2S + HOН = NH4HS + NH4OH
Правильный ответ: 1).
15. Сокращенное уравнение реакции: OH– + H+ = H2O соответствует взаимодействию:
1) Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O;
3) Ba(OH)2 + 2HCl = BaCl2 + 2H2O
4) 2KOH + H2SiO3 = K2SiO3 + 2H2O
Решение. В виде ионов будут находиться сильные электролиты: основание (Ba(OH)2 ) и кислота (HCl).
Правильный ответ: 3).
Органическая химия
(Фрагмент лекции и вопросы к «обучающим тестам)
1.4.2 Типы связей в атомах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Для атома углерода в органических соединениях возможны три состояния гибридизации:
sp3-, sp2- или sp-гибридизация.
| Тип гибридизации | Кратность связи | Углы между связями | Геометрическая форма молекулы | |
| sp3 | одинарная (σ) | 109°28’ | Тетраэдрическая |  |
| sp2 | двойная (σ+π) | 120° | Плоская |  |
| sp | тройная (σ+π+π) | 180° | Линейная |  |
Основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Тип связи в значительной степени определяется разностью электроотрицательностей (Δχ) элементов, участвующих в ее образовании:
Δχ = χА – χВ,
где χА и χВ – электроотрицательности атомов А и В.
Основные классы органических соединений и соответствующие функциональные группы
| ● | Углеводороды | R–Н | |
| | например | | |
| | Алканы | Все связи одинарные, цепь не замкнута | |
| | Циклоалканы | Все связи одинарные, цепь замкнута | |
| | Этиленовые углеводороды | Одна двойная связь | |
| | Ацетиленовые углеводороды | Одна тройная связь | |
| | Диеновые углеводороды | Две двойных связи | |
| | Ароматические углеводороды | Содержат бензольное кольцо, которое обозначается  или или 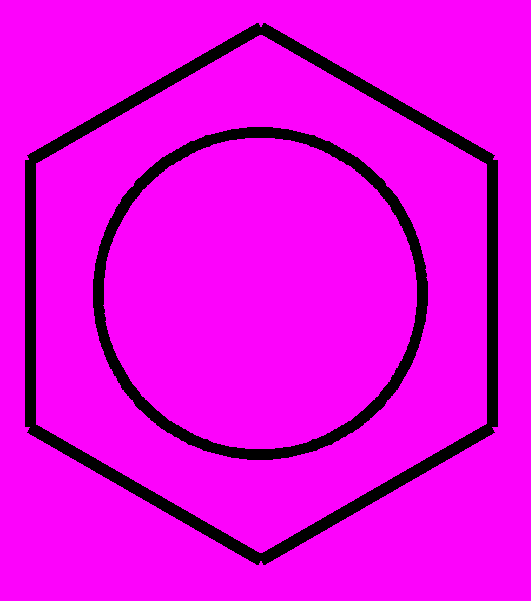 Все атомы углерода в бензольном кольце связаны двойными связями, углеродная цепь замкнута (циклическое строение) | |
| ● | Галогенпроизводные | R–Нal | |
| ● | Спирты | R–ОН | гидроксильная |
| ● | Альдегиды |  | карбонильная |
| | и | | |
| | кетоны | 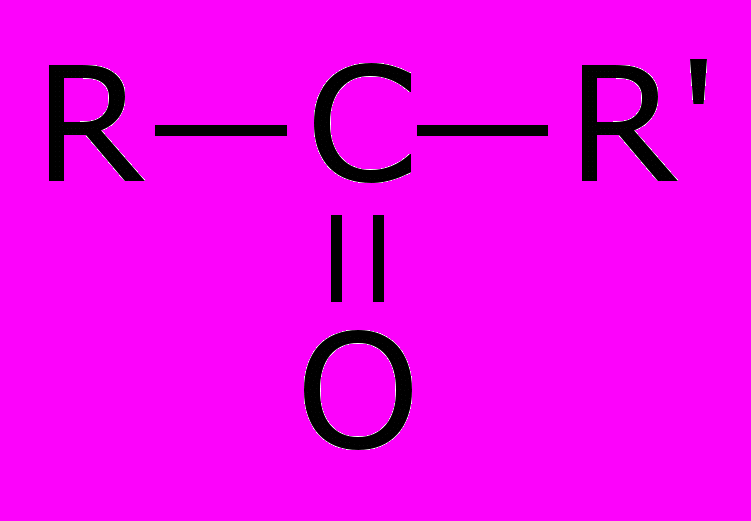 | |
| ● | Карбоновые кислоты |  | карбоксильная |
| | и | | |
| | их производные | 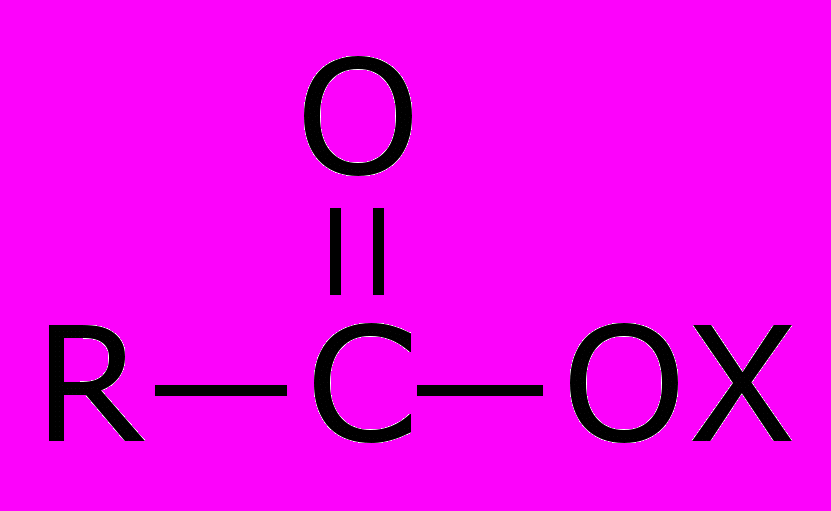 | |
| ● | Нитросоединения | R–NO2 | нитрогруппа |
| ● | Амины | R–NH2 | аминогруппа |
| | и | | |
| | диазосоединения | [R–N≡N]+X– | |
| ● | Металлорганические соединения | R—Me | |
