Чубриева светлана Юрьевна метаболический синдром у женщин репродуктивного возраста
| Вид материала | Автореферат |
СодержаниеПути развития МС у лиц женского пола. Первый путь Второй путь Практические рекомендации Список работ, опубликованных по теме диссертации |
- Файзуллаева Нигора Яхъяевна иммунологические изменения и иммунокоррекция герпетических, 297.14kb.
- Консервативное лечение миомы матки у женщин позднего репродуктивного возраста препаратом, 69.46kb.
- Совместный курс последипломного образования для врачей и молодых специалистов «Заболевания, 17.1kb.
- Собрания Российской Федерации Доклад Оположении детей в Российской Федерации Москва, 3799.15kb.
- Системный анализ параметров вектора состояния организма женщин репродуктивного возраста, 689.14kb.
- На правах рукописи, 279.48kb.
- Лекция. Фув. Волгму, 131.5kb.
- Лекция. Фув. Волгму, 136.46kb.
- Метаболический синдром (синдром Х) «болезнь цивилизации», 159.83kb.
- Бесплодие у женщин позднего репродуктивного возраста: принципы диагностики и лечения, 587.77kb.
Роль ожирения при МС оценивается неоднозначно. G.M. Reaven (1988) в первичном описании синдрома не включал абдоминальное ожирение в атерогенную группу, но подчеркивал его значимость в развитии МС. Результаты подтвердили, что с возрастом у пациенток с МС наблюдается увеличение степени ожирения (r=0,300, р<0,001), а именно, андроидного типа (r=0,311, р<0,001). Это позволяет предполагать ключевую роль абдоминального ожирения в развитии МС. Однако абдоминальное ожирение характерно не для всех пациенток. Многие проявления МС выражены независимо от ожирения, а также при гиноидном типе распределения жировой ткани.
Метаболический синдром может отмечаться у пациентов с нормальной массой тела (ИМТ менее 25 кг/м2). Для обозначения этого состояния было предложено название «metabolically obese normal weight или метаболическое ожирение при нормальной массе тела» [Karelis A.D. et al., 2004]. В настоящем исследовании «метаболическое ожирение при нормальной массе тела» было отмечено у 22% лиц женского пола. При этом у них отмечалось преобладание висцерального отложения жира с повышением ОТБ (р=0,03), значимо более высокий уровень ТГ (р=0,002) и низкий уровень ХС ЛПВП (р=0,02), более высокие концентрации базального (р<0,001) и постнагрузочного (р<0,001) инсулина. Это может свидетельствовать в пользу того, что кроме ожирения, в патогенезе МС у лиц женского пола существенную роль играют другие факторы, прежде всего, ИР и компенсаторная ГИ. У этих пациенток отмечалось снижение уровня ГСПГ (р<0,001), что может быть связано с сопутствующей гиперандрогенией, играющей значимую роль в совокупности метаболических и гормональных нарушений в составе МС.
У пациенток с «метаболическим ожирением при нормальной массе тела» отмечались также более высокие концентрации TNF-α (р=0,03), что может свидетельствовать о высокой секреторной активности жировой ткани у этих пациенток. TNF-α является селективным медиатором апоптоза в опухолевых клетках. Предполагается, что TNF-α может выступать в этом же качестве по отношению к преадипоцитам и адипоцитам человека. Запрограммированная гибель клетки может представлять собой еще один механизм, с помощью которого TNF-α регулирует клеточный состав жировой ткани. Таким образом, у пациенток с МС, TNF-α может уменьшать массу жировой ткани посредством снижения не только объема жировой клетки, но и числа адипоцитов.
Существует и противоположное состояние, когда у тучных пациентов не выявляется метаболических нарушений – «metabolically normal obese или ожирение без метаболических нарушений» [Karelis A.D. et al., 2004]. У 59 (3,3%) лиц женского пола с подозрением на МС, не вошедших в исследование, отмечались избыточная масса тела и ожирение без метаболических нарушений (концентрации ТГ, ХС ЛПВП, общего ХС, глюкозы и инсулина в крови находились в пределах возрастной нормы). В контрольную группу вошли 2 (0,11%) пациентки подросткового и 3 (0,17%) пациентки репродуктивного возраста, которые имели предожирение (ИМТ 25-30 кг/м2) без метаболических нарушений. В целом, «ожирение без метаболических нарушений» отмечалось лишь у 3,6% лиц женского пола. Возможно, причиной отсутствия метаболических нарушений явился молодой возраст обследуемых (от 15 до 28 лет), при котором не успел «развиться» синдром ИР, или существуют определенные протективные (например, высокий уровень ИФР-I) или генетические факторы, препятствующие развитию МС.
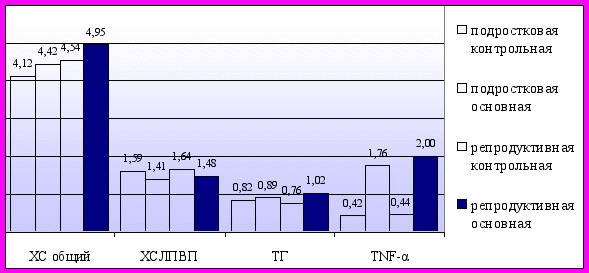
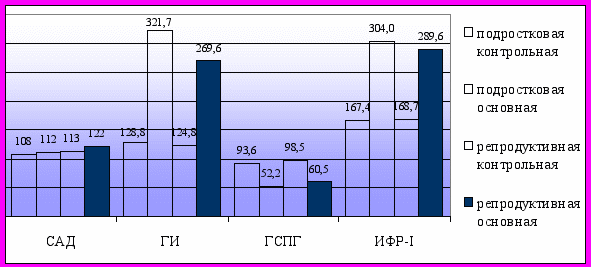
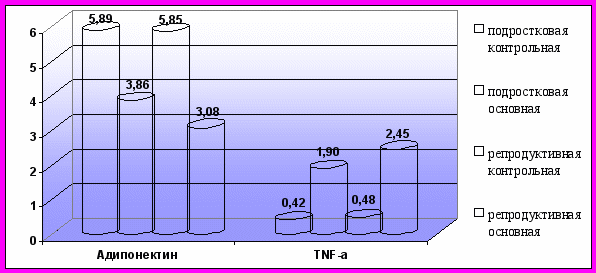
Таким образом, у лиц женского пола проявления МС (гипоальфахолестеринемия, гиперинсулинемия и др.) могут присутствовать при нормальной массе тела и при гиноидном типе распределения жировой ткани (рис. 3; рис. 4). У пациенток с МС без ожирения и с гиноидным типом распределения жировой ткани отмечались низкие уровни адипонектина и высокие концентрации TNF-α, что указывает на значимую роль этих адипоцитокинов в развитии метаболических и гормональных нарушений, характерных для МС, вне зависимости от абдоминального ожирения (рис. 5). По сравнению с подростковым возрастом у женщин репродуктивного возраста нарастает как количество клинико-лабораторных проявлений МС - появляется АГ (р<0,001), гипертриглицеридемия (р=0,002), гиперфибриногенемия (р=0,004), так и степень их выраженности.
Концентрация адипонектина в крови отрицательно коррелирует с ИМТ и ОТБ [Weyer C. et al., 2001] и связана с ИР [Lindsay R.S. et al., 2002]. Возможно, что развитие ИР по мере прогрессирования ожирения может быть следствием снижения секреции адипонектина в жировой ткани. Отмечена взаимосвязь концентрации адипонектина с показателями ожирения - ИМТ (r=-0,515, р=0,007) и окружностью талии (r=-0,332, р=0,03), а также с уровнем лептина (r=-0,443, р=0,001) и с индексом лептин/ИМТ (r=-0,426, р=0,002). При этом степень ожирения, в том числе абдоминального ожирения, с возрастом повышается (r=0,311, р<0,001), а уровень адипонектина — снижается (верхний квартиль уровня адипонектина в контрольной группе составил 4,98 мкг/мл у подростков и 4,30 мкг/мл у женщин репродуктивного возраста). Кроме показателей ожирения, уровень адипонектина был взаимосвязан с постнагрузочным уровнем глюкозы (r=-0,413, р=0,04), а у пациенток с выраженным ожирением – с базальным уровнем инсулина (r=-0,282, р=0,01). Эти результаты позволяют предположить, что адипонектин играет роль в развитии ИР и гипоадипонектинемия может привести к развитию СД. Кроме гипоадипонектинемии, обусловленной накоплением висцерального жира, имеются данные о существовании генетической гипоадипонектинемии, приводящей к развитию клинического фенотипа МС.
ммоль/л
пг/мл
ммоль/л
ммоль/л
Рис. 3. Средние значения показателей МС в группах без ожирения.
пмоль/л
мм рт.ст.
нмоль/л
нг/мл
Рис. 4. Средние значения показателей МС в группах без ожирения.
мкг/мл
пг/мл
Рис. 5. Средние значения уровней адипоцитокинов в обследуемых группах с гиноидным типом распределения жировой клетчатки.
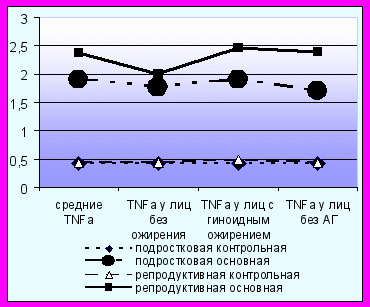
TNF- рассматривается, как фактор, связывающий ожирение и ИР [Rotter V. et al., 2003]. Помимо снижения чувствительности к инсулину, TNF-α участвует в патогенезе воспаления и атеросклероза, в частности, являясь мощным ингибитором синтеза адипонектина. В нашем исследовании не было выявлено взаимосвязей уровня TNF- с составляющими МС (кроме уровня мочевой кислоты), при этом определялись значимые различия между средними значениями контрольной и основной групп соответствующего возраста. Однако, при выделении групп с избыточной массой тела и ожирением была отмечена взаимосвязь TNF- с абсолютной и относительной гиперлептинемией (r=0,837, р=0,001) и гипоадипонектинемией (r=-0,823, р=0,008), что позволяет предположить участие TNF- в стимуляции секреции лептина и угнетении секреции адипонектина у тучных пациенток с МС. Возможно, что TNF- секретируемый адипоцитами жировой ткани реализует свои эффекты преимущественно локально в местах синтеза: снижает чувствительность жировой ткани к инсулину, стимулирует липогенез и рост адипоцитов. Опосредованно TNF- может вызывать и системные эффекты путем активации синтеза жирных кислот и повышения их концентрации в крови, а также за счет угнетения секреции адипонектина. В целом, в группах без ожирения (р=0,02) и с гиноидным типом ожирения (р<0,001) уровень TNF- был значимо выше у лиц женского пола с МС (рис. 6). Можно предположить, что повышенный уровень TNF- является важным компонентом МС вне зависимости от массы тела, в то время как роль лептина и адипонектина проявляется при избыточной массе тела и ожирении.
пг/мл
нг/мл
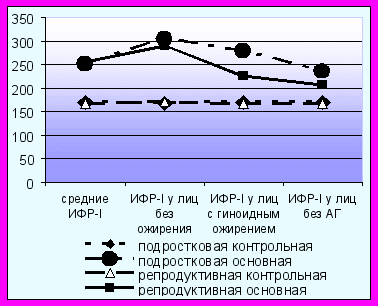
Рис. 6. Концентрации TNF-α и ИФР-I у лиц женского пола (в среднем, у лиц без ожирения, у лиц с гиноидным типом ожирения, у лиц без АГ).
Верхний квартиль уровня лептина у девушек-подростков (15,6 нг/мл) был практически в два раза выше по сравнению с уровнем лептина у женщин репродуктивного возраста (7,6 нг/мл). Более высокий уровень лептина у девушек-подростков, вероятно, связан с тем, что лептин является пермиссивным (запускающим) фактором для полового созревания и поддержания далее способности к репродукции. В целом, уровень лептина и индекс лептин/ИМТ были выше, чем в контрольных группах соответствующего возраста. Абсолютная и относительная гиперлептинемия отмечалась у 64,3% и 58,6% подростков и у 81,6% и 64,8% женщин репродуктивного возраста с МС. Отмечена взаимосвязь уровня лептина и индекса лептин/ИМТ со всеми составляющими МС: с ожирением, в том числе, с абдоминальным ожирением (r=0,322, р<0,001), с АГ (r=0,346, р<0,001), с гипертриглицеридемией (r=0,334, р<0,001) и гипоальфахолестеринемией (r=-0,258, р=0,005), с ГИ (r=0,254, р=0,005), с гипер-С-пептидемией (r=0,685, р<0,001), с индексами ИР.
При нарастании массы тела наряду с увеличением частоты гиперлептинемии возрастает и частота АГ. Одним из механизмов влияния лептина на уровень АД может являться наличие у тучных женщин селективной лептинорезистентности [Correia M.L.G. et al., 2002]. Следовательно, кроме ИР и ГИ, гиперлептинемия является одним из факторов развития АГ при МС. С нарастанием массы тела возрастает частота ановуляции, что может быть обусловлено снижением уровня ГСПГ под действием ГИ с увеличением доли свободных андрогенов, нарушающих фолликулогенез. Другой причиной может являться прямое действие гиперлептинемии на яичники. Повышенный уровень лептина подавляет стимулируемый ФСГ и ИФР рост фолликула [Kikuchi N. et al., 2001] и ингибирует овуляцию посредством прямого действия на преовуляторный фолликул [Duggal P.S. et al., 2000]. У женщин репродуктивного возраста с МС без ожирения уровень лептина и значение индекса лептин/ИМТ значимо ниже (р=0,006 и р=0,002), чем в контрольной группе, несмотря на то, что ИМТ у них значимо выше (р<0,001). Это означает абсолютную и относительную недостаточность лептина, что может способствовать развитию у худых женщин с МС ановуляции, так как лептин, являясь ангиогенным фактором, может участвовать в механизмах селекции доминантного фолликула и образования желтого тела [Cao R. et al., 2001]. Следовательно, гиперлептинемия у лиц женского пола с избыточной массой тела и ожирением может участвовать в патогенезе гормонально-метаболических нарушений в составе МС, а гиполептинемия не способствует развитию МС, но может участвовать в патогенезе репродуктивных нарушений.
При исследовании содержания ИФР-I в сыворотке крови было обнаружено достоверное повышение этого показателя во всех группах пациенток по сравнению с контрольной группой (рис. 6). Уровень ИФР-I повышался вне зависимости от ожирения (р<0,001), а также у лиц с гиноидным типом ожирения (р=0,003) и у женщин репродуктивного возраста без АГ (р=0,02). В исследованиях отмечено снижение уровня ИФР-I у пациентов при МС и СД [Gomez J.M. et al., 2003; Sandhu M.S. et al., 2002]. Установлено, что ИФР-I обладает антиапоптотическими, антиоксидантными, противовоспалительными, вазодилатационными, дезагрегационными свойствами [Conti E et al., 2004]. При этом отмечена способность ИФР-I улучшать тканевую чувствительность к инсулину и ингибировать секрецию инсулина β-клетками поджелудочной железы. Возможно, что у женщин репродуктивного возраста ИФР-I повышен компенсаторно (усиленная продукция ИФР-I печенью), как приспособительная реакция для уменьшения степени ИР. С возрастом происходит постепенное снижение выработки ИФР-I, уменьшается его продукция печенью, ослабевает протективное действие эстрогенов и появляется дисфункция эндотелия, ишемия миокарда, ИБС, острый коронарный синдром [Vasan R.S. et al., 2003].
D.J.P. Barker и соавт. (1993) выдвинули гипотезу о связи внутриутробной задержки роста и сниженной массы тела плода при рождении с развитием МС и СД 2-го типа в постпубертатном периоде. В исследовании патологическая масса тела при рождении (как низкая, так и высокая) была взаимосвязана со всеми составляющими МС - с развитием АГ, ожирения, нарушением углеводного обмена (ИР, ГИ, гипер-С-пептидемия, гипергликемия), нарушением липидного обмена. При этом у «маловесных» были наиболее высокими значения общего ХС и ХС ЛПНП (р=0,006), в то время как патологически высокая масса тела при рождении у пациенток с МС сопровождалась, кроме гиперхолестеринемии, тенденцией к гипертриглицеридемии и гипоальфахолестеринемии. Прослеживается взаимосвязь абсолютной и относительной гиперлептинемии у пациенток с патологической массой тела при рождении как у «маловесных», так и «крупных». При этом у лиц с патологически высокой массой тела при рождении уровень лептина и индекса лептин/ИМТ был наиболее высок (р<0,001). Следовательно, гиперлептинемия и лептинорезистентность могут быть взаимосвязаны с патологической массой тела при рождении у лиц с МС.
При патологически высокой массе тела при рождении отмечалось повышение базальных концентраций глюкозы (р=0,004), инсулина (р=0,05) и С-пептида (р=0,006), в то время как у пациенток с патологически низкой массой тела при рождении было выявлено повышение постнагрузочных концентраций глюкозы (р=0,009) и инсулина (р=0,05). При сравнении частоты возникновения и степени тяжести метаболических и гемодинамических нарушений в группах, имевших низкую и высокую массу тела при рождении, более выраженные структурно-функциональные изменения со стороны сердечно-сосудистой системы отмечались у пациенток, рожденных с массой тела от 4000 г. У этих пациенток отмечалась наклонность к «ремоделированию» сердца (концентрическая гипертрофия ЛЖ, нарушения диастолической функции), снижение толерантности к физической нагрузке и др.
Возможно, что у пациенток с МС и патологически высокой массой тела при рождении (21-28% лиц женского пола), метаболические и гормональные нарушения предопределены генетически («крупный» плод – это предиктор СД 2-го типа), в то время как у пациенток с патологически низкой массой тела при рождении (25-28% лиц женского пола), изменения, способствующие в будущем возникновению МС, возникают вследствие нарушения внутриутробного питания плода, приводящего к перестройке механизмов регуляции массы тела на более экономичный режим. В дальнейшем при наличии достаточного питания это приводит к положительному энергетическому балансу и может способствовать развитию ожирения со всеми проявлениями МС.
СПКЯ включен в состав МС по рекомендациям ААСЕ (2002). В группе пациенток с мультифолликулярным (18,6% девушек-подростков и 9,9% женщин репродуктивного возраста) и поликистозным типом структуры яичников (30,2% и 46,4% соответственно) корреляционные зависимости в целом не отличались, однако были более выражены у пациенток более старшего возраста, имеющих поликистозную структуру яичников. Последовательность этапов структурной перестройки яичников (мелкокистозной, мультифолликулярной, поликистозной) является частой сочетанной патологией [Coffler M.S., 2007]. Можно предположить, что данная трансформация структуры яичников происходит на фоне ухудшения метаболических показателей. С возрастом становятся более выраженными не только проявления МС, но и поликистозная структура яичников.
Изменения структуры яичников сопровождались многими проявлениями МС, такими как общее (р=0,006) и абдоминальное ожирение (р<0,001), гиперурикемия (р<0,001), гипергликемия (р<0,001), базальная (р<0,001) и постнагрузочная (р<0,001) гиперинсулинемия, гиперандрогенемия (р<0,001) с нарушением менструального цикла по типу олигоменореи (р=0,005), гипоадипонектинемия (р=0,006). При оценке метаболических нарушений в группе пациенток с СПКЯ отмечены выраженные изменения лабораторных показателей (рис. 7). Преобладание проявлений МС при поликистозной структуре яичников может свидетельствовать об ассоциированности данного типа строения яичников с ИР. Поэтому, хотя многие рекомендации и не относят характер ультразвуковой картины яичников к диагностическим критериям МС, данный признак может свидетельствовать о необходимости обследования пациенток с эхографическими маркерами СПКЯ на предмет наличия у них проявлений МС [Essah P.A. et al., 2007].
Гиперандрогения может играть роль в развитии ИР [Coviello A.D. et al., 2006]. Уровень общего тестостерона не является отражением тяжести гормональных нарушений у лиц женского пола с МС. Напротив, концентрация свободных андрогенов в крови коррелировала с ИР и ГИ в результате изменения уровня ГСПГ. Частота сниженного уровня ГСПГ составила 80% у девушек-подростков и 88% у женщин репродуктивного возраста с МС и нарастала при ожирении. Кроме того, у лиц женского пола с МС как в целом (р<0,001), так и в группах без ожирения (р<0,001) и с гиноидным типом отложения жира (р<0,001) уровень ГСПГ был значимо ниже, чем в контрольных группах соответствующего возраста. Так как влияние ожирения в данном случае ограничено, снижение уровня ГСПГ у данной категории лиц, вероятно, обусловлено существующими у них независимо от ожирения ИР и ГИ. Кроме того, отмечена корреляция уровня ГСПГ со многими проявлениями МС – с САД (r=-0,404, р<0,001), ИМТ (r=-0,375, р<0,001), окружностью талии (r=-0,430, р<0,001), уровнем ТГ (r=-0,396, р<0,001) и ХС ЛПВП (r=0,239, р<0,001), уровнем глюкозы натощак (r=-0,329, р<0,001), уровнем базального (r=-0,434, р<0,001) и постнагрузочного (r=-0,491, р<0,001) инсулина, уровнем лептина (r=-0,311, р<0,001) и др. Следовательно, из показателей гиперандрогении уровень ГСПГ, наиболее полно отражает тяжесть гормональных и метаболических нарушений и определение уровня ГСПГ может дополнить картину метаболического дисбаланса.
 Рис. 7. Частота встречаемости метаболических нарушений при поликистозной структуре яичников у лиц женского пола с МС.
Рис. 7. Частота встречаемости метаболических нарушений при поликистозной структуре яичников у лиц женского пола с МС. В последние годы ИР и ГИ рассматриваются как новые важные факторы в развитии рака [Ten S., Maclaren N., 2004; Dawson S.I., 2004]. Хотя выявление маркеров пролиферации не являлось задачей нашего исследования, нами было обнаружено увеличение частоты возникновения как непосредственно онкологических заболеваний, так и патологических состояний, формирующих группу риска по их возникновению (рис. 8). Наличие пролиферативных маркеров сопровождалось повышением ИМТ (р=0,008), окружности талии (р=0,03), базального (р=0,05) и постнагрузочного (р<0,001) уровня глюкозы, базального уровня инсулина (р=0,002), уровня лептина (р=0,03), концентрации TNFα (р=0,05), повышением частоты выявления патологии молочных желез (р<0,001) и снижением уровня ХС ЛПВП (р=0,003). Следовательно, высокая частота обнаружения маркеров пролиферации у пациенток с МС предполагает возможность участия ГИ в патогенезе неопластических процессов.
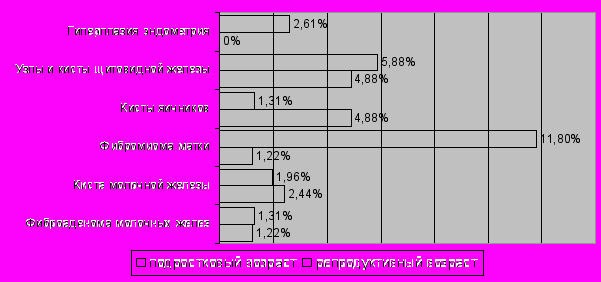 Рис. 8. Частота встречаемости маркеров пролиферации при ультразвуковом скринировании пациенток с МС.
Рис. 8. Частота встречаемости маркеров пролиферации при ультразвуковом скринировании пациенток с МС.Пациентки с МС входят в группу риска по развитию фиброаденоматоза молочных желез [Кампова-Полевая Е.Б. и др., 2006]. Частота встречаемости патологических изменений в молочных железах по данным УЗИ составила в основной подростковой группе 58,2%, в основной репродуктивной группе – 83,0% случаев. Выявленная взаимосвязь проявлений МС с преобладанием фиброзных изменений в структуре молочных желез по данным УЗИ (47,7% пациенток подросткового возраста и 63,3% женщин репродуктивного возраста) (рис. 9), позволяет предположить участие ГИ (р=0,003), ожирения (р<0,001), дислипидемии (р=0,01) в развитии данного заболевания у лиц женского пола.
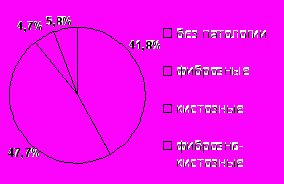
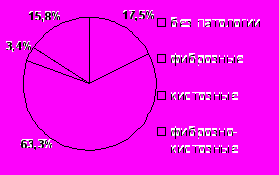
Рис. 9. Частота встречаемости изменений в молочных железах по данным ультразвукового исследования у лиц женского пола с МС.
Следовательно, для лиц женского пола репродуктивного возраста с МС, характерен перименопаузальный тип строения молочных желез: выраженный фиброз и инволютивные изменения железистой ткани, что не соответствует возрастной норме, необходимой для адекватного осуществления репродуктивной функции. Вследствие немногочисленности гинекологических жалоб и большей выраженности проявлений МС (ожирение, ГИ, АГ, дислипидемия), пациентки чаще обращаются к эндокринологу и кардиологу. Кроме вышеуказанных изменений у пациенток отмечались гиперлептинемия (р=0,01), гиперфибриногенемия (р<0,001), увеличение TNFα (р=0,007), гипоадипонектинемия (р=0,008) и снижение уровня ГСПГ (р=0,01), что предполагает взаимосвязанные факторы участия ИР, ГИ, гиперандрогении и адипоцитокинов в патогенезе «фиброзно-кистозной мастопатии».
Гипертрофия левого желудочка может рассматриваться как изначально компенсаторный структурный ответ на хроническую гемодинамическую рабочую перегрузку, направленный на увеличение работы сердца и поддержание нормального сердечного выброса. У пациенток подросткового возраста с МС гипертрофия ЛЖ связана с увеличением СИ (r=0,577, р<0,001), в то время как у пациенток репродуктивного возраста гипертрофия ЛЖ взаимосвязана с увеличением как СИ (r=0,239, р=0,008), так и ОПСС (r=0,323, р<0,001). Возможно, что гипертрофия ЛЖ при МС у девушек-подростков исходно представляет собой физиологическую реакцию сердца на нарастание ЧСС и сократимости миокарда из-за повышенной активации симпатической нервной системы с увеличением преднагрузки, а у женщин репродуктивного возраста гипертрофия ЛЖ дополнительно сопровождается увеличением постнагрузки на ЛЖ, связанное с повышением ОПСС вследствие гипертрофии гладкомышечных клеток стенки сосудов при ГИ.
У девушек-подростков с МС чаще отмечается нормальная геометрия ЛЖ (69,8%), в то время как у лиц женского пола репродуктивного возраста с МС концентрическая гипертрофия миокарда (40,6%) (рис. 10). Присутствие концентрической гипертрофии ЛЖ у пациенток с МС сопровождалось ухудшением большинства метаболических и гормональных показателей. Кроме составляющих МС (ГИ, АГ и др.), структурно-функциональное ремоделирование миокарда ЛЖ может быть обусловлена низким уровнем адипонектина (р=0,04), который способствует ремоделированию кардиомиоцитов, и высоким уровнем ИФР-I (р=0,001), который может действовать в качестве ростового фактора.
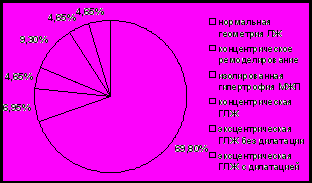
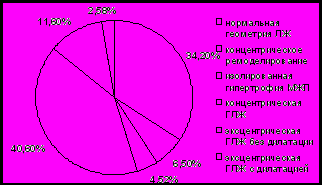
Рис. 10. Типы геометрии левого желудочка у пациенток с МС.
По мере нарастания проявлений МС в ответ на: 1) чрезмерную гемодинамическую нагрузку (увеличение степени АГ); 2) нарушение метаболизма (ИР, компенсаторная ГИ и увеличение концентрации ИФР-1); 3) нарушение секреции адипоцитокинов, участвующих в ремоделировании кардиомиоциотов (гипоадипонектинемии), изменяются и геометрические параметры ЛЖ и постепенно развивается концентрическая гипертрофия ЛЖ. По мере снижения компенсаторных возможностей уменьшается уровень инсулина, ИФР-I и развиваются не только изменения со стороны углеводного обмена (гликемия натощак и НТГ), но и со стороны ССС (тенденция к дилатации полости ЛЖ и эксцентрическая гипертрофия миокарда). Следовательно, дисбаланс адипоцитокинов и факторов роста может лежать в основе трофических процессов, участвующих в формировании ремоделирования сердца. Возможно, что повышение ИФР-I у лиц женского пола репродуктивного возраста при МС является протективным фактором препятствующим развитию заболеваний связанных с атеросклерозом, в то время как снижение уровня ИФР-1 является одним из неблагоприятных прогностических факторов в отношении риска сердечно-сосудистых исходов.
Пути развития МС у лиц женского пола. НТГ не характерно для девушек-подростков с МС, а базальная гипергликемия встречается довольно редко (14%) (табл. 2). В репродуктивном возрасте частота этих нарушений возрастает (22% и 36%, соответственно). Кроме того, у лиц женского пола с МС часто определяется базальная и постнагрузочная ГИ. При этом постнагрузочная ГИ у женщин репродуктивного возраста отмечается несколько реже, чем у девушек-подростков (87% против 93%). Возможно, это связано с этапностью нарушения углеводного обмена: повышение секреции инсулина как компенсаторный ответ на повышение уровня глюкозы в крови, увеличение нагрузки на β-клетки поджелудочной железы, их повреждение, приводящее к прогрессивному снижению секреции инсулина, и в итоге, к гипергликемии. Снижение секреции инсулина, приводящее к гипергликемии, происходит поздно, что фактически отделяет пациентов с МС от пациентов с СД 2-го типа. Далее существует 2 основных пути развития МС [Tenenbaum A. et. al., 2003] (рис. 11).
Первый путь – с сохранением функции β-клеток поджелудочной железы и гиперпродукцией инсулина, которая может компенсировать ИР. Данный путь приводит к осложнениям МС, проявляющимся в крупных сосудах. Этот путь у женщин репродуктивного возраста проявляется гораздо реже. Хотя возможные начальные проявления атеросклероза и способствующих ему структурно-функциональных изменений в виде нарушений липидного обмена, увеличения толщины интима-медиа, гипертрофии миокарда, нарушений диастолической функции (8,6% лиц подросткового и 37,9% женщин репродуктивного возраста), нарушений процессов реполяризации на ЭКГ (24,3% и 43,7%, соответственно) отмечались у многих пациенток, только у 4 человек (1,9%) из них выявлены явные атеросклеротические изменения, способствующие развитию ИБС. Возможно, небольшой процент обусловлен тем, что для женщин характерно малосимптомное течение ИБС [Репина М.А., 2007]. Другим возможным механизмом низкой встречаемости ИБС является протективное действие женских половых гормонов. Следующим фактором может быть протективное действие ИФР-I, который был значимо выше у пациенток как подросткового (р=0,05), так и репродуктивного возраста (р=0,009) в отличие от выявляемого снижения концентрации ИФР-I у пациентов с МС [Conti E. et al., 2004].
Второй путь – с массивным повреждением β-клеток поджелудочной железы, что приводит к снижению секреции инсулина и к гипергликемии. Этот путь ведет к формированию осложнений как на капиллярном уровне, так и в крупных сосудах. У женщин репродуктивного возраста этот путь нарушений встречается чаще, и многие из них уже имеют «скрытый» СД под маской совокупности метаболических нарушений, объединенных понятием МС.
Таким образом, метаболический синдром у лиц женского пола в подростковом и репродуктивном возрасте имеет в основном скрытое течение, но закладывает основы будущего неблагополучия во всех системах организма (сердечно-сосудистой, эндокринной, репродуктивной и др.) и представляет основу для прогрессирования ГИ с последующим снижением секреции инсулина и формированию СД 2-го типа. Атеросклеротические изменения сосудов развиваются медленнее вследствие протективного действия женских половых гормонов и повышенного уровня ИФР-I, и в репродуктивном возрасте реже приводят к возникновению заболеваний сердечно-сосудистой системы.
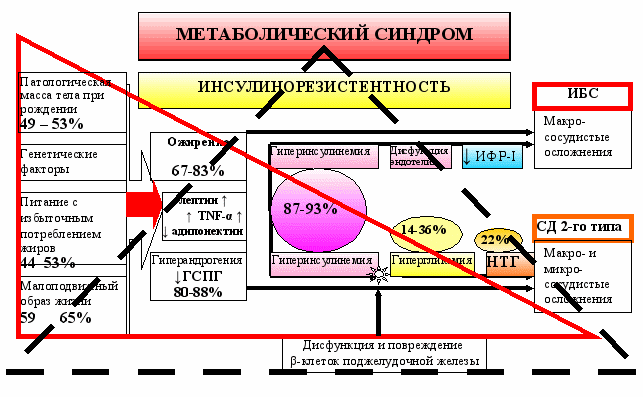
Рис. 11. Основные пути развития МС у лиц женского пола (непрерывный треугольник - подростковый возраст, прерывистый треугольник – репродуктивный возраст).
ВЫВОДЫ
- Среди лиц женского пола, обращающихся за медицинской помощью и имеющих признаки метаболического синдрома, данный симптомокомплекс встречается в 17% случаев (у лиц подросткового возраста – в 15% случаев, у лиц репродуктивного возраста – в 18% случаев). Для подросткового возраста более информативными являются модифицированные критерии IDF (2005) по которым частота встречаемости метаболического синдрома составила 58%. Для репродуктивного возраста более информативными являются критерии ААСЕ (2002) и модифицированные критерии IDF (2005) по которым частота встречаемости метаболического синдрома в обследуемой популяции составила 72% и 78%, соответственно.
- Частота встречаемости полного метаболического синдрома с учетом возрастных и региональных особенностей в исследуемой популяции составила 41% у лиц женского пола подросткового возраста и 70% у лиц женского пола репродуктивного возраста, а частота встречаемости неполного метаболического синдрома — 59% и 30%, соответственно. У лиц женского пола подросткового возраста как полный, так и неполный вариант метаболического синдрома в большинстве случаев сопровождался дополнительными факторами риска (40% и 36%, соответственно). У лиц женского пола репродуктивного возраста чаще отмечается полный вариант МС с дополнительными факторами риска (62%).
- Наиболее часто при метаболическом синдроме в подростковом возрасте отмечается базальная и постнагрузочная гиперинсулинемия (75% и 93%), гипоадипонектинемия (81%), избыточная масса тела и ожирение (67%), гиперхолестеринемия (73%). В репродуктивном возрасте у лиц женского пола с метаболическим синдромом отмечаются те же нарушения, как и в подростковом возрасте — гиперинсулинемия, гипоадипонектинемия, избыточная масса тела и ожирение, а также гиперфибриногенемия (85%), гиперлептинемия (82%), гипертриглицеридемия (83%) в сочетании с гипоальфахолестеринемией (67%).
- У лиц женского пола проявления метаболического синдрома (гиперхолестеринемия, гипоальфахолестеринемия, гиперинсулинемия и др.) могут присутствовать при нормальной массе тела и при гиноидном типе распределения жировой ткани. По сравнению с подростковым возрастом у женщин репродуктивного возраста нарастает как количество клинико-лабораторных проявлений метаболического синдрома (появляется артериальная гипертензия, гипертриглицеридемия, гиперфибриногенемия), так и степень их выраженности.
- Патологическая масса тела плода при рождении (как патологически низкая, так и патологически высокая) у лиц женского пола может являться предиктором развития метаболического синдрома во взрослом возрасте. Патологически высокая масса тела плода при рождении может являться предиктором развития в будущем сахарного диабета 2-го типа, в то время как патологически низкая масса тела плода при рождении, способствует развитию ожирения в составе метаболического синдрома.
- У лиц женского пола с нормальной массой тела метаболический синдром сопровождается абсолютной и относительной гиполептинемией. Пониженный уровень лептина не способствует развитию метаболического синдрома, но может участвовать в патогенезе репродуктивных нарушений. Абсолютная и относительная гиперлептинемия у лиц женского пола с избыточной массой тела и ожирением взаимосвязана со всеми компонентами метаболического синдрома и может участвовать в патогенезе гормонально-метаболических нарушений.
- У лиц женского пола репродуктивного возраста с метаболическим синдромом повышенный уровень ИФР-1 проявляет компенсаторно-протективные свойства в отношении сердечно-сосудистой системы и патологические свойства относительно углеводного обмена. Повышенный уровень TNF- участвует в патогенезе метаболического синдрома вне зависимости от массы тела, в то время как роль лептина и адипонектина проявляется при избыточной массе тела и ожирении.
- Для пациенток с метаболическим синдромом как подросткового (в 48% случаев), так и репродуктивного возраста (в 63% случаев) характерен перименопаузальный тип строения и фиброз железистой ткани молочных желез, диагностируемый при ультразвуковом исследовании. Высокая частота выявления ультразвуковых маркеров пролиферации (15% лиц подросткового возраста и 25% лиц репродуктивного возраста) может быть связана с хронической гиперинсулинемией, формирующей группу риска по возникновению онкологических заболеваний.
- Мультифолликулярная структура яичников (19% лиц подросткового возраста и 10% лиц репродуктивного возраста) и поликистозная структура яичников (30% и 46%, соответственно) может быть одним из компонентов метаболического синдрома у лиц женского пола. По сравнению с мультифолликулярной структурой, при поликистозном изменении структуры яичников отмечаются увеличение количества и степени выраженности проявлений МС базальная и постнагрузочная гиперинсулинемия, гипертриглицеридемия, гипоальфахолестеринемия, гиперлептинемия, снижение уровня глобулина, связывающего половые гормоны, фиброзные изменения структуры молочных желез.
- Из показателей гиперандрогении уровень глобулина, связывающего половые гормоны, наиболее полно отражает тяжесть гормональных и метаболических нарушений у лиц женского пола с метаболическим синдромом. Снижение концентрации глобулина, связывающего половые гормоны (у 80% пациенток подросткового возраста и 88% репродуктивного возраста), не зависело от ожирения и содержания половых гормонов, а было взаимосвязано с инсулинорезистентностью и гиперинсулинемией.
- У лиц репродуктивного возраста метаболический синдром сопровождается структурно-функциональными изменениями геометрии левого желудочка по типу концентрической гипертрофии (41%) и нарушением диастолической функции миокарда (38%). Кроме составляющих метаболического синдрома (гиперинсулинемии, артериальной гипертензии и др.), концентрическая гипертрофия миокарда может быть обусловлена низким уровнем адипонектина, который способствует ремоделированию кардиомиоцитов и высоким уровнем ИФР-I, который может действовать в качестве ростового фактора.
- У женщин репродуктивного возраста гиперинсулинемия приводит к прогрессивному снижению секреции инсулина и формированию «скрытого» сахарного диабета под маской метаболического синдрома. Атеросклеротические изменения сосудов развиваются медленнее вследствие протективного действия женских половых гормонов и в репродуктивном возрасте реже приводят к возникновению заболеваний сердечно-сосудистой системы. С целью диагностики ранних отклонений, приводящих к развитию СД 2-го типа и атеросклеротических заболеваний, целесообразно использовать разработанную нами программу обследования пациенток на предмет наличия у них метаболических и гормональных нарушений уже в подростковом и репродуктивном возрасте.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- У лиц женского пола подросткового и репродуктивного возраста для диагностики метаболического синдрома необходимо использовать модифицированные критерии IDF (2005), а также применять программу обследования и критерии метаболического синдрома, полученные в настоящей работе.
- При наличии любых признаков метаболического синдрома у лиц женского пола подросткового и репродуктивного возраста диагностику метаболического синдрома необходимо проводить даже при нормальной массе тела и при гиноидном типе распределения жировой ткани.
- При наличии в анамнезе жизни патологической массы тела при рождении, вследствие врожденной склонности к нарушению углеводного обмена профилактика метаболического синдрома должна начинаться еще в раннем детском возрасте и включать меры по изменению образа жизни и характера питания. При наличии в семейном анамнезе нарушений углеводного обмена у родственников своевременную диагностику и профилактику метаболического синдрома необходимо начинать уже в подростковом возрасте.
- В случае отсутствия гиперинсулинемии при метаболическом синдроме у лиц женского пола, необходимо определять содержание в крови уровня ИФР-I.
- У пациенток с одним и более дополнительными факторами риска, но не имеющих полной клинико-лабораторной картины, ранняя диагностика метаболического синдрома должна проводиться с помощью теста толерантности к глюкозе с одновременным определением уровня инсулина.
- При выявлении проявлений метаболического синдрома у лиц женского пола старше 15 лет, рекомендуется регулярно проходить тщательный ультразвуковой мониторинг репродуктивной системы (органы малого таза и молочные железы) для профилактики онкологических заболеваний репродуктивной системы. Необходимы консультации с онкологом, гинекологом, маммологом.
- При обнаружении у лиц женского пола подросткового и репродуктивного возраста перименопаузального типа строения молочных желез и/или преобладания фиброзного компонента в структуре железистой ткани, целесообразно проведение обследования на предмет наличия у них гормональных нарушений, характерных для метаболического синдрома.
- Для оценки степени выраженности метаболических нарушений наиболее информативно в раннюю фолликулярную фазу менструального цикла проводить определение уровня глобулина, связывающего половые гормоны.
- Снижение общего времени физической нагрузки, патологическое повышение артериального давления на высоте нагрузочной пробы, увеличение длительности восстановления АД после физической нагрузки взаимосвязаны со многими проявлениями метаболического синдрома и могут свидетельствовать о раннем нарушении функционального состояния сердечно-сосудистой системы. При выявлении концентрической гипертрофии миокарда у лиц женского пола репродуктивного возраста целесообразным является проведение обследования на предмет наличия у них метаболических и гормональных нарушений, характерных для метаболического синдрома.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Беляков Н.А. Инсулинорезистентность и синдром поликистозных яичников. Часть I. Исторические данные, распространенность, терминология и классификация, клеточные и молекулярные механизмы, клинические признаки и диагностические критерии / Беляков Н.А., Чубриева С.Ю., Глухов Н.В. // Эфферентная терапия. 2002. Т. 8, № 2. С. 3–11.
- Беляков Н.А. Инсулинорезистентность и синдром поликистозных яичников. Часть II. Патогенез, роль гиперинсулинемии и гиперандрогенемии, генетическая взаимосвязь / Беляков Н.А., Чубриева С.Ю., Глухов Н.В. // Эфферентная терапия. 2002. Т. 8, № 3. С. 16–29.
- Беляков Н.А. Ишемические изменения миокарда при метаболическом синдроме по данным холтеровского мониторирования электрокардиограммы / Беляков Н.А., Чубриева С.Ю., Великанова Л.И. // Вестник аритмологии. – 2000. – №.16. – С. 28-31.
- Беляков Н.А. Синдром поликистозных яичников как фактор риска сосудистых, метаболических и гинекологических заболеваний / Беляков Н.А., Чубриева С.Ю., Глухов Н.В. // Медицинский академический журнал. 2003. Т. 3, № 2. С. 19–35.
- Беляков Н.А. Метаболические нарушения при синдроме поликистозных яичников у женщин репродуктивного возраста / Беляков Н.А., Чубриева С.Ю., Глухов Н.В., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Медицинский академический журнал. — 2005. Т. 5, № 1. С. 74–87.
- Беляков Н.А. Метаболические и гормональные нарушения при синдроме поликистозных яичников у женщин репродуктивного возраста / Беляков Н.А., Чубриева С.Ю., Глухов Н.В., Великанова Л.И., Чубкин И.В. // Российский семейный врач. 2005. Т. 9, № 1. С. 27–33.
- Чубриева С.Ю. Роль лептина в развитии метаболических нарушений при синдроме поликистозных яичников у женщин репродуктивного возраста / Чубриева С.Ю., Глухов Н.В. // Медицинский академический журнал. 2006. Т. 6, № 4. С. 88–98.
- Беляков Н.А. Метаболический синдром и атеросклероз / Беляков Н.А., Чубриева С.Ю. // Медицинский академический журнал. 2007. Т. 7, № 1. С. 45–60.
- Чубриева С.Ю. Метаболический синдром у девушек-подростков / Чубриева С.Ю., Беляков Н.А., Глухов Н.В., Чубкин И.В. // Журнал акушерства и женских болезней. 2007. Т. LVI, Вып. 3. С. 3–13.
- Чубриева С.Ю. Метаболический синдром и его диагностические критерии / Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Вестник Российской Военно-медицинской академии. 2007. № 2(18). С. 128–133.
- Чубриева С.Ю. Жировая ткань как эндокринный орган (Обзор литературы) / Чубриева С.Ю., Глухов Н.В., Зайчик А.М. // Вестн. С.-Петерб. ун-та. Серия 11. Медицина. 2008. Вып. 1. С. 32–43.
- Беляков Н.А. Сахарный диабет как основной компонент патогенеза метаболического синдрома / Беляков Н.А., Чубриева С.Ю. // Медицинский академический журнал. 2008. Т. 8, № 1. — С. 116 127.
- Глухов Н.В. Заболевания, ассоциированные с синдромом поликистозных яичников и метаболическим синдромом / Глухов Н.В., Чубриева С.Ю., Беляков Н.А. // Эфферентная терапия. 2007. Т. 13, № 1. С. 17–19.
- Беляков Н.А. Метаболический синдром у девушек в период полового созревания / Беляков Н.А., Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Эфферентная терапия. 2007. Т. 13, № 1. С. 4–6.
- Чубриева С.Ю. Диагностические критерии метаболического синдрома у женщин // Эфферентная терапия. 2007. Т. 13, № 1. С. 63–69.
- Беляков Н.А. Роль лептина в патогенезе синдрома поликистозных яичников и метаболического синдрома у женщин / Беляков Н.А., Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Клиническая патофизиология. 2005. Т. 2, № 1. С. 73–80.
- Чубриева С.Ю. Диагностические критерии метаболического синдрома / Чубриева С.Ю., Глухов Н.В. // Российский семейный врач. 2007. Т. 11, № 1. С. 4–9.
- Беляков Н.А. Метаболический синдром и синдром поликистозных яичников / Беляков Н.А., Чубриева С.Ю., Глухов Н.В. // Доводы и практика: Тезисы докл. Французско-Российского конгресса семейных врачей. Санкт-Петербург, 29–31 января 2005 г. С. 7–8.
- Беляков Н.А. Дислипидемия при синдроме поликистозных яичников у женщин репродуктивного возраста / Беляков Н.А., Чубриева С.Ю., Глухов Н.В. // Высокие медицинские технологии в эндокринологии: Материалы V Всероссийского конгресса эндокринологов. Москва, 30 окт. – 02 ноября 2006 г. С. 617.
- Глухов Н.В. Уровень глобулина, связывающего половые гормоны, при синдроме поликистозных яичников у женщин репродуктивного возраста / Глухов Н.В., Чубриева С.Ю., Беляков Н.А. // Высокие медицинские технологии в эндокринологии: Материалы V Всероссийского конгресса эндокринологов. Москва, 30 октября – 02 ноября 2006 г. С. 577.
- Глухов Н.В. Преждевременное адренархе в анамнезе как ранний признак инсулинорезистентности и предвестник развития синдрома поликистозных яичников и метаболического синдрома / Глухов Н.В., Чубриева С.Ю., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 91.
- Чубриева С.Ю. Влияние метаболических нарушений на уровень лютеинизирующего и фолликулостимулирующего гормонов гипофиза при синдроме поликистозных яичников у женщин репродуктивного возраста / Чубриева С.Ю., Глухов Н.В., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 105.
- Чубриева С.Ю. Уровень лептина при синдроме поликистозных яичников у женщин репродуктивного возраста в зависимости от наличия ожирения / Чубриева С.Ю., Глухов Н.В., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 106.
- Глухов Н.В. Сниженная масса тела при рождении как предиктор склонности к развитию метаболических нарушений у женщин с синдромом поликистозных яичников / Глухов Н.В., Чубриева С.Ю., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. — Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 91–92.
- Чубриева С.Ю. Роль наследственной предрасположенности в развитии метаболических нарушений при синдроме поликистозных яичников / Чубриева С.Ю., Глухов Н.В., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 106.
- Глухов Н.В. Андрогенное лобно-теменное облысение как характерное клиническое проявление метаболического синдрома у женщин с синдромом поликистозных яичников / Глухов Н.В., Чубриева С.Ю., Великанова Л.И., Серебрякова И.П., Чубкин И.В. // Метаболический синдром у женщин: Материалы науч. конф. — Санкт-Петербург, 05–06 октября 2006 г. / Эфферентная терапия. 2007. Т. 13, № 1. С. 90–91.
- Чубриева С.Ю. Эхографические маркеры метаболического синдрома у девушек в возрастном периоде 15-21 год / Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Невский Радиологический Форум «Новые горизонты»: Сб. науч. трудов. Санкт-Петербург, 07–10 апреля 2007 г. «ЭЛБИ-СПб», 2007. С. 642–643.
- Глухов Н.В. Влияние диеты на метаболические показатели при синдроме поликистозных яичников у женщин репродуктивного возраста / Глухов Н.В., Чубриева С.Ю., Чубкин И.В. // Стандарты диагностики и лечения в клинике внутренних болезней. Сердечно-сосудистые заболевания: Материалы Рос. науч.-практ. конф. Санкт-Петербург, 14–16 ноября 2007 г. / Вестник Российской Военно-медицинской академии. 2007. № 2(18). С. 168.
- Чубриева С.Ю. Влияние малоподвижного образа жизни на метаболические показатели при синдроме поликистозных яичников у женщин репродуктивного возраста / Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Стандарты диагностики и лечения в клинике внутренних болезней. Сердечно-сосудистые заболевания: Материалы Рос. науч.-практ. конф. Санкт-Петербург, 14–16 ноября 2007 г. / Вестник Российской Военно-медицинской академии. 2007. № 2(18). С. 169.
- Чубриева С.Ю. Патологическая масса тела при рождении как предиктор развития метаболических нарушений у лиц женского пола подросткового возраста / Чубриева С.Ю., Глухов Н.В., Чубкин И.В. // Здоровье семьи — XXI век, Онкология XXI век: Материалы XII международной науч. конф. и III международной науч. онкологич. конф. г.Эйлат, Израиль, 29 апреля – 07 мая 2008 года. Пермь: Изд-во ПОНИЦАА, 2008. С. 393–394.
- Gloukhov N.V. Sex hormone-binding globulin levels in women of reproductive age with polycystic ovary syndrome / Gloukhov N.V., Tchoubrieva S.Yu., Belyakov N.A. // Abstracts of the 5th International Congress of Pathophysiology, June 28 – July 1, 2006, Beijing, China / Chinese Journal of Pathophysiology. 2006. Vol. 22, № 13. P. 284–285.
- Tchoubrieva S.Yu. Leptin levels in lean and obese women of reproductive age with polycystic ovary syndrome / Tchoubrieva S.Yu., Gloukhov N.V., Belyakov N.A. // Abstracts of the 5th International Congress of Pathophysiology, June 28 – July 1, 2006, Beijing, China / Chinese Journal of Pathophysiology. 2006. Vol. 22, № 13. P. 300.
- Belyakov N.A. Dyslipidemia in women of reproductive age with polycystic ovary syndrome / Belyakov N.A., Tchoubrieva S.Yu., Gloukhov N.V. // Abstracts of the 5th International Congress of Pathophysiology, June 28 – July 1, 2006, Beijing, China / Chinese Journal of Pathophysiology. 2006. Vol. 22, № 13. P. 12–13.
- Беляков Н.А., Сеидова Г.Б., Чубриева С.Ю., Глухов Н.В. Метаболический синдром у женщин. — СПб.: Издательский дом СПбМАПО, 2005. 440 с.
- Беляков Н.А. Метаболический синдром / Беляков Н.А., Чубриева С.Ю. // Гл. 3 в руководстве для врачей: «Ожирение» под редакцией Н.А. Белякова, В.И. Мазурова СПб.: Издательский дом СПбМАПО, 2003. С. 96–116.
- Беляков Н.А. Лечение метаболического синдрома / Беляков Н.А., Чубриева С.Ю. // Гл. 7 в руководстве для врачей: «Ожирение» под редакцией Н.А. Белякова, В.И. Мазурова СПб.: Издательский дом СПбМАПО, 2003. С. 219–231.
- Беляков Н.А. Пищевые добавки и природные энтеросорбенты / Беляков Н.А., Чубриева С.Ю. // Гл. 9 в руководстве для врачей: «Ожирение» под редакцией Н.А. Белякова, В.И. Мазурова СПб.: Издательский дом СПбМАПО, 2003. С. 301–317.
- Чубриева С.Ю. Метаболический синдром (эпидемиология, патогенез, клиническая картина и диагностика) / Чубриева С.Ю., Глухов Н.В. // Учебное пособие СПб.: Издательский дом СПбМАПО, 2006. 68 с.
- Глухов Н.В. Ультразвуковое исследование яичников (эндокринная патология яичников и нарушения овуляции) / Глухов Н.В., Чубриева С.Ю. // Учебно-метод. пособие. СПб.: Издательский дом СПбМАПО, 2006. 44 с.
- Чубриева С.Ю. Частота встречаемости и особенности проявлений метаболического синдрома у девушек подросткового возраста / // Журнал акушерства и женских болезней. 2009. Т. LVIII, Вып. 1. С. 12–19.
Список сокращений
АГ - артериальная гипертензия
АД – артериальное давление
ВОЗ - Всемирная организация здравоохранения
ГИ – гиперинсулинемия
ГИС - глюкозо-инсулиновое соотношение
ГСПГ - глобулин, связывающий половые гормоны
ИКДО - конечно-диастолический индекс
ИКСО - конечно-систолический индекс
ИММЛЖ – индекс массы миокарда левого желудочка
ИМТ - индекс массы тела
ИР – инсулинорезистентность
ИРИ - иммунореактивный инсулин
ИФА - иммуноферментный анализ
ИФР-I - инсулиноподобный фактор роста – I
КДР и КДО - конечные диастолические размер и объем
КСР и КСО - конечные систолические размер и объем
ММЛЖ - масса миокарда левого желудочка
МОК - минутный объем кровообращения
МС – метаболический синдром
НТГ - нарушение толерантности к глюкозе
ОТБ - отношение окружности талии к окружности бедер
ОТС - относительная толщина стенок
САД и ДАД – систолическое и диастолическое артериальное давление
СД – сахарный диабет
СИ - сердечный индекс
СПКЯ - синдром поликистозных яичников
ССЗ – сердечно-сосудистые заболевания
ТГ - триглицериды
ТЗСЛЖ - толщина задней стенки левого желудочка
ТМЖП - толщина межжелудочковой перегородки
ФР - факторы риска
ХС ЛПВП - холестерин липопротеиды высокой плотности
ХС ЛПНП - холестерин липопротеиды низкой плотности
ХС ЛПОНП - холестерин липопротеиды очень низкой плотности
ATP III - Американские клинические рекомендации по лечению взрослых
EGIR - Европейская группа по изучению инсулинорезистентности
HOMAb-cell - гомеостатический индекс функции b-клеток поджелудочной железы
HOMAIR - гомеостатический индекс инсулинорезистентности
IDF -Международная федерация диабетологов
TNF- - фактор некроза опухоли-
ААСЕ - Американская ассоциация клинических эндокринологов
