Клинико-патогенетические аспекты формирования церебральных нарушений при сахарном диабете 1 типа у детей и подростков 14. 00. 09 педиатрия
| Вид материала | Автореферат |
- Программа и Типовой План элективного курса по офтальмологии: "Поражение глаз при сахарном, 37.99kb.
- Взаимосвязь вариабельности артериального давления и уровня глюкозы крови при артериальной, 276.43kb.
- «клинико-метаболическиe, психосоциальныe закономерности формирования психосоматических, 1200.57kb.
- Рессия и экстернальный локус контроля при сахарном диабете II типа значимо взаимосвязаны, 108.58kb.
- Питание при сахарном диабете, 43.84kb.
- Информационно-методический материал для медицинских работников Сахарный диабет серьёзная, 47.48kb.
- А. В. Худяков Ивановская государственная медицинская академия, 672.35kb.
- Ермолаева Александра Ионашевна особенности течения цереброваскулярных заболеваний при, 538.95kb.
- Клинико-патогенетические механизмы развития внешне и внутрисекреторной недостаточности, 559.83kb.
- Метаболические и нейрофизиологические аспекты артериальной гипертензии у детей и подростков, 536.25kb.
Рис.10. Содержание мозгового нейротрофического фактора в сыворотке крови пациентов с СД с учетом выраженности церебральных нарушений при различной длительности заболевания
В то же время у больных 3-й группы определялось снижение уровня данного нейропептида по сравнению с детьми без церебральных нарушений как при длительности СД менее 3 лет (р=0,0323), так и болеющих от 3 до 6 лет (р=0,0434), а также более 6 лет (р=0,0443). У длительно болеющих пациентов с клиническими проявлениями ЦН определялось достоверное снижение уровня МНТФ по сравнению с детьми с субклиническими церебральными нарушениями (р=0,0445). У детей 2-й группы реактивное повышение уровня МНТФ по сравнению с контролем было значимым на всех стадиях болезни (р=0,0337, р=0,0175 и р=0,0036, соответственно), но при этом ниже, чем у пациентов 1-й группы на ранних стадиях СД (р=0,0490). Наиболее значительным было реактивное усиление продукции МНТФ на всех стадиях болезни у пациентов с СД, не имеющих церебральных нарушений (р=0,0145, р=0,0074, р=0,0002, соответственно)
Полученные данные, вероятно, отражают декомпенсацию процессов нейротрофического обеспечения у лиц с формирующейся энцефалопатией. Действительно, в литературе приводится множество подтверждений о неблагоприятном значении сниженной продукции МНТФ в отношении церебральных структур при различных патологических процессах (A.Nitta et al., 2002, J.M.Gatt, 2007, T.L.Huang et al., 2007, S.R.Joca et al., 2007). Установленная в нашем исследовании достоверная отрицательная корреляция уровня МНТФ с длительностью интервалов III-V КСВП (R=-0,4273, р=0,0175), позволяет предположить определенное нейрофизиологическое значение сниженной экспрессии данного фактора в проведении импульса между нижним мостом и средним мозгом.
В исследовании установлена отрицательная корреляция уровня МНТФ с латентным периодом 2-й стадии фазы медленного сна, (R=-0,7500, р=0,0321) и фазы быстрого сна (R=-0,6785, р=0,0437), общим количеством и продолжительностью апноэ/гипопноэ в период сна (R=-0,7785, р=0,0437, R=-0,7071, р=0,0482), а также индексом апноэ/гипопноэ (R=-0,8857, р=0,0188). Последний факт может объясняться несколькими причинами: во-первых, повышение гипоксических событий периода сна вследствие нарушения центральной регуляции акта дыхания является одним из симптомов дисциркуляторной энцефалопатии, прогрессирующих по мере нарастания ее тяжести, также как и снижение реактивной активации нейротрофической защиты коррелирует со степенью выраженности церебральной патологии, обусловленной СД; во-вторых, снижение экспрессии МНТФ может усиливать нейротоксичное действие доноров NO и астроцитарную активацию, в том числе, на центры регуляции дыхания; в-третьих, ухудшение центральной регуляции акта дыхания при прогрессировании поражения ЦНС усугубляет гипоксическое повреждение глиальных структур, что может нарушать протективную роль последних в отношении нейронов, снижая уровень активации нейротрофических факторов (C.Reali et al., 2005).
Выявленная достоверная отрицательная корреляция между уровнем белка S-100В и уровнем МНТФ (R=-0,2672, р=0,0245) может, с одной стороны указывать на возможную патогенетическую роль сниженного уровня нейропротекции, обеспечиваемую нейротрофическим фактором, в отношении повреждении астроцитарных структур, а с другой стороны, на возможное патогенное значение гипоксического повреждения глиальных структур в отношении снижения нейротрофического обеспечения нейронов.
У пациентов с неблагоприятным анте- и перинатальным анамнезом было отмечено достоверное повышение уровня белка S-100В и нейроспецифической енолазы в крови по сравнению с детьми без перинатального неблагополучия при длительности СД до 3 лет [S-100 – 221,2 (154,2;278,5) нг/л и 173,4 (132,5;247,3)нг/л, соответственно] [НСЕ – 20,3 (16,7; 27,0) мкг/мл и 11,5 (10,2;12,9) мкг/мл, соответственно], а также более выраженное снижение уровня МНТФ при длительности СД более 6 лет [5362 (5149;5717) пг/мл и 5707 (5543;6180) пг/мл, соответственно], что подтверждало повышенную уязвимость нейрональных и глиальных структур ЦНС в дебюте сахарного диабета и более выраженную декомпенсацию нейротрофического обеспечения мозга при длительном стаже болезни у данного контингента детей. Следовательно, тяжесть поражения ЦНС при данном заболевании в определенной мере обусловлена особенностями реакции структур мозга на гипоксию и метаболический стресс, делающих определенные участки ЦНС (прежде всего мезэнцефальные) наиболее уязвимыми при прочих равных условиях. К таким особенностям следует отнести не только сохраняющуюся длительно субклиническую альтерацию клеточных мембран ЦНС у пациентов, перенесших перинатальную гипоксию (Э.Ф.Яворская, 1990, Г.Н.Федоров и соавт., 2006), но и, по нашему мнению, избыточную продукцию белка S-100В, оказывающую нейротоксическое действие, а также более выраженную недостаточность активации нейротрофического обеспечения.
Кроме того, воздействие сильного и/или продолжительного стресса на развивающийся мозг в антенатальном периоде способно привести к программированию гиперактивации системы ответа на стресс, что приводит к повышению реактивности структур лимбико-ретикулярного комплекса, нарушению механизма отрицательной обратной глюкокортикостероидной связи (хронической относительной гиперкортизолемии в последующем периоде онтогенеза (E.Charmandari et al., 2003). Следовательно, у больных диабетом, подвергшихся неблагоприятным антенатальным воздействиям, наличие преморбидно обусловленной гиперергической реактивности ЛРК на стресс (как метаболический, так и психоэмоциональный) способно приводить к более выраженному выбросу контринсулярных гормонов, усилению продукции вазоконстрикторных субстанций в ответ на гипогликемию и текущие стрессовые жизненные события, создавая патофизиологическую основу для лабильного течения болезни и для более выраженного повреждения в этих условиях соответствующих структур мозга.
Н
Длительность СД
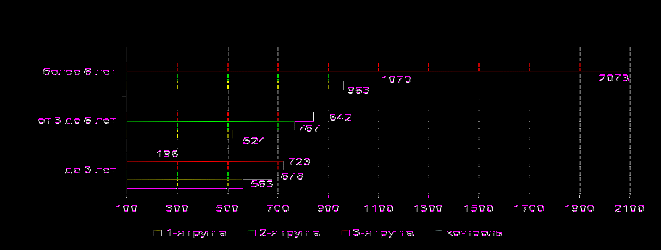
овым и относительно малоизученным нейропептидом, принимающим значимое участие в регуляции пищевого поведения, цикла сон-бодрствование, нейроэндокринной и автономной нервной системы является орексин (D.Burdakov et al, 2005, H.Davidowa, A.Plagemann, 2005, A.E.Kelley et al, 2005). У пациентов 3-й группы (рис.11) повышение орексина А в крови по сравнению с контролем носило статистически достоверный характер на всех стадиях заболевания (р=0,0042, р=0,0005, р=0,0002, соответственно), а по сравнению с детьми без церебральных нарушений – при длительном течении болезни (р=0,0403). У детей, имеющих субклинические проявления ЦН, повышение содержания орексина А по сравнению с контролем также отмечалось на всех стадиях болезни (р=0,0052, р=0,0031, р=0,0022), а у пациентов без церебральных изменений повышение содержания орексина А по сравнению с контролем достигало достоверности различий при длительном течении болезни (р=0,0051).
Р
Орексин А (пг/мл)
ис.11. Содержание орексина А в сыворотке крови пациентов с СД с учетом выраженности церебральных нарушений при различной длительности заболевания
У пациентов с оптимальным метаболическим контролем СД часто определяется тенденция к нестабильному уровню гликемии в течение дня, поскольку у таких больных повышена вероятность легких гипогликемий, и соответственно, контррегуляторных эффектов. В то же время, орексин является частью глюкосенсорной сети и играет определенную роль в поддержании стабильного уровня глюкозы, повышаясь при гипогликемии, стимулируя синтез глюкокортикостероидов и катехоламинов (R.Ouedraogo, et al., 2003, O.Johren et al., 2004), что может объяснять выявленное в работе повышение его уровня у больных диабетом.
Полученные нами данные, выявившие повышение уровня орексина у больных 2-й и 3-й группы, особенно, у длительно болеющих лиц, подтверждают вероятную роль изменения активности орексиновой системы мозга в формировании церебральных нарушений при сахарном диабете. Известны данные о модулирующем влиянии эндогенного орексина на когнитивные функции (L.B.Jaeger et al., 2002, S.A.Deadwyler et al., 2007), эмоциональную сферу (L.Brundin et al., 2007), мотивационное поведение (G.C.Harris et al., 2005), развитие нейроэндокринных нарушений (S.A.Farr, et al., 2005, Zwirska-Korczala K et al., 2007), формирование аддиктивного поведения (B.Boutrel, de L.Lecea, 2008).
Выявленная достоверная отрицательная корреляция уровня орексина А со средней скоростью кровотока в ПМА (R=-0,4354, р=0,0308), ЗМА (R=-0,4810, р=0,0432) и БА (R=-0,4767, р=0,0223) подтверждала связь ухудшения гемодинамического обеспечения определенных структур мозга с активацией орексиновой системы. Отмечено также повышение уровня орексина А у пациентов с пролонгированной длительностью интервала I-V КСВП (более 4,2 мс) по сравнению с больными, имеющими нормальную длительность данного интервала [889 (693;1869) и 1019 (902,5;2088,5), р=0,0967, соответственно], что указывало на связь изменения активности орексиновой системы с замедлением проведения импульса по проводящим путям среднего и промежуточного мозга, чему имеются экспериментальные подтверждения (T.L. Horvath et al., 1999, M.Wu et al., 2002), так как область передней и задней части паравентрикулярного ядра таламуса обильно снабжается волокнами орексиновых нейронов (G.J.Kirouac, et al., 2005).
Усиление выработки орексина может служить причиной нарушения структуры сна, его повышенной фрагментации. Выявленная у больных СД достоверная отрицательная корреляция уровня орексина А с латентным периодом 4-й стадии медленного сна (R=-0,8571, р=0,0136), продолжительностью ФБС (R=-0,7207, р=0,0376) подтверждает участие орексиновой системы в регуляции длительности и чередования стадий и фаз сна. Тесной взаимосвязью орексиновых нейронов с допаминергической системой в мезолимбической зоне (M.Narita et al., 2007) можно объяснить наблюдавшуюся в нашем исследовании редукцию стадии «сонных веретен», характерную для больных с недостаточностью дофамина (R.Manni, et al., 2007).
Установленная отрицательная корреляция уровня орексина А с уровнем сатурации как в фазе медленного (R=-0,6296, р=0,0498), так и в фазе быстрого сна (R=-0,7377, р=0,0343), предполагает наличие связи между усугублением гипоксии и активацией орексиновой системы у больных диабетом. Возможно, лабильность уровня гликемии, а также скрытые ночные гипогликемические состояния, столь часто отмечающиеся у детей и подростков с СД при оптимальном контроле заболевания, стимулируя выработку орексина, вызывают также дисфункцию нейронов ЦНС, регулирующих процессы дыхания. Также нельзя исключить, что нейроны орексиновой системы при их избыточной активации могут воздействовать на близлежащие нейроны других структур регуляции (G.J.Kirouac, et al., 2005), в том числе, акта дыхания.
Одним из серьезных патофизиологических последствий сахарного диабета является формирование дисбаланса регуляторов эндотелиально-вазальной системы, в частности, изменения синтеза и рилизинга оксида азота, обладающего вазодилатирующими свойствами (S.Moncada еt al., 1991, H.Li, U.Forstermann, 2000), что является составной частью патогенеза формирования диабетической микроангиопатии (М.В.Комкова, 2006, C. Dacou-Voutetakis et al., 1998, H.C.Lam et al., 2003).
У пациентов 2-й и, особенно, 3-й группы (рис.12) отмечалась тенденция к возрастанию уровня эндотелина в сыворотке крови на всех стадиях диабета, хотя статистическая достоверность его повышения по сравнению с группой пациентов без церебральных изменений была зафиксирована только у пациентов 3-й группы с длительностью диабета более 6 лет (р=0,0408). Это свидетельствовало об усилении вазоконстрикторных влияний при более выраженных проявлениях поражения мозга.
Р
Эндотелин-1 (фмоль/л)
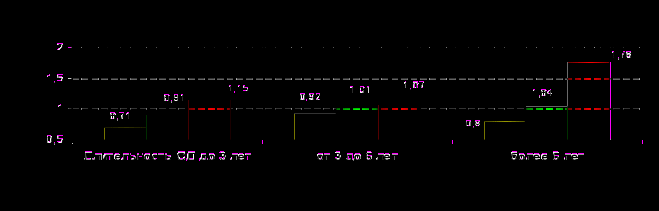 ис.12. Содержание эндотелина-1 в сыворотке крови в анализируемых группах пациентов с СД при различной длительности заболевания
ис.12. Содержание эндотелина-1 в сыворотке крови в анализируемых группах пациентов с СД при различной длительности заболевания У больных 3-й группы повышение уровня общих нитритов (рис.13) по сравнению с 1-й группой было достоверным на всех стадиях СД (до 3 лет, от 3 до 6 лет и более 6 лет) (р=0,0354, р=0,0008, р=0,0204, соответственно), а также по сравнению с 2-й группой у пациентов со стажем болезни от 3 до 6 лет (р=0,0451). Повышение уровня общих нитритов у больных с церебральными изменениями отражало компенсаторный характер усиления продукции оксида азота в стремлении поддержать равновесие между вазоконстрикторными и вазодилататорными влияниями с постепенной декомпенсацией последних на более поздних стадиях диабета.
Тенденция к повышению уровня общих нитритов у пациентов 2-й группы по сравнению с лицами без церебральных дисфункций была достоверной у длительно (свыше 6 лет) болеющих пациентов (р=0,0309). Следовательно, дисбаланс продукции вазоактивных субстанций у детей с субклиническими проявлениями ЦН был выражен меньше, чем в 3 группе, но степень напряженности системы эндотелиальной регуляции у них была, несомненно, выше по сравнению с лицами без церебральных нарушений.
Р
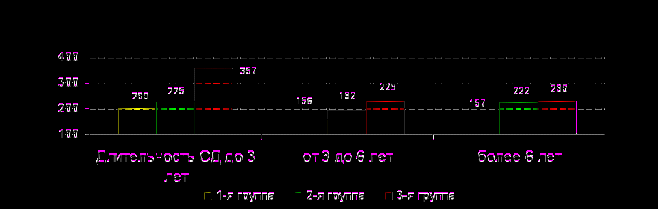
Общие нитриты (мкмоль/л)
ис.13. Содержание общих нитритов в сыворотке крови в анализируемых группах пациентов с СД при различной длительности заболевания
Анализ содержания сосудисто-эндотелиального фактора роста в сыворотке крови (рис. 14) у пациентов с различной выраженностью мозговых дисфункций при различной длительности сахарного диабета показал, что у пациентов 3-й группы уровень СЭФР в крови на всех стадиях СД (до 3 лет, от 3 до 6 лет и более 6 лет) был достоверно выше, чем в у лиц без церебральных нарушений (р=0,0354, р=0,0008, р=0,0204, соответственно).
О
Длительность СД
тмечалось также повышение уровня СЭФР у пациентов данной группы по сравнению с пациентами, имеющих субклинические церебральные изменения, при длительности заболевания от 3 до 6 лет и более 6 лет (р=0,0452, р=0,0493, соответственно). У пациентов с субклиническими проявлениями церебральных нарушений (2-я группа) отмечалось достоверное повышение уровня СЭФР по сравнению с пациентами без церебральных нарушений при длительности заболевания менее 3 лет и более 6 лет (р=0,0195, р=0,0480, соответственно).
Р
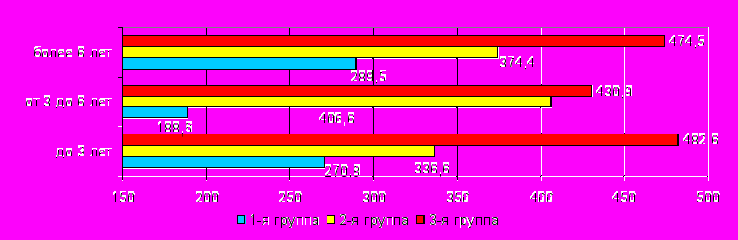
СЭФР (пкг/мл)
ис.14. Содержание сосудисто-эндотелиального фактора роста в сыворотке крови в анализируемых группах пациентов при различной длительности СД
Установлена также определенная связь содержания изучаемых эндотелиальных медиаторов у лиц с показателями средней скорости кровотока, полученными по данным ТКДГ, в передней и задней мозговых артериях. Так при снижении скорости кровотока в ПМА менее 60 см/сек медиана содержания общих нитритов составила 292,1 мкмоль/л (145,4;349,6), а при большей скорости кровотока – 187,4 (139,8;230,0) мкмоль/л (р=0,0456), уровня СЭФР, соответственно, – 412,4 (290,4;544,0) пкг/мл и 107,4 (79,2; 184,2) пкг/мл (р=0,0273). При снижении скорости кровотока в ЗМА менее 50 см/сек медиана содержания СЭФР составила 433,4 (187,9;566,2) пкг/мл, а при большей скорости кровотока – 152,8 (105,2;395,6) пкг/мл (р=0,0450). Различия в уровне эндотелина у пациентов со сниженной и нормальной скоростью церебрального кровотока в исследуемых артериях были статистически недостоверными.
Кроме того, проведение корреляционного анализа содержания эндотелиальных факторов в крови с характеристиками церебрального кровотока позволило выявить достоверную отрицательную корреляцию уровня СЭФР со средней скоростью кровотока в ПМА (R=-0,4447, р=0,0443), в ЗМА (R=-0,6694, р=0,0023), в БА (R=-0,4104, р=0,0496) и положительную связь с индексом резистентности в СМА (R=0,4924, р=0,0378) и в ЗМА (R=0,5109, р=0,0302). Эти данные свидетельствовали о тесной связи нарастания дисбаланса эндотелиальных регуляторов и ангиогенеза с ухудшением показателей кровотока в магистральных артериях мозга, осуществляющих кровоснабжение срединных структур ЦНС.
Был проведен анализ корреляционных взаимосвязей содержания эндотелиальных медиаторов в сыворотке крови у обследуемых пациентов с данными их полисомнографического обследования. Выявлена умеренная положительная корреляция уровня эндотелина со средней продолжительностью гипопноэ периода сна (R=0,6666, р=0,1019) и отрицательная – со средней сатурацией периода быстрого сна (R=-0,7537, р=0,0835). Установлена прямая умеренная корреляционная связь уровня общих нитритов с продолжительностью и представленностью 3-й стадии ФМС (R=0,7387, р=0,0578) и достоверная прямая связь с показателями средней сатурации периода бодрствования внутри сна (R=0,8827, р=0,0198). В то же время отмечалась достоверная обратная связь содержания общих нитритов с длительностью (р=0,0407) и процентной представленностью (р=0,0084) периода бодрствования внутри сна, а также сильная отрицательная связь с общей продолжительностью периода апноэ/гипоноэ (R=-0,6914, р=0,0823).
Уровень сосудисто-эндотелиального фактора роста (СЭФР) у больных диабетом положительно коррелировал со средним уровнем сатурации периода бодрствования внутри сна (R=0,7944, р=0,0405), а также длительностью и представленностью 3-й стадии медленного сна (R=0,7748, р=0,0415), при этом отмечена достоверная отрицательная связь с длительностью и процентной представленностью периода бодрствования внутри сна (р=0,0407, р=0,0008, соответственно). Это свидетельствовало о возможной положительной роли увеличения продукции нитритов и активации ангиогенеза в противодействии гипоксии и сегментации структуры ночного сна у больных диабетом.
Активация сосудистых ростовых факторов может быть причиной повышенной проницаемости микрососудов, избыточного их новообразования при диабете, например, в области сетчатки глаза (Cukiernik M, et al., 2004), становится причиной развития пролиферативной ретинопатии, приводящей в дальнейшем к слепоте. В то же время процесс ангиогенеза имеет и большое приспособительное значение в условиях хронической гипоксии, к которой приводят обменные и сосудистые диабетические нарушения, предотвращающее ишемическое повреждение важных жизненных органов. Эта протективная роль СЭФР может осуществляться благодаря стимуляции пролиферации и дифференцировки клеток-предшественников нейронов (T.D.Palmer, et al., 2000), его пермиссивному воздействию на стимуляцию продукции мозгового нейротрофического фактора (A.Louissaint, et al., 2002), а также в качестве агента, обеспечивающего быстрое прохождение глюкозы через ГЭБ в условиях острой гипогликемии, и предотвращающего, таким образом, неблагоприятные последствия нейрогликопении (D.Dantz et al., 2002).
Установленная в работе прямая связь концентрации СЭФР с уровнем МНТФ (R=0,3123, p=0,0031) и обратная связь с уровнем НСЕ (R=-0,3454, p=0,0412) подтверждала определенное протективное значение повышения продукции СЭФР при церебральных нарушениях вследствие его потенцирующего воздействия на нейротрофическое обеспечение мозга.
Наличие положительной корреляции уровня орексина с концентрацией эндотелина (R=0,2752, p=0,0081), а также отрицательной связи уровня орексина с концентрацией оксидов азота (R=-0,2558, p=0,0174) позволило связать изменения уровня данного нейропептида со степенью выраженности эндотелиальной дисфункции, хотя, скорее всего, эта связь носит опосредованный характер. В частности, повышение уровня орексина в ответ на метаболический стресс запускает механизм активации гипоталамо-гипофизарно-надпочечниковой оси (M.Kuru et al., 2000), который может являться одним из ключевых патогенетических звеньев формирования микроангиопатии при диабете (А.С.Ефимов, 1989), индуцируя соответствующие изменения уровней эндотелиальных регуляторов. Однако известны данные о непосредственном участии орексина в регуляции тонуса сосудов через взаимодействие с нитрергической системой (C.D.Shih, Y.C.Chuang, 2007), поэтому выявленные корреляционные связи орексина с содержанием вазоактивных субстанций в крови могут являться отражением части механизма поддержания стабильного сосудистого тонуса при сахарном диабете.
Полученные результаты, свидетельствовавшие о существовании прямой зависимости тяжести клинических и нейрофизиологических изменений у детей с СД с уровнем белка S-100В и СЭФР в крови, и обратной зависимости – с уровнем МНТФ, а также уровня S-100В в крови с уровнем МНТФ, послужили поводом для анализа частоты и характера церебральных дисфункций с учетом коэффициента соотношений данных пептидов в крови (S-100В + СЭФР) / МНТФ=К. Анализ частоты встречаемости различных значений К в анализируемых группах пациентов показал, что среди пациентов 1-й группы, куда вошли больные, не имеющие субклинических и клинических признаков церебральных дисфункций, частота случаев с К менее 0,06 достигала 77,8%, что было в 3 раза выше, чем среди больных 2-й группы с субклиническими ЦН (р=0,0002). Случаи со значениями К свыше 0,11 в этой группе вообще не встречались. Во 2-й группе большинство пациентов (72,7%) составили больные с уровнем К=0,06–0,11, что было в 3 раза больше, чем в 1-й группе (р=0,0002). В 3-й группе большинство пациентов имели К>0,11 (85,7%) при отсутствии случаев с К<0,06.
При этом тяжесть установленных клинико-неврологических диагнозов в этой группе нарастала при увеличении значений К. Так, если у больных с К= 0,06 – 0,11 эти диагнозы были представлены преимущественно непостоянными проявлениями астенического синдрома и/или нейроциркуляторной дистонией, то у пациентов с К>0,11, эти проявления носили более стойкий характер, и кроме того, отмечались неврозоподобные, цефалгические, дисфорические и когнитивные нарушения. На основании приведенных данных, впервые было установлено, что показатель соотношения К=(S-100В + СЭФР)/МНТФ, может служить объективным биохимическим высокоинформативным критерием тяжести церебральных нарушений у детей и подростков с СД, позволяя классифицировать легкие (К=0,06 – 0,11) и среднетяжелые их клинические формы (К > 0,11) («Способ диагностики степени тяжести диабетической энцефалопатии у детей и подростков» (№2008128337 от 11.07.2008).

