Клинико-патогенетические аспекты формирования церебральных нарушений при сахарном диабете 1 типа у детей и подростков 14. 00. 09 педиатрия
| Вид материала | Автореферат |
- Программа и Типовой План элективного курса по офтальмологии: "Поражение глаз при сахарном, 37.99kb.
- Взаимосвязь вариабельности артериального давления и уровня глюкозы крови при артериальной, 276.43kb.
- «клинико-метаболическиe, психосоциальныe закономерности формирования психосоматических, 1200.57kb.
- Рессия и экстернальный локус контроля при сахарном диабете II типа значимо взаимосвязаны, 108.58kb.
- Питание при сахарном диабете, 43.84kb.
- Информационно-методический материал для медицинских работников Сахарный диабет серьёзная, 47.48kb.
- А. В. Худяков Ивановская государственная медицинская академия, 672.35kb.
- Ермолаева Александра Ионашевна особенности течения цереброваскулярных заболеваний при, 538.95kb.
- Клинико-патогенетические механизмы развития внешне и внутрисекреторной недостаточности, 559.83kb.
- Метаболические и нейрофизиологические аспекты артериальной гипертензии у детей и подростков, 536.25kb.
При проведении неврологического обследования детей и подростков, страдающих сахарным диабетом 1 типа, у 91 пациента (52,3%) были выявлены различные клинические синдромы церебральных нарушений (ЦН) (рис.1). Самым частым из них был астенический симптомокомплекс, отмечавшийся у 56,0% больных с ЦН, развитие которого связано с истощением функциональных возможностей нервной системы вследствие аутоинтоксикации, нарушений кровоснабжения мозга и обмена в мозговой ткани (Б.В.Лебедев, 1995). Вегетативные расстройства, которые отмечались у 52,7% пациентов с клиническими синдромами ЦН, проявлялись, чаще всего, в нескольких анатомо-физиологических системах, сопровождаясь активными жалобами соматического характера. Другим весьма распространенным неврологическим нарушением является цефалгический синдром, выявлявшийся у 38,5% обследованных больных, формирование которого обусловлено дезинтеграцией неспецифических систем мозга под воздействием провоцирующих факторов: стрессов, дисгормональных нарушений, а также колебаний уровня гликемии. В основе развития неврозоподобных состояний, встречавшихся у 27,5% обследованных пациентов с ЦН, лежит дисфункция функциональных систем мозга, регулирующих психомоторную и вегетативную деятельность организма – гипоталамической области, ретикулярной формации, лимбической системы на фоне врожденной, в том числе наследственной их неполноценности (О.В. Воробьева, А.М. Вейн, 1999, Д.Р. Штульман, О.С. Левин, 1999). Синдром клинически выраженных когнитивных нарушений, который диагностировался при наличии жалоб пациентов и/или их родителей на плохую сообразительность, забывчивость, неустойчивое внимание, отмечался у 24,2% детей с ЦН. Диссомнические расстройства, которые фиксировались при наличии жалоб на трудности засыпания, поверхностный сон, иногда чувство разбитости после сна, сонливость в дневное время, выявлялись у 19,8% пациентов с ЦН. Существование клинически выраженных нейроэндокринных нарушений, выявленных у 16,5 % пациентов с СД, также объясняется декомпенсацией нейротрансмиттерных дефектов гипоталамической регуляции под влиянием метаболических и микроциркуляторных расстройств, присущих СД. Эмоциональные нарушения, проявляющиеся беспокойством, психической неуравновешенностью, вспыльчивостью, раздражительностью, плаксивостью, пониженным настроением, а у детей младшего возраста ─ гиперактивностью, двигательной расторможенностью, выявлялись у 1
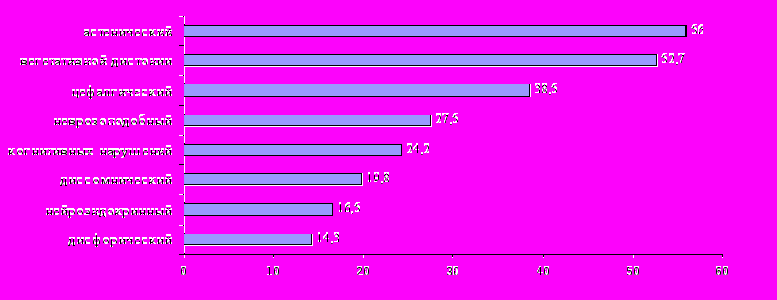 4,3% пациентов с ЦН.
4,3% пациентов с ЦН.Р
%
ис.1. Частота клинических синдромов церебральных нарушений
у детей и подростков с СД
Поскольку основными клиническими проявлениями диффузного поражения мозга, характерного для дисциркуляторно-дисметаболической энцефалопатии, являются когнитивные нарушения (С.В.Котов и соавт., 2000, Н.Н.Яхно, В.В.Захаров, 2002), изучение последних составило основу нейропсихологической части нашего исследования. Использование «Пробы на запоминание 10 слов», применявшейся в нашем исследовании, позволило получить информацию о процессах произвольной слухоречевой механической памяти.
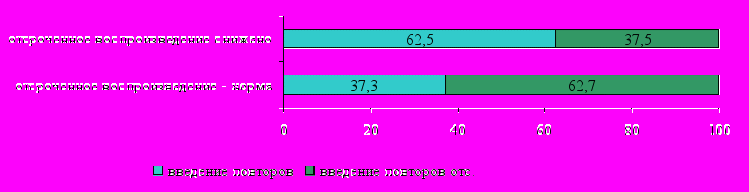
Максимального (не ниже 9-10 баллов) объема непосредственного воспроизведения (НВ) теста достигли 77,0% обследованных пациентов, из них у 76,1% больных объем отсроченного воспроизведения (ОВ) при интерференции счетом не был снижен, а у 23,9% детей регистрировалось снижение ОВ при интерференции счетом, характерное для дисфункции гипоталамо-гипофизарной области мозга (Н.К.Корсакова, Л.И.Московичюте,1988).
У 37,3 % пациентов с нормальным объемом НВ и ОВ и у 62,5% с нормальным объемом НВ и сниженным объемом ОВ (рис.2) отмечалось введение более одного повторяющегося слова при воспроизведении теста, свидетельствовавшее о функциональной недостаточности височно-базальных отделов мозга. Среди этих больных в 24,1% случаев также регистрировалось введение одного дополнительного слова при воспроизведении пробы. У 37,5% пациентов с нормальным объемом НВ и со сниженным ОВ введения повторов зафиксировано не было, что является характерным для дисфункции медиальной области височных долей мозга.
Р
%
ис.2 Характеристика результатов пробы на запоминание 10 слов у пациентов с СД с максимальным объемом непосредственного воспроизведения
Нормальный объем НВ и ОВ при отсутствии введения повторов или добавочных слов трактовался как отсутствие мнестических дисфункций (64 человека – 36,8%). Пациенты с нормальным объемом НВ, но со снижением ОВ и/или с наличием повторов, а также наличием единичных дополнительных слов при воспроизведении теста составили группу с легкими мнестическими дисфункциями (70 человек – 40,2%).
У 40 пациентов с СД (23,0%) выявлено снижение объема непосредственного воспроизведения на уровне нижних пределов возрастных норм или даже менее 7- 8 баллов, из них в 65,0% случаев отмечалось снижение объема воспроизведения при интерференции счетом, а в 82,5% случаев – введение более одного дополнительного слова при воспроизведении теста. Данный вид нарушений расценивался как выраженные мнестические дисфункции (МД). Нарушение механизма избирательности воспроизведения с введением побочных ассоциаций обусловлено изменением функционального состояния медиальных отделов лобных долей мозга.
В группе без клинических церебральных изменений пациенты с отсутствием мнестических дисфункций встречались в 2,3 раза чаще, чем среди больных с установленными диагнозами нарушений ЦНС (55,4% и 19,8%, соответственно, p=0,0001). Мнестические дисфункции легкой степени среди больных без клинических церебральных проявлений отмечались почти с такой же частотой, как и в группе пациентов с их наличием (37 чел.– 44,6% и 33 чел.– 36,3%, р>0,05). Выраженные МД определялись только в группе пациентов с установленными диагнозами нарушений ЦНС (43,9%, p=0,0001). Практически все пациенты, у которых отмечались клинические проявления нарушений памяти, вошли в состав этой группы.
В результате проведенного исследования функции внимания было установлено, что у больных СД патологические и низкие значения точности внимания определялись в 44,3 % случаев, при этом (табл.1) у больных с клинико-неврологическими синдромами нарушений ЦНС они отмечались в 2 раза чаще, чем у пациентов без таковых (p=0,0001). Наблюдалось повышение частоты патологических и низких значений точности внимания в 2,4 раза в группе пациентов без клинических ЦН с наличием МД по сравнению с пациентами без МД (р=0,026). В то же время у 17,4% пациентов без ЦН и без МД определялись сниженные показатели точности внимания.
Таблица 1
Частота различных показателей точности внимания в тесте Тулуз-Пьерона у пациентов с СД с учетом наличия клинических церебральных нарушений и
мнестических дисфункций (МД)
| Группы пациентов Показатели точности | Наличие клинических церебральных нарушений | р1 | р2 | |||
| Есть (n=91) | Нет (n=83) | |||||
| Общая группа (n=83) | МД есть (n=37) | МД нет (n=46) | ||||
| Патологические и низкие | 54 59,3 | 23 27,7 | 15 40,5 | 8 17,4 | 0,0001 | 0,0265 |
| Средние | 27 29,7 | 41 49,4 | 16 43,3 | 25 54,3 | 0,0086 | 0,3795 |
| Хорошие и высокие | 10 11,0 | 19 22,9 | 6 16,2 | 13 28,3 | 0,0424 | 0,2933 |
р – статистические различия между группами больных: р1 – с наличием и отсутствием клинико-неврологического диагноза; р2 – с наличием и отсутствием МД в группе без клинико-неврологического диагноза
Таким образом, по данным клинико-неврологического и нейропсихологического обследования у 78,2% детей и подростков с СД выявлялись церебральные нарушения, характерные для поражения структур, относящихся к лимбико-ретикулярному комплексу, из них у 66,9% пациентов они проявлялись в виде клинических синдромов, а у 33,1% – в виде когнитивных дисфункций. Полученные данные позволили разделить обследуемых пациентов на 3 группы.
1-ю группу составили 38 больных (21,8%), не имевших клинико-неврологических нарушений, а также признаков мнестических дисфункций и нарушений показателей внимания;
2-ю группу составили 45 больных (25,9%) с наличием мнестических дисфункций и нарушений внимания по данным тестирования;
3-я группа состояла из 91 пациента (52,3%) с наличием клинических неврологических синдромов и выраженными мнестическими дисфункциями.
Последующий анализ психологических, нейрофизиологических и биохимических изменений проводился с учетом этих трех выделенных групп.
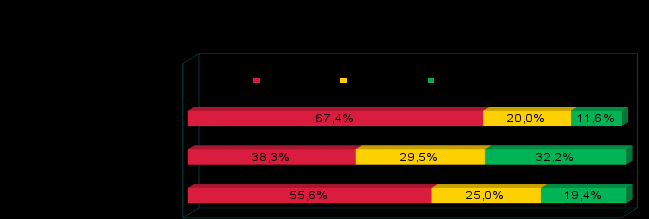
Нарушения сна по типу инсомний (расстройства инициации и поддержания сна) или парасомний (различных феноменов, возникающих в процессе сна) по результатам шкалы оценки качества сна диагностировались при сумме баллов более 12. Диссомнии выявлялись у 27% детей и подростков с СД, при этом в 1-й группе их зафиксировано не было, во 2-й группе – они определялись у 24,4% больных (р1-2=0,0007), а в 3-й – у 39,6% пациентов (р1-3=0,00001). Таким образом, частота нарушений сна по данным анкетирования превысила частоту диссомний, выявленную по результатам активных жалоб пациентов и/или их родственников, у больных с субклиническими церебральными дисфункциями в 2,5 раза, а с клиническими – в 4 раза.
Признаки легкой и маскированной депрессии, согласно результатам обследования по шкале депрессии НИИ им. Бехтерева, встречались у 33,3% пациентов 2-й группы и у 45,8% детей 3-й группы, в то время как среди пациентов 1-й группы подобных особенностей психоэмоциональной сферы обнаружено не было (р2-1= =0,0018 и р3-1=0,0001). Поскольку патогенетические механизмы депрессии связаны с дисбалансом функциональной активации полушарий головного мозга, функциональным дефицитом серотонинергической системы и нарушением регуляции норадренергической системы (И.П.Ашмарин, П.В.Стукалов, 1996; Н.М.van Praag , 1994; К.J.Ressler, Ch.D.Nemeroff, 2000), то полученные данные свидетельствуют о нарастании дисфункции данных структур при формировании поражения мозга у больных сахарным диабетом.
По данным теста Спилбергера-Ханина показатели высокой личностной тревожности определялись у 44,4% подростков с субклиническими и у 50,0% подростков с клиническими проявлениями ЦН, тогда как у больных 1-й группы – только у 20,0% (р2-1=0,0799 и р3-1=0,0223). Достаточно высокий уровень личностной тревожности у большинства пациентов с СД свидетельствует об их конституциональной восприимчивости к стрессу и склонности переживать негативные эмоции в связи с различными трудностями гораздо острее, чем у детей с низким уровнем тревоги. Это может приводить у них к более лабильному течению СД и, следовательно, более выраженному поражению систем неспецифической регуляции мозга, в частности, структур мозга, входящих в лимбическую систему, являющуюся анатомическим субстратом эмоций (А.Б.Смулевич, 2001, Е.В.Вербицкий, 2003, E.Ofek, H.Pratt, 2005). Кроме того, длительное перенапряжение нервной деятельности с постоянным раздражением структур лимбико-ретикулярного комплекса (ЛРК) как в результате психоэмоционального стресса, вызванного фактом наличия неизлечимой болезни, так и вследствие постоянного воздействия метаболического стресса, приводит к усилению активности гиппокампа при ослаблении контроля со стороны передних областей коры головного мозга (З.А.Зорина и соавт., 1999). Увеличение количества пациентов с высокой личностной тревогой во 2-й и 3-й группах по сравнению с пациентами свидетельствует о нарастании дисфункции вышеназванных структур мозга при формировании церебральных нарушений у больных диабетом.
У 16,5% пациентов 3-й группы были зафиксированы поведенческие девиации, укладывающиеся в понятие синдрома лимбической системы. Для последнего характерными являются психопатоподобное поведение с чертами истероидности и ипохондричности, неадекватное поведение с элементами демонстративности, лживости, иногда расторможенность инстинктивных форм поведения: булимия, гиперсексуальность, агрессивность. Подтверждением повышенного риска психопатизации среди подростков с СД является выявленное в нашем исследовании стремление у 13,2% пациентов испытать особое измененное состояние сознания при гипогликемиях, которое свидетельствует о тенденции к аддиктивному поведению у данной категории больных.
В
 ыявленное нами повышение частоты церебральных нарушений у детей на начальных (до 3 лет) стадиях болезни (рис.3) по сравнению с болеющими 3-6 лет (р=0,052), очевидно, связано с реакцией нейрональных структур в дебюте СД на метаболический аффект, вызванный манифестацией заболевания (прежде всего в определенных зонах ЛРК), а также последующим снижением интенсивности этой реакции вследствие адаптации к стрессу и проведения терапевтической коррекции.
ыявленное нами повышение частоты церебральных нарушений у детей на начальных (до 3 лет) стадиях болезни (рис.3) по сравнению с болеющими 3-6 лет (р=0,052), очевидно, связано с реакцией нейрональных структур в дебюте СД на метаболический аффект, вызванный манифестацией заболевания (прежде всего в определенных зонах ЛРК), а также последующим снижением интенсивности этой реакции вследствие адаптации к стрессу и проведения терапевтической коррекции. Рис.3. Относительное количество пациентов с различной выраженностью церебральных нарушений с учетом длительности сахарного диабета
Отмеченное возрастание частоты клинически выраженных церебральных дисфункций у пациентов с длительным (более 6 лет) стажем болезни (р=0,0047) подтверждало существующую точку зрения о том, что неврологические нарушения у части больных при СД неуклонно прогрессируют, несмотря на полноценность гипогликемизирующей терапии СД (С.В.Котов и соавт., 2000). Очевидно, тканевые метаболические нарушения сохраняются постоянно, независимо от уровня гликемии, и, по-видимому, в определенной степени генетически детерминированы. Кроме того, при длительном течении болезни происходит развитие микроциркуляторных осложнений СД, в том числе в ЦНС, а также нарушение гемодинамики в магистральных сосудах мозга вследствие развития микроангиопатии vasa vasorum (J.Shen et al., 2002). Показанное в нашем исследовании увеличение частоты случаев (рис.4) с изменениями сосудов на глазном дне в 1,8 раза среди детей с клиническими церебральными проявлениями, а также в 1,4 раза среди детей с субклиническими ЦН по сравнению с пациентами без таковых (р2-1=0,0322 и р3-1=0,3583) подтвердило связь ретинальной микроангиопатии с формированием диабетической энцефалопатии.
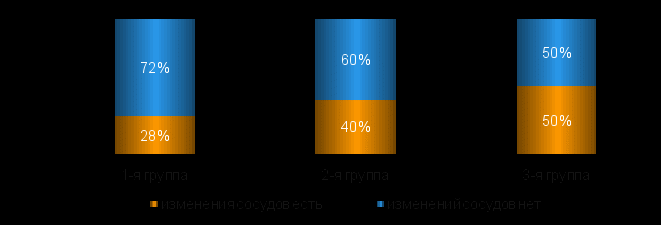
Рис.4. Частота пациентов с микроциркуляторными осложнениями сахарного диабета на глазном дне в анализируемых группах
Проведение анализа силы влияния основных характеристик углеводного обмена на формирование церебральных нарушений не выявило существенных различий в частоте клинических и нейропсихологических дисфункций при оптимальном (HbA1c до 7,5%) и субоптимальном (HbA1c от 7,5% до 9,0%) контроле заболевания. В то же время показатели максимальной амплитуды колебаний гликемии, будучи минимальными у пациентов 1-й группы [медиана 7,1 (5,7;9,5) ммоль/л], возрастали у больных 2-й [8,5 (6,3;10,4) ммоль/л] и, особенно, 3-й группы [10,9 (7,5;12,2) ммоль/л] (р2-1=0,5612, р3-1=0,0324, р3-2= 0,0681). По мнению многих диабетологов, HbA(1c), отражая средние значения гликемии, существенным образом не соотносится с гликемической нестабильностью (R.Derr, E.Garrett, 2003), тогда как последняя может иметь для формирования микроциркуляторных осложнений гораздо более патогенное значение, чем сама по себе хроническая гипергликемия (A.Сeriello, et al., 2008). Выявленная тенденция к повышению максимальной амплитуды колебаний гликемии у пациентов с субклинической и, особенно, с клинической формой поражения ЦНС, по сравнению с пациентами без таковых свидетельствует о взаимосвязи церебральных нарушений с лабильным течением заболевания, которая может носить обоюдный характер. С одной стороны, нестабильность уровня гликемии может обладать более выраженным повреждающим действием на структуры лимбико-ретикулярного комплекса (ЛРК), чем хроническая, но стабильная гипергликемия. С другой стороны, при нарушении регуляторных процессов на уровне структур ЛРК течение СД у детей приобретает ряд клинических особенностей, характеризующихся повышенной избыточной контррегуляторной гипергликемией, значительными колебаниями уровня постстрессорной гликемии, приводящими, в итоге, к увеличению амплитуды среднесуточной гликемии и, значит, к более лабильному течению сахарного диабета (В.Brosig et al., 2001). Кроме того, особенности эмоциональной сферы пациентов с СД, в виде усиления тревожно-депрессивных тенденций, могут оказывать влияние на долгосрочный метаболический контроль заболевания, воздействуя негативным образом на личностные характеристики ребенка, его обучаемость в школе сахарного диабета, соблюдение режима и комплаентность (S.Bargagna, et al., 1997, G.Vila et al., 1997, M.Nakazato, et al., 2000, M.J.Martinez Chamorro et al., 2002).
При длительности СД более 6 лет признаки клинически выраженных церебральных нарушений выявлялись у всех пациентов, заболевших до 7-летнего возраста, в то время как среди детей с той же длительностью болезни, но манифестировавших в более старшем возрасте, они отмечались в 67,7% случаев (р=0,0403). Средний возраст при выявлении СД у больных 3-й группы был достоверно ниже, чем у пациентов 1 группы [8,5 (6,9;10,2) лет и 9,3 (7,9;12,4) лет, соответственно, р=0,035].
Анализ анамнестических данных обследуемых пациентов выявил повышение частоты неблагоприятных факторов анте- и перинатального периода у больных с церебральными дисфункциями: так во 2-й группе такие указания имелись у 31,1% больных (р2-1=0,0681), а в 3-й группе – у 65,9% детей (р3-1=0,0001), в то время как у пациентов 1-й группы указания на подобные особенности перинатального периода отсутствовали. Считается, что перенесенная перинатальная гипоксия, даже при отсутствии клинических проявлений со стороны ЦНС в неонатальном возрасте, может в последующем периоде онтогенеза под воздействием экзогенных или эндогенных стрессоров стать причиной срыва адаптации, задержки биологического созревания ЦНС, формирования высших функций головного мозга, а также развития пограничной нервно-психической патологии (Н.Б. Андреева и соавт.,1990, А.А. Афонин,1993, Н.Н. Лагодина, 1998, А.Ю.Ратнер, 2005), что и происходит у таких детей при заболевании сахарным диабетом.
В настоящее время достигнуто понимание того, что формирование многих патологических процессов обусловлено или взаимосвязано с нарушениями нормальной физиологии сна. Изменения структуры сна у 66,7% пациентов с СД, по данным полисомнографического исследования (ПСИ), характеризовались наличием феноменов атипичного распределения представленности глубокого сна с равномерным распределением или даже постепенным увеличением его представленности в течение ночи. У лиц без нарушений углеводного обмена наибольшая представленность глубокого (3-я и 4-я стадии медленноволновой фазы) сна наблюдается в первом цикле сна с постепенным убыванием его представленности в цикле сна к утру, что является характерным для нормального сна (Г.В.Ковров, А.М. Вейн, 2004). Вероятно, эти проявления обусловлены нарушением функции нейронов орексиновой системы регуляции сна, имеющих также отношение к контролю метаболизма глюкозы.
Полисомнографическое исследование выявило также повышение частоты сегментации у пациентов с диабетом по сравнению со здоровыми лицами как медленноволновой (75,0% и 33,3%, соответственно, р=0,0027), так и парадоксальной фазы сна (78,1% и 25,0%, соответственно, р=0,0001), которая проявлялась многочисленными переключениями из одной стадии в другие и возвращением в исходную стадию сна (рис.5). Это свидетельствовало о нестабильности в работе центральных механизмов поддержания стадий сна, что считается одним из ранних признаков цереброваскулярных нарушений (A.R.Braun et al., 1997, P.Maquet 1997). Нарушение закономерного распределения стадии дельта-активности в периоде ночного сна, характерно и для депрессии, что указывает на взаимосвязь нарушений механизмов регуляции сна и развития депрессии (N.Breslau, 2006).
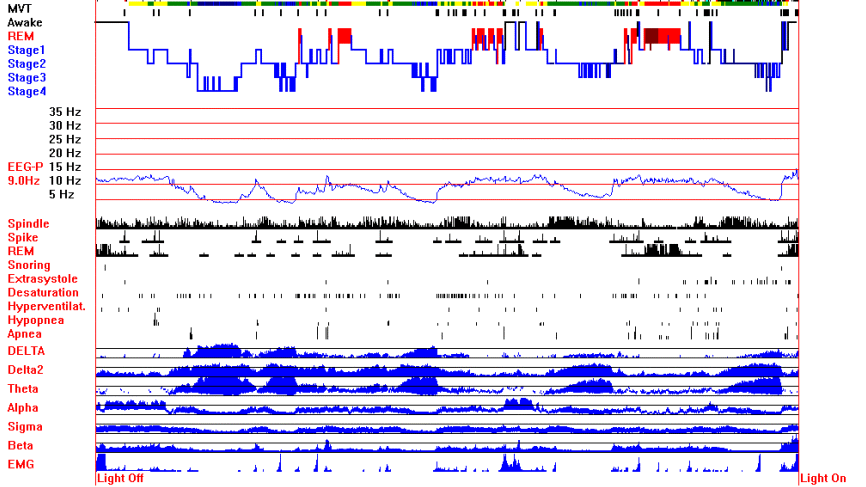
Рис. 5. Гипнограмма и другие события сна пациента с СД 1 типа
Обозначения: вверху – гипнограмма, отражающая глубину сна, посредством чередования фаз медленного сна (стадии – Stage 1 – 4) и фаз быстрого сна (REM); ниже – изменения частоты интегрального показателя ЭЭГ сна (EEG-P) в Гц; внизу – события сна, включающие: изменения электромиограммы (EMG), появления веретен сна (Spindle), пиков в ЭЭГ сна (Spike) и др.
Кроме того, ниже событий сна показаны изменения амплитуд отдельных частотных диапазонов ЭЭГ: Delta, Delta2, Theta, Alpha, Sigma, Beta, а также электромиограммы (EMG).
Другой особенностью медленного сна пациентов с диабетом было увеличение времени микроактиваций и движений во время сна по сравнению со здоровыми лицами [29,5 (25,5; 35,5) мин и 14,5(10,5;22,5) мин, р=0,0327]. У пациентов с диабетом также на 62,2% была выше общая продолжительность времени бодрствования периода ночного сна [50,0 (38,0;62,0) мин и 24,0 (20,0;38,0) мин, р=0,0051]. Увеличение числа микроактиваций, движений и общей продолжительности времени бодрствования внутри сна свидетельствует об уменьшении глубины сна. Подобные феномены регистрируются при тревожных расстройствах с той разницей, что при данных состояниях обычно имеет место сокращение периода дельта-сна. (Е.В., Вербицкий, 2006, M.G.Craske et al., 2002, T.M.Brown, T.W.Uhde, 2003, G.N.Papadimitriou, P.Linkowski, 2005). При этом основным патогенетическим фактором является дисбаланс ингибирующих и активирующих неспецифических систем мозга (избыточная активность системы пробуждения, недостаточность синхронизирующих механизмов), что сочетается с надсегментарной вегетативной активацией и гипофункцией парасимпатической иннервации в кардиоваскулярной системе (J.L.Abelson et al., 2007).
Характерной особенностью сна пациентов с диабетом по данным ПСИ являлась частая регистрация случаев нарушений дыхания, большая часть из которых соответствовала синдрому апноэ/гипопноэ сна легкой степени тяжести (А.Л. Калинкин, 2004). Так количество апноэ/гипопноэ у больных СД по сравнению со здоровыми детьми было повышено в 4 раза [1467 (258;2147) и 265 (145,335), соответственно, р=0,0114], средняя продолжительность апноэ/гипопноэ – в 2,5 раза [18,0 (12,0;27,0) сек и 9,5 (7,0;14,0) сек, р=0,0355], а индекс апноэ/гипопноэ – в 3 раза [8,0 (1,0; 21,0) эпиз./час и 3,0 (2,5;6,0) эпиз./час, р=0,0418]. Установлено, что у большинства пациентов с диабетом дыхание часто сопровождается посапыванием и похрапыванием, вероятность регистрации которого увеличивается при развитии глубокого сна. Действительно, количество эпизодов храпа и средняя продолжительность храпа были в несколько раз выше, чем у здоровых лиц [784 (592;1476) и 122 (43,5;196,5), соответственно, р=0,0017] и [91(69;162) мин и [27,0 (12,5; 45,0) мин, соответственно, р=0,0027], особенно при развитии глубокого сна, как следствие избыточного ослабления центральных активирующих влияний на соответствующие группы мышц. Снижение амплитуды дыхательных движений – гипопноэ в итоге уменьшает поступление кислорода в артериальную кровь и приводит к десатурациям, индекс которых у пациентов с СД был в несколько раз выше чем у лиц без нарушений углеводного обмена [2,0 (1,0;4,4) эпиз./час и 0,4 (0,1;1,6) эпиз./час, соответственно, р=0,0194], особенно, в фазу медленного сна [1,20 (0,70; 5,90) эпиз./час и 0,6 (0,25; 1,95) эпиз./час, соответственно, р=0,0072]. В итоге минимальный уровень кислородного насыщения у пациентов с СД был достоверно ниже, чем у здоровых лиц [89,0 (82,0;87,0)% и 93,0 (91,0;94,0)%, соответственно, р=0,0026]. Вероятной причиной нарушения дыхания во сне являются нарушения центральной регуляции акта дыхания, считающиеся одним из ранних признаков цереброваскулярных нарушений (J.Robbins et al., 2005). Гипоксия, возникающая вследствие обструктивного апноэ и гипопноэ, приводит к тахикардии и вазоконстрикции церебральных сосудов, включая область гипоталамуса, усугубляя патогенное влияние дисметаболических и дисциркуляторных влияний сахарного диабета на мозг.
Выявленные особенности структуры и событий сна были представлены в наибольшей степени у лиц с наличием клинических проявлений церебральных нарушений (рис.6, табл.1). Так среди больных, отнесенных к 3-й группе, достоверно чаще по сравнению с 1-й и 2-й группами, отмечалось удлинение 2-го и 3-го циклов сна (р=0,0063, р=0,0335, соответственно), атипичная представленность 2-й стадии сна (р=0,0237, р=0,0472, соответственно), увеличенная сегментация ФБС (р=0,0063, р=0,0335, соответственно), а также, по сравнению с пациентами 1-й группы, достоверно чаще отмечалось атипичная представленность глубокого сна (р=0,0237), фазы быстрого сна (р=0,0063) и увеличенная сегментация ФМС (р=0,0237). Кроме того, определялось статистически значимое по сравнению c 1-й и 2-й группами увеличение продолжительности бодрствования внутри сна (р=0,0121, р=0,0442, соответственно), движений во сне (р=0,0381, р=0,0438, соответственно), количества эпизодов храпа (р=0,0095, р=0,0002, соответственно), количества апноэ/гипопноэ (р=0,0116, р=0,0228, соответственно) и индекса десатур
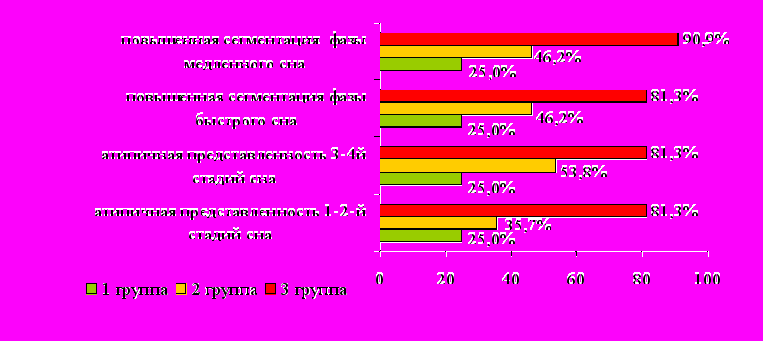 ации (р=0,0054, р=0,0252, соответственно).
ации (р=0,0054, р=0,0252, соответственно). 