Клинико-патогенетические аспекты формирования церебральных нарушений при сахарном диабете 1 типа у детей и подростков 14. 00. 09 педиатрия
| Вид материала | Автореферат |
- Программа и Типовой План элективного курса по офтальмологии: "Поражение глаз при сахарном, 37.99kb.
- Взаимосвязь вариабельности артериального давления и уровня глюкозы крови при артериальной, 276.43kb.
- «клинико-метаболическиe, психосоциальныe закономерности формирования психосоматических, 1200.57kb.
- Рессия и экстернальный локус контроля при сахарном диабете II типа значимо взаимосвязаны, 108.58kb.
- Питание при сахарном диабете, 43.84kb.
- Информационно-методический материал для медицинских работников Сахарный диабет серьёзная, 47.48kb.
- А. В. Худяков Ивановская государственная медицинская академия, 672.35kb.
- Ермолаева Александра Ионашевна особенности течения цереброваскулярных заболеваний при, 538.95kb.
- Клинико-патогенетические механизмы развития внешне и внутрисекреторной недостаточности, 559.83kb.
- Метаболические и нейрофизиологические аспекты артериальной гипертензии у детей и подростков, 536.25kb.
Таблица 1
| Показатели ПСИ Группы пациентов | Бодрствование внутри сна (мин) | Движения (мин) | Количество эпизодов храпа | Количество апноэ / гипопноэ | Индекс десатурации (эпиз./час) |
| 1 группа (n=8) | 37 (24,0;48,0) | 17,5 (8,5;26,5) | 165,0 (85,5;276,5) | 27,5 (20,0;66,5) | 0,8 (0,3; 1,8) |
| 2 группа (n=13) | 42,0 (18,5;59,0) | 22,0 (10,5;34,5) | 390,0 (225,5;850,0) | 39,0 (24,5;126,0) | 1,5 (0,4; 2,0) |
| 3 группа (n=11) | 64,0 (48,0;72,0) | 30,0 (24,5;54,0) | 1190,0 (765,0;1950,0) | 95,0 (54,5; 208,0) | 4,2 (1,6; 5,0) |
| р1 | 0,5422 | 0,2245 | 0,0341 | 0,0397 | 0,0443 |
| р2 | 0,0121 | 0,0381 | 0,0095 | 0,0116 | 0,0054 |
| р3 | 0,0442 | 0,0438 | 0,0002 | 0,0228 | 0,0252 |
Примечание: р – статистические различия между группами: р1 – 1-й и 2-й группой;
р2 – 1-й и 3-й группой; р3 – 2-й и 3-й группой
Однако у пациентов с субклиническими церебральными нарушениями (2-я группа) также определялось статистически значимое по сравнению c 1-й группой увеличение количества эпизодов храпа (р=0,0341), количества апноэ/гипопноэ (р=0,0397) и индекса десатурации (р=0,0443).
Таким образом, сахарный диабет влияет на структуру сна через ряд сложных механизмов, затрагивая деятельность различных нейрофизиологических и нейрохимических процессов, связанных с функциональным назначением отдельных стадий сна, а возрастание структурных нарушений и гипоксических событий в период ночного сна у пациентов по мере увеличения выраженности церебральных нарушений подтверждает наличие патогенетической взаимосвязи между дисфункцией систем ЦНС, регулирующих сон-бодрствование, и формированием диабетической энцефалопатии.
Исследование особенностей мозговой гемодинамики и паттерна коротколатентных слуховых вызванных потенциалов мозга было проведено у 88 детей и подростков с сахарным диабетом, из них 27 пациентов были с отсутствием клинико-неврологических проявлений и мнестических дисфункций (1-я группа), 33 человека – с наличием легких МД и/или нарушений внимания при отсутствии клинических ЦН (2-я группа) и 28 человек – с клиническими синдромами проявлений ЦН (3-я группа).
При проведении допплерографического исследования церебрального кровотока было установлено, что в общей группе пациентов с СД показатели средней скорости кровотока были снижены по сравнению с лицами без нарушений углеводного обмена в средней мозговой артерии (СМА) [72,0 (68,0;81,5) см/сек и 76,0(70,3;89,9) см/сек, р=0,0815] и задней мозговой артерии (ЗМА) [41,5 (39,3;44,0) см/сек и 50,0 (45,0; 54,8) см/сек, р=0,0454]. Индексы резистентности в общей группе больных СД по сравнению с контролем были значимо повышены в СМА [0,58 (0,54;0,61 и 0,52 (0,48;0,55), р=0,0221] и ЗМА [0,56 (0,54;0,59) и 0,54 (0,52;0,57), р=0,0736], тогда как в передней мозговой (ПМА) и базилярной артерии (БА) они достоверно не отличались от контрольных значений. Таким образом, мозговая гемодинамика у пациентов с СД характеризовалась различной степенью снижения кровенаполнения и повышением индекса резистентности артериального русла.
С учетом наличия изменений венозного оттока было выявлено преимущественно 3 типа ангиодистонических изменений:
1-й тип изменений церебрального кровотока по данным транскраниальной допплерографии (ТДГ1), отмечавшийся у 22,7% пациентов, характеризовался начальными проявлениями венозной дисгемии, определявшейся ретроградным кровотоком по глазничным венам, иногда несколько ускоренным (до 6-8 см/сек), усилением оттока по внутренним яремным и позвоночным венам, то есть экстракраниальным компенсированным типом церебральной венозной дисгемии;
2-й тип изменений церебрального кровотока (ТДГ2), выявлявшийся у 32,9% больных, расценивался как церебральная венозная дисгемия по интракраниальному типу 2-й степени, определявшейся гиперкинетическим кровотоком в базальных венах, прямом синусе, в ряде случаев, сочетающегося с ретроградным кровотоком по глазничным венам;
3-й тип изменений церебрального кровотока (ТДГ 3), отмечавшийся у 32,9% пациентов с СД, был представлен гипертонически-гипокинетическим вариантом кровотока в артериях основания головного мозга, характеризовавшимся снижением конечной диастолической и средней линейной скорости кровотока при повышении индекса резистентности в сочетании с признаками церебральной венозной дисгемии 1-й – 2-й степени (ускоренный кровоток по прямому синусу, ретроградный кровоток по верхнеглазничным венам).
Было установлено (рис. 7), что варианты 3-го типа церебрального кровотока встречались только среди больных 2-й (р1-2=0,0029) и 3-й группы (р1-3=0,00001), отмечаясь среди последних в 2,6 раза чаще, чем во второй группе (р2-3=0,0368). У пациентов 1-й группы нормальные варианты церебрального кровотока встречались в 2 раза чаще, чем у пациентов 2-й группы (р=0,0361) и в 9 раз чаще, чем у пациентов 3-й группы (р=0,00001). При этом у последних норма ТДГ определялась в 4,7 раза реже, чем у больных СД с субклиническими церебральными изменениями (р=0,0095).
В нашем исследовании выявлены существенные различия в частоте распределения различных вариантов допплерографических изменений церебрального кровотока в зависимости от степени нарушений микроциркуляции на глазном дне: наиболее неблагоприятные варианты церебрального кровотока определялись чаще у лиц с наличием микроциркуляторных нарушений на глазном дне (58,3% и 17,5%, соответственно, р=0,0002). По данным нейровизуализационных исследований, патологические изменения в ретинальных артериях развиваются параллельно с изменениями в мелких церебральных сосудах (T.Y.ссылка скрытаV.I.Kwa et al., 2002, N.Patton et al., 2005) и характеризуются типичными для микроангиопатии ультраструктурными изменениями (S.A.Moore et al., 1985), сопровождаясь, в частности, повреждением области базальных ганглиев (S.C.Ferguson et al., 2003), которые являются частью системы, обеспечивающей селективность психических процессов (Ю.Д.Кропотов, 2005).
При анализе допплерометрических характеристик церебрального кровотока с учетом наличия мозговых дисфункций (табл.2) выявлено статистически значимое снижение средней скорости кровотока у пациентов 3-й группы в ПМА и ЗМА по сравнению с 1-й группой (р=0,0382 и р=0,0445, соответственно), а также достоверное повышение индекса резистентности по сравнению с 1-й группой передней мозговой (р=0,0232) и основной артерии (р=0,0326).
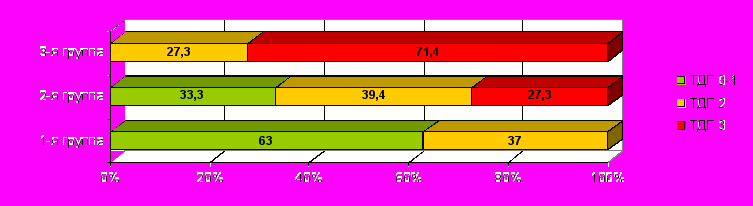 Рис.7. Частота основных вариантов допплерографических изменений (ТДГ) в группах пациентов с различной выраженностью церебральных нарушений
Рис.7. Частота основных вариантов допплерографических изменений (ТДГ) в группах пациентов с различной выраженностью церебральных нарушений Установлено статистически значимое снижение средней скорости кровотока у пациентов 2-й группы по сравнению с 1-й группой в ПМА (р=0,0453) и БА (р=0,0431). Тенденции к снижению скорости кровотока и повышению индекса резистентности у пациентов 1-й группы по сравнению со здоровыми лицами были наиболее выражены в ПМА и ЗМА, не достигая, однако, статистически значимых различий (р>0,05).
Таким образом, выявленные в нашем исследовании наиболее значимые изменения церебральной гемодинамики у больных диабетом были представлены в ПМА и ЗМА. Сосудистый бассейн ПМА обеспечивает кровоснабжение медиальных отделов лобных и части теменных долей мозга, передних и средних отделов мозолистого тела, передних отделов подкорковых образований и гипоталамуса. Глубокие ветви ЗМА питают крышу среднего мозга, гиппокамп, таламус, большую часть гипоталамуса. Поэтому при стенозе в бассейне ПМА и ЗМА формируется комплекс нейропсихологических симптомов, включающий в себя патологические феномены, происхождение которых обусловлено дефицитом кровоснабжения мозговых зон, объединенных данными сосудистыми бассейнами. Центральное место в клинической нейропсихологической картине такой недостаточности занимают нарушения памяти, которые по своей структуре соответствуют описанным выше мнестическим расстройствам, связанным с поражением диэнцефально-гипоталамической области.
Таблица 2
Показатели средней скорости кровотока и индекса резистентности в артериях мозга в анализируемых группах пациентов с СД (медианы, квартили)
| Показатели кровотока Группы пациентов | ПМА | СМА | ЗМА | БА | ||||
| Vm (см/сек) | IR | Vm (см/сек) | IR | Vm (см/сек) | IR | Vm (см/сек) | IR | |
| 1 группа (n=27) | 56,2 | 0,56 | 74,5 | 0,56 | 42,5 | 0,54 | 45,0 | 0,51 |
| 54 | 0,55 | 72,5 | 0,54 | 39 | 0,52 | 39,5 | 0,52 | |
| 62,5 | 0,59 | 83 | 0,57 | 45,5 | 0,56 | 49 | 0,56 | |
| 2 группа (n=33) | 53,0 | 0,56 | 72,0 | 0,56 | 40,0 | 0,54 | 42,5 | 0,53 |
| 52 | 0,56 | 70,0 | 0,55 | 37 | 0,52 | 40,5 | 0,50 | |
| 59,5 | 0,59 | 80,0 | 0,58 | 42,5 | 0,58 | 44 | 0,54 | |
| 3 группа (n=28) | 47,5 | 0,60 | 68,0 | 0,60 | 35,7 | 0,57 | 40,0 | 0,55 |
| 44 | 0,58 | 64,5 | 0,56 | 34 | 0,55 | 37,5 | 0,53 | |
| 52,5 | 0,62 | 73,0 | 0,62 | 39,5 | 0,59 | 45 | 0,58 | |
| р1 | 0,0453 | 0,1715 | 0,6421 | 0,2866 | 0,0832 | 0,6514 | 0,0431 | 0,0696 |
| р2 | 0,0382 | 0,0232 | 0,0856 | 0,1239 | 0,0445 | 0,0519 | 0,0287 | 0,0326 |
| р3 | 0,6002 | 0,0345 | 0,1205 | 0,2287 | 0,0638 | 0,2148 | 0,6722 | 0,0415 |
Ухудшение показателей кровотока в магистральных сосудах мозга, выявленное у пациентов с сахарным диабетом, может быть обусловлено несколькими возможными патофизиологическими причинами: развитием микроангиопатии сосудов, питающих стенку крупных сосудов (vasa vasorum); нарушениями механизмов центральной регуляции церебральной гемодинамики (G.Rodriguez et al., 1993), в том числе, из-за поражения автономных центров ствола мозга; формированием диабетической полинейропатии вегетативных волокон nervi vasorum (автономной нейропатии) крупных церебральных сосудов (Т.Е.Чернышова и соавт., 2005); развитием атеросклеротического процесса церебральных сосудов крупного и среднего калибра (A.Chan et al., 1983); нарушением гемодинамики в результате колебания уровня гликемии (R.B.Duckrow, 1990, M.Wakisaka et al., 1990); поражением церебральных венозных сосудов, приводящих к нарушениям венозного оттока по позвоночным сплетениям и регионарными изменениями тонуса внутричерепных вен. Не исключено, что развитие диабетической микроангиопатии ведет к нарушению мозгового кровотока не только через расстройства миогенной и метаболической регуляции, но также и через нарушения нейрогенной и нейрогуморальной регуляции тонуса крупных мозговых сосудов (O.B.Paulson et al., 1990).
При изучении паттерна коротколатентных слуховых вызванных потенциалов мозга (КСВП) было установлено, что у пациентов с СД определялось удлинение времени латентных периодов пиков КСВП по сравнению с нормой, достоверное по времени ответа при контрлатеральной стимуляции для IV [5,01(4,77;5,12) мс 4,79 (4,68;5,02) мс, р=0,0071], V [5,73 (5,51;5,92) мс и 5,55 (5,41; 5,66) мс, р=0,0422] и VI пика [6,83 (6,47;7,13) мс и 6,43 (6,21; 7,01) мс, р=0,0015].
Изучение характеристик КСВП с учетом наличия и выраженности проявлений церебральных дисфункций (табл. 3), позволило выявить достоверное по сравнению с пациентами без ЦН удлинение латентного периода ответа V пика у пациентов 3-й группы (р=0,0341) и длительностей интервалов III-V (р=0,0482) и I-V (р=0,0311), а также снижение соотношений амплитуд V/I (р=0,0318). В группе больных с субклиническими ЦН отмечалось статистически значимое по сравнению с пациентами без ЦН удлинение латентного периода ответа V пика (р=0,0455) и снижение соотношений амплитуд V/I (р=0,0478). Показатели КСВП у пациентов 1-й группы достоверно не отличались от контрольных значений за исключением длительности латентного периода ответа IV и VI пика (р=0,0423 и р=0,0432). Таким образом, установлено замедление проведения слухового импульса у больных с СД, имеющих субклинические признаки церебральных нарушений в виде мнестических дисфункций и/или нарушений функции внимания, что позволяет применять данный метод для объективизации доклинических изменений в ЦНС.
Проведенный корреляционный анализ между параметрами КСВП и допплерографическими характеристиками мозгового кровотока позволил установить наличие достоверных положительных корреляций между индексом резистентности ПМА и длительностью латентного периода ответа IV и V пика (R=0,707, р=0,016, R=0,721,р=0,018, соответственно), а также длительностью интервала III-V (R=0,775, р=0,004). Определялись также положительные корреляции индекса резистентности СМА с длительностью латенций V пика КСВП (R=0,601, р=0,041) и амплитудным соотношением V/I (R=0,805, р=0,002). Выявлены положительные корреляции индекса резистентности ЗМА с длительностью межпиковых интервалов III-V (R=0,663, р=0,027) и I-V (R=0,621, р=0,042) КСВП. В основной артерии ИР прямо коррелировал с длительностью интервалов III-V (R=0,625, р=0,036) и I-V КСВП (R=0,605, р=0,049).
Эти данные указывали на прогрессирование нарушений проведения импульса между стволовыми и мезэнцефальными структурами по мере ухудшения показателей церебрального кровотока.
Таблица 3
Показатели коротколатентных слуховых вызванных потенциалов (КСВП) в анализируемых группах пациентов с СД (медианы, квартили)
| Параметры КСВП Группы пациентов | Длительность латентных периодов пиков КСВП (мс) | Длительность межпиковых интервалов (мс) | ||||||||
| I | II | III | IV | V | VI | VII | I-III | III-V | I-V | |
| 1 группа (n=27) | 1,73 | 2,74 | 3,75 | 5,07 | 5,60 | 6,90 | 8,0 | 1,99 | 1,94 | 3,94 |
| 1,60 | 2,57 | 3,56 | 4,89 | 5,55 | 6,65 | 7,57 | 1,875 | 1,835 | 3,74 | |
| 1,76 | 2,78 | 3,84 | 5,12 | 5,81 | 7,15 | 8,19 | 2,105 | 2,05 | 4,24 | |
| 2 группа (n=33) | 1,68 | 2,72 | 3,7 | 4,98 | 5,74 | 6,88 | 8,14 | 2,14 | 1,98 | 4,11 |
| 1,45 | 2,57 | 3,54 | 4,74 | 5,68 | 6,75 | 7,58 | 2,00 | 1,79 | 3,89 | |
| 1,72 | 2,87 | 3,81 | 5,08 | 5,92 | 7,24 | 8,53 | 2,21 | 2,12 | 4,25 | |
| 3 группа (n=28) | 1,72 | 2,52 | 3,68 | 4,98 | 5,94 | 6,90 | 7,61 | 2,20 | 2,08 | 4,32 |
| 1,46 | 3,54 | 4,9 | 5,72 | 6,46 | 7,53 | 0,07 | 2,00 | 2,02 | 4,10 | |
| 1,78 | 3,96 | 5,34 | 6,04 | 6,96 | 8,12 | 0,13 | 2,41 | 2,18 | 4,32 | |
| р1 | 0,6847 | 0,2381 | 0,2365 | 0,2341 | 0,0455 | 0,5003 | 0,5038 | 0,2837 | 0,3876 | 0,2983 |
| р2 | 0,3483 | 0,7834 | 0,4276 | 0,1267 | 0,0341 | 0,9032 | 0,3484 | 0,1350 | 0,0482 | 0,0311 |
| р3 | 0,5623 | 0,5932 | 0,5028 | 0,0823 | 0,2958 | 0,4093 | 0,6734 | 0,1250 | 0,0934 | 0,0722 |
С целью изучения патогенетической роли нейропептидов в формировании поражения ЦНС при сахарном диабете 1-го типа у 88 детей и подростков с СД, прошедших клинико-неврологическое, нейропсихологическое, допплерографическое и электрофизиологическое обследование, было изучено содержание следующих мозгоспецифических пептидов в сыворотке крови: белка S-100В, нейроспецифической енолазы (НСЕ), мозгового нейротрофического фактора (МНТФ), орексина А. Контрольную группу составили 20 здоровых детей и подростков.
Был проведен анализ уровней изучаемых нейропептидов при различной длительности болезни с учетом наличия церебральных изменений. У пациентов 3-й группы (с клинически выраженными церебральными нарушениями) содержание S-100В в крови (рис.8) было достоверно выше на всех стадиях болезни (длительность СД менее 3 лет, от 3 до 6 лет и более 6 лет) как по сравнению с контролем (р=0,0002, р=0,0311, р=0,0005, соответственно), так и по сравнению с группой больных без церебральных нарушений (р=0,0252, р=0,0429, р=0,0106). У пациентов 2-й группы (с субклиническими церебральными дисфункциями) уровень S-100В в крови был также выше по сравнению с 1-й группой на всех этапах СД, достигая достоверности различий при длительности СД более 6 лет (р=0,0327). Медиана концентрации белка S-100В в крови в 1-й группе была повышена в 1,7 раза по сравнению с лицами без нарушений углеводного обмена и референтными его значениями при длительности СД до 3 лет и более 6 лет (р=0,0351 и р=0,0124, соответственно).
Астроциты и микроглия могут играть двоякую роль в отношении нейронов, как защищая их от повреждения через активацию нейротрофических факторов, так и индуцируя их дегенерацию через образование токсичных молекул (C.Reali et al., 2005). S-100В может оказывать токсический (дозозависимый) эффект на культуру астроцитов, опосредуемый через активацию индуцибельной NO-синтазы посредством активизации транскрипции фактора NFkappaB (A.G.Lam et al., 2001) и стресс-активированных киназ p38 и JNK. (G. Esposito et al., 2005), вызывая увеличение интенсивности и числа клеток, подвергающихся апоптозу (J.Hu, L.J.Van Eldik, 1996). Повышение уровня S-100B в крови у больных СД можно рассматривать как результат развития реактивного глиоза и повышенной проницаемости ГЭБ, вызванных гипергликемией и церебральной гипоксией.
Выявленная определенная динамика интенсивности данного процесса на различных этапах эволюции сахарного диабета может объясняться выраженной реакцией глиальных структур в дебюте СД, прежде всего в определенных зонах лимбико-ретикулярного комплекса, на метаболический аффект, вызванный манифестацией заболевания, последующей адаптацией к нему со снижением этой интенсивности этой реакции, и усилением активации астроцитоза при длительном течении болезни в связи с развитием микроциркуляторных осложнений СД.
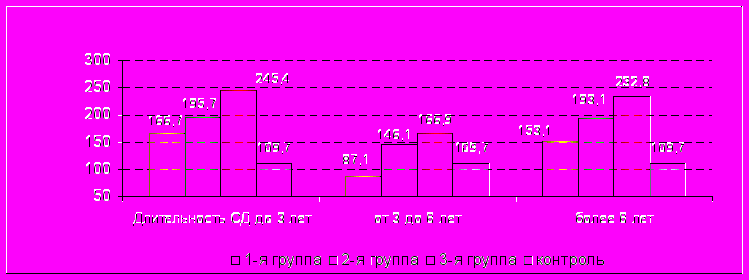
S-100В (нг/л)
Рис.8. Содержание белка S-100В в сыворотке крови пациентов с СД с учетом наличия и выраженности церебральных нарушений при различной длительности заболевания
Клиническое проспективное наблюдение за детьми с отсутствием клинических и нейропсихологических признаков церебральных расстройств показало, что манифестация церебральных дисфункций у пациентов с исходным уровнем S-100В более 140 нг/л происходила в 3 раза чаще, чем у больных с уровнем S-100В менее 140 нг/л (р=0,018). Эти результаты позволили предложить уровень S-100В 140 нг/л в крови в качестве критерия группы риска по формированию церебральных нарушений при сахарном диабете 1 типа у детей и подростков.
Определялась достоверная отрицательная корреляция уровня S-100В со средней скоростью кровотока в задней мозговой артерии (R=-0,4279, р=0,0395). Проведение корреляционного анализа концентрации данного нейропептида в крови с основными характеристиками КСВП позволило выявить наличие достоверной прямой корреляционной зависимости между уровнем белка S-100В в крови и длительностью латентного периода ответа V и VI пика при контралатеральной стимуляции, а также длительностью интервала I-V КСВП (R=0,3310, р=0,0498; R=0,4262, р=0,0133; R=0,4959, р=0,0033, соответственно). Это свидетельствовало о роли процессов реактивного астроцитоза в формировании нейрофизиологических нарушений в срединных структурах мозга.
Таким образом, повышение уровня белка S-100В связано, преимущественно, с дисциркуляторными нарушениями в зоне структур ЛРК, что подтверждает с высокой степенью вероятности преимущественную активацию реактивного глиоза при сахарном диабете именно в этой области мозга.
Выявленная достоверная отрицательная корреляция уровня S-100В в сыворотке крови с показателями средних уровней сатурации в фазах медленного и быстрого сна, а также с минимальным уровнем сатурации (R=-0,6767, р=0,0398, R=-0,6377, р=0,0430, R=-0,8986, р=0,0143) указывала на взаимосвязь между нарастанием гипоксии в период сна и увеличением содержания данного нейропептида в крови. Объяснений этому факту может быть предложено несколько: во-первых, оба данных процесса являются следствием хронической тканевой гипоксии, присущей сахарному диабету, приводящей как к реактивному глиозу и повышению уровня S-100В в крови, так и к снижению падения уровня кислорода в крови при оксиметрии; во-вторых, повышение гипоксических событий периода сна вследствие нарушения центральной регуляции акта дыхания является одним из симптомов дисциркуляторной энцефалопатии, поэтому их выраженность и частота, так же как и уровень S-100В в крови увеличивается по мере нарастания ее тяжести; в-третьих, возрастание экспрессии S-100В может быть не только следствием, но и причиной патогенного воздействия на структуры мозга (F.Malchiodi-Albedi, et al., 2001), что, не исключено, оказывает нейротоксическое воздействие, в том числе, на центры регуляции дыхания.
Наличие отрицательной корреляции между уровнем S-100В и возрастом при манифестации СД (R=-0,4067, р=0,0042) указывало на более значительное повреждение глиальных структур мозга у лиц, заболевших СД в раннем возрасте. Гипоксические факторы (гипер-, гипогликемии), воздействующие на мозг ребенка, при прочих равных условиях нарушают его созревание тем больше, чем более незрелы его структуры. И поскольку важную роль в процессах дифференцировки нервных клеток и становлении когнитивных функций играет инсулин (W.Kern et al., 2001), то при его дефиците будут страдать более интенсивно развивающиеся участки ЦНС (т.е. чем меньше возраст ребенка).
П
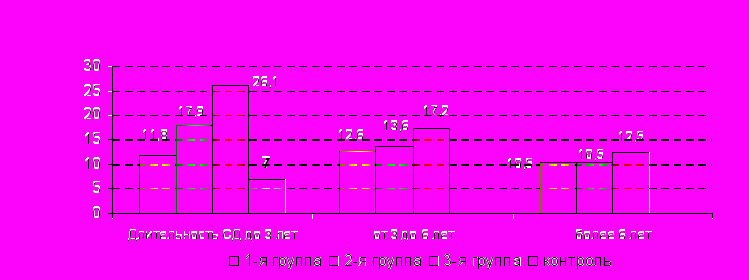
НСЕ (мкг/мл)
овышение уровня НСЕ у пациентов 3-й группы (рис.9), как и белка S-100В было достоверно выше по сравнению с контролем на всех этапах (длительность СД менее 3 лет, от 3 до 6 лет и более 6 лет) заболевания (р=0,0002, р=0,0004, р=0,0001, соответственно) и по сравнению с пациентами без церебральных нарушений при длительности СД до 3 лет (р=0,0323). У больных 2-й группы повышение уровня НСЕ также носило достоверный характер по сравнению с контролем при всех сроках длительности диабета (р=0,0058, р=0,0063, р=0,0036, соответственно) и по сравнению с пациентами с СД 1-й группы при небольшом стаже болезни (р=0,0452). У пациентов 1-й группы уровень НСЕ был также повышен по сравнению с контролем на всех этапах СД (р=0,0321, р=0,0058, р=0,0033).
Рис.9. Содержание нейроспецифической енолазы в сыворотке крови пациентов с СД с учетом наличия и выраженности церебральных нарушений при различной длительности заболевания
Высокий уровень НСЕ у пациентов с клинико-неврологическими проявлениями церебральных дисфункций свидетельствует о более выраженном гипоксическом повреждении ЦНС у них по сравнению с лицами без ЦН, поскольку более тяжелое поражение ЦНС сопряжено с повышением уровня НСЕ в крови (P. Marangos, D. Schmechel, 1987; T. Wallimann et al., 1992).
Выявленные положительные корреляции уровня НСЕ в сыворотке с длительностью латенции VI пика (R=0,6500, р=0,0420), интервала III–V (R=0,6142, р=0,0468) и I-V КСВП (R=0,6857, р=0,0284) позволили констатировать, что изменения параметров КСВП крови у пациентов с СД, свидетельствующие о нарушениях в мезэнцефальной области, пропорциональны степени нейрональной гипоксии, оцениваемой по концентрации НСЕ. Подобная связь между центральными нейрофизиологическими нарушениями и повышенным уровнем НСЕ показана при билирубиновой энцефалопатии (I.Akman, et al., 2004).
В общей группе больных СД наблюдалось реактивное повышение экспрессии мозгового нейротрофического фактора (рис.10) по сравнению со здоровыми лицами, вызванное, очевидно, активизацией процессов нейротрофической защиты в условиях нарушения энергетического обеспечения вследствие хронической гипергликемии и колебания уровня глюкозы в крови. Данный процесс можно рассматривать как защитно-приспособительный, так как повышение МНТФ улучшает ГАМК-ергическую и глицинергическую передачу в нейронах (M.A. Carrasco et al., 2007), приводит к активизации перестройки цитоскелета и длительной пот
МНТФ (пг/мл)
енц
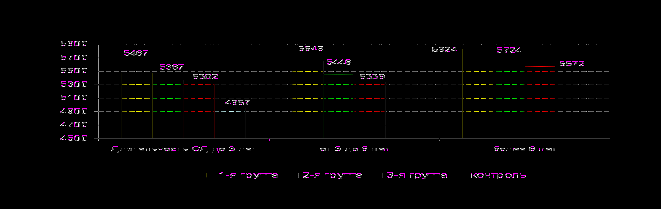 иации, лежащей в основе формирования памяти. (G.Lynch et al., 2008).
иации, лежащей в основе формирования памяти. (G.Lynch et al., 2008). 