Методы анализа биологичеcки активных веществ и их свойства
| Вид материала | Документы |
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- План лекций по химии для студентов 1 курса специальности 060201. 65 «Стоматология», 220.47kb.
- Темы лекций по аналитической химии: Общие положения и принципы аналитической химии, 23.35kb.
- План лекций по дисциплине «Токсикологическая химия» для студентов IV курса специальности, 18.73kb.
- План работы площадок (кроме холлов 1-2 этажей) в рамках Всероссийского фестиваля науки, 126.35kb.
- Производство и применение биологических средств защиты растений на основе энтомофагов,, 37.05kb.
- Лекция № Тема: «Методы и свойства», 168.5kb.
- I. электрохимические методы анализа, 355.17kb.
- Задачи в области управления активами в настоящий момент Пути совершенствования активных, 271.14kb.
- Биотехнология белковых лекарственных веществ. Рекомбинантные белки, принадлежащие, 79.62kb.
2. Реакции на ненасыщенное лактонное кольцо.
Основаны на способности ненасыщенного лактонного кольца легко окисляться в щелочной среде с образованием окрашенных продуктов реакции. Для СГ обычно проводят реакции:
1. Реакция Балье. При взаимодействии с пикриновой кислотой в щелочной среде СГ образуют комплексы, окрашенные в оранжевый цвет.
2. Реакция Кедде. При взаимодействии с 3,5-динитробензойной кислотой СГ образуют комплексы, окрашенные в красный цвет,
3. Реакция Легаля. При взаимодействии с нитропруссидом натрия в щелочной среде СГ образуют комплексы, окрашенные в красный цвет.
4. Реакция Раймонда. При взаимодействии с мета-динитробензолом СГ образуют комплексы, окрашенные в красно-фиолетовый цвет.
3. Реакции на углеводную часть молекулы.
Основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами.
1. Моносахара, входящие в состав СГ, после предварительного гидролиза вступают во все цветные реакции, свойственные углеводам (Феллинга, серебряного зеркала).
- Для дезоксисахаров используют реакцию Келлер-Килиани.
Дезоксисахара в присутствии сульфата железа (III), ледяной уксусной кислоты и конц. серной образуют комплексы, окрашенные в синий или сине-зеленый цвет. Необходимым условием для проведения этой реакции является отсутствие на конце углеводной цепи обычных сахаров (глюкозы).
Достоверное заключение о присутствии в лекарственном растительном сырье СГ можно сделать только при положительном результате всех трех групп качественных реакций на различные части молекулы.
В ГФ-Х1 на сырье наперстянок пурпурной и крупноцветковой, ландыша майского и горицвета весеннего качественных реакций не предусмотрено.
Кроме того, СГ образуют нерастворимые комплексы с растворами дубильных веществ, что используется при отравлениях СГ.
Количественное определение СГ проводят методом биологической стандартизации (ГФ-Х1, вып.2, с. 163-175).
Метод основан на способности СГ вызывать в токсических дозах остановку сердца животных в стадию систолы. В качестве подопытных животных используют лягушек, голубей или кошек. Чувствительность животных к сердечным гликозидам определяют в сравнении со стандартными индивидуальными веществами или экстрактами, которые вырабатывают в специальных научно-исследовательских институтах. Активность выражают в единицах действия (ЕД), которые, в зависимости от вида животных обозначают:
ЛЕД - «лягушачьи» ЕД, КЕД - «кошачьи» ЕД или ГЕД «голубиные» ЕД.
ЛЕД соответствует наименьшей дозе стандартного препарата, вызывающей остановку сердца стандартной лягушки (самец травяной лягушки массой 28-33 г). В нормативной документации на лекарственное сырье и препараты, содержащих СГ, обязательно указывается ВАЛОР (количество ЕД в 1 г сырья).
Недостатками метода биологической стандартизации являются его трудоемкость, высокая стоимость, большая ошибка опыта (до 25%).
Поэтому нормативная документация на некоторые виды сырья и препараты требует определять их количественное содержание физико-химическими методами (хроматофотоэлектроколориметрическим или хроматоспектрофотометрическим) методами. Они основаны на предварительном хроматографическом разделении СГ с последующим фотоэлектроколориметрическим или спектрофотометрическим определением.
13. Оценка качества сырья, содержащего витамины.
Методы анализа.
Согласно существующей нормативной документации подтверждают присутствие витаминов только в листьях крапивы. Определяют наличие витамина К1.
Метод определения хроматографический. Определение основано на способности витамина К1 флюоресцировать в УФ-свете.
Экстрагируют из растительного сырья витамин К1 гексаном.
Хроматографическое разделение проводят восходящим способом на пластинке «Силуфол» при температуре 40-70 0С.
Система растворителей: бензол - петролейный эфир (1:1). Готовую хроматограмму выдерживают в УФ-свете при длине волны 360 нм (2 минуты). На пластинке— должно появиться пятно с желто-зеленой флюоресценцией.
Количественное определение витаминов проводят в плодах шиповника (витамин С) и облепихи (каротиноиды в пересчете на β-каротин).
Плоды шиповника - ГФ XI изд., стр.274 - витамина С должно быть не менее 0,2%.
Метод определения - титриметрический. Метод основан на способности аскорбиновой кислоты восстанавливать 2,6-дихлорфенолиндофенолят натрия.
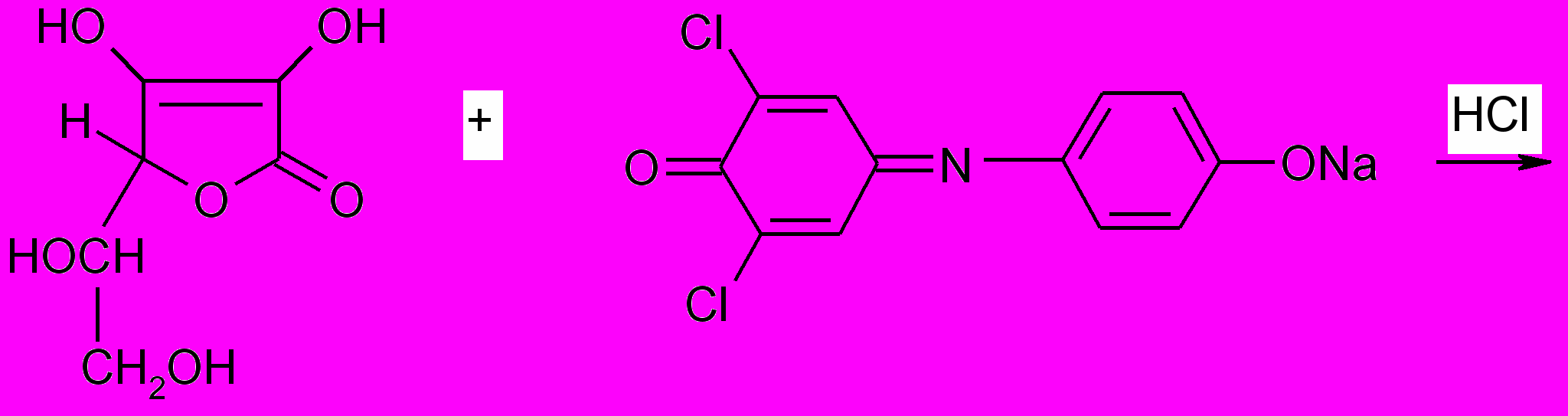
аскорбиновая кислота 2,6-дихлорфенолиндофенолят натрия
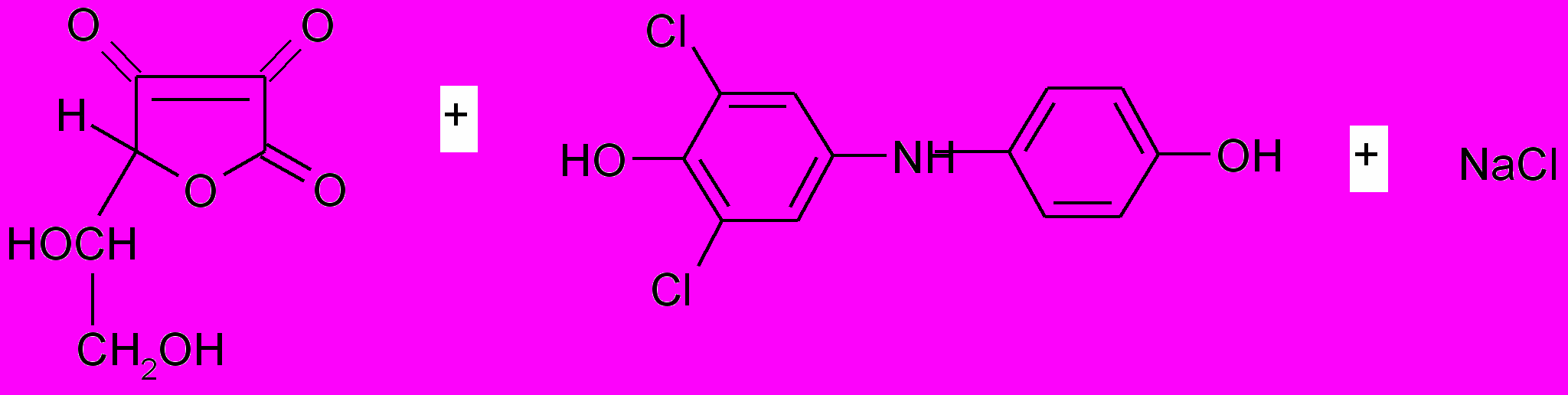
дигидроаскорбиновая 2,6-дихлорфенолиндофенол
кислота (восстановленная форма)
2,6-дихлорфенолиндофенол в щелочной среде имеет синюю окраску, в кислой - красную, а при восстановлении - обесцвечивается.
Определение ведут в кислой среде. В качестве титранта используют натриевую соль. Титруют до розового окрашивания.
Для сырья шиповника, которое используют для изготовления «Холосаса», «Каротолина» и сиропов определяют содержание органических кислот (не менее 2,6%). Метод прямого титрования, основанный на нейтрализации органических кислот раствором NаОН. Индикаторы - фенолфталеин и метиленовый синий. Титруют до лилово-красной окраски.
Плоды облепихи свежие - ФС 42-1052-76.
Содержание каротиноидов в пересчете на β-каротин должно быть не менее 10 мг%. Метод определения фотоэлектроколориметрический.
Метод основан на определении оптической плотности естественно окрашенного раствора каротиноидов при длине волны 450 нм.
Растворитель - бензин или петролейный эфир. Стандартный раствор - бихромат калия.
Оценку качества витаминосодержащего сырья проводят и по другим группам биологически активных веществ: полисахаридов (трава череды), флавоноидов (трава сушеницы), дубильных веществ (кора калины), экстрактивных веществ (кора калины, цветки календулы, столбики с рыльцами кукурузы, трава пастушьей сумки).
Для сырья крапивы, рябины, земляники, смородины - количественного определения биологически активных веществ не проводят.
Из 88 видов лекарственного растительного сырья, включенного в ГФ-Х1 в 17 видах сырья не проводится количественной стандартизации сырья.
1. Цветки липы. 10. Плоды черники.
2. Цветки календулы. 11. Плоды жостера слабительного
3. Цветки бузины черной. 12. Плоды рябины.
4. Листья мать-и-мачехи. 13.Плоды калины.
5. Листья крапивы. 14. Семена льна.
6. Трава хвоща полевого. 15. Семена тыквы.
7. Трава горца почечуйного. 16.Семена лимонника.
8. Корни алтея. 17. Плоды лимонника.
9. Корневища и корни девясила.
Биологические свойства.
Сердечные гликозиды способны вызывать в токсических дозах остановку сердца животных в стадию систолы. В качестве подопытных животных используют лягушек, голубей или кошек. Чувствительность животных к сердечным гликозидам определяют в сравнении со стандартными индивидуальными веществами или экстрактами, которые вырабатывают в специальных научно-исследовательских институтах.
Сапонины в виде гликозидов токсичны для холоднокровных (рыбы, ля-гушки, круглые черви). Они нарушают функцию жабр, которые являются не столько органом дыхания, но и регулятором солевого осмотического давления в морганизме. Сапонины парализуют или вызывают гибель холоднокровных даже в небольших разведениях (1:1000000).
Также они обладают гемолитической активностью, т.е. способны растворять липидную часть оболочки эритроцитов. В результате этого оболочка из полупроницаемой становится проницаемой, гемоглобин свободно поступает в плазму крови и растворяется в ней. Образуется красный прозрачный раствор - «лаковая кровь».
В связи с этим сапонины не применяются для внутривенного введения, так как вызывают анемию. При приеме внутрь, после гидролиза в желудочно-кишечном тракте до агликонов, сапонины теряют гемолитическую активность. Все указанные выше свойства биологически активных веществ используются в анализе лекарственного растительного сырья.
Качественный химический анализ.
Для установления подлинности лекарственного растительного сырья используют простейшие качественные реакции и хроматографические пробы на действующие и сопутствующие вещества, основанные на их свойствах. Методика изложена в соответствующей нормативной документации на исследуемый вид сырья в разделе "Качественные реакции".
По технике выполнения и характеру получаемых результатов химические реакции делят на несколько групп;
1) качественные реакции;
2) микрохимические реакции;
3) гистохимические реакции;
4) микросублимация.
Качественные реакции.
I. Качественные реакции выполняют на сухом сырье с такими видами сырья: коры дуба, калины, крушины, корневища бадана, корневища и корни девясила, корни одуванчика, алтея, женьшеня, барбариса, цветки липы, семена льна, склероции спорыньи (всего по существующей НД - для 12 видов сырья).
II. В основном качественные реакции проводят с извлечением из лекарственного растительного сырья. Исходя из свойств биологически активных веществ, их извлекают из сырья водой, спиртом различной концентрации или органическим растворителем, реже с добавлением щелочи или кислоты.
Водное извлечение готовят из сырья содержащего гликозиды: полисахариды, сапонины, фенологликозиды, антрагликозиды, дубильные вещества.
Подкисленной водой извлекают из сырья алкалоиды в виде солей.
Большую группу биологически активных веществ извлекают этиловым и метиловым спиртом различной концентрации (сердечные гликозиды, кумарины, лигнаны, флавоноиды).
Если реакция достаточно специфична и чувствительна, то ее проводят с неочищенным извлечением из сырья. Например:
1) общеалкалоидные осадочные реакции;
2) реакции с раствором хлорида алюминия на флавоноиды (трава зверо- боя, горца птичьего, горца перечного); |
3) проба Синода на флавоноиды в цветках бессмертника;
4) реакция с раствором щелочи на антраценпроизводные (кора крушины, корни ревеня);
5) реакция с раствором железоаммонийных квасцов на дубильные веще- ства (кора дуба, корневища змеевика, бадана).
Часто проведению реакции мешают сопутствующие вещества (белки, амины, стерины, хлорофилл), в этом случае используют очищенное извлечение (например, из сырья, содержащего сердечные гликозиды, кумарины, алкалоиды, фенологликозиды, лигнаны).
Очищают извлечение осаждением сопутствующих веществ раствором ацетата свинца и сульфата натрия или используют прием смены растворителей, либо метод распределительной хроматографии.
Микрохимические реакции.
Микрохимические реакции проводят обычно одновременно с микроскопическим анализом, наблюдая результаты под микроскопом:
1) на эфирное и жирное масло с раствором Судан III;
2) на одревесневшие лигнифицированные элементы с раствором флорог-люцина и 25% раствором серной кислоты или конц. хлористоводородной кислоты. На кору дуба (порошок) проводят реакцию с железоаммонийными квасцами, результат реакции изучают под микроскопом.
Гистохимические реакции.
Гистохимические реакции — это такие реакции, с помощью которых можно выявить те или иные соединения непосредственно в клетках или структурах, где они локализуются.
По ГФ-Х1 гистохимические реакции проводят на слизь с раствором туши в корнях алтея и семенах льна.
Микросублимация.
Микросублимация - непосредственное выделение из сухого растительного материала веществ, которые легко возгоняются при нагревании. Полученный сублимат исследуют под микроскопом, затем проводят микрохимическую реакцию с соответствующим реактивом (ГФ-Х1 - кора крушины).
Хроматографический анализ.
Для разделения многокомпонентных смесей, какими являются извлечения из сырья, для очистки и идентификации соединений используют хроматографию.
По механизму, лежащему в основе разделения, различают адсорбционную, распределительную, ионообменную и газожидкостную хроматографию. Чаще используют распределительную восходящую хроматографию на бумаге и в тонком слое сорбента - силикагель, окись алюминия, различные полимеры (неподвижная фаза). В качестве подвижной фазы используют систему растворителей. Для эффективного разделения имеет значение подбор компонентов подвижной фазы.
Руководствуются элюотропным рядом растворителей по Шталю (гексан, гептан, циклогексан, четыреххлористый углерод, бензол, хлороформ, эфир, этилацетат, пиридин, ацетон, этанол, метанол, вода). Растворители расположены в порядке возрастания полярности.
Система растворителей и методика указаны в нормативной документа- ции на сырье. Чаще используют: бутанол-уксусная кислота-вода (БУВ) 4:1:5 4:1:2; хлороформ-метанол 1:9, 2:8; уксусная кислота-вода 15:85.
При хроматографировании анализируемые вещества образуют на бумаге или пластинке зоны или пятна, которые обнаруживают по их свечению в ультрафиолетовом свете. В зависимости от химической природы вещества буде наблюдаться характерная флюоресценция. Достоверность идентификации сырья методом хроматографии повышается, если полученную хроматограмму проявить хромогенными реактивами. Используют реактивы для качественных реакций, которые дают специфические, устойчивые окраски.
Методом хроматографии на бумаге подтверждают подлинность сырья, содержащего флавоноиды (трава череды, листья вахты трехлистной, корни стальника), алкалоиды, антраценпроизводные, кумарины.
В тонком слое сорбента на пластинках «Силуфол» идентифицируют са-понины (корни аралии и женьшеня), флавоноиды (трава хвоща полевого, цветки и плоды боярышника), фенологликозиды (корневища и корни родиолы розовой), витамины (листья крапивы, кора калины), лигнаны, иридоиды.
Широко используют все методы хроматографии в научно- исследовательских целях для выделения и анализа всех биологически активных веществ лекарственных растений.
При анализе побегов багульника болотного (ГФ—Х1) и его эфирного масла, используемых для производства препарата «Ледин», применяют метод газожидкостной хроматографии (ГЖХ). Метод ГЖХ высокочувствителен, универсален, специфичен и позволяет автоматизировать процесс контроля. Недвижной фазой является жидкость, нанесенная на твердый инертный носитель, подвижной фазой является газ. Разделение компонентов происходит за счет различной растворимости компонентов эфирного масла в неподвижной фазе (жидкости).
Компоненты перемещаются по неподвижной фазе с различной скор , стью, в результате чего выходят друг за другом в потоке газа-носителя. В качестве газа-носителя применяют азот, гелий, водород. Анализ проводится в различных газовых хроматографах марки ЛХМ-72, "Хром-4" с плазменным ионизационным детектором с применением внутреннего стандарта. Хроматограмма записывается на диаграммной ленте в виде пиков.
В последнее время успешно развивается высокоэффективная жидкостная хроматография (ВЭЖХ). Это вариант колоночной хроматографии на полиамиде, но подвижная фаза (жидкость) проходит через колонку с большой скоростью за счет высокого давления. Это удобно для разделения, качественного и количественного анализа нелетучих термолабильных соединений (например, сердечные гликозиды).
Подлинность сырья, содержащего горечи, подтверждает органолептиче-ский показатель - горький вкус. Показатель горечи - это наибольшее разведение водного извлечения из 1 г сырья или препарата, при котором ощущается горький вкус. В качестве стандарта используется раствор хинина (1:200 000). В настоящее время этот показатель используется только в поисковых работах.
Методы количественного определения БАВ.
Методики определения количественного содержания действующих веществ описаны в соответствующей частной нормативной документации. Выбор метода зависит от физических и химических свойств БАВ. Используют гравиметрические (весовые), титриметрические (объемные) и физико-химические (инструментальные) методы анализа.
Гравиметрические методы.
Гравиметрические (весовые) методы основаны на избирательной различной растворимости биологически активных веществ в воде и неполярных органических растворителях. Применяют для сырья, содержащего гликозиды, например, полисахариды (хорошо растворимы в воде и нерастворимы в крепких спиртах - осаждаются 95% этанолом), сапонины (растворимы в метиловом спирте и не растворимы в диэтиловом эфире и ацетоне); лигнаны, дубильные вещества (осаждение желатином, солями тяжелых металлов или адсорбция кожным порошком); алкалоиды, выделяемые в виде солей или в виде оснований.
Методы просты в исполнении, но длительны, т.к. выделившийся осадок отделяют фильтрованием или центрифугированием, высушивают и доводят до постоянной массы. Кроме того, метод дает завышенные результаты, потому что, вместе с БАВ осаждаются и сопутствующие вещества. Но для некоторых видов сырья, например, содержащего полисахариды, этот метод наиболее специфичен.
Гравиметрический метод предложен в ГФ-Х1 на листья подорожника большого, траву череды, слоевища ламинарии; в частных НД - на сырье безвременника, дурмана индейского, плауна-баранца.
Титриметрические методы.
Титриметрические (объемные) методы основаны на химических свойствах биологически активных веществ:
1. На их способности легко окисляться:
- перманганатом калия (дубильные вещества);
- раствором йода (простые фенольные соединения - арбутин);
- 2,6-дихлорфенолиндофеолятом натрия (аскорбиновая кислота).
2. На основных свойствах основаны титриметрические методы определения алкалоидов. Алкалоиды ведут себя как основания и могут быть определены путем: |
- прямого титрования (например, сырье анабазиса, софоры толстоплодной, чилибухи);
- обратного титрования (сырье белены, дурмана, красавки, трава термопсиса, корневища с корнями чемерицы) растворами кислот.
Слабые основания определяют методом кислотно-основного титрования и в неводных средах, где титрантом служит хлорная кислота. Точку эквивалентности устанавливают по индикатору или потенциометрически (ГФ-Х1 - трава чистотела — метод неводного потенциометрического титрования).
Титриметрические методы экономичны, быстры в исполнении, но недостаточно точны и дают завышенные результаты. С их помощью можно определить только сумму биологически активных веществ.
Физико-химические методы.
Наиболее точны и высокочувствительны фотометрические методы (фотоколориметрия и спектрофотометрия), основанные на измерении количества света, поглощенного веществом, суммой веществ или комплексом вещества в видимой, ультрафиолетовой и инфракрасной области спектра. Используют фотометрические методы для определения почти всех групп биологически активных веществ (сердечные гликозиды, экдистероны, сапонины, кумарины, хромоны, лигнаны, флавоноиды, антраценпроизводные, дубильные вещества, алкалоиды, каротиноиды).
Фотоэлектроколориметрические методы основаны на измерении степени поглощения немонохроматического (полихроматического) света на довольно широком участке спектра окрашенных растворов с помощью фотоэлектроколориметра. Для получения окрашенных соединений используют реактивы, дающие яркие, устойчивые окраски; на флавоноиды, кумарины, фенологликозиды проводят реакцию образования азокрасителя с диазотированными сульфаниламидами (ГФ-Х1 - листья вахты, корневища и корни родиолы розовой),
Для анализа алкалоидов используют частные цветные реакции, основанные на окислении, конденсации и дегидратации алкалоидов концентрированными кислотами (коробочки мака, трава мачка желтого).
Антраценпроизводные дают вишнево-красное окрашивание со щелочами (кора крушины, корни ревеня, корневища и корни марены красильной).
Спектрофотометрические методы основаны на способности веществ и их окрашенных продуктов реакции избирательно поглощать монохроматический свет в определенной области спектра. Такими свойствами обладают флавоноиды, кумарины, антраценпроизводные, сапонины, индивидуальные алкалоиды, экдистероны. Измерение проводят с помощью спектрофотометра. Для большинства видов сырья, содержащих флавоноиды, измеряют:
- собственное поглощение суммы флавоноидов (ГФ-Х1 - цветки бессмертника, цветки пижмы);
- поглощение окрашенного комплекса с алюминия хлоридом (трава горца перечного, горца птичьего, зверобоя, листья сумаха, скумпии).
Для сырья, содержащего антраценпроизводные, используют реакцию со щелочью (листья сенны).
Для сырья, содержащего фенологликозиды, используют реакцию диазо-тирования (корневища и корни родиолы розовой).
Наиболее точными являются хроматоспектрофотометрические методы, основанные на разделении веществ при помощи хроматографии с последующим их определением спектрофотометрически. Можно определять количественное содержание как суммы, так и индивидуальных веществ. Применяют для определения индивидуальных алкалоидов (цитизин в траве термопсиса очередноцветкового, берберин в корнях барбариса), флавоноидов (плоды и цветки боярышника, трава сушеницы), кумаринов (плоды амми большой), ксантонов (трава золототысячника), ланатозидов в сырье наперстянки шерстистой.
Реже для анализа лекарственного растительного сырья применяется флюорометрия, полярография, денситометрия, амперометрия, кондуктометрия.
Определение эфирного масла.
Количество эфирного масла в сырье определяют при приемке сырья и в процессе его хранения.
Методы количественного определения основаны на легкой летучести эфирных масел и способности их перегоняться с водяным паром. В зависимости от физических и химических свойств компонентов, входящих в состав масла, используют 4 метода. Все методики описаны в ГФ XI изд., вып.1, стр.290 в разделе «Общие методы анализа». Содержание масла выражают в объемно-весовых процентах. Масса сырья, степень его измельчения, время перегонки, метод и возможные растворители указаны в соответствующей НД на лекарственное растительное сырье.
Определение сердечных гликозидов.
Все лекарственное растительное сырье, содержащее сердечные гликозиды подвергается биологической стандартизации на лягушках кошках, голубях. Активность выражается соответственно в ЛЕД, КЕД, ГЕД. Общие методы оценки биологической активности описаны в ГФ-Х1, вып.2, стр.163 в разделе «Биологические методы контроля качества лекарственных средств». Валор, т.е. содержание единиц действия в растительном сырье и особенности методики определения приведены в соответствующих частных нормативных документах.
Метод основан на способности сердечных гликозидов вызывать в токсических дозах остановку сердца животных в стадию систолы. Чувствительность животных к сердечным гликозидам определяют в сравнении со стандартом.
Недостатками метода биологической стандартизации являются его трудоемкость, высокая стоимость, большая ошибка опыта (до 25%).
Из 88 видов лекарственного растительного сырья, включенного в ГФ-Х1 в 17 видах сырья не проводится количественной стандартизации сырья.
1. Цветки липы. 10. Плоды черники.
2. Цветки календулы. 11. Плоды жостера слабительного
3. Цветки бузины черной. 12. Плоды рябины.
4. Листья мать-и-мачехи. 13.Плоды калины.
5. Листья крапивы. 14. Семена льна.
6. Трава хвоща полевого. 15. Семена тыквы.
7. Трава горца почечуйного. 16.Семена лимонника.
8. Корни алтея. 17. Плоды лимонника.
9. Корневища и корни девясила.
При разработке и пересмотре НД ставится задача предусмотреть оценку качества сырья по количественному содержанию основных биологически активных и экстрактивных веществ. При этом используются современные физико-химические методы анализа природных соединений.
