Методы анализа биологичеcки активных веществ и их свойства
| Вид материала | Документы |
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- План лекций по химии для студентов 1 курса специальности 060201. 65 «Стоматология», 220.47kb.
- Темы лекций по аналитической химии: Общие положения и принципы аналитической химии, 23.35kb.
- План лекций по дисциплине «Токсикологическая химия» для студентов IV курса специальности, 18.73kb.
- План работы площадок (кроме холлов 1-2 этажей) в рамках Всероссийского фестиваля науки, 126.35kb.
- Производство и применение биологических средств защиты растений на основе энтомофагов,, 37.05kb.
- Лекция № Тема: «Методы и свойства», 168.5kb.
- I. электрохимические методы анализа, 355.17kb.
- Задачи в области управления активами в настоящий момент Пути совершенствования активных, 271.14kb.
- Биотехнология белковых лекарственных веществ. Рекомбинантные белки, принадлежащие, 79.62kb.
Химические свойства
Химические свойства гликозидов многообразны и обусловлены наличием гликозидной связи и строением сахаров и агликона. Под действием ферментов при наличии воды гликозиды гидролизуются. Возможен гидролиз ферментативный, кислотный и щелочной. Оптимальной для ферментативного гидролиза является температура 30-50 °С, при температуре свыше 50°С ферменты денатурируют.
Химические свойства сердечных гликозидов обусловлены наличием стероидного ядра, лактонного кольца, углеводной цепи и присутствием гликозидной связи. Самыми нестойкими в молекулах сердечных гликозидов являются лактонное кольцо и гликозидная связь.
В случае, когда на конце углеводной цепи находятся глюкоза или рамноза, сердечные гликозиды легко обрывают конечную молекулу моносахарида и образуют вторичные гликозиды.
Реакции на стероидную структуру основаны на способности стероидного ядра сердечных гликозидов и стероидных сапонинов подвергаться дегидратации под действием кислотных реагентов (уксусный ангидрид, конц. серная кислота, трихлоруксусная кислота) с образованием окрашенных комплексных соединений (реакция Либермана-Бурхарда).
Реакции на ненасыщенное лактонное кольцо сердечных гликозидов основаны на способности ненасыщенного лактонного кольца легко окисляться полинитросоединениями (нитропруссид натрия, пикриновая кислота) в щелочной среде с образованием окрашенных в желтый или красный цвет продуктов реакции.
Реакции на углеводную часть молекулы гликозида основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами. Моносахара, входящие в состав гликозида вступают во все цветные реакции, свойственные углеводам (с раствором Феллинга, серебряного зеркала).
Фенольные гликозиды дают:
- растворимые в воде феноляты с гидроксидом натрия: флавоноиды и кумарины - желтого; антрагаикозиды - вишнево-красного цвета;
- окрашенные комплексные соли с хлоридом окисного железа или железоаммонийными квасцами от зеленой до фиолетовой окраски (простые фенолы, кумарины, лигнаны, флавоноиды, дубильные вещества);
- с хлоридом алюминия - желтую окраску с желто-зеленой флюоресценцией (флавоноиды);
- с ацетататом свинца и магния, солями меди, молибдена, циркония (все фенольные соединения);
- реакцию азосочетания с солями диазония с образованием азокрасителя в
зависимости от структуры от желтого до вишнево-красного цвета.
Флавоноиды способны восстанавливаться (проба Синода),
простые фенольные соединения – (гидрохинон) окисляться раствором йода.
Дубильные вещества легко окисляются кислородом воздуха, перманганатом калия и другими окислителями. Они способны образовывать прочные межмолекулярные связи с белками и другими полимерами (пектиновые вещества, целлюлоза), легко адсорбироваться на кожном порошке, целлюлозе, клетчатке.
Из водных растворов дубильные вещества осаждаются желатином, алкалоидами - основным ацетатом свинца, бихроматом калия, сердечными гликозидами.
Алкалоиды образуют нерастворимые (или слабо растворимые) осадки с комплексными йодидами металлов, высокомолекулярными неорганическими кислотами, высокомолекулярными органическими веществами кислого характера (общеалкалоидные осадочные реакции).
Алкалоиды вступают в реакции, зависящие от наличия в их молекулах различных функциональных групп. Например, морфин содержит фенольный гидроксил, поэтому он со щелочами образует феноляты;
дает реакции с хлоридом окисного железа и другими реактивами.
ГРУППЫ СЫРЬЯ ПО БАВ
1. Полисахариды
с порошком микрохимические реакции на слизь:
- с тушью;
- с метиленовым синим;
- с раствором КОН;
- проделать микрореакцию на крахмал с раствором Люголя;
- проделать реакцию на одревесневшие элементы - с 1% спиртовым раствором флороглюцина и концентрированной НCl (1-2 капли).
Подлинность лекарственного растительного сырья подтверждают качественными реакциями.
Фармакопейными (ГФ-Х1, вып.2) являются следующие:
- на инулин:
1) альфа-нафтол и конц. серная кислота окрашивает корни одуванчика в фиолетово-розовый цвет;
2) альфа-нафтол и конц. серная кислота окрашивает корневища и корни девясила в красно-фиолетовый цвет, тимол и конц. серная кислота - в оранжево-красный цвет.
- на слизь:
1) раствор аммиака (NH3) или едкого натра (NаОН) окрашивает корни алтея в желтый цвет;
2) при смачивании водой цветки липы ослизняются;
3) на порошок семян льна выполняют гистохимическую реакцию с раствором туши.
При помощи качественных реакций чаще выявляются слизи:
Под влиянием раствора NaOH они приобретают лимонно-желтоватый цвет, пoд воздействием метиленового синего - голубой.
На фоне черной туши слизь имеет вид бесцветных сгустков.
Количественное определение
полисахаридов ГФ-Х1, вып.2 предлагает для листьев подорожника большого и слоевищ ламинарии. Метод определения
- гравиметрический (весовой), основанный на осаждении полисахаридного водного извлечения 95% спиртом. Стадии анализа:
1) экстракция полисахаридов водой;
2) осаждение полисахаридов из водного извлечения 95% спиртом;
3) высушивание осадка и доведение его до постоянной массы.
В слоевишах ламинарии, кроме того, определяют содержание йода после сжигания навески бромйодометрическим методом.
Там же определяют содержание песка (SiO2).
В сырье алтея, липы, льна, мать-и-мачехи, подорожника блошного количественного определения биологически активных веществ и экстрактивных веществ не проводят.
2. Оценка качества сырья, содержащего жиры. Методы анализа.
Существующая в фармации нормативная документация предусматривает качественные реакции на жиры при проведении микроскопического анализа
плодов и семян - ГФ-Х1, вып. 1, стр.279:
готовят поперечный срез плодов и семян в растворе Судана III и подогревают; капли жирного масла окрашиваются в оранжево-розовый цвет.
Этой реакцией, в частности, подтверждают наличие жирного масла в эндосперме семян льна.
Количественное определение жира в лекарственном растительном сырье:
Определение содержания жира в растительном сырье проводят в жиромасличной промышленности, в сельском хозяйстве, в пищевой промышленности.
Метод определения - гравиметрический. Метод основан на растворимости жиров в органических растворителях. Наиболее часто используют метод Сокслета и метод Рушковского.
По методу Сокслета определяют массу жирного масла после отгона органического растворителя.
По методу Рушковского о масссе жирного масла судят по убыли массы навески сырья после обработки органическим растворителем. Определение ведется в аппарате Сокслета. Определение длительное (от 16 часов до 3-х суток), недостаточно точное, т.к. извлекаются не только жиры, но и пигменты, каротиноиды, смолистые вещества.
3. Эфирные масла
Метод количественного определения содержания эфирного масла в растительном сырье основан на:
- физических свойствах эфирного масла - летучести и практической нерастворимости в воде;
- на отсутствии химического взаимодействия эфирного масла и воды;
- на законе Дальтона о парциальных давлениях.
Согласно закону, смесь жидкостей закипает тогда, когда сумма их парциальных давлений достигает атмосферного давления.
Следовательно, давление паров смеси жидкостей (вода + эфирное масло) достигнет атмосферного давления еще до кипения воды.
В соответствии с ГФ-Х1, вып. 1, стр.290 (раздел «Общие методы анализа») определение проводят одним из 4 методов в зависимости от количества в сырье эфирного масла, его состава, плотности и термолабильности.
Метод 1 и 2 применяют, если эфирное масло имеет плотность меньше 1 и не растворяется в воде.
Метод 3 и 4 применяют для сырья, содержащего эфирное масло, которое претерпевает изменения, образует эмульсию, легко загустевает и имеет плотность близкую к единице.
Метод 1 (метод Гинзберга) - применяют для сырья, где много эфирного (масло термостабильное), в его составе преобладают моно- и бициклические монотерпены. Приемник для сбора эфирного масла помещается в экстрактивной колбе.
Этим методом определяют содержание эфирного масла в сырье можжевельника, мяты, шалфея, эвкалипта, тмина.
Метод 2 (метод Клавенджера) - используют, когда сырье содержит эфирного масла менее 0.2-0.3 %.
Этот метод дает меньшую ошибку опыта. Приемник вынесен за пределы экстракционной колбы, что позволяет определить в сырье содержание термолабильного эфирного масла. Этим методом определяют содержание эфирного масла в сырье ромашки, тмина, мяты, шалфея, эвкалипта.
Метод 3 (метод Клавенджера). Приемник см. 2-й метод. В приемник прибавляют органический растворитель для разрушения эмульсии или растворения загустевшего или тяжелого масла. Определяют эфирное масло в сырье аниса, аира, тысячелистника.
Метод 4 впервые включен в ГФ Х1 и отличается от 3-его метода возможностью контролировать температуру конденсации. Во время гидродистилляции температура в отстойнике не должна превышать 25°С.
В ГФ-Х1, вып.2, стр.227 на побеги багульника болотного даны два показателя содержания эфирного масла в сырье:
- если сырье предназначено для получения экстемпоральных лекарственных форм, то эфирного масла должно быть не менее 0.1%;
- если сырье предназначено для получения ледина, то эфирного масла должно быть не менее 0.7%.
В таком эфирном масле дополнительно определяют содержание ледола методом газо-жидкостной хроматографией. Ледола должно быть не менее 17%.
Сырье, содержащее эфирное масло, которое при перегонке претерпевает изменения, образует эмульсию, легко загустевает или имеет плотность, близкую к единице, анализируют методами 3 или 4.
4. Качественные реакции на антраценпроизводные
Из сырья антраценпроизводные извлекают водой или спиртом различной концентрации.
Для получения свободных агликонов, гликозиды в растительном сырье подвергают гидролизу, свободные агликоны извлекают этиловым эфиром и хлороформом.
Для обнаружения антраценпроизводных в сырье используют качественные реакции, основанные на химических свойствах и хроматографическое исследование.
- Реакция образования фенолятов со щелочью:
а) по характерной оранжевой окраске корней и коры или
на сухом сырье - при нанесении нескольких капель 10%-ного раствора натрия гидроксида на сырье появляется вишнево-красное пятно.
Положительный результат наблюдается, если антраценпроизводные присутствуют в окисленной форме. Рекомендована ГФ-Х1 для подтверждения подлинности Cortex Frangulae;
б) с водным извлечением (1:10) - при добавлении к водному извлечению из сырья нескольких капель 10%-ного раствора щелочи образуется вишнево-красное окрашивание - производные антрахинона,
желтое окрашивание - производные антранола и антрона;
фиолетовое окрашивание – ализарин.
Окраска при взаимодействии со щелочью появляется только у окисленных форм антраценопроизводных,
а восстановленные формы четкой реакции с NaOH не дают, и для их обнаружения необходимо осуществить предварительное окисление; например, свежесобранная кора крушины дает эту реакцию с NaOH только после предварительной обработки ее пероксидом водорода.
в) реакция Борнтрегера. Позволяет обнаружить эмодины в присутствии других антраценпроизводных.
Проба основана на способности антрагликозидов подвергаться щелочному гидролизу с образованием свободных агликонов.
Одновременно производится окисление восстановленных форм.
После подкисления гидролизата агликоны извлекают эфиром.
Эфирный слой окрашивается в желтый цвет.
При встряхивании эфирного слоя с аммиаком эмодины, имеющие гидроксильные группы в бета-положении, переходят в водный слой, окрашивая его в вишнево-красный цвет.
Хризофанол остается в органическом слое, окрашивая его в желтый цвет.
Предложена в ГФ-Х1 для подтверждения подлинности Cortex Frangulae, Folia Sennae, Fructus Rhamni catharticae, Radices Rhei, Rhizomata et radices Rubiae.
2. Реакция микросублимации (микровозгонки).
Основана на способности АП возгоняться при 200 °С с последующей конденсацией на холодной поверхности без изменения основной структуры.
И может быть проведена в двух вариантах:
в пробирке и на предметном стекле.
При нанесении на сублимат раствора натрия гидроксида образуется вишнево- красное окрашивание.
Дана в ГФ-Х1 для подтверждения подлинности Согtех Frangulae.
3.Реакция образования лаков.
Основана на способности антраценпроизводных образовывать со спиртовым раствором магния ацетата комплексы, окрашенные в вишнево-красный цвет.
4.Для качественного обнаружения производных антрацена часто используется бумажная и тонкослойная хроматография.
О присутствующих веществах судят по характеру их флуоресценции в УФ-свете до и после обработки хроматограмм соответствующими реагентами (парами аммиака, растворами едких щелочей).
Количественное определение.
Все методы количественного определения антраценпроизводных в сырье основаны на отделении свободных агликонов после кислотного гидролиза. Агликоны экстрагируют в органический растворитель и определяют различными методами.
1. Фотоэлектроколориметрический метод.
Основан способности окрашенных фенолятов поглощать свет при длине волны 530-540 нм.
Предложен в 1957 г. Аутергоффом (Германия), модифицирован А.С. Романовой и А.И. .Баньковским (НПО «ВИЛАР», 1965).
Аутергофф предложил гидролиз и экстракцию агликонов объединить в одну стадию кипячением навески сырья с ледяной уксусной кислотой и с последующей экстракцией диэтиловым эфиром.
Стадии определения суммы производных антрацена:
1- гидролиз антраценпроизводных и экстракция агликонов из сырья;
2- получение окрашенных солей
Эфирное извлечение обрабатывают в делительной воронке отдельными порциями щелочно-аммиачного раствора (5% раствор NаОН, содержащий 2% раствора аммиака).
Антраценпроизводные в виде окрашенных фенолятов переходят в водную фазу (обрабатывают до тех пор, пока последняя порция щелочно-аммиачного раствора не будет оставаться бесцветной).
3- окисление восстановленных форм антраценпроизводных
Для перевода всех форм антраценпроизводных в окисленные, часть щелочно-аммиачного раствора фенолятов нагревают на водяной бане в течение 15 мин. Восстановленные формы окисляются кислородом воздуха и вступают в реакцию со щелочно-аммиачным раствором, окраска становится интенсивнее (сырье крушины и ревеня). В сырье марены красильной окисление восстановленных форм проводят пергидролем.
4 - измерение оптической плотности окрашенных растворов с по-
фотоэлектроколориметра (ФЭК) при длине волны 530-540 нм (зеленый фильтр).
Содержание антраценпроизводных в сырье (%) рассчитывают по калибровочному графику, построенному по кобальта хлориду (СоС12 в пересчете на истизин (хризацин).
Фотоэлектроколориметрический метод рекомендован ГФ-Х1 для определения содержания (%)антраценпроизводных в сырье крушины, ревеня, марены красильной.
В корневищах и корнях марены красильной по ФС регламентируется определение связанных производных антрацена.
Количественное содержание связанных производных антрацена определяют вычитанием количества свободных производных антрацена (агликонов} из суммы производных антрацена.
При определении свободных производных антрацена отсутствует стадия гидролиза антрагликозидов. Агликоны извлекают из сырья эфиром, получают окрашенные феноляты, окисляют восстановленные формы пергидролем, определяют оптическую плотность окрашенных фенолятов по калибровочному графику, построенному по кобальта хлориду, рассчитывают содержание свободных производных антрацена в сырье марены красильной.
2. Спектрофотометрический метод.
Этим методом определяют содержание антраценпроизводных в листьях сенны.
Основные стадии метода:
- экстракцию сеннозидов проводят водой при нагревании;
- водное извлечение очищают от смолистых веществ;
- окисление восстановленных форм проводят с помощью FeCl3;
- гидролиз гликозидов антрахинонов проводят 50%-ным раствором серной кислоты;
- оптическую плотность окрашенных растворов измеряют с помощью спектрофотометра при длине волны 523 нм;
- содержание суммы производных антрацена в пересчете на хризофанол вычисляют по калибровочному графику, построенному по кобальта хлориду.
5. Качественный анализ дубильных веществ.
Для получения суммы дубильных веществ растительное сырье экстрагируют горячей водой в соотношении 1:30 или 1:10.
Качественные реакции на дубильные вещества можно подразделить
на 2 группы:
- Общие реакции осаждения – для обнаружения дубильных веществ
- Групповые – для установления принадлежности дубильных веществ к определенной группе
Для обнаружения дубильных веществ в растительном сырье используют следующие реакции:
- Специфической реакцией на дубильные вещества является реакция осаждения желатином. Используют 1 %-й раствор желатина на 10 %-ном растворе хлорида натрия. Появляется хлопьевидный осадок, растворимый в избытке желатина. Отрицательная реакция с желатином свидетельствует об отсутствии дубильных веществ.
- Реакция с солями алкалоидов. Образуется аморфный осадок за счет образования водородных связей с гидроксильными группами дубильных веществ и атомами азота алкалоида.
Эти реакции дают одинаковый результат независимо от группы дубильных веществ.
Реакции, позволяющие определить группу дубильных веществ.
1.Реакция Стиасни – с 40 % раствором формальдегида и конц. HCl -
Конденсированные дубильные вещества образуют осадок кирпично-красного цвета
2.Бромная вода (5 г брома в 1 л воды) - к 2-3 мл испытуемого раствора прибавляют по каплям бромную воду до появления в растворе запаха брома; в случае присутствия конденсированных дубильных веществ образуется оранжевый или желтый осадок.
3. Окрашивание с солями трехвалентного железа, железоаммонийными квасцами –
черно-синее (дубильные вещества гидролизуемой группы, которые являются производными пирогаллола)
или черно-зеленое (дубильные вещества конденсированной группы, которые являются производными пирокатехина).
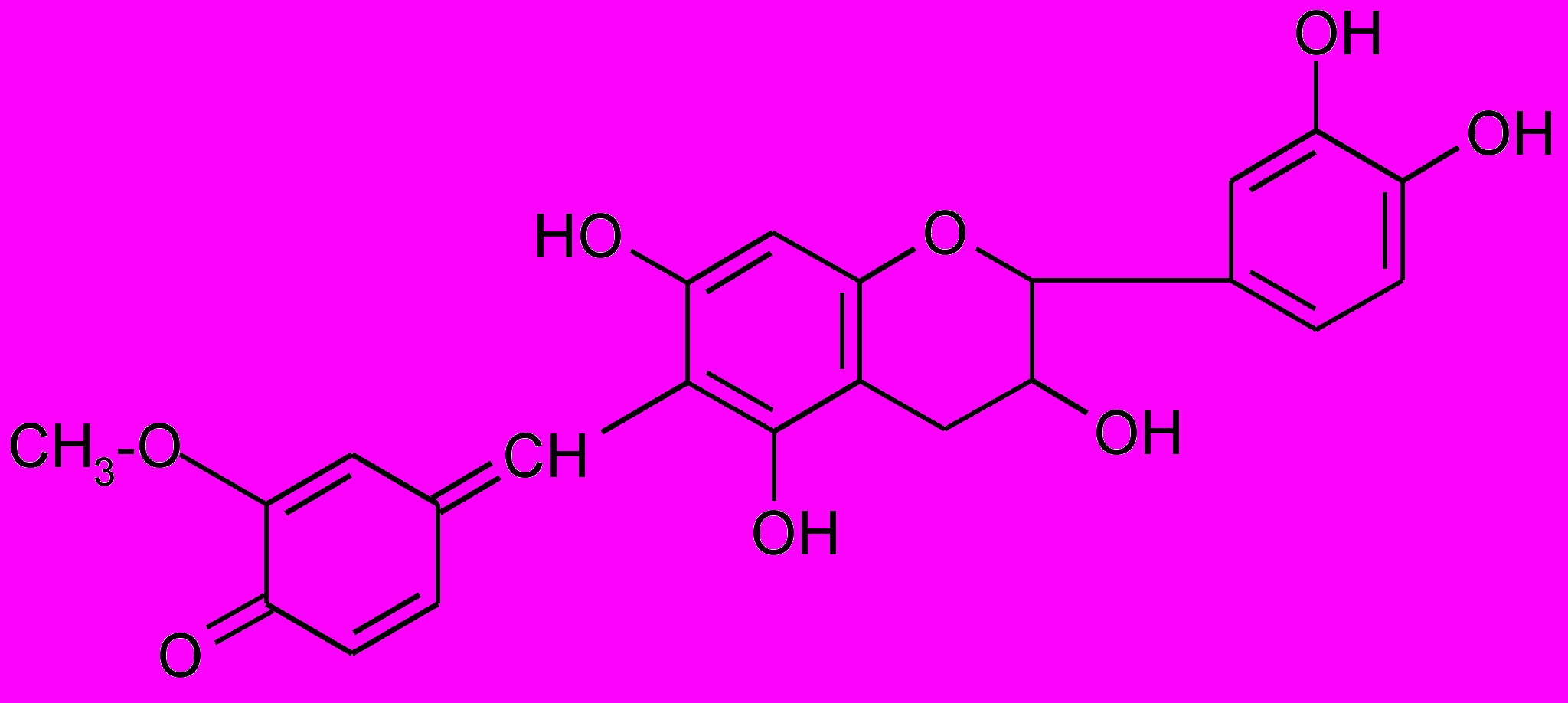
4.Катехины дают красное окрашивание с ванилином
(в присутствии конц. HCl или 70 %-ной H2SO4 развивается яркая красная окраска).
Катехины образуют при этой реакции окрашенный продукт следующего строения:
- Реакцией отличающей пирогалловые танниды от пирокатехиновых является реакция нитрозометилуретаном.
При кипячении растворов дубильных веществ с нитрозометилуретаном танниды пирокатехинового ряда осаждаются полностью,
а присутствие пирогалловых таннидов можно обнаружить в фильтрате путем прибавления железоаммиачных квасцов и натрия ацетата – фильтрат окрашивается в фиолетовый цвет.
- Свободная эллаговая кислота дает красно-фиолетовую окраску при добавлении нескольких кристаллов нитрита натрия и трех-четырех капель уксусной кислоты.
7. Для обнаружения связанной эллаговой кислоты (или гаксаоксидифеновой) уксусную кислоту заменяют 0,1 н. серной или соляной кислотой (кармино-красная окраска, переходящая в синюю).
8. Дубильные вещества с белками создают непроницаемую для воды пленку (дубление). Вызывая частичное свертывание белков, они образуют на слизистых оболочках и раневых поверхностях защитную пленку.
9. При соприкосновении с воздухом (например, резке свежих корневищ) дубильные вещества легко окисляются, превращаясь во флобафены или красени, которые обусловливают темно-бурую окраску многих кор и других органов, настоев.
Флобафены нерастворимы в холодной воде, растворяются в горячей воде, окрашивая отвары и настой в бурый цвет.
10. С 10 %-ным раствором среднего ацетата свинца (одновременно добавляют 10 %-ный раствор уксусной кислоты) :
образуется белый осадок, нерастворимый в уксусной кислоте – дубильные вещества гидролизуемой группы
(осадок отфильтровывают и в фильтрате определяют содержание конденсированных дубильных веществ, с 1 %-ным раствором железоаммонийных квасцов – черно-зеленое окрашивание);
белый осадок, растворимый в уксусной кислоте – дубильные вещества конденсированной группы.
11. Для идентификации отдельных соединений используют хроматографический анализ, рассматривая в УФ-свете. Обработку хроматограмм производят раствором железа хлорида или ванилиновым реактивом
Структуру устанавливают с помощью ИК-спектров, ПМР-спектров.
Реакция с 1 %-ным спиртовым раствором железоаммониевых квасцов является фармакопейной, проводится с отваром из сырья – кора дуба, корневище змеевика, соплодия ольхи, плоды черники;
А также непосредственно в сухом сырье – кора дуба, кора калины, корневища бадана.
Количественное определение.
- Гравиметрические или весовые методы – основаны на количественном осаждении дубильных веществ желатином, ионами тяжелых металлов или адсорбцией кожным (гольевым) порошком.
Официальным в дубильно-экстрактовой промышленности является весовой единый метод (ВЕМ):
В водных вытяжках из растительного материала вначале определяют общее количество растворимых веществ (сухой остаток) путем высушивания определенного объема вытяжки до постоянной массы;
затем из вытяжки удаляют дубильные вещества, обрабатывая ее обезжиренным кожным порошком; после отделения осадка в фильтрате вновь устанавливают количество сухого остатка.
Разность в массе сухого остатка до и после обработки вытяжки кожным порошком показывает количество подлинных таннидов.
- Титриметрические методы.
К ним относятся:
- Желатиновый метод - Метод Якимова и Курницкой – основан на способности дубильных веществ образовывать нерастворимые комплексы с белками. Водные извлечения из сырья титруют 1 % раствором желатина, в точке эквивалентности комплексы желатино-таннаты растворяются в избытке реактива.
Титр устанавливают по чистому таннину. Точку валентности определяют путем отбора наименьшего объема титрованного раствора, вызывающего полное осаждение дубильных веществ.
Метод наиболее точный, т.к. позволяет определить количество истинных дубильных веществ.
Недостатки: длительность определения и трудность установления точки эквивалености.
2) Перманганатометрический метод (метод Левенталя в модификации Курсанова). Это фармакопейный метод, основан на легкой окисляемости перманганатом калия в кислой среде в присутствии индикатора и катализатора индигосульфокислоты, которая в точке эквивалентности раствора меняется от синего до золотисто-желтого.
Особенности определения, позволяющие оттитровать только макромолекулы дубильных веществ: титрование проводится в сильно разбавленных растворах (извлечение разбавляеттся в 20 раз) при комнатной температуре в кислой среде, перманганат добавляется медленно, по каплям, при интенсивном перемешивании.
Метод экономичный, быстрый, прост в исполнении, но недостаточно точен, так как перманганат калия окисляет частично и низкомолекулярные фенольные соединения.
3) Для количественного определения таннина в листьях сумаха и скумпии используется метод осаждения дубильных веществ сульфатом цинка с последующим комплексонометрическим титрованием трилоном Б в присутствии ксиленолового оранжевого.
3. Физико-химические методы.
1) Фотоэлектроколориметрические - основаны на способности ДВ образовывать окрашенные соединения с солями трехвалентного железа, фосфорно-вольфрамовой кислотой, реактивом Фолина-Дениса и др.
2) Хроматоспектрофотометрические и нефелометрические методы используют в научных исследованиях.
6. Методы анализа сырья, содержащего сапонины.
Наличие сапонинов в лекарственном растительном сырье можно установить при помощи качественных реакций, которые проводят непосредственно с сырьем или с извлечением из него.
Качественные реакции на сапонины основаны на их физических, химических и биологических свойствах. Для проведения качественных реакций готовят водный настой 1:10 при нагревании на водяной бане. После охлаждения настой фильтруют.
Реакции, основанные на физических свойствах.
Для проведения реакции на пенообразование берут две пробирки, в одну добавляют 5 мл 0,1 моль/л HCl, в другую добавляют 5 мл 0,1 моль/л NaOH и сильно встряхивают. Если образуется стойкая пена в обеих пробирках или в пробирке с кислотой – это говорит о кислых тритерпеновых сапонинах.
Стероидные сапонины дают дают обильную, стойкую пену в щелочной среде.
Химические методы.
Относятся реакции осаждения сапонинов и цветные реакции.
1.Из водных растворов сапонины осаждаются гидроксидами бария и магния, солями меди, ацетатом свинца.
Причем тритерпеновые – осаждаются средним ацетатом свинца, а стероидные – основным.
2. Из спиртовых извлечений (или растворов) стероидные сапонины и тритерпеновые сапонины выпадают в осадок при добавлении 1% спиртового раствора холестерина в виде холестеридов.
3. Стероидные сапонины, так же как и сердечные гликозиды, дают реакцию Либермана-Бухарда с уксусным ангидридом и кислотой концентрированной серной – образуется быстро переходящая окраска от розовой до зеленой и синей.
4. Реакция Санье - стероидные сапонины от тритерпеновых можно отличить по реакции с 1% раствором сурьмы треххлористой, концентрированной серной кислотой, содержащей уксусный ангидрид, если образуется желтое окрашивание.
Учитывая, что многие из перечисленных химических реакций могут давать и другие соединения, проводят еще и биологические испытания.
На биологических свойствах сапонинов
основана реакция гемолиза с 2 % взвесью эритроцитов в изотоническом растворе. Кровь становится прозрачной, ярко-красной. Для проведения этой реакции из растительного сырья готовят настой на изотоническом растворе.
Государственная фармакопея XI издания (вып.2) рекомендует использовать качественные реакции для подтверждения подлинности для трех видов сырья.
1. Корневища с корнями синюхи голубой. С водным извлечением проводится реакция пенообразования, основанная на способности сапонинов снижать поверхностное натяжение жидкости (воды) и давать в отваре стойкую и обильную пену после встряхивания.
2. Корни аралии маньчжурской. Метанольное извлечение хроматографируют в тонком закрепленном слое силикагеля (на пластинках «Силуфол») в системе растворителей хлороформ-метанол-вода (61:32:7). В качестве свидетелей используют раствор «Сапарала». Хроматограмму проявляют 20% H2SO4 и нагревают в сушильном шкафу (1=105°С) в течение 10 мин. Появляются 3 пятна вишневого цвета на уровне пятен аралозидов в «сапарале».
3. Корни женьшеня.
а) Реакция с порошком корня женьшеня (на гликозиды). При нанесении конц. H2SO4 на порошок корня женьшеня через 1-2 минуты появляется кирпично-красное окрашивание, переходящее в красно-фиолетовое, а затем - в фиолетовое.
б) Наличие панаксозидов доказывают при помощи разделения извлечения из корня женьшеня в тонком слое силикагеля и последующим проявлением хроматограммы раствором фосфорно-вольфрамовой кислоты при нагревании. Панаксозиды проявляются в виде розовых пятен.
Единого метода количественного определения сапонинов в лекарственном растительном сырье нет.
Чаще всего используют физико-химические методы:
1.Потенциометрический метод. Метод основан на определении изменения электродвижущей силы (ЭДС) в результате титрования. Метод используется для определения суммы аралозидов в корнях аралии маньчжурской.
Этапы определения: - подготовительный; экстракция аралозидов метиловым спиртом и их кислотный гидролиз:
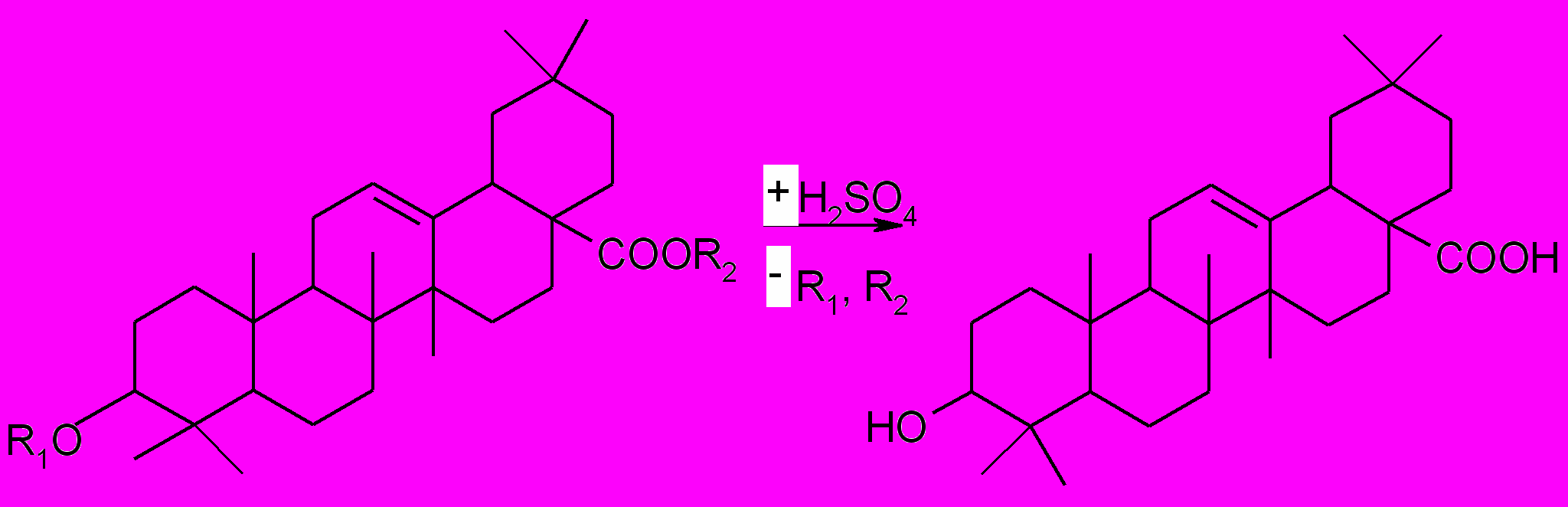
R1, R2 – сахара олеаноловая кислота
- очистка от сопутствующих веществ - осаждение олеаноловой кислоты в результате смены растворителя (разбавление спиртового извлечения водой и охлаждение);
- растворение олеаноловой кислоты в горячей смеси метилового и изобутилового спиртов (1:1,5);
- количественное определение - титрование раствором едкого натра (0,1 моль/л) в смеси метилового спирта и бензола:
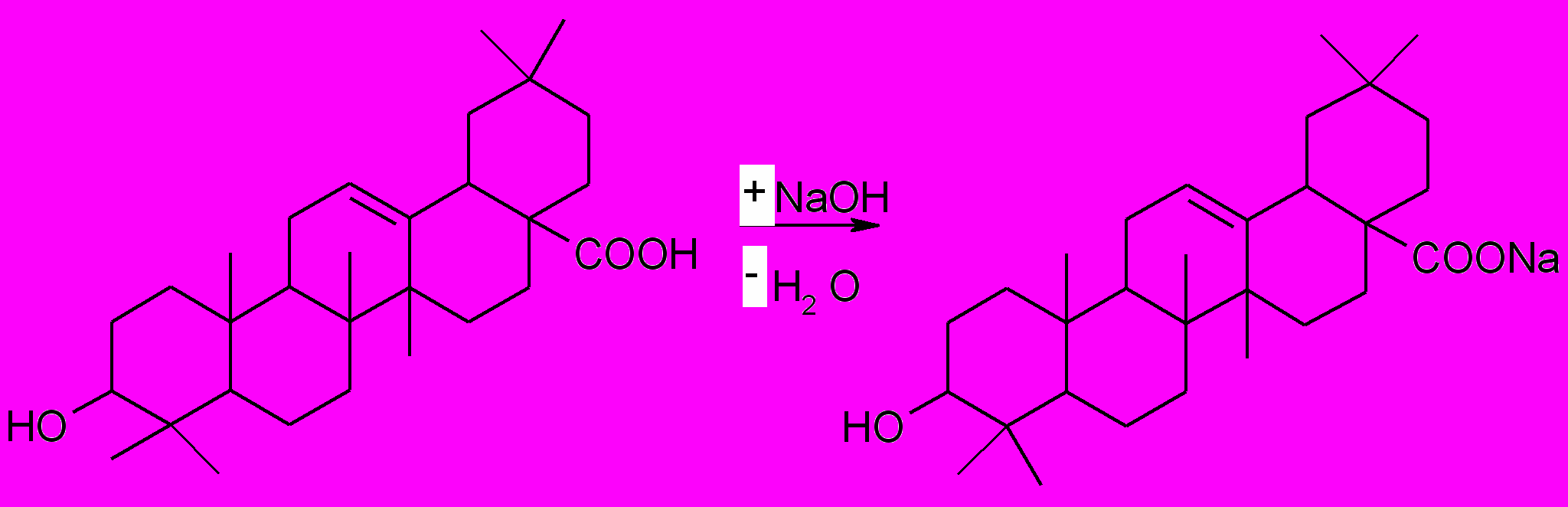
Точку эквивалентности определяют потенциометрически.
2. Спектрофотометрический метод. Метод основан на способности сапонинов и их окрашенных комплексов поглощать монохроматический свет при определенной длине волны. Метод предложен для определения содержания сапонинов в следующих видах сырья:
а) корневища с корнями диоскореи ниппонской. Проводят кислотный гидролиз сапонинов с последующим проведением реакции свободного агликона (диосгенина) с реактивом (п-диметиламинобензальдегид). Образуется окрашенный комплекс;
б) корни солодки. Проводят осаждение глицирризиновой кислоты концентрированным раствором аммиака. Осадок растворяют и определяют оптическую плотность полученного раствора.
3. Гравиметрический метод - определение экстрактивных веществ. Метод основан на определении сухого остатка после высушивания суммы веществ, извлеченных из сырья соответствующим экстрагентом. Метод предложен для оценки качества сырья женьшеня, почечного чая, синюхи голубой, солодки.
В сырье астрагала шерстистоцветкового и заманихи высокой количественное содержание биологически активных веществ не определяют.
4. Ранее для количественной оценки сырья использовали определение гемолитического индекса и пенного числа.
Количественное определение сапонинов гемолитическим методом основано на предположении, что гемолитическое действие прямо пропорционально количеству вещества в растворе.
Гемолитический индекс – наименьшая концентрация извлечения из сырья, которая вызывает полный гемолиз эритроцитов. Для этого к настою сырья на изотоническом растворе добавляют 2% взвесь бараньих эритроцитов. В результате гемолиза кровь становится прозрачной, ярко-красной, лакированной (эритроциты перейдут в плазму). Расчет проводят на 1 г испытуемого вещества.
5. Пенное число – наименьшая концентрация извлечения из 1 г сырья, при встряхивании которого в течение 15 секунд образуется пена, устойчивая в течение 15 минут.
6. Определяли силу действия сапонинового сырья на рыбах, то есть рыбный индекс. Это наименьшая концентрация извлечения, при которой гибнут рыбы массой до 0,5 г, длиной 3-4 см в течение 1 часа.
7. Анализ сырья, содержащего СГ.
Качественные реакции на СГ проводят с очищенным спиртовым извлечением из растительного сырья.
Все реакции на СГ можно разделить на 3 группы:
- реакции на углеводную часть молекулы (2-дезоксисахара) (реакция Келлер-Килиани);
- на стероидную структуру (реакция Либермана-Бухарда);
- на лактонное ненасыщенное кольцо.
1. Реакции на стероидную структуру.
Основаны на способности стероидного ядра СГ подвергаться дегидратации под действием кислотных реагентов (уксусный ангидрид, конц. серная кислота, трихлоруксусная кислота) с образованием окрашенных комплексных соединений. Образующиеся в результате реакций окрашивания меняются во времени, поэтому необходимо наблюдать их в момент соприкосновения реактивов, а затем отмечать изменение окраски в течение 10-15 минут.
Для СГ обычно проводят реакции:
1. Реакция Либермана-Бурхарда. При взаимодействии СГ со смесью уксусного ангидрида и конц. серной кислотой появляется розовое окрашивание, переходящее в зеленое.
2. Реакция Розенгейма. При взаимодействии СГ с 90% водным раствором трихлоруксусной кислоты появляется розовое окрашивание, переходящее в лиловое и затем в синее.
3. Реакция с хлоридом сурьмы (III). СГ при взаимодействии с хлоридом сурьмы в среде уксусного ангидрида образуют лиловое окрашивание
2. Реакции на ненасыщенное лактонное кольцо.
Основаны на способности ненасыщенного лактонного кольца легко окисляться в щелочной среде с образованием окрашенных продуктов реакции. Для СГ обычно проводят реакции:
1. Реакция Балье. При взаимодействии с пикриновой кислотой в щелочной среде СГ образуют комплексы, окрашенные в оранжевый цвет.
2. Реакция Кедде. При взаимодействии с 3,5-динитробензойной кислотой СГ образуют комплексы, окрашенные в красный цвет,
3. Реакция Легаля. При взаимодействии с нитропруссидом натрия в щелочной среде СГ образуют комплексы, окрашенные в красный цвет.
4. Реакция Раймонда. При взаимодействии с мета-динитробензолом СГ образуют комплексы, окрашенные в красно-фиолетовый цвет.
3. Реакции на углеводную часть молекулы.
Основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами.
1. Моносахара, входящие в состав СГ, после предварительного гидролиза вступают во все цветные реакции, свойственные углеводам (Феллинга, серебряного зеркала).
- Для дезоксисахаров используют реакцию Келлер-Килиани.
Дезоксисахара в присутствии сульфата железа (III), ледяной уксусной кислоты и конц. серной образуют комплексы, окрашенные в синий или сине-зеленый цвет. Необходимым условием для проведения этой реакции является отсутствие на конце углеводной цепи обычных сахаров (глюкозы).
Достоверное заключение о присутствии в лекарственном растительном сырье СГ можно сделать только при положительном результате всех трех групп качественных реакций на различные части молекулы.
В ГФ-Х1 на сырье наперстянок пурпурной и крупноцветковой, ландыша майского и горицвета весеннего качественных реакций не предусмотрено.
Кроме того, СГ образуют нерастворимые комплексы с растворами дубильных веществ, что используется при отравлениях СГ.
Количественное определение СГ проводят методом биологической стандартизации (ГФ-Х1, вып.2, с. 163-175).
Метод основан на способности СГ вызывать в токсических дозах остановку сердца животных в стадию систолы. В качестве подопытных животных используют лягушек, голубей или кошек. Чувствительность животных к сердечным гликозидам определяют в сравнении со стандартными индивидуальными веществами или экстрактами, которые вырабатывают в специальных научно-исследовательских институтах. Активность выражают в единицах действия (ЕД), которые, в зависимости от вида животных обозначают:
ЛЕД - «лягушачьи» ЕД, КЕД - «кошачьи» ЕД или ГЕД «голубиные» ЕД.
ЛЕД соответствует наименьшей дозе стандартного препарата, вызывающей остановку сердца стандартной лягушки (самец травяной лягушки массой 28-33 г). В нормативной документации на лекарственное сырье и препараты, содержащих СГ, обязательно указывается ВАЛОР (количество ЕД в 1 г сырья).
Недостатками метода биологической стандартизации являются его трудоемкость, высокая стоимость, большая ошибка опыта (до 25%).
Поэтому нормативная документация на некоторые виды сырья и препараты требует определять их количественное содержание физико-химическими методами (хроматофотоэлектроколориметрическим или хроматоспектрофотометрическим) методами. Они основаны на предварительном хроматографическом разделении СГ с последующим фотоэлектроколориметрическим или спектрофотометрическим определением.
8. Методы анализа сырья, содержащего простые фенольные соединения.
Качественный и количественный анализ сырья основан на физических и химических свойствах.
Качественный анализ.
Включает качественные реакции и хроматографические пробы.
Фенольные соединения в виде гликозидов извлекают из растительного сырья водой, затем извлечения очищают от сопутствующих веществ, осаждая их растворами ацетата свинца. С очищенным извлечением выполняют качественные реакции.
