Методы анализа биологичеcки активных веществ и их свойства
| Вид материала | Документы |
- Контрольная работа По дисциплине физико-химические свойства и методы контроля качества, 77.41kb.
- План лекций по химии для студентов 1 курса специальности 060201. 65 «Стоматология», 220.47kb.
- Темы лекций по аналитической химии: Общие положения и принципы аналитической химии, 23.35kb.
- План лекций по дисциплине «Токсикологическая химия» для студентов IV курса специальности, 18.73kb.
- План работы площадок (кроме холлов 1-2 этажей) в рамках Всероссийского фестиваля науки, 126.35kb.
- Производство и применение биологических средств защиты растений на основе энтомофагов,, 37.05kb.
- Лекция № Тема: «Методы и свойства», 168.5kb.
- I. электрохимические методы анализа, 355.17kb.
- Задачи в области управления активами в настоящий момент Пути совершенствования активных, 271.14kb.
- Биотехнология белковых лекарственных веществ. Рекомбинантные белки, принадлежащие, 79.62kb.
Простые фенолы и агликоны фенологликозидов дают
характерные для фенольных соединений реакции:
- с железоаммонийными квасцами
- с солями тяжелых металлов
- с диазотированными ароматическими аминами.
Специфические реакции (ГФ Х1):
- на арбутин (сырье толокнянки и брусники) используют цветные качественные реакции:
- с кристаллическим сульфатом закисного железа.
Реакция основана на получении комплекса, изменяющего окраску от сиреневого до темного с дальнейшим образованием темно-фиолетового осадка.
- с 10 %-ным раствором натрия фосфорно-молибденовокислого в кислоте хлористоводородной.
Реакция основана на образовании комплексного соединения синего цвета.
- на салидрозид (сырье родиолы розовой):
- реакция азосочетания с диазотированным сульфацилом натрия с образованием азокрасителя вишнево-красного цвета.

салидрозид азокраситель
Хроматографическое исследование
Используется ТСХ для обнаружения простых фенольных соединений в сырье родиолы розовой (ГФ Х1, вып. 2, ст. 75, с. 364-366).
Проба основана на разделении веществ в тонком слое силикагеля (пластинка «Силуфол») метанольного извлечения из сырья в системе растворителей хлороформ-метанол-вода (26:14:3) с последующим проявлением хроматограммы диазотированным сульфацилом натрия. Пятно салидрозида с Rf = 0,42 окрашивается в красноватый цвет.

Количественное определение.
Для количественного определения простых фенологликозидов в лекарственном растительном сырье используют различные методы: гравиметрические, титриметрические и физико-химические.
1. Гравиметрическим методом определяют содержание флороглюцидов в корневищах папоротника мужского. Метод основан на извлечении флороглюцидов из сырья диэтиловым эфиром в аппарате Сокслета. Извлечение очищают, отгоняют эфир, полученный сухой остаток высушивают и доводят до постоянной массы. В пересчете на абсолютно сухое сырье содержание флороглюцидов не менее 1,8%.
2. Титриметрический йодометрический метод используется для определения содержания арбутина в сырье брусники и толокнянки. Метод основан на окислении агликона гидрохинона до хинона 0,1 М раствором йода в кислой среде и в присутствии натрия гидрокарбоната.
Выделяют стадии определения:
- Извлечение арбутина из сырья водой
- Очистка водного извлечения основным ацетатом свинца
- Кислотный гидролиз арбутина. Гидролиз проводится концентрированной серной кислотой в присутствии цинковой пыли, чтобы выделившийся свободный водород предотвращал собственное окисление гидрохинона.
- Титрование 0,1 М раствором йода. В качестве индикатора используют раствор крахмала.

3. Спектрофотометрический метод используется для определения содержания салидрозида в сырье родиолы розовой.
Метод основан на способности окрашенного азокрасителя поглощать монохроматический свет при длине волны 486 нм. Стадии определения:
- Извлечение салидрозида водой
- Очистка водного извлечения осаждением балластных веществ раствором ацетата свинца и натрия сульфата
- Получение окрашенного азокрасителя по реакции салидрозида с диазотированным сульфацилом натрия
- Определение оптической плотности окрашенного раствора с помощью спектрофотометра при длине волны 486 нм
- удельного показателя поглощения ГСО салидрозида Е1%1см = 253.
Содержание салидрозида не менее 0,8 %.
9. Качественное определение.
Специфических реакций для всех групп флавоноидов не существует.
Часто используют следующие качественные реакции и хроматографическое исследование:
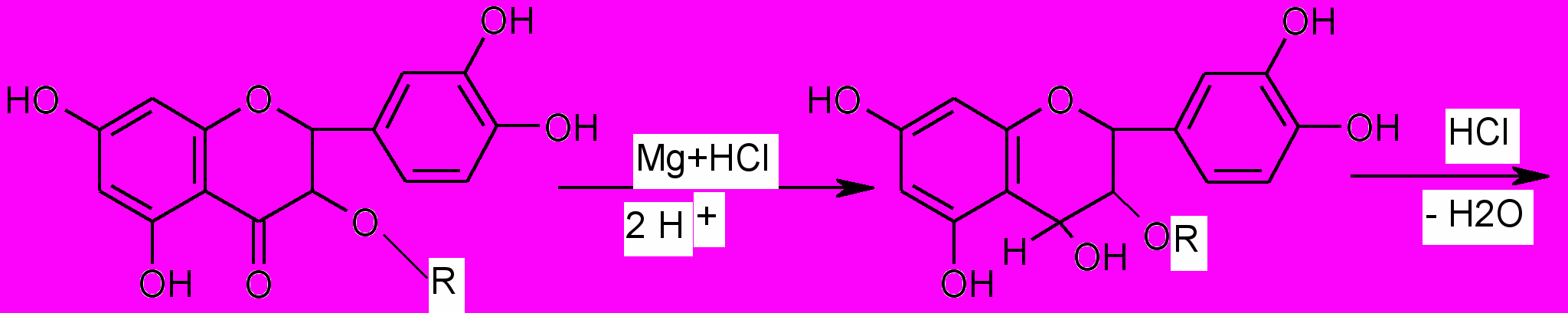
1. Характерной реакцией на флавоноиды - Цианидиновая проба или
проба Синода (проба Chinoda)(основана на восстановление их атомарным водородом в кислой среде в присутствии магния или цинка).
Флавоноиды при восстановлении магнием или цинком в присутствии концентрированной хлористоводородной кислоты образуют красное окрашивание, обусловливаемое образованием антоцианидинов:
хроменол
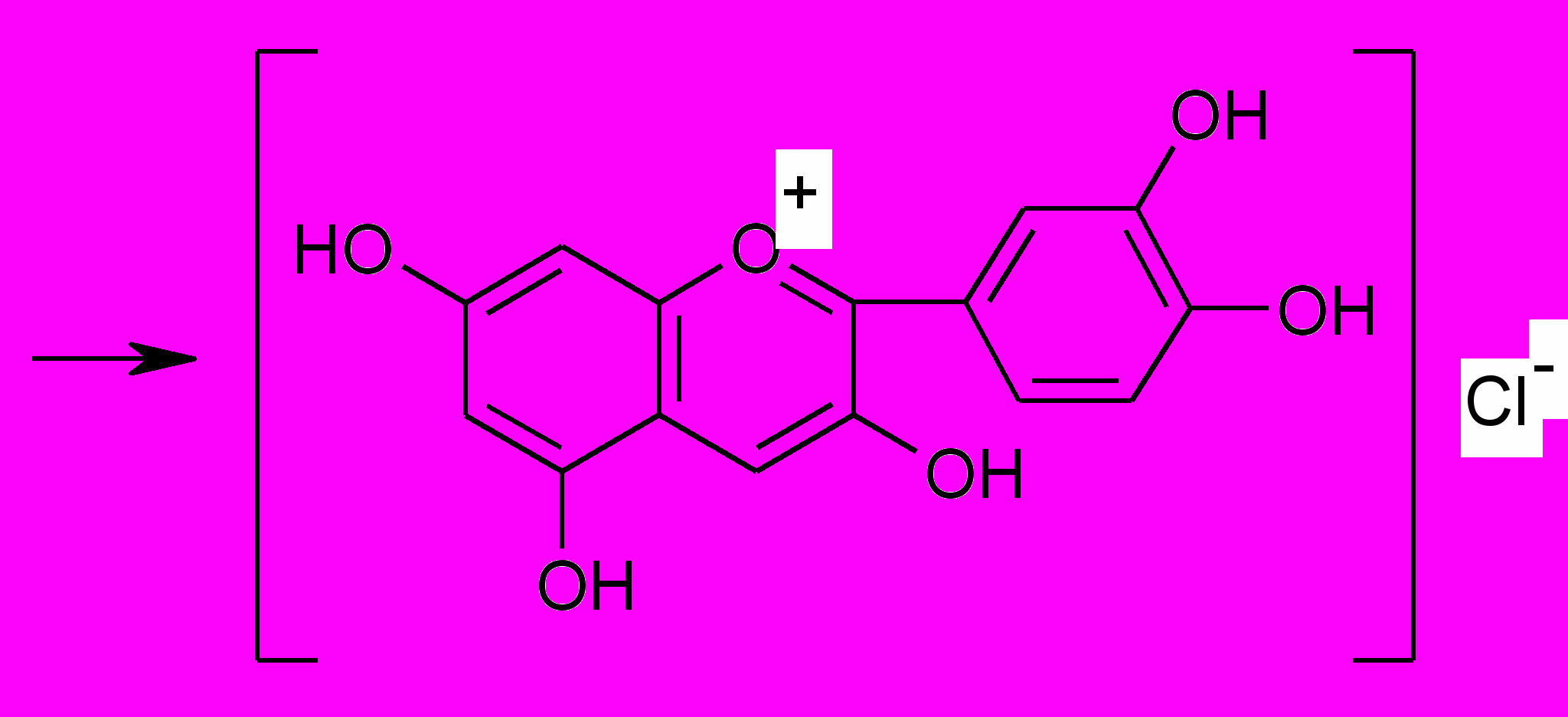
цианидин хлорид
Реакция очень чувствительна, основана на восстановлении карбонильной группы и образовании антоцианида.
Халконы и ауроны при помощи цианидиновой реакции не обнаруживаются, но при добавлении конц. HCl (без магния) образуют красное окрашивание за счет образования оксониевых солей.
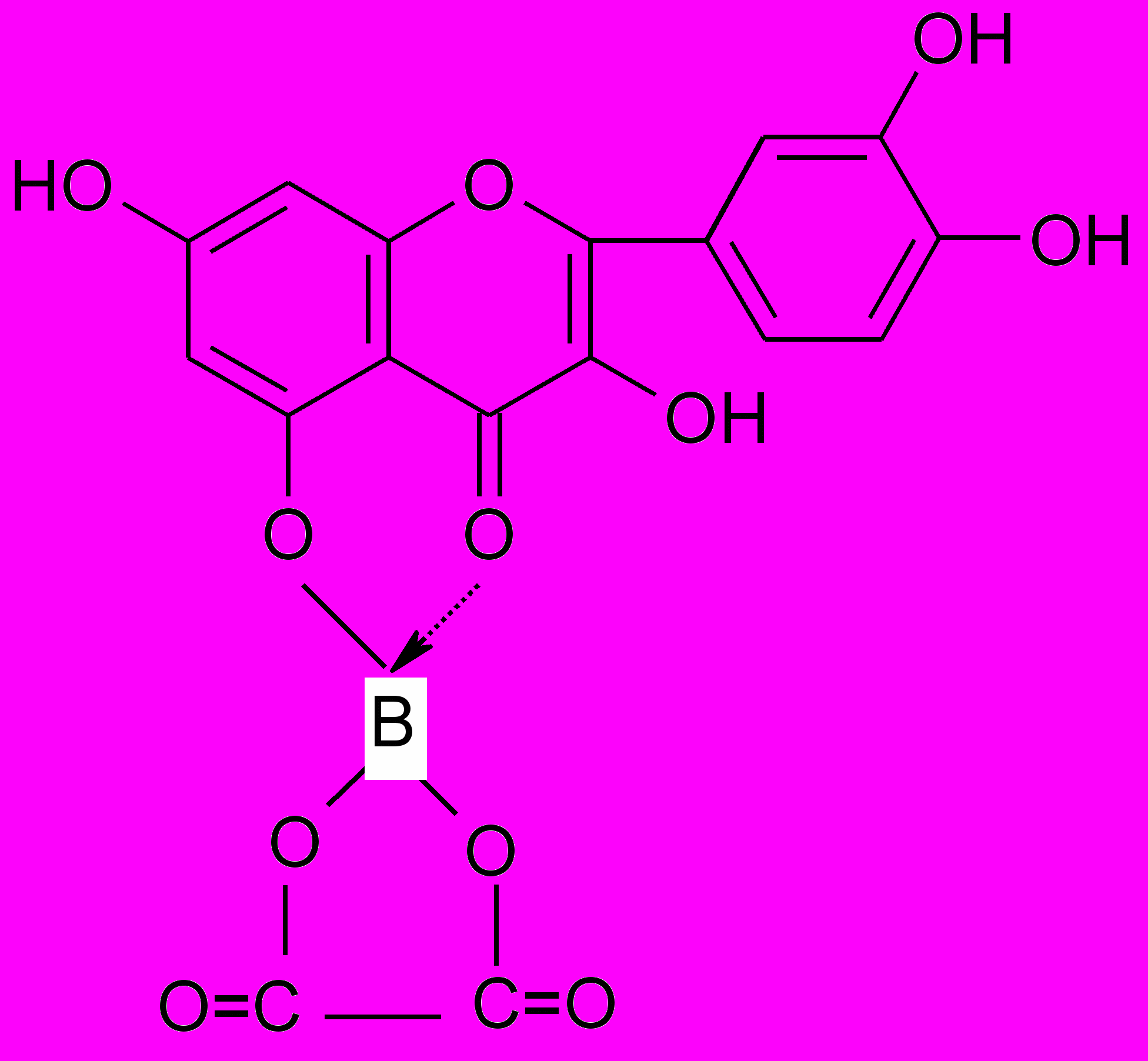
- Борно-лимонная реакция с реактивом Вильсона (по 0,5 г борной и лимонной кислот в метаноле).
Реакция отличия флавоноидов от фуранохромонов. Флавоноиды дают комплексы с борной кислотой желтой окраски с желто-зеленой флюоресценцией, которые не разрушаются лимонной кислотой (образование батохромного комплекса):
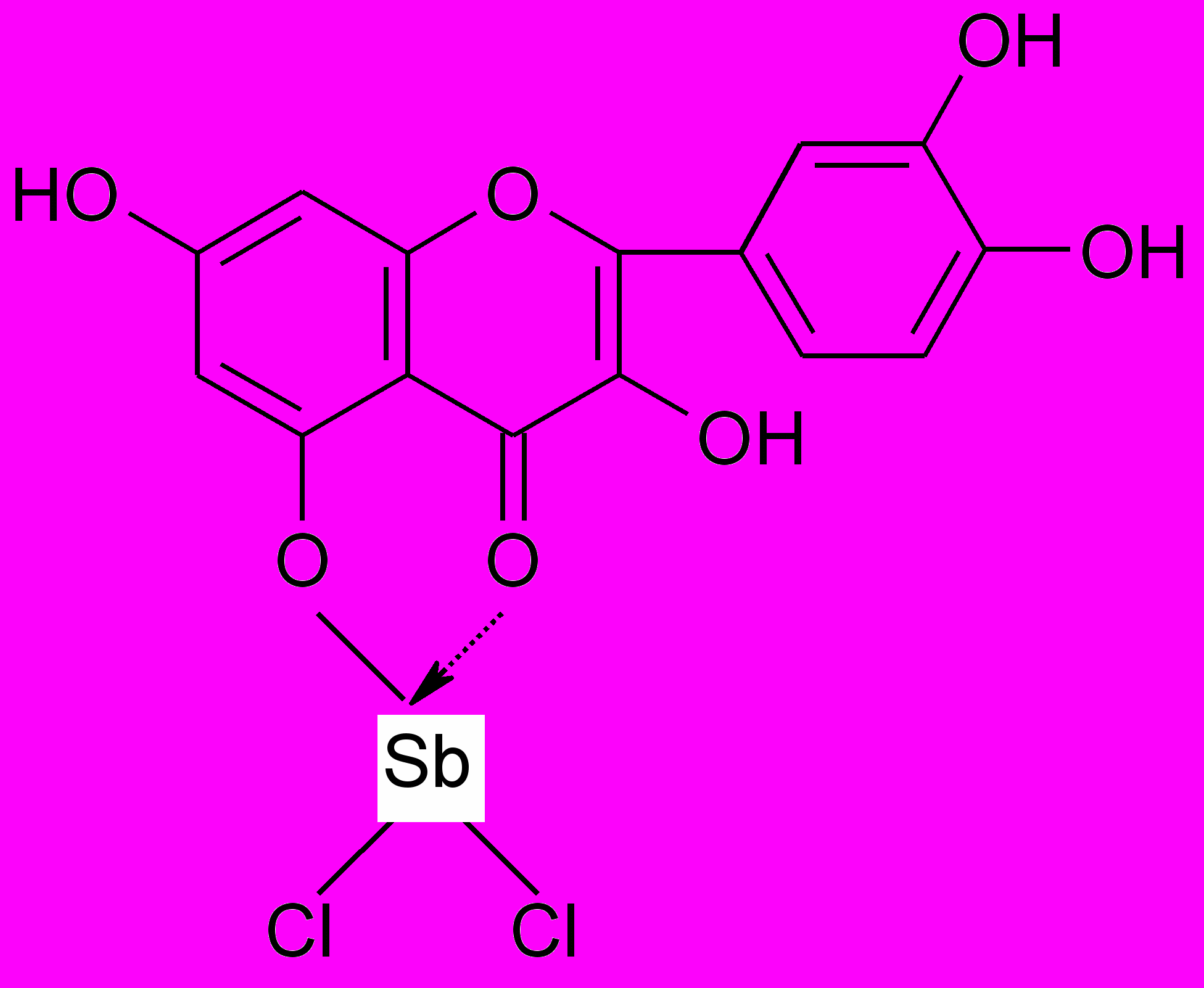
3. Реакция с треххлористой сурьмой.
5-оксифлавоны и 5-оксифлавонолы, взаимодействуя с треххлористой сурьмой, образуют комплексные соединения, окрашенные в желтый или красный цвет:
- С 2-5 %-ным спиртовым раствором AlCl3 желто-зеленое окрашивание говорит о наличии флавоноидов. Образуются хелатные комплексы за счет водородных связей, возникающих между карбонильной и оксигруппой, желтого цвета с желто-зеленой флюоресценцией.
Эта реакция приведена в ГФ Х1 изд. для подтверждения подлинности сырья
зверобоя, горца перечного и птичьего. Аналогично образуются комплексы с солями циркония.
- Реакция с солями железа (хлорид окисного железа), образуются комплексные соединения, окрашенные в черно-синий цвет, если флавоноиды триоксипроизводные и в зеленый, если диоксипроизводные.
- Реакция с 1 %-ным раствором основного ацетата свинца.
Антоцианидины дают синий аморфный осадок. Флавоны, халконы и ауроны – осадки ярко-желтого цвета.
- Реакция с 10 %-ным раствором щелочи с образованием фенолятов желтого цвета на флавоны и флавонолы. Антоцианидины образуют со щелочами соли от синего до оливково-зеленого цвета.
- Реакция азосочетания с диазосоединениями. Образуется азокраситель оранжевого, красного или вишнево-красного цвета.
8. С 1 %-м раствором ванилина в конц. HCl образуют красно-малиновое окрашивание катехины (производные флороглюцина и резорцина).
4. С раствором аммиака, щелочи флавоны, флаваноны, флавонолы, флаванонолы дают желтое окрашивание, при нагревании переходящее в оранжевое или красное;
халконы и ауроны тотчас же дают красное или пурпурное окрашивание.
Чистые катехины окрашивания не дают, однако присутствие даже в небольшом количестве примесей (продуктов окисления) вызывает появление желтой окраски.
Антоцианы в присутствии аммиака или карбоната натрия дают синее или фиолетовое окрашивание.
5. С 1 %-м раствором ванилина в конц. HCl образуют красно-малиновое окрашивание катехины (производные флороглюцина и резорцина).
6. Флавоны, халконы, ауроны, содержащие свободные орто-гидроксильные группировки в кольце В, при обработке спиртовых растворов средним ук-
суснокислым свинцом образуют осадки, окрашенные в ярко-желтый и красный цвета.
Антоцианы образуют осадки, окрашенные как в красный, так и в синий цвета.
7. С 1-2 %-ным спиртовым раствором AlCl3 желто-зеленое окрашивание говорит о наличии флавоноидов.
С целью обнаружения флавоноидов в растительном материале широко
используется хроматография на бумаге и в тонком слое сорбента, колоночная хроматография.Используют различные системы растворителей:
- БХ чаще всего БУВ (бутанол-уксусная кислота- вода) 4:1:5; 4:1:2;
- ТСХ – хлороформ-метанол 8:3; 8:2.
Обнаружение компонентов на хроматограмме осуществляется просматриванием их в УФ свете.
Идентифицируют флавоноиды по характерному свечению на хроматограммах в УФ-свете и после проявления хромогенными реактивами.
Катехины и лейкоантоцианиды не флюоресцируют. Гликозиды флавонов и изофлавонов флюоресцируют голубым или синим светом, флавонолов – темно-коричневым или черным, агликоны флавонов – коричневым, флавонолов – желтым, халконы и ауроны имеют желтую или оранжевую флюоресценцию.
После просматривания в УФ свете хроматограммы можно обработать одним из реактивов:
1) 5 %-ным спиртовым раствором AlCl3 c последующим нагреванием при 105 0С в течение 3-5 минут; (ярко-желтая окраска пятна в видимом свете и яркую желто-зеленую флуоресценцию в УФ –свете);
2) с 5 %-ной SbCl3 в четыреххлористом углероде (реактив Мартини-Беттоло); Желтая или желто-оранжевая окраска указывает на наличие флавонов, флавонолов, флаванонов и изофлавонов;красная или красно-фиолетовая – халконов.
3) с 2 %-ным спиртовым раствором щелочи
4) при обработке пятна парами аммиака усиливается голубая флуоресценция (изофлавоноиды)
что позволяет получить зоны с более яркой флуоресценцией в УФ свете.
5) Реактив Вильсона (раствор борной и б\в лимонной кислоты в б\в метаноле)
6) Реакция азосочетания – на наличие 7-оксифлаванолов, 7-оксиизофлаванолов.
Хроматографические методы анализа.
С целью обнаружения флавоноидов в растительном материале широко
используется хроматография на бумаге и в тонком слое сорбента.
Обнаружение компонентов на хроматограмме осуществляется просматриванием их в УФ свете.
При этом флавоны, флавонол-3-гликозиды, флаваноны, халконы и их 7-гликозиды – в виде желтых или желто-зеленых пятен; флавонолы и их 7-гликозиды – в виде желтых или желто-зеленых пятен; ксантоны в виде оранжевых пятен.
Изофлавоны при этом не проявляются.
После просматривания в УФ свете хроматограммы можно обработать одним из реактивов:
1) 5 %-ным спиртовым раствором AlCl3 c последующим нагреванием при 105 0С в течение 3-5 минут; (ярко-желтая окраска пятна в видимом свете и яркую желто-зеленую флуоресценцию в УФ –свете);
2) с 5 %-ной SbCl3 в четыреххлористом углероде (реактив Мартини-Беттоло); Желтая или желто-оранжевая окраска указывает на наличие флавонов, флавонолов, флаванонов и изофлавонов;красная или красно-фиолетовая – халконов.
3) с 2 %-ным спиртовым раствором щелочи
4) при обработке пятна парами аммиака усиливается голубая флуоресценция (изофлавоноиды)
что позволяет получить зоны с более яркой флуоресценцией в УФ свете.
Реактив Вильсона (раствор борной и б\в лимонной кислоты в б\в метаноле)
5) Реакция азосочетания – на наличие 7-оксифлаванолов, 7-оксиизофлаванолов.
Количественное определение.
В последние годы все большее распространение получают различные:
1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья.
К таким методам относятся фотоэлектроколориметрия, спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента.
1. Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме.
Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования.
2. фотоэлектроколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде, в реакции азосочетания с солями диазония.
ГФ Х1 издания дает ФЭК-метод для определения содержания суммы флавоноидов в листьях вахты трехлистной. Предварительно сырье очищают от хлорофилла хлороформом, получают спиртовое извлечение флавоноидов, затем измеряют оптическую плотность окрашенного раствора с помощью фотоэлектроколориметра. Содержание суммы флавоноидов рассчитывают по калибровочному графику, построенному по стандартному образцу рутина.
Известна цветная реакция флавоноидов с азотнокислым и уксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином.
В настоящее время широко используется метод спектрофотометричекий.
3. Спектрофотометрический метод (СФМ)
СФМ основан на способности флавоноидов или их окрашенных комплексов поглощать монохроматический свет при определенной длине волны.
- Получают спиртовое извлечение и измеряют собственное поглощение в:
- цветках бессмертника песчаного при длине волны 315 нм, рассчитывают содержание флавоноидов на изосалипурозид с использованием оптической плотности ГСО изосалипурозида;
- корнях стальника при длине волны 260 нм; рассчитывают на ононина;
- цветках пижмы измеряют оптическую плотность флавоноидов и фенолкарбоновых кислот в буферном растворе и пересчитывают на лютеолин с учетом оптической плотности ГСО лютеолина;
- Получают спиртовое извлечение, затем проводят реакцию образования комплекса с 2 %-ным раствором алюминия хлорида и измеряют оптическую плотность в:
- траве зверобоя в пересчете на рутин с учетом оптической плотности ГСО рутина;
- траве горца перечного в пересчете на кверцетин с учетом удельного показателя поглощения комплекса кверцетина с алюминия хлоридом;
- траве горца птичьего в пересчете на авикулярин с учетом удельного показателя поглощения комплекса авикулярина с алюминия хлоридом.
3) Получают извлечение антоцианов 1 %-ным раствором хлористоводородной кислоты из цветков василька синего, при этом образуются окрашенные оксониевые соли, у которых измеряют оптическую плотность и пересчитывают на 3,5 дигликозид цианидина (цианин) с учетом удельного показателя поглощения цианина в 1 %-ном растворе хлористоводородной кислоты.
- Хроматоспектрофотометрический метод.
1. Предварительное разделение флавоноидов в тонком слое сорбента (цветки боярышника). Стадии определения:
- получение спиртового извлечения;
- очистка извлечения;
- хроматографическое разделение флавоноидов на пластинке «Силуфол» в системе растворителей хлороформ-метанол 8:2 вместе со свидетелем ГСО гиперозида;
- идентификация гиперозида и свидетеля на пластинках в УФ-свете;
- элюирование гиперозида и ГСО смесью диоксана и воды 1:1;
- измерение оптической плотности испытуемого раствора и ГСО при длине 565 им;
- расчет содержания гиперозида.
- Предварительное разделение на колонке с полиамидом (плоды боярышника)
Стадии определения:
- получают спиртовое извлечение;
- отгоняют спирт и обрабатывают остаток 10%-ным раствором натрия хлорида;
- полученный раствор наносят на колонку с полиамидом;
- элюируют флавоноиды с колонки 95%-ным этанолом, собирают окрашенный в желтый цвет элюат в мерную колбу на 25 мл;
- измеряют оптическую плотность элюата при длине волны 365 нм;
- параллельно измеряют оптическую плотность элюата ГСО гиперозида, полученного аналогично элюату флавоноидов;
- пересчитывают на гиперозид с учетом оптической плотности элюата ГСО
гиперозида.
3. В траве сушеницы топяной выделяют следующие стадии количественного определения:
- получают спиртовое извлечение;
- отгоняют спирт и остаток обрабатывают 10%-ным раствором натрия хлорида;
- полученный раствор переносят на колонку с полиамидом;
- элюируют флавоноиды с колонки 95%-ным этанолом и собирают окрашенный в темно-желтый цвет элюат в мерную колбу на 50 мл;
- измеряют оптическую плотность элюата при длине волны 338 нм;
- параллельно определяют оптическую плотность раствора стандартного вещества сравнения (СОВС) калия бихромата;
- пересчитывают на гнафалозид А с учетом оптической плотности СОВС и
коэффициента пересчета калия бихромата на гнафалозид А и поправочного
коэффициента на неполное элюирование гнафалозида А с полиамидного сорбента.
4. Количественное содержание ксантонов в траве золототысячника:
- получают извлечение подкисленным 60%-ным этанолом;
- 2 мл извлечения наносят на колонку с полиамидным сорбентом;
- элюируют ксантоны 95%-м этанолом и собирают окрашенный в желтый цвет элюат в мерную колбу на 50 мл;
- получают окрашенный комплекс с алюминия хлоридом;
- измеряют оптическую плотность окрашенного комплекса;
- параллельно измеряют оптическую плотность окрашенного комплекса ГСО алпизарина с алюминия хлоридом;
- пересчитывают на алпизарин с учетом оптической плотности комплекса ГСО алпизарина с алюминия хлоридом.
Количественное определение.
В последние годы все большее распространение получают различные:
1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья.
К таким методам относятся фотоэлектроколориметрия, спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента.
Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме.
Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования.
Используется фотоколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде.
Известна цветная реакция флавоноидов с азотнокислым и уксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином.
В настоящее время широко используется метод спектрофотометричекий.
10. Методы анализа кумаринов
Для обнаружения кумаринов в растительном сырье проводят качественные реакции и хроматографическое исследование, используя лактонные свойства кумаринов:
- вступать в реакцию разрыва лактонного кольца (лактонная проба);
- давать окрашенные растворы с диазосоединениями;
- флуоресцировать в УФ-свете.
