Лечебный Фитоцентр «феникс»
| Вид материала | Документы |
СодержаниеСписок принятых сокращений 1. Аналитический обзор 2. Обоснование выбранного направления 3. Материалы и Методы 4. Экспериментальные исследования 4.1. Физико-химические свойства Флараксина. |
- Пособие для врачей Издание третье, переработанное и дополненное Ответственный редактор, 4797.24kb.
- Учебная программа для специальности: 1-79 01 01 Лечебное дело Факультет: лечебный, 388.42kb.
- Рабочая программа практических занятий по основам психотерапии лечебный и педиатрический, 29.04kb.
- Чжуанцзы Глава 1 странствия в беспредельном, 2827.87kb.
- Учебники и учебные пособия». Ростов-на-Дону: «Феникс», 8462.24kb.
- Утверждаю: Директор ООО «Феникс-Маркет» /Зайцев А. М/ Расценки на монтаж и ремонт оборудования, 43.53kb.
- Занятия лфк оказывают лечебный эффект только при правильном, регулярном, длительном, 202.6kb.
- Первые бортовые ЭВМ ракетно-космических комплексов Глава из книги Б. Н. Малиновского, 437.67kb.
- Тематический планы лекций по специальности 060101 лечебное дело (лечебный факультет, 7.31kb.
- Всвязи с этим приобретает значение разработка физических методов лечения, обеспечивающих, 21.9kb.
Список принятых сокращений
ФАВ – физиологически активные вещества
ЧСА – человеческий сывороточный альбумин
ПОЛ – перекисное окисление липидов
У – объем распределения, л/кг
С1 – клиренс, л/ч
T1/2аб – период полуабсорбции, ч
T1/2эл – период полуэлиминации, ч
S – площадь под кривой «концентрация-время», мг.ч/л
Реферат
1 книга отчета: 114 стр., 1 том 114 стр., 25 табл., 37 источников
Токсичность (острая и хроническая), кумуляция, иммунная система, фармакокинетика «флараксина».
Проведено изучение фармакологических свойств вещества «флараксин» в эксперименте.
Использованы фармакологические, токсикологические, биохимические, физико-химические и др.методы исследования.
Установлено, что в условиях in vitro и in vivo «Флараксин» обладает выраженными антиоксидантными свойствами. Флараксин является малокумуирующим веществом, не оказывает неблагоприятного влияния на состояние гуморального звена иммунитета.
Определены фармакокинетические параметры, обнаружено, что Флараксин наименее активно поступает в почки и печень, наиболее в кожу, слизистую оболочку тонкого кишечника и в глаза.
Разработан проект Временной Фармакологической Статьи (ВФС).
Проведены клинические испытания 1 и 2 фазы по лечению меланобластом.
Содержание
- Аналитический обзор
- Обоснование выбранного направления
- Материал и методы исследования
- Экспериментальные исследования
- Физико-химические свойства Флараксина
- Кумулятивные свойства Флараксина и острая токсичность вещества-основы (ВО)
- Изучение влияния Флараксина на иммунологическую реактивность
- Исследование антиоксидантных свойств Флараксина и активности аминотрансфераз в крови больных, пролеченных Флараксином
- Поиск средств лечения отравлений, вызванных передозировкой Флараксина
- Фармакокинетические параметры Флараксина
- Проект ВФС, лабораторный регламент на производство Флараксина
- Физико-химические свойства Флараксина
5. Клинические исследования
- Выводы
- Список использованных источников
1. Аналитический обзор
В доступной литературе имеется ограниченное количество публикаций, свидетельствующих о наличии у полифенолов противоопухолевой активности (1, 2, 3) и высокой токсичности.
Проведенные в 1990 г. В КНИИФТ исследования (4) показали, что Флараксин (состоящий из вещества-основы ВО и содержащей йод соли) обладает умеренной токсичностью и определенной противоопухолевой способностью (в опытах в культуре тканей). Это свидетельствует о необходимости дальнейшего изучения Флараксина.
2. Обоснование выбранного направления
В 1990 г. Были осуществлены эксперименты по изучению острой и хронической токсичности Флараксина, специфической активности и др. Установлено, что вещество тормозит более, чем на 50% рост меланомы
В-16 (опыты на культуре ткани и на мышах) в терапевтических дозах (5-10 мг/кг в сутки) не оказывает неблагоприятного влияния на функцию ЦНС, сердечно-сосудистую систему ССС, периферическую кровь, кроветворение и др.
Все эти эксперименты послужили обоснованием для разрешения Фармакологической комиссии МЗ Украины проведения клинических испытаний.
Исследования 1991 г. Были направлены на изучение кумулятивных свойств, фармакокинетических параметров Флараксина, его влияния на гуморальное звено иммунитета, разработку ВФС и др. (в рамках требований Фармакологической комиссии МЗ Украины). Начаты клинические испытания Флараксина.
3. Материалы и Методы
Опыты проведены на собаках, крысах линии Вистар, белых мышах, а также осуществлены исследования сыворотки крови больных, пролеченных Флараксином.
Описание методов исследования будет приведено в соответствующих разделах отчета.
4. Экспериментальные исследования
4.1. Физико-химические свойства Флараксина.
В работе использовали порошки Циклофосфана, Проспидина, Флараксина (лиофилизированной формы), Вещество-основа ВО, лецитин-стандарт (10% раствор в спирте), общие липиды эритроцитов (10% раствор в спирте), Цитохром-С (Fе 0,35%, Англия), стабильный радикал трифенил-вердазил, человеческий сывороточный альбумин. В качестве растворителя брали воду для инъекций. Спектры поглощения растворов записывали на спектрофотометре «Shimadzu MPC-5000» (Япония), ИК-спектры, флуоресценции на спектрофлуориметре «Hitachi MPF-4» (Япония). Липосомы готовили по методике (5) в средах 20 мМ трис-НСl, 0,1m NaСl (рН 7,4). Ультразвуковую обработку проводили на диспергаторах УЗДН-2 (22 кГц, 10мин) и MSE (Англия, 40кГц, 20 мин) с последующим центрифугированием 15 мин при 8x103 об/мин-1. Размеры липосом (100-300 нм) измеряли с помощью спектрофотометра оптического смещения "Malwern" (Англия), рассеянный свет аргонового лазера (=488 нм) регистрировали под углом 90o в гомодинном режиме. Микровязкость липосом из общих липидов эритроцитов измеряли с помощью несимметричного полиметинового красителя 4501у по методике (6)
Кинетика взаимодействия Флараксина, ВО и ЧСА.
Ч
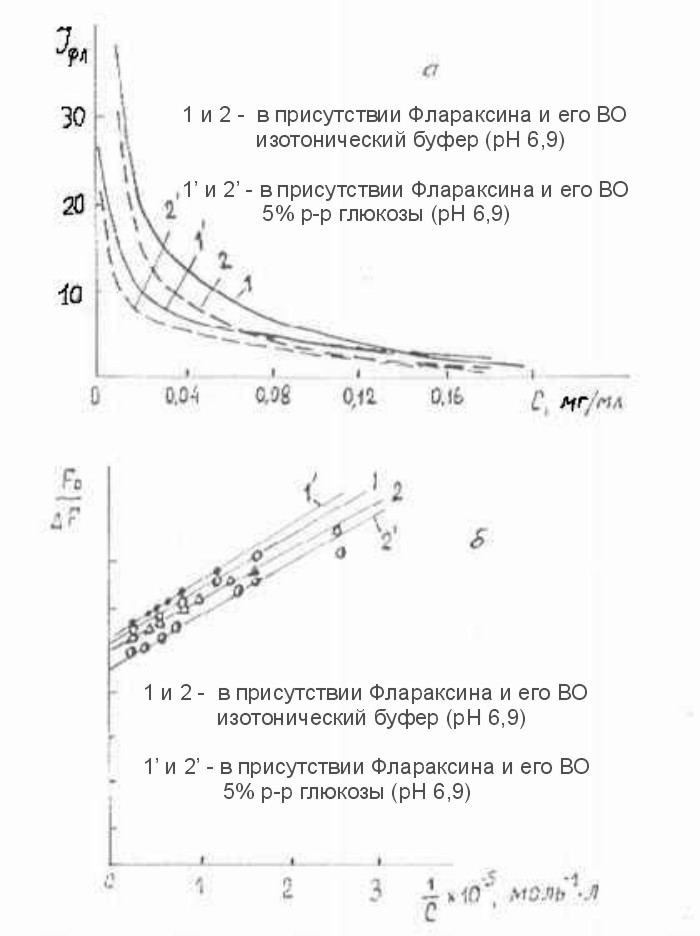
Рис.4.1 (а, б). Изменение интенсивности флуоресценции ЧСА в зависимости от концентрации ФЛАРАКСИНА или вещества-основы Флараксина в зависимости от F0/F=f (1/c)
СА – человеческий сывороточный альбумин, ВО – вещество-основа Флараксина.
Информацию о кинетике взаимодействия исследуемых физиологически активного вещества (ФАВ) с ЧСА можно получить, используя метод тушения его флуорес-ценции. Нами было проведено спектро-флуориметрическое титрование растворов ЧСА (С=0,25 мг/мл) растворами ФАВ. На Рис.4.1а приведены зависимости, отражающие изменение интенсивности флуоресценции ЧСА на длинах волн 330нм и 305нм (в=280нм) с возрастанием концентрации Флараксина (1) и ВО (2) в изотоническом буфере и в растворе 5% глюкозы.
Как можно видеть, эффективность тушения флуоресценции вещест-вом-основой ВО Флараксина больше, чем самим Флараксином. На Рис.4.1.(б) показаны графики в координатах Скетчарда F0/F=f(1/c) (7), а в Табл.4.1 - оцененные величины констант тушения Kq ( 330нм и 305нм).
Как следует из полученных результатов эксперимента, близкие значения Kq для разных длин волн, а также порядок констант (более низкие значения констант, чем для наносекундной динамики, характер-ной для внутри-глобулярных белков (8) свидетельствуют о влиянии окружения (вязкость среды, размеры и заряд тушителя) на процесс взаимодействия ФАВ с ЧСА. При этом замена изотонического буфера на 5% глюкозу приводило к ингибированию процесса тушения в случае Флараксина, величина Kq уменьшается на порядок, в то время как для вещества-основы Флараксина - Kq уменьшается в ~ 1,5 раза.
Таблица 4.1. Величины констант тушения флуоресценции ЧСА под влиянием Флараксина и вещества-основы Флараксина.
| Вещество | Kq, [моль-1·сек-1·л] | |
| - | Изотонический буфер | 5% глюкоза |
| Флараксин | ||
| фл 330 нм | (4,1±0,1)·105 | (4.2)·104 |
| фл 305 нм | (3,0±0,1)·105 | - |
| Вещество-основа Флараксина | ||
| фл 330 нм | (5,6±0,2)·105 | (3,65)·105 |
| фл 305 нм | (6,6±0,2)·105 ) | - |
Т.е. система Флараксин - ЧСА, характеризующаяся более быстрым обменом протонов, сильнее реагирует на ассоциированную Н-связями среду 5% глюкозы (контролируемый диффузией процесс), чем система вещество-основа Флараксина - ЧСА, характеризующаяся более медленным протонным обменом, наличием прочных межмолекулярных Н-связей /9/.
Таким образом, проведенные исследования показали, что взаимодействие ЧСА с Флараксином протекает более медленно, чем с его веществом-основой, применение в качестве растворителя 5% глюкозы еще более ингибирует взаимодействие ЧСА с Флараксином.
