Научно-практическая конференция «Старт в науку» Определение оптимальной методики восстановления оксида меди водородом для проведения демонстрационного эксперимента
| Вид материала | Документы |
- Альдегиды и кетоны, 102.22kb.
- Vi межшкольная научно-практическая конференция учащихся «старт в науку» Историко-краеведческая, 158.55kb.
- Научно практическая конференция «Старт в науку». Поколение next и язык sms сообщений., 226.5kb.
- Научно-практическая конференция «Старт в науку» «Определение жесткости воды водозаборных, 229.45kb.
- Районная научно практическая конференция школьников «первый шаг в науку 2011», 141.76kb.
- Районная научно практическая конференция по математике «Шаг в науку», 226.7kb.
- Методика проведения компьютерной лабораторной работы «Взаимодействие параллельных токов», 2070.55kb.
- Международная научно-практическая конференция «Детское движение Русского Мира тенденции, 57.63kb.
- Международная научно-практическая конференция «Инновационные процессы в экономической,, 160.11kb.
- Xiii научно-практическая конференция «первые шаги в науку», 379.04kb.
Министерство образования Пензенской области.
Муниципальное общеобразовательное учреждение
средняя общеобразовательная школа села Трескино.
_____________________________________________________________
Научно-практическая конференция «Старт в науку»
Определение оптимальной методики восстановления оксида меди водородом для проведения демонстрационного эксперимента
Научно-исследовательская работа.
Выполнила – Кулагина Юлия
ученица 9 класса МОУ СОШ с. Трескино
Колышлейского района
Научный руководитель-
учитель химии МОУ СОШ с. Трескино
Прокопенко Наталья Евгеньевна.
2010 г.
Химия- наука экспериментальная
Введение.
На уроках химии очень большая роль принадлежит опытам. Те опыты, которые показывают всему классу одновременно, называются демонстрационным экспериментом. Демонстрационный эксперимент играет очень важную роль в процессе усвоения химических знаний: помогает лучше понять материал, ведь говорят, что лучше один раз увидеть, чем много раз услышать.
Есть опыты, которые характеризуют одно вещество или группу веществ, похожих по своим свойствам. Как правило, их демонстрация ограничена отдельно взятой темой, а есть универсальные, которые могут быть показаны в разных классах при изучении нескольких тем. Именно к таким опытам относится восстановление меди двухвалентной из ее оксида.
Не смотря на то, что этот простой опыт общеизвестен, его можно показать по разному и использовать на уроках неорганической химии практически во всех классах: и для только что начинающих изучать химию восьмиклассников, и для учащихся девятых классов, постигающих премудрости химии элементов, и для одиннадцатых классов, учащиеся которых обобщают и систематизируют свои знания. Учитывая многофункциональность данного опыта, а также важность применения на уроке химии демонстрационного эксперимента нами была выбрана тема исследования: Определение оптимальных условий восстановления оксида меди водородом для проведения демонстрационного эксперимента; и поставлена Цель исследования :
- провести восстановления оксида меди II несколькими, предлагаемыми в литературе, способами.
-установить оптимальные условия проведения вышеупомянутого демонстрационного эксперимента.
Объекты исследования:
Демонстрационный эксперимент восстановления меди II из оксида водородом
Предмет исследования :
установки для восстановления меди II из оксида водородом
Для реализации поставленной цели были определены следующие задачи:
1. узнать:
- требования к проведению демонстрационного эксперимента на уроке химии;
- возможности демонстрации восстановления меди из оксида на уроках химии;
- способы проведения вышеуказанного демонстрационного опыта: особенности реактивов и установок
2. Провести восстановление меди из оксида на разных установках.
3. Проанализировав результаты, сделать вывод о соответствии способов восстановление меди из оксида на разных установках требованиям к демонстрационному эксперименту.
В ходе проведения работы использовались следующие методы:
- изучение литературы по исследуемой проблеме;
- химический эксперимент;
- наблюдение, анализ полученных данных.
После предварительного изучения способов проведения восстановления меди из оксида была сформулирована рабочая гипотеза:
Если при использовании определенной методики проведения восстановления меди из оксида соблюдается максимальное количество требований, предъявляемых к химическому эксперименту, то именно эту методику для проведения данного опыта можно считать оптимальной.
Практическая значимость исследования:
- установлены оптимальные условия для проведения восстановления меди из оксида меди II;
- на основании материалов исследования сформулированы рекомендации для
интересующихся химией учащихся и учителей по проведению данного опыта.
1. Демонстрационный химический эксперимент
1.1. Роль демонстрационного эксперимента на уроке химии.
Демонстрация опытов это искусство,
требующее особых навыков и напряженного внимания.
Демонстрационный химический эксперимент является эффективнейшим средством наглядности в преподавании химии. Благодаря опытам, ученики получают возможность знакомиться с внешним видом веществ, с их изменениями, с условиями различных химических превращений, учатся наблюдать и делать выводы из наблюдений, знакомятся с основными приемами проведения химического эксперимента.
Правильная техника выполнения демонстрационных опытов, манипуляции с химическим оборудованием и реактивами позволяет воспитать точность и аккуратность.
Демонстрация химических опытов на уроке дает эмоциональную разгрузку, поднимает интерес к рассказу учителя, позволяет сделать смысловую паузу и тем самым способствует лучшему усвоению учебного материала.
Итак, ценность демонстрационного эксперимента заключается в его образовательных и воспитательных возможностях.
1.2. Требования к проведению демонстрационного химического эксперимента.
Первое и основное требование ко всякому химическому опыту – это его безопасность. Условия, обеспечивающие безопасное проведение демонстрационного эксперимента определены в инструкции по проведению данного вида эксперимента и частными инструкциями по работе с определенной группой веществ. Для обеспечения безопасности при проведении опытов требуется овладеть глубокими знаниями определенных свойств веществ и неукоснительно соблюдать правила техники безопасности. Некоторые вещества, как правило, взрывчатые и сильно ядовитые применять для школьного демонстрационного эксперимента нельзя, некоторые следует использовать с большой осторожностью с применением вытяжного шкафа, защитных средств (перчатки и очки) или применять методику экологически чистого эксперимента.
Следующее важное требование – научность. Опыт должен соответствовать уровню подготовленности учащихся и быть доступным для их понимания. Эксперимент должен соответствовать изучаемой теме, иллюстрировать и раскрывать рассказ учителя или ставить перед учащимися проблемную задачу.
Очень важно усвоить хороший стиль экспериментальной работы. Все технические детали приборов должны быть изготовлены правильно и подогнаны безукоризненно. Отрицательное впечатление производят плохо подобранные пробки, трубки с неоплавленными или необрезанными концами, грубо вырезанные фильтры, неряшливо собранные приборы, грязная или разнокалиберная лабораторная посуда. Химические реактивы надо использовать нужной марки и квалификации по чистоте, растворы надлежащей концентрации. На емкостях с растворами и сухими реактивами должны быть этикетки, написанные аккуратно и химически грамотно.
Размеры оборудования и количества реактивов должны обеспечивать наглядность опыта: все, что происходит на демонстрационном столе, ученики в классе должны хорошо видеть.
Поскольку время урока ограничено, любому демонстрационному опыту отводится краткий промежуток времени, и поэтому он всегда должен быть тщательно подготовлен и проверен. Для демонстрации не подходят опыты, для проведения которых требуется очень много времени. Такие опыты желательно закладывать заранее или демонстрировать их основные этапы с помощью технических средств. И, наконец, опыт не должен требовать слишком много времени и сил на его подготовку.
Итак, основными требованиями к проведению демонстрационного эксперимента являются: безопасность проведения, научность, эстетичность, наглядность, быстрота протекания реакции, простота в исполнении.
2. Восстановление оксида меди II водородом.
2.1. Возможности демонстрации восстановления оксида меди II водородом в школьном курсе химии.
Мы пришли к выводу, что данная реакция может быть продемонстрирована при изучении следующих разделов и тем в восьмом классе: «Превращения веществ», «Оксиды и летучие водородные соединения», «Признаки химических реакций», «Реакции замещения», «Генетическая связь между классами неорганических соединений», «Окислительно-восстановительные реакции»; в девятом классе: «Металлы в природе. Общие способы их получения», «Водород и его свойства»;
в одиннадцатом классе: «Классификация химических реакций», «Металлургия», «Медь и ее соединения».
Как видно из приведенного перечня, реакция восстановления оксида меди II
достаточно «востребованная» и по усмотрению учителя может быть использована в разных классах при изучении разных тем.
2.2. Химические основы восстановления оксида меди II
В соединениях с кислородом медь может проявлять степень окисления +1 и +2. Оксид меди двухвалентной представляет - чёрные кристаллы, не растворимые в воде - CuO; В природе - минерал тенорит. Малотоксичен (относится к VIII к восьмой группе хранения реактивов). В лаборатории может быть получен при разложении малахита. При нагревании до 1100°С разлагается на Сu2О (Оксид меди (I)) и О2. Активные металлы, водород, углерод, угарный газ, аммиак восстанавливают оксид меди (II) до металлической меди. Восстановление меди из оксида водородом идет в соответствии с химической реакцией:
CuO + H2 = Cu + H2O+Q ,
Данная реакция замещения является окислительно-восстановительной, слабо экзотермической, необратимой, некаталитической, гетерогенной, то есть протекает на границе раздела твердой фазы (CuO) и газообразной фазы (Н2). Термодинамически реакция восстановления оксида меди водородом возможна и при комнатной температуре 25 гр. С (298 К), но ее скорость будет столь мала, что заметных изменений не будет видно. Реально, реакция будет наблюдаться при температуре выше 100 гр. С. Таким образом, для увеличения скорости данной реакции требуется два условия: нагревание приведенных в соприкосновение реагентов и увеличение площади соприкосновения реагирующих веществ, что достигается увеличением степени дисперсности CuO. Водород получают обычным способом: взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2↑
2.3.Способы постановки опыта по восстановлению оксида меди II водородом
Для проведения данной реакции в учебнике О.С. Габриэляна Химия 9 класс стр 100 рис 45. рекомендована такая установка для проведения данного опыта:
В
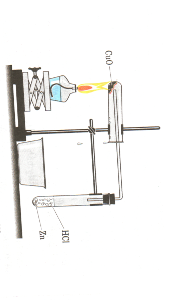 пробирку помещают порошок оксида меди, собирают прибор для получения водорода, проверяют газ на чистоту и нагревают оксид меди в токе водорода.
пробирку помещают порошок оксида меди, собирают прибор для получения водорода, проверяют газ на чистоту и нагревают оксид меди в токе водорода.В книге Штемплера Г.И., Мустафина А.И. «Учебный химический эксперимент» рекомендовано применение следующей установки для восстановления оксида меди:
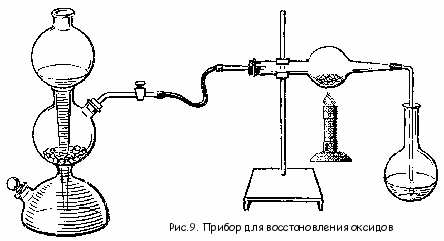
По рекомендациям автора следует собрать установку в соответствии с предложенной схемой. До начала проведения опыта все части прибора заполнить водородом, для чего открыть зажим у аппарата Киппа. Вместо аппарата Киппа можно использовать прибор для получения газов (ППГ-4) или другой способ получения достаточного выхода водорода. Вытеснить воздух и проверить водород на чистоту. Для этого соберать водород в пробирку и поджечь. Слабый хлопок говорит о чистоте водорода. Проводить опыт без предварительной проверки водорода на чистоту нельзя.
Отметив отсутствие взаимодействия водорода с оксидом меди при обычных условиях, не прекращая тока водорода, осторожно нагреть трубку с оксидом меди в течение 20-30 секунд.
Наблюдать изменение цвета реагирующих веществ в соответствии с уравнением реакции
CuO + H2 = Cu + H2O
После превращения всей порции исходного оксида в красный порошок меди (определяется визуально) прекратить нагревание и охладить продукт в токе водорода. Только когда его температура приблизится к комнатной, кран аппарата Кипа можно закрыть.
Особенно заинтересовала нас модификация опыта, предложенная Б.Н.Пасечником в журнале Химия в школе. 2001. № 2. Автор предлагает усовершенствованный опыт «Образование медного зеркала при восстановлении оксида меди водородом», описанного П.Н.Жуковым еще в 1971 г. По заявлению автора опыт адаптирован к современным условиям.
Суть предложенной методики проведения восстановления оксида меди водородом такова: Следует взять чисто вымытую пробирку, выдохнуть в нее воздух так, чтобы ее стенки запотели. Поместить в нее черный порошок оксида меди, полученный разложением малахита, осторожно вращая пробирку, распределить оксид меди по ее стенкам тонким слоем, поместить в пробирку газоотводную трубку прибора для получения газов, в котором выделяется водород и осторожно нагреть ее в пламени спиртовки. На стенках пробирки должен образоваться красивый металлический налет из восстановленной меди – медное зеркало.
2.4 Определение оптимальной методики проведения восстановления оксида меди II водородом для проведения демонстрационного эксперимента.
Предположив что модификация опыта предложенная Б.Н. Пасечником « Медное зеркало» будет привлекательнее остальных с эстетической точки зрения, мы начали практическую часть работы именно с нее.
При выполнении данной методики возникли следующие сложности:
- от дыхания запотевало горлышко и прилегающая к нему часть пробирки, но никак не ее дно, которое прогревать намного удобнее и безопаснее, да и зеркальный налет хорошо выглядит именно на дне;
- равномерно распределенный по увлажненной части пробирки оксид меди упрямо ссыпался вниз при нагревании;
- медь выделялась исключительно в виде красных кристалликов, которые упорно не хотели образовывать зеркальную поверхность
- полученное, наконец, после долгих трудов зеркало было не столь красивым как обещали.
Рекомендованная в учебнике установка не подвела: верхний слой лежащего у донышка пробирки оксида исправно восстановился, стенки пробирки запотели от выделившейся воды, однако процесс восстановления только верхнего слоя оксида занял 9 минут, что для урока в 40 минут является непозволительной роскошью.
Установка, предложенная в книге Штемплера Г.И., Мустафина А.И. «Учебный химический эксперимент» оказалась не очень проста в сборке, но безопасна, поскольку непрореагировавший водород достаточно удален от огня спиртовки, оксид меди, рассыпанный по хлоркальциевой трубке тонким слоем прореагировал с водородом в течении 3 минут, что вполне допустимо для демонстрационного опыта. Остуженная в токе водорода медь ярко выделялась на нижней стенки хлоркальциевой трубки, пары воды конденсировались в ее узкой части и капельки влаги сползали вниз, в сторону склянки с водой, где активно пробулькивал сквозь толщу воды водород, что, в совокупности, обеспечивало достаточную наглядность опыта.
Таким образом, оптимальной для проведения данного опыта оказалась методика, предложенная в книге Штемплера Г.И., Мустафина А.И. «Учебный химический эксперимент», но по прежнему остается заманчивой идея отработать методику получения идеально красивого медного зеркала.
Заключение.
Поведенное исследование показало, что восстановление меди из оксида может быть использовано в качестве демонстрационного опыта при изучении многих разделов и тем химии.
Данный опыт соответствует максимальному количеству требований к демонстрационному эксперименту на установке, предложенной в книге Штемплера Г.И., Мустафина А.И. «Учебный химический эксперимент».
Именно эта модификация опыта может быть рекомендована для практического осуществления.
Список литературы.
1. Габриэлян О. С.Химия 9 класс-учебник для общеобразовательных учреждений 16 издание- Москва Дрофа 2009г. стр100
2. Пасечник Б.Н. «Взаимодействие водорода с оксидом меди (II) с образованием медного зеркала» - Химия в школе. 2001. № 2. С.72-73.
3. Штемплера Г.И., Мустафина А.И. «Учебный химический эксперимент». Кафедра химии и методики обучения химического факультета Саратовского госуниверситета-2006 г.
4. Техника безопасности в кабинете химии
5. Обязательный минимум содержания