Разработка и внедрение технологии промышленного производства и системы управления качеством ассоциированной паротитно-коревой вакцины 03. 01. 06 биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01., 843.88kb.
- Курс семестр Всего зачетных единиц Трудоемкость дисциплины в часах, 26.33kb.
- Рекомендации по внутришкольному управлению качеством образования, 2175.02kb.
- Типовой план проекта «Разработка стратегии и внедрение системы стратегического управления», 117.19kb.
- Реферат отчета о научно-исследовательской работе по теме: «Разработка и внедрение ресурсосберегающей, 76.5kb.
- Для управления качеством ремонтных работ широко применяются технологические методы, 453.24kb.
- Программа по дисциплине «Управление качеством», 44.79kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
Специфическая активность сливов вируса паротита в зависимости
от номера слива по годам.
| Параметр | 2003 г. | 2004 г. | 2005 г. | ||||
| | слив 1 | слив 2 | слив 3 | слив 1 | слив 2 | слив 1 | слив 2 |
| N наблюдений | 1845 | 1841 | 158 | 2121 | 2134 | 1499 | 1490 |
| Среднее | 6,50 | 6,62 | 5,99 | 6,58 | 6,77 | 6,58 | 6,42 |
| Доверит. -95,00% | 6,48 | 6,60 | 5,94 | 6,56 | 6,76 | 6,56 | 6,40 |
| Доверит. -+95,00% | 6,51 | 6,64 | 6,05 | 6,59 | 6,78 | 6,60 | 6,44 |
| Стандартное отклонение | 0,35 | 0,42 | 0,36 | 0,35 | 0,28 | 0,35 | 0,38 |
| Коэффициент вариации(%) | 5,38% | 6,28% | 6,05% | 5,34% | 4,20% | 5,29% | 5,94% |
На основании анализа 8099 производственных сливов за 2003-2005 годы видно, что специфическая активность первых и вторых сливов в процессе производства паротитной вакцины статистически не имела достоверных различий по годам. Коэффициент вариации находился в пределах 4.2-6.28%. Показатели специфической активности третьих сливов были значительно ниже, что явилось основанием для дальнейшего их исключения из этапов производства. О стабильности получения полуфабриката паротитной вакцины свидетельствуют карты Шухарта (на примере Х-Карты), рис 5.
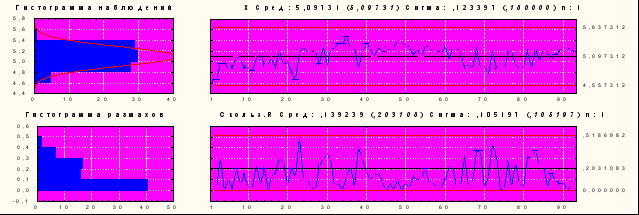
Х – карта Среднее 5,10 Сигма 0,123 n: 1
Рисунок № 5. Контрольная Х-карта Шухарта индивидуальных значений для специфической активности паротитной вакцины (2004 год).
Представленные данные по статистическому анализу распределения активности паротитной вакцины, произведенной, в 2004 году, показывают стабильность технологических процессов
Средние показатели множественности заражения клеток вакцинным вирусом эпидемического паротита в 2003 и 2004 г.г. были статистически неотличимы, однако вариабельность заражающей дозы в 2003 г. по сравнению с 2004 г. была выше в 2,2 раза. После введения элементов статистического управления процессом вариабельность удалось оптимизировать на уровне 2004 года. (Табл. 14).
Таблица № 14
Вариабельность инфицирующей дозы (ТЦД50 на клетку) при заражении клеток ФЭП вакцинным вирусом паротита
| Статистические параметры | 2003 год | 2004 год |
| n | 89 | 110 |
| M | 0,00074 | 0,00075 |
| Доверит.- 3 Ϭ | 0,00057 | 0,00068 |
| Доверит. +3 Ϭ | 0,00091 | 0,00082 |
| V, (%) | 111,81% | 49,43% |
Специфическая активность сливов вакцинного вируса паротита при внесении минимальных доз (0,00012 ТЦД50 на клетку в 2003 году и 0,00026 ТЦД50 на клетку в 2004 г) и максимальных доз (0,0078 и 0,0019) не отличалась, что позволяет сделать заключение, что принятые дозы заражения являлись оптимальными.
Значения параметров, контролируемых при производстве готовой моновакцины против эпидемического паротита, не отличались статистически в 2003 и 2004 году. (Табл. 15).
Таблица № 15
Значения показателей, контролируемых при выпуске
паротитной моновакцины, (М±σ)
| Показатель | Требование ФС | 2003 год | 2004 год |
| n = 93 (19) | n = 196 (27) | ||
| Концентрация белка на дозу, мкг | Не более 2 | 0,44±0,13 | 0,66±0,28 |
| Спец.активн.серий, lg ТЦД50/0.5 мл | Не менее 4,3 | 5,10±0,18 | 5,14±0,18 |
| Точность розлива, % | Не выше 10 | 0,66±0,25 | 0,97±0,43 |
| Кол-во антибиотиков, мкг/доза | Не более 20 | 3,73±0,69 | 4,96±1,17 |
| Потеря массы при высушивании, % | Не более 2 | 1,14±0,29 | 1,17±0,25 |
| Остаточный кислород, % | Не выше 1 | 0,31±0,06 | 0,24±0,04 |
| рН, ед. рН | 7,2 -7,8 | 7,42±0,09 | 7,43±0,7 |
Вариабельность контролируемых показателей, предусмотренных ФС, в 2005 году сохранилась на уровне 2003-2004 годов. Проведенный статистический анализ технологических процессов производства паротитной моновакцины не выявил параметров, вариабельность которых была бы не случайна. Единственным корректирующим действием была отмена сбора третьих сливов.
Проведенные исследования доказали, что производство коревой и паротитной вакцин в МПБП стабильно, однако уровень стабильности полуфабрикатов, достаточный для выпуска моновакцин против кори и эпидемического паротита, обеспечивающий необходимый для надежной защиты от этих инфекций, был недостаточен для обеспечения выпуска качественной ассоциированной вакцины.
Полученные при анализе производства в 2002 году данные сделали возможным сузить диапазон множественности заражения при производстве полуфабриката для коревой вакцины, в результате чего увеличилась специфическая активность и снизилась вариабельность данного показателя.
Таким образом, комплекс данных, полученных при изучении вариабельности специфической активности полуфабрикатов вакцинных вирусов кори и эпидемического паротита, позволил нам в 2002 году сделать вывод, что сведение этих полуфабрикатов с таким расчетом, чтобы разница между активностью вируса паротита и активностью вируса кори составляла не менее 0,9 lg ТЦД50, позволит создать технологию производства ассоциированной вакцины.
Создание технологии производства ассоциированной паротитно-коревой вакцины (АПКВ).
Статистический анализ процессов приготовления вируссодержащих культур вакцинных вирусов эпидемического паротита и кори привел не только к существенной стандартизации выпускаемых моновакцин, но и создал необходимые предпосылки создания ассоциированной вакцины на базе этих вакцинных вирусов.
Специфическая активность компонентов АПКВ имеет решающее значение для эффективности и безопасности препарата. Многолетняя разработка способа оптимизации специфической активности компонентов ассоциированной паротитно-коревой вакцины привела к научному открытию – созданию технологии производства АПКВ. Новизна данной разработки подтверждена выдачей патентов РФ и Евразийского патента.
В табл. 16 приведены данные по специфической активности компонентов созданной АПКВ за 2003-2005 гг. По ФС титр коревого компонента в дозе (0,2 мл) должен быть не ниже 3 lg ТЦД50/0,5 мл, паротитного - не ниже 4,3 lg ТЦД50/0,5 мл, превышение титра паротитного компонента над коревым - не ниже 0,9 lg ТЦД50/0,5 мл.
Таблица № 16
Показатели специфической активности компонентов АПКВ
| | | Титр компонентов lg ТЦД 50/0,5 мл | Превышение активности, паротит/корь | |||
| Год | n | Коревой | Паротитный | |||
| М± σ | Min-max | М± σ | Min-max | |||
| 2003 | 122 | 3,87± 0,21 | 3,37 – 4,44 | 5,01±0,18 | 4,60 – 5,37 | 1,14±0,19 |
| 2004 | 108 | 3,74±0,19 | 3,27 – 4,23 | 5,07 ±0,13 | 4,77 – 5,37 | 1,34±0,23 |
| 2005 | 113 | 3,96±0,25 | 3,34 – 4,37 | 5,02±0,19 | 4,44 – 5,37 | 1,09± 0,20 |
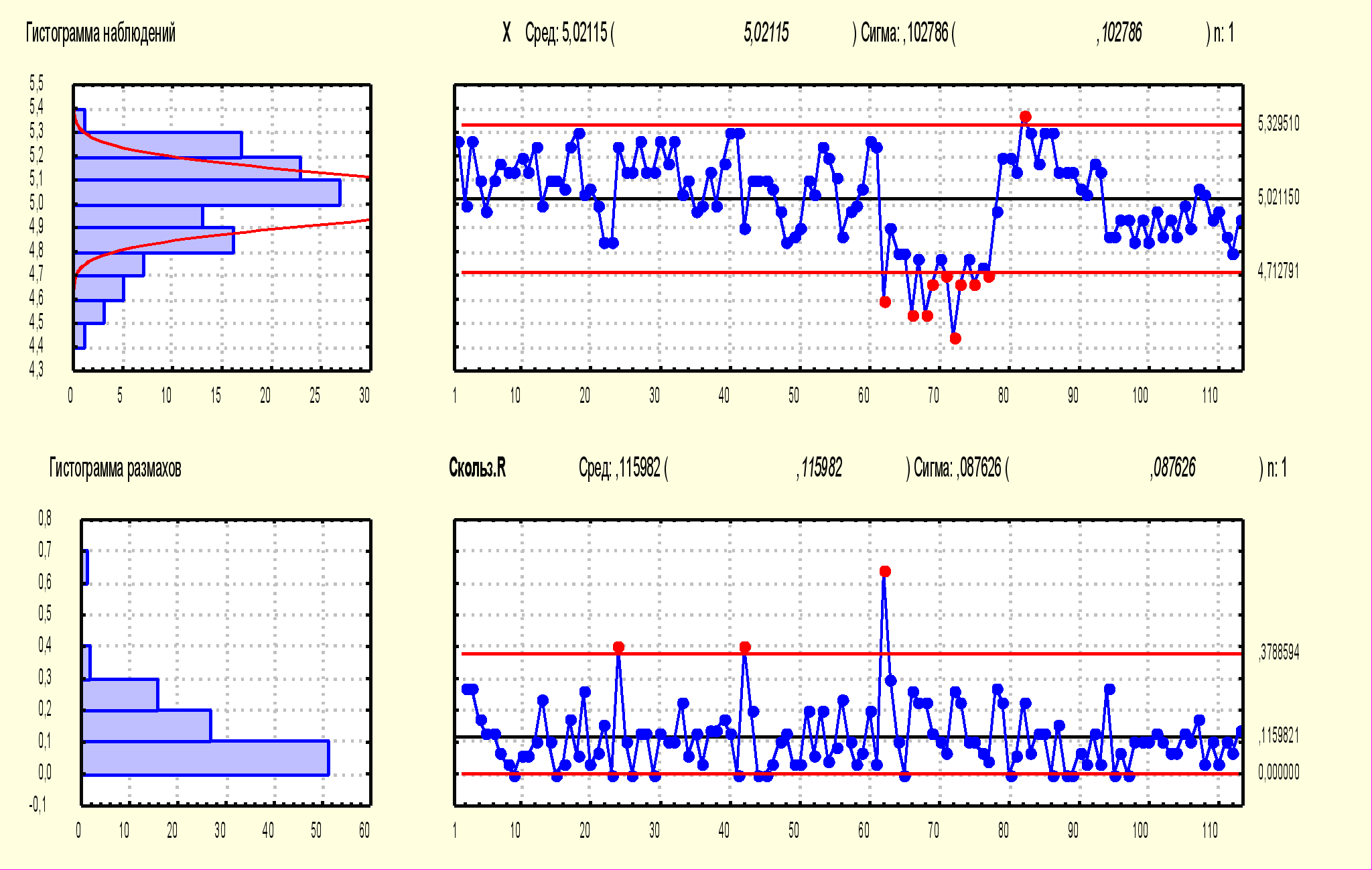
Как видно из табл. 16, специфическая активность как коревого, так и паротитного компонентов за исследуемый период различались незначительно и была более высокой, чем установлена в ФС, специфическая активность паротитного компонента значительно превышала активность коревого. Стабильность показателей специфической активности была подтверждена результатами, представленными в контрольных Х-картах Шухарта обоих компонентов вакцины. На рис. 6 приведены Х-карты специфической активности коревого и паротитного компонентов АПКВ.
2
Х-карта Сред 5,01 Сигма 0,18 n: 1
Х-карта Сред 3,87 Сигма 0,21 n: 1
003 г
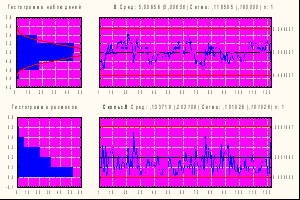 | 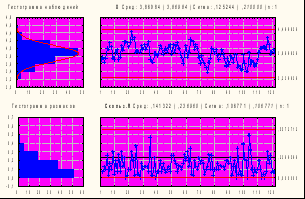 |
Рис. № 6-1 Х-карта специфической Рис. № 6-2 Х-карта специфической
активности паротита активности кори
2
Х-карта Сред 5,07 Сигма 0,13 n: 1
Х-карта Сред 3,74 Сигма 0,19 n: 1
004 г
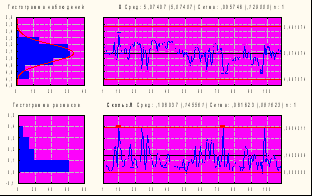 | 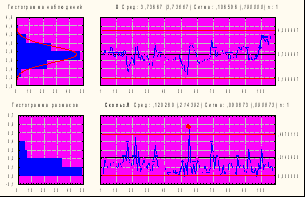 |
Рис. № 6-3 Х-карта специфической Рис. № 6-4 Х-карта специфической
активности паротита активности кори
2
Х-карта Сред 5,02 Сигма 0,19 n: 1
Х-карта Сред 3,96 Сигма 0,25 n: 1
005 г
 5,635976 5,019867 4,440758 | 4,732672 3,962452 3,219855 1 10 20 30 40 50 60 70 80 90 100 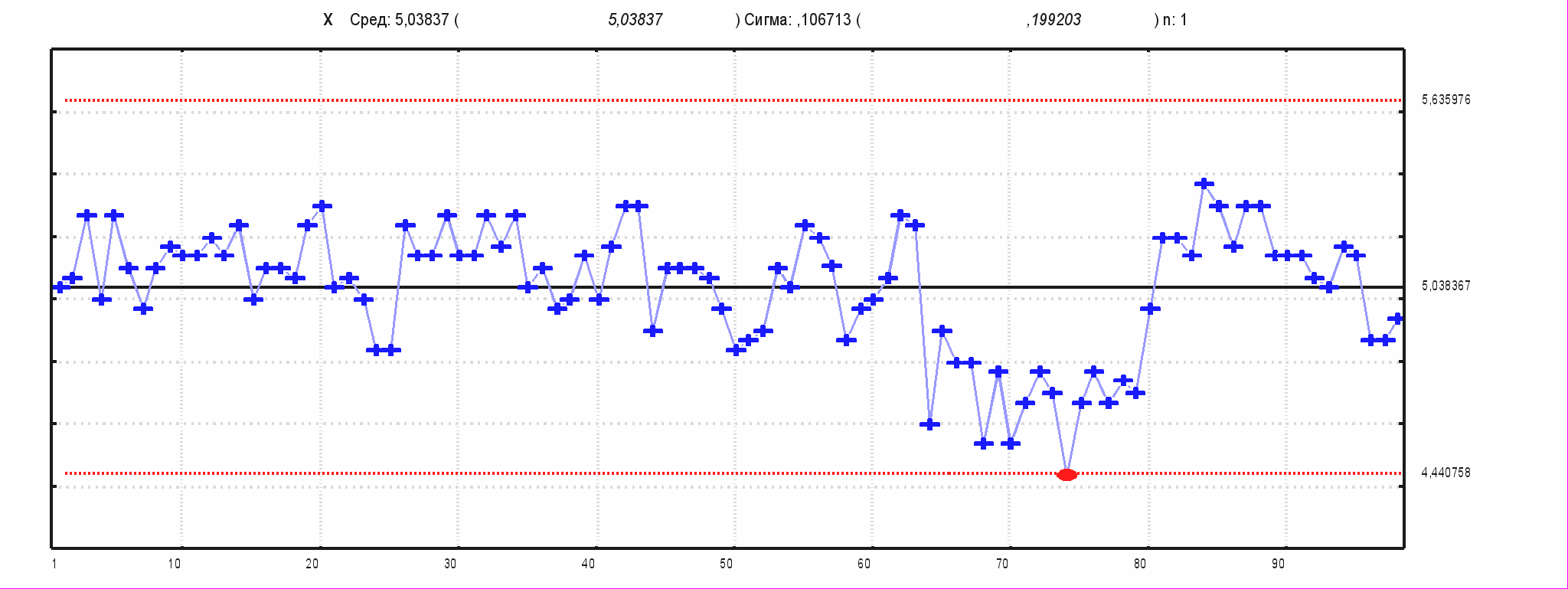 |
Рис. № 6-5 Х- карта специфической Рис. № 6-6 Х-карта специфической
активности паротита активности кори
Анализ приведенных контрольных карт показал, что все значения параметров находятся не только в границах, установленных нормативными документами, но и в статистических границах, что свидетельствует о стабильности процесса производства АПКВ за исследуемый период. Что касается остальных показателей, контролируемых по ФС, то их значения не превышают допустимых границ, (табл. 17), что подтверждает высокую воспроизводимость процесса производства ассоциированной паротитно-коревой вакцины с использованием разработанной и внедренной системы статистического управления качеством.
Таблица № 17
Значения показателей, контролируемых при выпуске АПКВ, (М±σ)
| Показатель | Требование ФС | 2003 год | 2004 год | 2005 год |
| n =122 (18) | n = 108 (24) | n = 113 (16) | ||
| Концентрация белка на дозу, мкг | Не более 8 | 0,40±0,1 | 0,48±0,16 | 0,41±0,13 |
| Точность розлива, % | Не более10 | 0,86±0,69 | 0,69±0,30 | 1,18±0,43 |
| К-во антибиотиков, мкг/доза | Не более 25 | 4,2±0,59 | 4,38±0,57 | 5,49±0,42 |
| Потеря массы при высушивании, % | Не более 2 | 1,18±0,24 | 1,12±0,28 | 1,12±0,24 |
| Остаточный кислород, % | Не более 1 | 0,26±0,03 | 0,28±0,05 | 0,25±0,40 |
| рН, ед. рН | 7,2-7,8 | 7,48±0,03 | 7,49±0,06 | 7,48±0,07 |
Наряду с приведенными контрольными картами нами использовались многомерные контрольные карты Хоттелинга, позволяющие провести единый интегральный анализ (рис. 7).
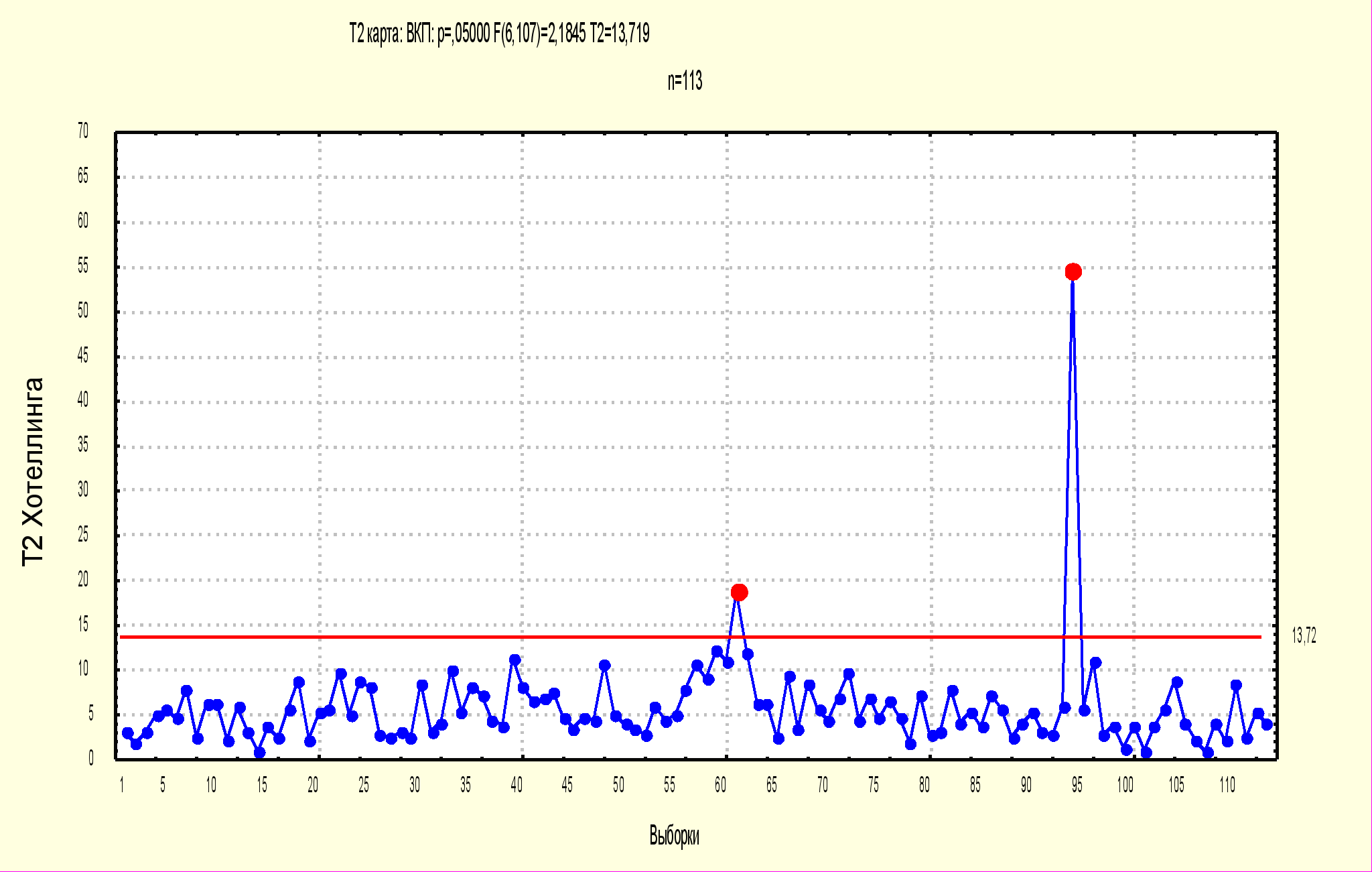
Рисунок № 7. Многомерная контрольная карта Хоттелинга при производстве АПКВ 2005 г.
Анализ приведенных материалов (рис. 7) показывает, что процесс производства АПКВ стабилен. Только один показатель выходит за рамки статистических границ, им является показатель точности розлива. Это обусловлено тем, что фактические значения этого показателя намного ниже допускаемых границ, (0.86 - 1.18%, при допустимых не более 10%).
Профилактическая эффективность ассоциированной вакцины не отличалась от эффективности моновакцин. Достигалось это тем, что содержание вирусных компонентов кори и паротита в АПКВ практически не отличалось от моновакцин и между компонентами вакцины не наблюдалось конкуренции антигенов, табл. 18.
Таблица № 18
Содержание коревого и паротитного компонентов в моновакцинах
против кори и паротита и в АПКВ
| Год | Вакцина | Коревой компонент | Паротитный компонент | ||||
| n | M ± σ | Min-max | n | M ± σ | Min-max | ||
| 2003 | моно | 118 | 3,92±0,23 | 3,34–4,57 | 93 | 5,10±0,18 | 4,64–5,47 |
| АПКВ | 122 | 3,87±0,21 | 3,37–4,44 | 122 | 5,01±0,18 | 4,60–5,37 | |
| 2004 | моно | 65 | 4,16±0,13 | 3,70–4,37 | 196 | 5,14± 0,18 | 4,57–5,44 |
| АПКВ | 108 | 3,74±0,19 | 3,27– 4,23 | 108 | 5,07±0,13 | 4,77–5,37 | |
| 2005 | моно | 191 | 4,25±0,31 | 3,64–4,90 | 41 | 4,93±0,17 | 4,61–5,44 |
| АПКВ | 113 | 3,96±0,25 | 3,34–4,37 | 113 | 5,02±0,19 | 4,44–5,37 | |
Анализ разработанной в МПБП технологии производства ассоциированной паротитно – коревой вакцины методом контрольных карт Шухарта и многомерных карт Хотеллинга показал стабильность как самого процесса, так и показателей качества. Испытания, в соответствии с Программой, утвержденной Комитетом МИБП МЗ РФ (протокол № 9 от 04 ноября 1999 г.), предусматривали вакцинацию детей, не привитых и не болевших корью и эпидемическим паротитом, в возрасте от 12 до 24 месяцев АПКВ, а контрольные группы детей – моновакцинами против кори и паротита. Сведения о вакцинах, использованных для изучения иммуногенных свойств, представлены в табл.19.
Результаты серологического изучения вакцинированных показали, что количество отреагировавших на введение вакцинного вируса кори не зависит от того, вводился ли вирус кори в моновакцине, или же в составе АПКВ.
Таблица № 19
