Разработка и внедрение технологии промышленного производства и системы управления качеством ассоциированной паротитно-коревой вакцины 03. 01. 06 биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01., 843.88kb.
- Курс семестр Всего зачетных единиц Трудоемкость дисциплины в часах, 26.33kb.
- Рекомендации по внутришкольному управлению качеством образования, 2175.02kb.
- Типовой план проекта «Разработка стратегии и внедрение системы стратегического управления», 117.19kb.
- Реферат отчета о научно-исследовательской работе по теме: «Разработка и внедрение ресурсосберегающей, 76.5kb.
- Для управления качеством ремонтных работ широко применяются технологические методы, 453.24kb.
- Программа по дисциплине «Управление качеством», 44.79kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
Оценка стабильности промышленного производства моновакцин против кори и эпидемического паротита для создания ассоциированного препарата.
Технология производства полуфабрикатов паротитной и коревой вакцин включала следующие стадии:
- получение первично-трипсинизированных фибробластов японского перепела;
- инфицирование клеточной суспензии и культивирование вируса в роллерных аппаратах;
- отмывание зараженных монослоев клеток и культивирование вируса на клетках в бессывороточной среде;
- получение индивидуальных сборов вакцинных вирусов;
- объединение индивидуальных сборов;
- осветляющую фильтрацию, добавление криопротектора и получение жидкого полуфабриката.
Полученные полуфабрикаты использовали как для приготовления моновакцин против кори и паротита, так и для приготовления ассоциированной вакцины. Предпринимаемые ранее попытки создания АПКВ не увенчались успехом из-за невозможности получения компонентов вакцины с требуемыми параметрами. С целью устранения выявленных недостатков нами была предложена методология описания производственных процессов с фиксированием измеряемых характеристик и величин. Для этого мы провели статистический анализ параметров технологического процесса, контролируемых при производстве моновакцин.
Подбор линии клеток для контроля специфической активности вирусов кори и эпидемического паротита.
Оценку биологической активности полученных вирусов, согласно регламенту, проводили в монослойной культуре клеток Vero. Мы проанализировали 4 трофоварианта линии клеток VERO, полученные из Института вирусологии им Д.И.Ивановского (РФ), США, Канады и Англии.
Были отобраны 2 трофоварианта клеток VERO B и VERO WHO, которые были аттестованы в ГИСК им. Л.А. Тарасевича и ЕСАСС соответственно.
Изготовление и паспортизация эталонного и рабочего банка линий клеток VERO.
Снижение уровня апоптоза в клетках, культивируемых in vitro, требует создания и использования эталонного и рабочего банков линий клеток, сохраняемых длительное время в жидком азоте и периодического их обновления. Банк клеток был создан в период с 2001 по 2003 г.г. в рамках выполнения исследований по данной диссертации на предприятии, что соответствует требованиям ВОЗ (1988) и РД 42-28-10-89. Для изготовления эталонного и рабочего банков использовали суспензии клеток линий VERO B и VERO WHO. Полученные культуры были размножены, культивированы стационарным и роллерным методами, проконтролированы на отсутствие возможных контаминантов, в т.ч. микоплазм. Были изучены ростовые свойства и морфология клеток при культивировании. Клетки были расфасованы в криопробирки, заморожены и заложены на длительное хранение в жидкий азот. Эталонные и рабочие банки линий VERO B и VERO WHO были изготовлены на изолированных площадях из клеток 140 и 141, 179 и 181 пассажей соответственно. После размораживания жизнеспособность клеток в суспензии линии VERO B и VERO WHO составила 87-92 и 89-94% . Клетки обладали удовлетворительными адгезивными и ростовыми свойствами, формировали монослой на 5-7 сутки инкубирования, а полученные культуры были стерильными, не содержали микоплазменной контаминации и не отличались морфологически от исходных клеток. Морфологические и культуральные свойства линий клеток VERO восстанавливались через 2-3 пассажа после криоконсервирования. Следует также отметить, что клетки линий VERO B и VERO WHO сохраняли на исходном уровне жизнеспособность и культуральные свойства в течение 2-х лет хранения (срок наблюдения) в жидком азоте.
При повседневном контроле специфической активности вирусных сборов и вакцин против кори и паротита использовали клетки Vero. и отраслевые стандартные образцы вирусов паротита штамм Л-3 (серия ОСО-8) и вируса кори штамм Л-16 (серия ОСО-347), аттестованные в ГИСК.
Для постоянного контроля активности вирусов кори и паротита лаборатория контроля использует в год не менее 10 ампул культур. Созданный рабочий банк позволил обеспечить производственные потребности в стандартном клеточном сырье на последующие, как минимум, 15 лет.
По материалам выполненных исследований созданы и паспортизированы эталонные и рабочие банки наиболее перспективных для контроля производства линий клеток VERO.
Статистическая оценка технологических процессов производства моно вакцин против кори и эпидемического паротита.
Статистическая оценка отраслевых стандартных образцов вакцинных вирусов на примере отраслевого стандартного образца (ОСО) 8 вакцинного вируса эпидемического паротита, штамм Л-3.
Стандартизовав линию клеток, пригодных для определения биологической активности, мы провели оценку технологических процессов производства моновакцин против кори и эпидемического паротита. С этой целью мы изучили процесс определения биологической активности. Для этого использовали данные по титрам специфической активности отраслевого стандартного образца ОСО 8 вакцинного вируса эпидемического паротита штамм Л-3 за 2004 год.
При анализе ОСО 8 было проанализировано 118 наблюдений. Среднегеометрический показатель значения титра равен 5,19 lg ТЦД50/0,5 мл, минимальный титр – 4,37 lg ТЦД50/0,5 мл., максимальный – 5,54 lg ТЦД50/0,5 мл., σ – 0,21. Полученные результаты позволяют с помощью величины показателя стандартного отклонения оценить разброс данных от среднего значения и выявить характер распределения.
При нормальном распределении 68% всех наблюдений лежит в диапазоне М ± 1 σ, 95 % в диапазоне М ± 2 σ и 99,73% значений в диапазоне М ± 3 σ.
В нашей выборке М±3σ (5,19±0,63) , все показатели должны располагаться в интервале от 4,56 lg ТЦД50/0,5 мл до 5,82 lg ТЦД50/0,5 мл. Фактически в выборке только одно значение выходит за рамки М ± 3 σ, т.е. диапазон нормального распределения содержит 99,15% значений, что является доказательством нормального распределения. Для дальнейшей оценки использовали ГОСТ Р ИСО 5479-2002 «Статистические методы. Проверка отклонения распределения вероятностей от нормального распределения».
Для подтверждения «нормальности» распределения строили нормальный вероятностный график с помощью программы STATISTICA.
При построении графика по оси Y откладывали вычисленные значения zj (ожидаемые нормальные вероятностные значения), а по оси X - наблюдаемые значения специфической активности. Если наблюдаемые значения специфической активности распределены нормально, то все значения на графике должны быть на, или вблизи прямой линии. На рис. 4 приведен нормальный вероятностный график значений специфической активности ОСО 8 вакцинного вируса эпидемического паротита.
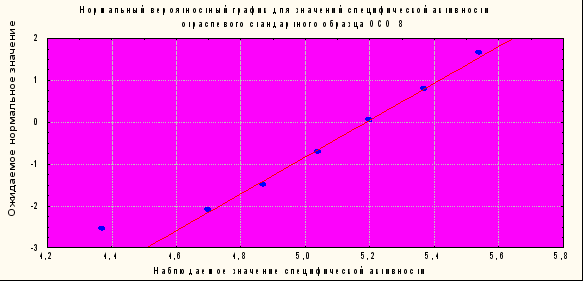
Рисунок № 2. Нормальный вероятностный график для значений специфической активности отраслевого стандартного образца вируса паротита ОСО 8.
Как видно из рис. 2, основная часть показателей находится на прямой линии, что свидетельствует о близости распределения данных по специфической активности стандартного образца вакцинного вируса эпидемического паротита к нормальному распределению, т.е. вариабельность титра ОСО 8 вакцинного штамма вируса паротита имеет случайный характер.
Аналогичное заключение было сделано и при анализе определения биологической активности ОСО 347 вакцинного вируса кори Л 16.
Эти данные позволяют сделать заключение о возможности внедрения статистической системы контроля производства для оценки стабильности производственных процессов.
Статистическая оценка стабильности производства жидких полуфабрикатов вакцин против кори и эпидемического паротита.
Статистической оценке подвергали результаты анализа сливов вакцинного вируса кори, полученного на клетках фибробластах эмбрионов перепела (ФЭП), в период с 2002 по 2005 г.г. Установлено, что биологическая активность каждого слива (с первого по четвертый) подчиняется нормальному распределению. Результаты анализа образцов культуральных жидкостей первого слива в 2002 г.г. приведены на рис. 3.
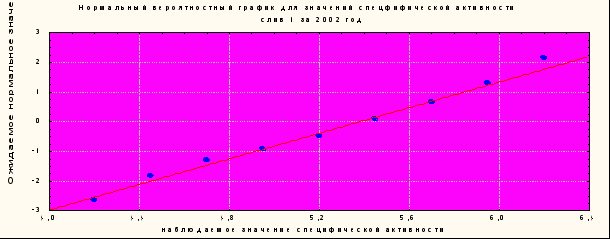
Рисунок № 3. Нормальный вероятностный график для значений специфической активности 1 слива вируса кори за 2002 год.
Проведенный статистический анализ специфической активности 1-4 сливов в период с 2002 по 2005 год представлен в табл. 9.
Таблица № 9
Специфическая активность сливов вируса кори в зависимости
от номера слива по годам.
| № слива | 2002 | 2003 | 2004 | 2005 | ||||
| n | Х+σ | n | Х+σ | n | Х+σ | n | Х+σ | |
| 1 | 391 | 5,37 0,44 | 487 | 5,28 0,41 | 736 | 5,40 0,42 | 1175 | 5,24 0,56 |
| 2 | 408 | 6,03 0,42 | 476 | 5,64 0,53 | 734 | 5,70 0,62 | 1178 | 5,52 0,64 |
| 3 | 408 | 6,20 0,44 | 466 | 6,10 0,45 | 723 | 6,31 0,45 | 1160 | 6,18 0,55 |
| 4 | 296 | 6,30 0,40 | 429 | 6,36 0,40 | 219 | 6,20 0,38 | 925 | 6,22 0,48 |
Далее мы оценили вариабельность процесса накопления вируса кори с помощью контрольных карт Шухарта и кусум-карт. Только среди первых сливов на карте удалось выявить выпадение единственной точки из допустимых границ.
Несмотря на стабильность значений специфической активности вакцинного вируса кори в целом, выявлены различия в титрах между колбами. Одним из регистрируемых факторов, оказывающих влияние на величину титров, является показатель множественности заражения, который выражается в ТЦД50 на клетку. Анализ данных за 2002-2004 гг. приведен в табл. 10.
Таблица № 10
Показатели множественности заражения клеток ФЭП вирусом кори
| № п/п | Год | n | Min., ТЦД50/кл | Маx. ТЦД50/кл | Маx/Min | Размах | М± σ | М/ σ |
| 1 | 2002 | 19 | 0,0040 | 0,093 | 23,25 | 0,0890 | 0,024±0,023 | 1,04 |
| 2 | 2003 | 26 | 0,0050 | 0,037 | 7,40 | 0,0320 | 0,016±0,009 | 1,77 |
| 3 | 2004 | 34 | 0,0001 | 0,030 | 300,00 | 0,0299 | 0,014±0,008 | 1,75 |
Как видно из табл. 10 множественность заражения на клетку вирусом кори в азные годы колебалась в широких пределах - от 0,0001 ТЦД50/кл до 0,093 ТЦД50/кл. Вполне вероятно, что различия в множественности заражения сказываются на биологической активности вирусных сливов. Действительно, анализ данных показал, что в 2002 году, когда вариабельность заражающих доз была максимальной, наблюдалась определенная тенденция снижения накопления вакцинного вируса кори в сливах с высокой множественностью заражения (табл. 11).
В дальнейшем были проведены корректирующие действия по уменьшению вариабельности множественности заражения на стадии заражения клеток ФЭП. Максимальная заражающая доза была снижена с 0,09 (в 2002 году) до 0,04-0,03 в 2003 - 2008 году, соответственно. В результате биологическая активность третьих и четвертых сливов (определяющих биологическую активность объединенных сливов) меньше варьировала.
Таблица № 11
Анализ данных по влиянию множественности заражения на титры
сливов по данным за 2002 год
| № п/п | ТЦД50/кл. | По всем сливам в целом, М ± σ | СЛИВЫ | |||
| I | II | III | IV | |||
| М ± σ | М ± σ | М ± σ | М ± σ | |||
| 1 | Тысячные доли | n = 511 5,92±0,49 | n = 137 5,44±0,37 | n = 135 6,01±0,32 | n = 135 6,07±0,45 | n = 104 6,22±0,39 |
| 2 | 0,01 | 140 5,99±0,50 | 40 5,51±0,36 | 40 5,99±0,35 | 40 6,32±0,42 | 20 6,30±0,32 |
| 3 | 0,02 | 390 6,09± 0,64 | 100 5,26±0,40 | 99 6,09±0,41 | 99 6,49±0,36 | 92 6,55±0,30 |
| 4 | 0,03 | 134 5,93±0,68 | 38 5,23±0,36 | 38 6,14±0,69 | 38 6,19±0,48 | 20 6,35±0,48 |
| 5 | 0,04 | 57 5,91±0,34 | 19 5,79±0,29 | 19 5,98±0,39 | 19 5,95±0,33 | – |
| 6 | 0,06 | 51 6,00±0,41 | 17 5,74±0,27 | 17 6,41±0,27 | 17 5,86±0,36 | – |
| 7 | 0,09 | 80 5,82±0,55 | 20 5,20±0,51 | 20 5,90±0,44 | 20 6,06±0,36 | 20 6,13±0,30 |
На следующем этапе производства, после проведения всех контрольных операций, проводили объединение вируссодержащих сборов. Индивидуальные вирусные сборы последовательно собирали из флаконов в 50-литровый пакет. Полученный с помощью осветляющей фильтрации полуфабрикат после замораживания, хранения и контроля качества размораживали, смешивали со стабилизатором ЛС-18, разливали по ампулам и лиофилизировали. Ампулы с сухой вакциной маркировали и контролировали по показателям, изложенным в ФС. Эти показатели были подвергнуты статистической обработке. Данные за 2002 и 2004 гг. суммированы в табл. 12.
Таблица № 12
Значения показателей, контролируемых при выпуске
коревой моновакцины, (М±σ)
| Показатель | Требование ФС | 2002 год | 2004 год |
| n = 81 | n = 65 | ||
| Концентрация белка на дозу, мкг | Не более 2 | 0,68±0,28 | 0,014±0,0065 |
| Спец.активн.серий, lg ТЦД50/0.5 мл | Не менее 3 | 3,69±0,2 | 4,16±0,13 |
| Точность розлива, % | Не выше 10 | 1,39±0,61 | 0,97±0,43 |
| Кол-во антибиотиков, мкг/доза | Не более 20 | 3,7±0,3 | 3,5±0,64 |
| Потеря массы при высушивании,% | Не более 2 | 0,84±0,27 | 0,98±0,26 |
| Остаточный кислород, % | Не выше 1 | 0,38±0,07 | 0,34±0,05 |
| рН, ед. рН | 7.2 -7.8 | 7,56±0,09 | 7,6±0,09 |
Проведенный статистический анализ позволил осуществить корректирующие воздействия, которые способствовали стабилизации показателей качества выпускаемой вакцины, при этом увеличилась биологическая активность, повысилась точность разлива, снизилась концентрация белка, резко снизилась вариабельность всех исследованных параметров.
Исследуемые показатели специфической активности коревой вакцины представлены в виде Х-карты Шухарта (рис.4)
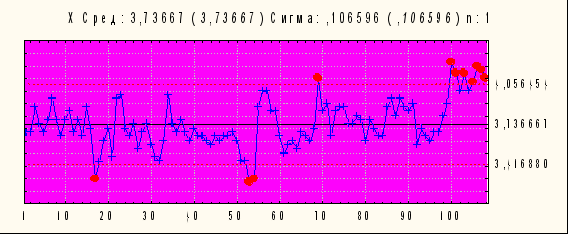
Х – карта Среднее 3,74 Сигма 0,106 n: 1
Рисунок № 4. Контрольная Х-карта Шухарта индивидуальных значений для специфической активности коревой вакцины (2004 год)
Статистическая оценка, проведенная с использованием контрольных карт, свидетельствует о стабильности производства коревой вакцины.
Аналогичная статистическая оценка технологических процессов была проведена при производстве паротитной вакцины.
В табл. 13 приведены суммарные данные по статистическому анализу активности сливов культуральной жидкости при производстве паротитной вакцины в 2003 - 2005 годах.
Таблица № 13
