Для самостоятельного изучения «Биохимия как наука. Этапы развития биохимии. Методы биохимических исследований» (Скоробогатова З. М.)
| Вид материала | Методические рекомендации |
- Для самостоятельного изучения Биохимия как наука. Этапы развития биохимии, 2094.45kb.
- Основы биохимии спорта, 1521.5kb.
- Председатель цикловой методической комиссии, 42.51kb.
- Тема строение белков и ферментативный катализ вопросы лекции, 137.02kb.
- Лекция №6. Структура биологии как науки. Ранние этапы эволюции жизни, 433.89kb.
- Планирование будущего развития с использованием техники сценариев, 15.36kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Резюмируя можно сказать, что объектом ее изучения являются химические элементы, 71.81kb.
- Курс (8 семестр) 2010/2011уч год специальность «Стоматология» Календарно-тематический, 183.27kb.
- 1. История как наука: этапы становления, предмет, методы исследования, функции исторического, 609.65kb.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Обязательная литература
1. Губський Ю.І. Біологічна хімія. – Київ – Вінниця: НОВА КНИГА, 2007. – С. 286 – 295; 217
2.Практикум з біологічної хімії/ За ред. проф. Склярова О.Я. – Київ: Здоров‘я, 2002. –
С. 146 - 151
3.Тестовые задания по биологической химии/ Под ред.Б.Г.Борзенко. - Донецк, 2000.-С.148-202
4.Лекции по биохимии
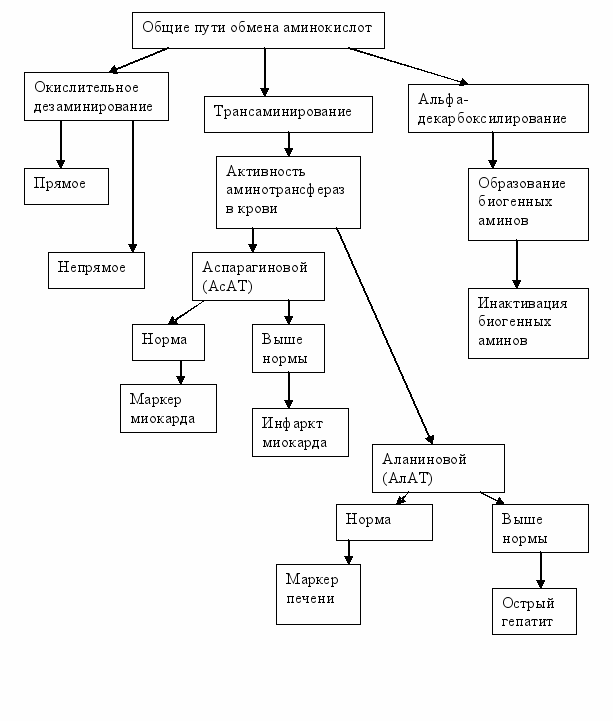
5.Граф логической структуры (Приложение 1)
6.Инструкция к практическому занятию
Дополнительная литература
1.Губський Ю.Г. Біологічна хімія. - Київ - Тернопіль: Укрмедкнига, 2000. - С. 234-242
2.Березов Т.Т., Коровкин Б.Ф. Биологическая химия. - М.: Медицина, 1998. - С.431 - 446
3.Березов Т.Т., Коровкин Б.Ф. Биологическая химия. - М.: Медицина, 1990. - С.337-348
4.Николаев А.Я. Биологическая химия. - М.: ООО «Медицинское информационное агентство», 1998.-С. 308 – 315; 334
После изучения вышеперечисленных вопросов для самопроверки усвоения материала по изучаемой теме Вам предлагается решить следующие целевые обучающие задачи. Правильность решений проверьте, сопоставив их с эталонами ответов.
Целевые обучающие задачи
Задача 1. В реакциях трансаминирования участвуют сложные ферменты аминотрансферазы. Какой витамин входит в состав их коферментов?
А. В2
В. В6
С. В12
D. РР
Е. В1
Задача 2. В эксперименте на животных было выявлено, что в реакции трансаминирования участвуют ферменты аминотрансферазы. Назовите кофермент, входящий в состав этих ферментов.
А. ФАД
В. НАД
С. Тиаминпирофосфат
D. Тетрагидрофолиевая кислота
Е. Пиридоксальфосфат
Задача 3. В инфекционном отделении для постановки диагноза используют определение активности аланинтрансаминазы. Какой кофермент входит в состав этого фермента?
А. ФМН
В. ФАД
С. Пиридоксальфосфат
D. ТГФ К
Е. НАД
Задача 4. При поступлении пациента в инфекционное отделение ему был поставлен предварительный диагноз «вирусный гепатит» и назначено биохимическое обследование. Изменение активности какого фермента подтвердит данный диагноз?
А. Карбамоилфосфатсинтетазы
В.Глутаматдегидрогеназы
С.Ксантиноксидазы
D.Аланинтрансаминазы
Е. Аргиназы
Задача 5. В кардиологическом отделении для подтверждения диагноза «инфаркт миокарда» используется определение активности одного из приведенных ниже ферментов. Какого именно?
А. Карбамоилфосфатсинтетазы
В. Глутаматтрансаминазы
С. Аспартаттрансаминазы
D. Аланинтрансаминазы
Е. Моноаминоксидазы
Правильность решений проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач:
1 - В, 2 - Е.
Краткие методические рекомендации к проведению занятия
В начале занятия проводятся контроль исходного уровня знаний студентов и его коррекция, выполнение самостоятельной работы. Затем студенты приступают к выполнению лабораторной работы, используя при этом инструкцию.
После выполнения лабораторной работы необходимо оформить протокол, сделать выводы к работе, которые проверяет и контролирует преподаватель. Проводится анализ самостоятельной работы студентов и коррекция.
В конце занятия проходит итоговый контроль, подводятся итоги занятия.
Задания для самостоятельной аудиторной работы
Задание 1
Завершите уравнение реакции:
Аминокислота → Альфа-кетокислота + ?
Какой процесс оно описывает:
а) окислительное дезаминирование аминокислот;
б) альфа-декарбоксилирование аминокислот;
в) трансаминирование?
- Напишите в общем виде уравнение реакции окислительного дезаминирования аминокислот, указав промежуточный продукт, названия ферментов и коферментов. При каких значениях рН наиболее эффективно работают эти ферменты?
- В дезаминировании какой аминокислоты участвует НАД-зависимый фермент? Как он называется? Приведите уравнение реакции. В чем заключается ее биологическая роль?
Задание 2
Докажите, что глутамат и аспартат являются заменимыми аминокислотами.
2.1.Напишите в общем виде уравнение реакции трансаминирования (переаминирова-
ния). Как называются ферменты, катализирующие эти реакции? Какой у них
кофермент? Биологическая роль реакций трансаминирования.
- Напишите уравнения реакций, катализируемых аланиновой и аспарагиновой аминотрансферазами. На чем основан метод определения активности этих ферментов? Диагностическое значение определения активности аланиновой и аспарагиновой аминотрансфераз.
Задание 3
Напишите схему глюкозо-аланинового цикла. Какова его биологическая роль?
Задание 4
Как называется процесс, описываемой приводимой ниже схемой:
Аминокислота + альфа-кетоглутарат → Альфа-кетокислота + глутамат
Глутамат → Альфа-кетоглутарат + аммиак?
Почему?
Задание 5
Напишите уравнение приводимой ниже реакции (с формулами). Какое соединение образуется? Какова его биологическая роль? К какому типу реакций общего пути обмена аминокислот относится данная реакция?
Глутамат → ? + диоксид углерода
- Декарбоксилирование аминокислот. Напишите в общем виде уравнение реакции альфа-декарбоксилирования. Как называются ферменты, катализирующие эти реакции? Какой у них кофермент? Биологическая роль реакций альфа-декарбоксилирования аминокислот.
- Напишите уравнения реакций образования гистамина, серотонина и дофамина. Биологическая роль этих соединений.
- Инактивация биогенных аминов. Напишите в общем виде ее схему, указав название фермента и кофермента.
ІІ. Завершите схемы приводимых ниже метаболических преобразований
- Дополните схему, укажите на ней реакцию трансаминирования. Напишите формулы всех соединений, встречающихся в данной схеме.
? → бета-окисление → ? → процесс? → цитрат → изоцитрат → ? → ? → оксалоацетат→?→ аланин
- Дополните схему, укажите на ней реакцию общего пути обмена аминокислот. Как называется эта реакция? Напишите формулы всех соединений, встречающихся в данной схеме.
Глюкоза → процесс? → пируват → ? → аспартат
- Дополните схему, укажите в ней реакции общего пути обмена аминокислот. Как называются эти реакции? Напишите формулы всех соединений, встречающихся в данной схеме.
? → альфа-кетоглутарат → процесс? → сукцинат → ? → ? → оксалоацетат→ ? →
→ ? → аланин
Инструкция к практическому занятию: «Определение активности АлАТ и АсАТ»
Принцип метода. В результате работы аминотрансфераз образуются альфа-кетокислоты, которые в реакции с 2,4-ДНФГ (динитрофенилгидразином) образуют цветные соединения – гидразоны. Гидразон пировиноградной кислоты в щелочной среде имеет красно-бурое окрашивание, интенсивность которого пропорциональна количеству пировиноградной кислоты. По количеству пировиноградной кислоты судят об активности аминотрансфераз.
Материальное обеспечение: 0,1% раствор 2,4-ДНФГ; 0,4М раствор едкого натра, субстратно-буферные смеси для определения активности АсАТ и АлАТ, сыворотка крови, термостат, ФЭК, термометр, водяная баня, пипетки, пробирки, штативы.
Определение активности АсАТ
1. Внесите в пробирку 0,5 мл субстратно-буферной смеси для определения активности АсАТ и добавьте в пробирку 0,1 мл сыворотки крови.
2. Поместите пробирку в термостат на 15 минут, температура 37 С.
3. Затем добавьте в пробирку 0,5 мл раствора 2,4 –динитрофенилгидразина.
4. Реакционную смесь необходимо выдержать в течение 20 минут при комнатной температуре,
5. Далее добавьте в пробирку 5 мл 0,4М раствора едкого натра и оставьте раствор на 10 минут при комнатной температуре для стабилизации окраски.
6. Через 10 минут необходимо измерить оптическую плотность раствора на ФЭКе при зеленом светофильтре (длина волны 500 – 560 нм) в кювете толщиной 1 см.
Определение активности АлАТ
1. Внесите в пробирку 0,5 мл субстратно-буферной смеси для определения активности АлАТ и добавьте в пробирку 0,1 мл сыворотки крови.
2. Поместите пробирку в термостат на 30 минут, температура 37 С.
3. Затем добавьте в пробирку 0,5 мл раствора 2,4 –динитрофенилгидразина.
4. Реакционную смесь необходимо выдержать в течение 20 минут при комнатной температуре,
5. Далее добавьте в пробирку 5 мл 0,4М раствора едкого натра и оставьте раствор на 10 минут при комнатной температуре для стабилизации окраски.
6. Через 10 минут необходимо измерить оптическую плотность раствора на ФЭКе при зеленом светофильтре (длина волны 500 – 560 нм) в кювете толщиной 1 см.
Для определения активности обоих ферментов Вам необходимо построить калибровочные графики. При построении калибровочного графика на оси ординат необходимо отложить значения оптической плотности, а на оси абсцисс - содержание пировиноградной кислоты (ПВК) в калибровочных пробах (в мкмолях). Активность ферментов в данных условиях исследования (в мкмолях ПВК, образовавшейся при инкубации 1 мл сыворотки за 1 час), рассчитывается по формулам:
Х=10 х С (для АсАТ) и Х=10 х 2 х С (для АлАТ), где:
С- количество ПВК по калибровочному графику (в мкмолях);
10-коэффициент перерасчета на 1 мл сыворотки;
2- коэффициент перерасчета на 1 час инкубации.
Лабораторные нормы: для АсАТ - 0,1- 0,5 мкмолей ПВК на 1 мл сыворотки крови за 1 час инкубации, для АлАТ - 0,1-0,7 мкмолей ПВК на 1 мл сыворотки крови за 1 час инкубации.
Калибровочные графики зависимости оптической плотности растворов ПВК от содержания ПВК:
а) для определения активности АсАТ:
б) для определения активности АлАТ:
ВЫВОДЫ:
Подпись преподавателя:
Приложение 1
Граф логической структуры
ТЕМА 1.17. ИССЛЕДОВАНИЕ ПРОЦЕССОВ ДЕТОКСИКАЦИИ АММИАКА И БИОСИНТЕЗА МОЧЕВИНЫ
Актуальность темы
Аммиак образуется главным образом при катаболизме аминокислот, биогенных аминов и нуклеотидов. Кроме того, большое количество аммиака образуется в кишечнике при гниении белков, а также в скелетных мышцах при усиленной физической нагрузке.
Аммиак является токсическим соединением, и для его обезвреживания в тканях и органах существуют специальные механизмы.
Наибольшую роль в процессе обезвреживания аммиака играет печень, в которой аммиак превращается в нетоксичную мочевину. Образование мочевины (орнитиновый цикл) имеет большое значение для сохранения здоровья. Однако при серьезных расстройствах в работе печени, например, при циррозе, тяжелом гепатите, отравлении ядами, жировом перерождении печени, а также при желудочно-кишечных кровотечениях, развитии коллатералей между системой воротной вены и общей системой кровообращения, аммиак накапливается в крови, приводя к гипераммониемии. Клинические проявления гипераммониемии усиливаются после приема белковой пищи, при этом количество мочевины в крови и моче снижается.
Лечение таких больных, а также детей, страдающих врожденной недостаточностью одного из ферментов цикла мочевины, должно быть основано на понимании процесса ее образования в печени.
Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь оценивать состояние азотистого обмена и функциональное состояние печени и почек по результатам определения содержания мочевины в крови и моче для последующего использования в клинической диагностике.
Конкретные цели: Цели исходного уровня:
Уметь:
| 1. Интерпретировать воздействие аммиака на организм, его токсичность для ЦНС, симптомы | |
| 2. Интерпретировать пути обезвреживания аммиака в различных тканях, его транспорт по крови | Интерпретировать структуру и свойства аминокислот, амидов кислот (кафедра медицинской и фармацевтической химии) |
| 3. Обосновать роль и место синтеза моче-вины в обмене веществ как главного пути обезвреживания аммиака, его взаимосвязь с другими метаболическими путями | Интерпретировать структуру и свойства мочевины, методы ее определения в растворах (кафедра медицинской и фармацевтической химии) |
| 4. Интерпретировать данные о содержании мочевины в сыворотке крови и моче для оценки состояния азотистого обмена в норме и при патологии | |
Для проверки исходного уровня Вам предлагается выполнить ряд заданий.
Задания для самопроверки и самокоррекции исходного уровня.
Задание 1. При гидролизе пептида образовались амфотерные соединения, образующие соли при добавлении как соляной кислоты, так и гидроксида натрия. Какие это соединения?
А. Оксикислоты
В. Жирные кислоты
С. Амиды кислот
D. a-аминокислоты
Е. Амины
Задание 2. К неизвестному веществу добавили раствор гидроксида натрия и нагрели. Наблюдалось посинение лакмусовой бумаги и резкий запах аммиака. Какое вещество было открыто этим опытом?
А. Аминокислота
В. Сложный эфир
С. Пептид
D. Амид кислоты
Е. Первичный амин
Задание 3. При нагревании мочевины с баритовой водой наблюдается выделение аммиака, посинение лакмусовой бумаги и образование белой мути карбоната бария. К какому классу соединений относится мочевина в соответствии с полученными данными?
А. К аминокислотам
В. К амидам кислот
С. К нитрилам
D. К первичным аминам
Е. К вторичным аминам
Задание 4. К кристаллам вещества добавили несколько капель азотной кислоты и нитрита натрия. При встряхивании выделяются пузырьки газа (азот и углекислый газ). Какое вещество разложилось при действии азотной кислоты?
А. Первичный амин
В. Вторичный амин
С. Мочевина
D. Аминокислота
Е. Мочевая кислота
Правильность решений заданий проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного уровня:
1 – D, 3 – В.
Информацию для восполнения исходного уровня можно найти в следующей литературе:
1. Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. -М.: Медицина, 1991. – С. 182, 208-210, 314-318, 338 - 343
2. Рево А. Я., Зеленкова В.В. Руководство к лабораторным занятиям по биоорганической химии. - М.: Медицина, 1980. –С. 92-100
3. Лекции по биоорганической химии
Содержание обучения
Содержание обучения должно обеспечивать достижение целей обучения, чему способствует граф логической структуры изучаемой темы (Приложение 1).
Основные теоретические вопросы, позволяющие выполнить целевые виды деятельности:
1. Основные пути и источники образования аммиака в организме, причины и проявления
его токсичности
2. Важнейшие механизмы обезвреживания аммиака:
2.1. Восстановительное аминирование a-кетоглутарата
2.2. Образование амидов дикарбоновых кислот
2.3. Образование аммонийных солей в почках
2.4. Образование мочевины в печени
3. Роль аланина в транспорте азота аминокислот для синтеза мочевины
4. Орнитиновый цикл мочевинообразования. Механизм и ферменты процесса, его регуляция, взаимосвязь с ЦТК и трансаминированием
5. Особенности обезвреживания аммиака в нервной ткани
6. Принцип метода и ход работы по определению мочевины уреазным методом
